1 Introduction
De nombreuses études sur les mollusques bivalves et d’autres organismes ont montré la présence d’une association positive entre l’hétérozygotie multilocus (HML) et les traits de vie liés à la valeur sélective 〚1–8〛. Les mécanismes génétiques par lesquels cette association peut être produite ont été le sujet d’expérimentations et d’approches théoriques récentes 〚7, 9–11〛. L’expression phénotypique mesurée la plus commune dans cette association a été la taille et de nombreuses études sur les juvéniles en populations naturelles de bivalves ont montré une corrélation positive significative entre ce caractère et l’hétérozygotie multilocus (HML) 〚8〛.
Dans la plupart de ces travaux, l’hypothèse la plus souvent retenue est la superdominance, qui sous-entend que les génotypes hétérozygotes présentent une valeur sélective supérieure aux génotypes homozygotes 〚12〛. Pour Zouros et Pogson 〚7〛, deux mécanismes peuvent être à l’origine de la superdominance : (i) une sélection favorable aux hétérozygotes, où intrinsèquement l’association d’allèles différents est plus avantageuse (superdominance vraie) et (ii) le non-respect de la panmixie, à savoir des phénomènes de consanguinité faisant ressortir le fardeau génétique par dépression de consanguinité (superdominance associative). La relation HML/valeur sélective alimente le débat sur le maintien du polymorphisme dans les populations naturelles, car, dans l’état actuel des connaissances, les fréquences de mutation seules ne peuvent pas expliquer les forts taux de polymorphisme observés. Pour les sélectionnistes, la première hypothèse peut expliquer en partie le maintien du polymorphisme dans les populations naturelles, puisqu’elle tend à favoriser les allèles moins fréquents par sélection stabilisante. Cette hypothèse s’ajoute aux hypothèses sélectionnistes de valeurs sélectives variables (fréquence–dépendance, valeurs sélectives variables dans l’espace et le temps, sélection différentielle, etc.) et s’oppose à la variation sélectivement neutre proposé par les neutralistes 〚13〛.
Outre l’exemple de l’anémie falciforme, des études sur les poissons en aquaculture ont montré que certains génotypes pouvaient induire des taux de croissance supérieurs lorsque les conditions environnementales étaient contrôlées 〚14, 15〛. Allegrucci et al. 〚16〛 ont mis en évidence des mortalités sélectives pour certains génotypes chez le bar, Dicentrarchus labrax, lors d’une étude d’acclimatation à l’eau douce. Des travaux concernant la physiologie du métabolisme montrent qu’il peut exister une relation inverse entre le taux d’hétérozygotie et l’activité métabolique. Diehl et Kœhn 〚17〛 ont montré que les individus présentant un nombre de locus hétérozygotes plus important avaient une consommation d’oxygène plus faible. Dans une étude comparable, Hawkins et al. 〚18〛 ont montré que des individus présentant un nombre plus important de locus hétérozygotes possédaient un turnover des protéines plus rapide. Ces résultats suggèrent que la consommation d’énergie allouée à la biosynthèse des protéines est plus faible chez les individus présentant un taux d’hétérozygotes plus important. Ceci leur permettrait une allocation d’énergie à d’autres fonctions, telles que la survie, la croissance, la reproduction ou la recherche de nourriture 〚19〛.
L’objectif de notre travail était de tester les corrélations entre les caractères héréditaires (allozymes) et différents caractères phénotypiques liés à la croissance et à la reproduction dans une population naturelle d’un poisson marin hermaphrodite protandre, le sar commun, Diplodus sargus. La problématique générale se pose dans les termes suivants : « existe-t-il une association positive entre l’hétérozygotie et les paramètres phénotypiques liés à la valeur sélective ? ». Les paramètres testés sont le taux de croissance, l’âge en fonction du sexe, l’âge d’inversion du sexe et la date de ponte. Pour répondre à cette question, nous avons analysé la distribution du nombre de locus polymorphes, l’hétérozygotie (multilocus et par locus), les déséquilibres en hétérozygotes observés (multilocus et par locus) par rapport à ceux attendus sous l’équilibre de Hardy–Weinberg et la différenciation génétique des groupes formés en relation avec les caractères cités précédemment. Pour l’analyse de la croissance et des paramètres liés au sexe et à la reproduction, nous avons suivi les recommandations de Zouros 〚20〛 pour favoriser la détection d’une corrélation positive entre hétérozygotie et phénotype, à savoir un nombre important de locus, un nombre important d’individus échantillonnés et un trait phénotypique affecté par un grand nombre de locus.
2 Matériel et méthodes
Les analyses ont porté sur 842 individus pêchés à Banyuls-sur-Mer entre le 11 octobre 1995 et le 6 décembre 1996 grâce à différentes techniques : plongée en scaphandre autonome, chalutage, filets maillants. Suivant le phénotype analysé, tout ou une partie des individus ont été utilisés.
2.1 Phénotypes analysés
Quatre caractères phénotypiques susceptibles d’être influencés par des processus sélectifs ont été retenus pour être associés aux génotypes pour l’ensemble des locus : la croissance, l’âge en fonction du sexe, l’âge d’inversion du sexe et la date de ponte.
Concernant la croissance, le postulat est qu’un individu à croissance rapide apporte une contribution supérieure à la génération suivante. Différents scénarios sont envisagés : (i) un poisson peut atteindre plus rapidement une taille adulte pour échapper à la prédation (théorie de Stage duration de Cushing 〚21〛 et de the bigger is better de Bailey et Houde 〚22〛, (ii) un poisson peut atteindre la maturité sexuelle plus rapidement si elle est contrôlée par la taille 〚23〛, (iii) un poisson peut posséder une efficacité métabolique plus importante lui permettant une plus grande allocation d’énergie à la fonction de reproduction 〚19〛. La croissance individuelle a été obtenue à partir des stries annuelles de ralentissement de la croissance hivernale des otolithes (i.e. pièces calcifiées de l’oreille interne 〚24〛). Les distances du centre à chaque strie ont été mesurées par analyse d’image à l’aide du logiciel Visilog 4 (Noesis®) afin d’estimer la taille à chaque âge par rétrocalcul (cf. l’algorithme de Lea 〚25〛). Les tailles rétrocalculées sont utilisées pour déterminer les courbes de croissance individuelle sur la base de l’équation de von Bertalanffy 〚26〛. Nous avons repris le taux de croissance K estimé en fonction des tailles rétrocalculées sur les deux premières années où la croissance est la plus rapide et n’est pas perturbée par la maturité sexuelle. L’analyse de la croissance a été effectuée sur la totalité des individus.
Le sar commun est un poisson hermaphrodite protandre, passant successivement de mâle à femelle vers l’âge de 3 ou 4 ans 〚27, 28〛. Or, certains individus semblent ne pas subir cette inversion 〚29〛. Ce sont des mâles très âgés et de jeunes femelles que nous avons considérés comme atypiques. L’identification du sexe s’appuie sur l’examen des gonades lors de la dissection des individus. Pour cette analyse, l’identification du sexe pour chaque classe d’âge a permis de détecter les individus atypiques correspondant aux mâles de plus de six ou sept ans et aux femelles de quatre ou cinq ans et moins. Compte tenu des contraintes de prélèvement, nous n’avons utilisé que 564 individus pour lesquels l’identification du sexe ne présentait pas d’ambiguïté.
Lors de la lecture des marques de ralentissement de croissance, la structure des otolithes a montré des variations pouvant être attribuées à des perturbations physiologiques liées à l’inversion sexuelle. En effet, les mâles possèdent des otolithes avec des stries simples, alors que les femelles présentent deux structures distinctes : la même structure que les mâles sur les premières années, puis l’apparition de nombreuses stries surnuméraires 〚29〛. Ce type de structure a déjà été décrit chez un autre sparidé protandre, le marbré, Lithognathus mormyrus 〚30〛. Nous avons réalisé nos analyses sur des femelles groupées en fonction de leur âge présumé d’inversion sexuelle caractérisé par le changement de structure des stries. Nous avons identifié quatre groupes correspondant aux différents âges d’inversion sexuelle : deux ans, trois ans, quatre ans et cinq/six ans. Les individus femelles présentant une modification de structure dès l’âge de deux ans correspondent aux individus atypiques. Cette analyse a été réalisée sur 346 femelles.
La reproduction de D. sargus a lieu de mars à mai 〚27, 28, 31〛 avec un maximum au mois d’avril pour Banyuls-sur-Mer, correspondant à une seule cohorte annuelle 〚29〛. Les observations réalisées sur les prises des chalutiers pélagiques dans le golfe du Lion montrent un pic de capture pendant la période de ponte, qui suggère une migration des individus reproducteurs sur des zones sableuses au large 〚32, 33〛. Pour l’analyse de la date de ponte, nous avons réalisé des chalutages sur fond meuble au large des zones rocheuses pour capturer les individus potentiellement en phase de ponte. Ces chalutages ont été effectués sur trois périodes, correspondant aux mois de mars, avril et mai. Les analyses ont été réalisées sur 125 individus.
Pour chaque phénotype analysé, grâce à l’estimation de l’âge par les otolithes, nous avons déterminé la composition en cohortes pour chaque groupe.
2.2 Électrophorèse enzymatique
Un morceau de muscle ainsi que le foie ont été prélevés sur chaque individu et ensuite broyés au moyen d’un homogénéisateur « ultraturax » dans une solution de broyage à pH 6,8 (Tris : 1,2 g/l, EDTA : 0,37 g/l, NADP : 0,049 g/l). Du tétrachlorure de carbone est additionné à la solution pour précipiter les lipides. Le broyât obtenu est centrifugé à 15 000 g pendant 30 min à 4 °C. Les électrophorèses sont réalisées sur gels d’amidon à 12% (Sigma : S-5651) et sur gels d’acétate de cellulose vendus prêt à l’emploi (laboratoire Helena : Titan III).
L’étude est basée sur l’analyse électrophorétique de 27 locus, dont 17 sont apparus polymorphes 〚29, 34〛. La nomenclature des différents gènes d’une même fonction enzymatique est celle adoptée par Shaklee et al. 〚35〛 pour les poissons. Les systèmes enzymatiques, leurs noms, leurs abréviations et leurs numéros ont été exprimés selon les recommandations de l’IUBNC (International Union of Biochemistry, Nomenclature Committee).
2.3 Analyses génétiques
La relation entre génotype et phénotype a été analysée à l’aide d’un modèle simple de régression linéaire entre le nombre de locus hétérozygotes par individus (HML) et les performances phénotypiques (taux de croissance K, âge en fonction du sexe, âge d’inversion du sexe et date de ponte). Cette méthode prédictive est basée sur la comparaison de la forme mathématique de la relation « hétérozygotie–valeur sélective » 〚12〛. Elle prend en compte la structure génétique des individus pour tester si la HML présente une corrélation positive avec le gradient du caractère phénotypique étudié. Nous calculons la moyenne de la valeur du caractère sur les individus présentant uniquement deux locus hétérozygotes, puis trois locus hétérozygotes, et ainsi de suite. La relation a été testée grâce à une régression linéaire pour sa simplicité d’utilisation et la bonne visualisation des résultats 〚10〛. Pour tester l’hypothèse H0 « absence de corrélation entre la HML et le phénotype », nous avons calculé la probabilité à 95% pour que la pente de la droite de régression soit nulle.
Parallèlement, nous avons calculé le taux d’hétérozygotie multilocus observée (He), à savoir la fréquence des génotypes hétérozygotes observés dans chaque groupe. Ce calcul a été réalisé en ne prenant en compte que les locus polymorphes. Nous avons également estimé les F-statistics (paramètres f et θ, respectivement, pour les indices FIS et FST selon la notation de Wright 〚36〛) à partir des équations (1)–(4) pour les valeurs par locus et avec l’équation (10) pour les valeurs multilocus selon Weir et Cockerham 〚37〛. Les FIS mesurent le déficit ou l’excès d’hétérozygotes par rapport à l’équilibre de Hardy–Weinberg à l’intérieur de chaque groupe constitué à partir des caractères phénotypiques 〚38〛. Les FST mesurent la différenciation entre groupes. L’hétérozygotie et les F-statistics ont été calculés en utilisant le logiciel Genetix 4.0 (disponible sur http://www.univ-monpt2.fr/genome-pop/genetix.htm). La méthode des tests exacts a été retenue pour tester les probabilités d’écarts à l’équilibre de Hardy–Weinberg et la différenciation génétique, car elle reste sensible pour des échantillons de faibles effectifs 〚39〛. Ces probabilités ont été calculées en utilisant le logiciel Genepop 3.1d 〚40〛.
3 Résultats
3.1 Croissance
La relation « HML–croissance » ne présente pas de corrélation significative. La valeur de la pente de la droite de régression est faible (0,0158) (Fig. 1A). L’intervalle de confiance est faible, sauf pour les classes d’hétérozygotie d’effectifs très faibles. L’hétérozygotie (He) et les FIS analysés en multilocus présentent une variabilité sans lien avec le gradient de croissance (Fig. 1B). Seule la classe de croissance C5, correspondant à une croissance moyenne compte tenu du nombre total de classes (huit), présente un déficit en hétérozygote significatif. Les analyses par locus montrent que six locus parmi les 17 étudiés présentent au moins une valeur de FIS significative (PGM*, ME*, EST-1*, AAT-2*, EST-3* et 6PGD*) sur l’ensemble des classes. Quatorze valeurs de déficits en hétézygotes se répartissent sur l’ensemble des classes de croissance (Annexe 1A). Il n’existe pas de différenciation génétique entre les classes de croissance (FST = –0,0006 ; p = 0,77). La structure démographique est variable d’une classe à l’autre (Fig. 2A). Les classes C3, C4, C5 et C6 se composent d’individus âgés d’un à neuf ans, appartenant à l’ensemble des cohortes dont les proportions sont variables. Les autres classes (C1, C2 et C7) présentent huit cohortes. Seule la classe C8 ne présente que cinq cohortes.
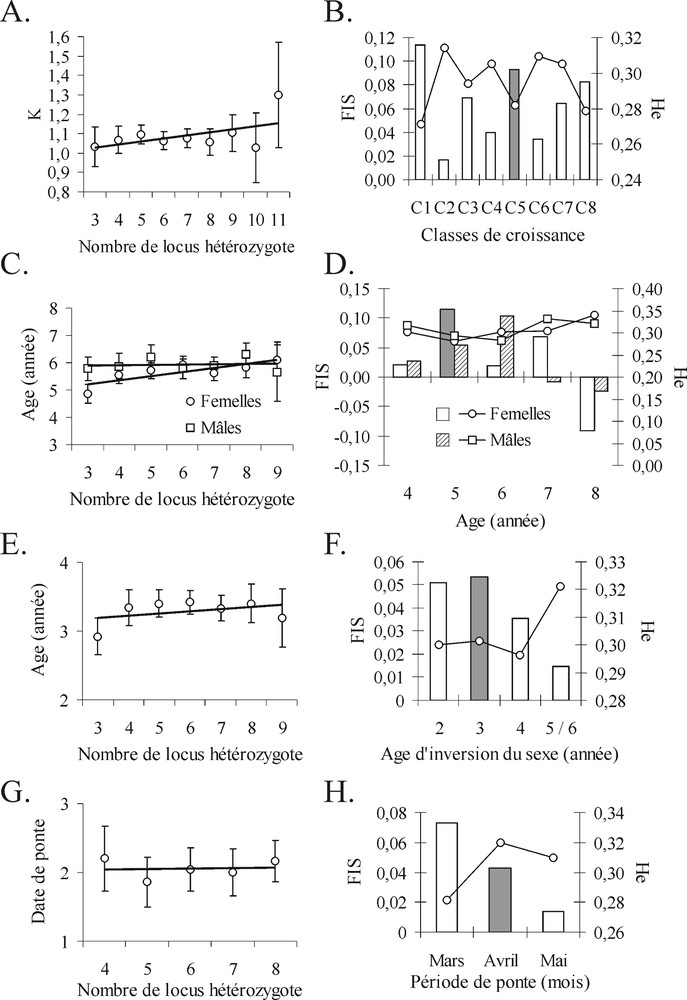
Régressions linéaires entre le nombre de locus hétérozygote (HML) et les caractères phénotypiques (graphique de gauche) A. Croissance. C. Âge en fonction du sexe. E. Âge d'inversion du sexe. G. Date de ponte : 1 = mars, 2 = avril, 3 = mai), hétérozygotie He (courbe) et des déséquilibres en hétérozygotes multilocus FIS (histogramme) (graphique de droite). B. Croissance (C1 à C8 gradient croissant). D. Âge en fonction du sexe. F. Âge d'inversion du sexe. Date de ponte. Graphiques de gauche : pour chaque point figure l'intervalle de confiance. Graphiques de droite : les valeurs de FIS significativement différentes de zéro sont représentées par des histogrammes en grisé.
Distribution des FIS par locus et multilocus (* p < 0,001) de l’hétérozygotie observée (H obs), du polymorphisme à 95% (P(0,95)) et du nombre moyen d’allèle (Nb. moy all.) pour la croissance.
| C1 (17) | C2 (92) | C3 (210) | C4 (205) | C5 (138) | C6 (113) | C7 (44) | C8 (23) | |
| PGM* | 0,484 | 0,009 | 0,117 | 0,047 | 0,148* | 0,197 | 0,005 | 0,436* |
| LDH* | — | — | 0,000 | 0,000 | — | –0,002 | 0,000 | — |
| ME* | 0,616* | 0,114 | 0,028 | –0,029 | 0,077 | 0,036 | 0,062 | 0,343 |
| EST-1* | 0,484 | 0,332* | 0,231* | 0,215* | 0,118 | 0,063 | 0,459* | –0,023 |
| AAT-1* | — | –0,043 | –0,040 | –0,028 | –0,050 | 0,078 | 0,374 | –0,023 |
| GPI-1* | 0,000 | –0,011 | –0,017 | –0,023 | –0,008 | –0,014 | –0,024 | — |
| GPI-2* | 0,000 | –0,048 | 0,069 | 0,091 | –0,044 | –0,030 | –0,062 | –0,023 |
| GPD* | 0,000 | –0,038 | –0,046 | –0,031 | –0,034 | –0,029 | –0,039 | –0,073 |
| AAT-2* | –0,028 | 0,145 | 0,108 | 0,118 | 0,126 | 0,203* | 0,391* | 0,366 |
| XO* | –0,220 | 0,016 | 0,107 | 0,054 | 0,050 | –0,029 | –0,037 | 0,036 |
| EST-3* | 0,056 | –0,056 | 0,106* | 0,144* | 0,250* | 0,104 | 0,168 | 0,250 |
| 6PGD* | –0,016 | 0,058 | 0,126* | –0,031 | 0,182* | –0,020 | –0,052 | –0,031 |
| IDH* | –0,161 | –0,159 | –0,018 | –0,061 | 0,112 | –0,008 | –0,069 | –0,117 |
| GDA* | 0,109 | –0,052 | 0,068 | 0,026 | 0,027 | –0,010 | –0,053 | –0,091 |
| SOD* | — | –0,006 | –0,010 | –0,017 | –0,004 | 0,000 | 0,000 | — |
| MDH* | 0,256 | 0,085 | 0,022 | 0,033 | 0,019 | –0,027 | 0,000 | –0,290 |
| ADA* | –0,156 | –0,017 | 0,023 | 0,017 | 0,072 | 0,051 | 0,070 | 0,083 |
| Multilocus | 0,114 | 0,017 | 0,069 | 0,04 | 0,093* | 0,034 | 0,064 | 0,083 |
| H obs. | 0,2712 | 0,3140 | 0,2942 | 0,3047 | 0,2820 | 0,3096 | 0,3052 | 0,2788 |
| P(0,95) | 0,6471 | 0,8235 | 0,7647 | 0,7059 | 0,7647 | 0,7059 | 0,8235 | 0,6471 |
| Nb. moy all. | 2,4706 | 3,2353 | 3,8235 | 4,2353 | 3,4118 | 3,8235 | 2,9412 | 2,4118 |
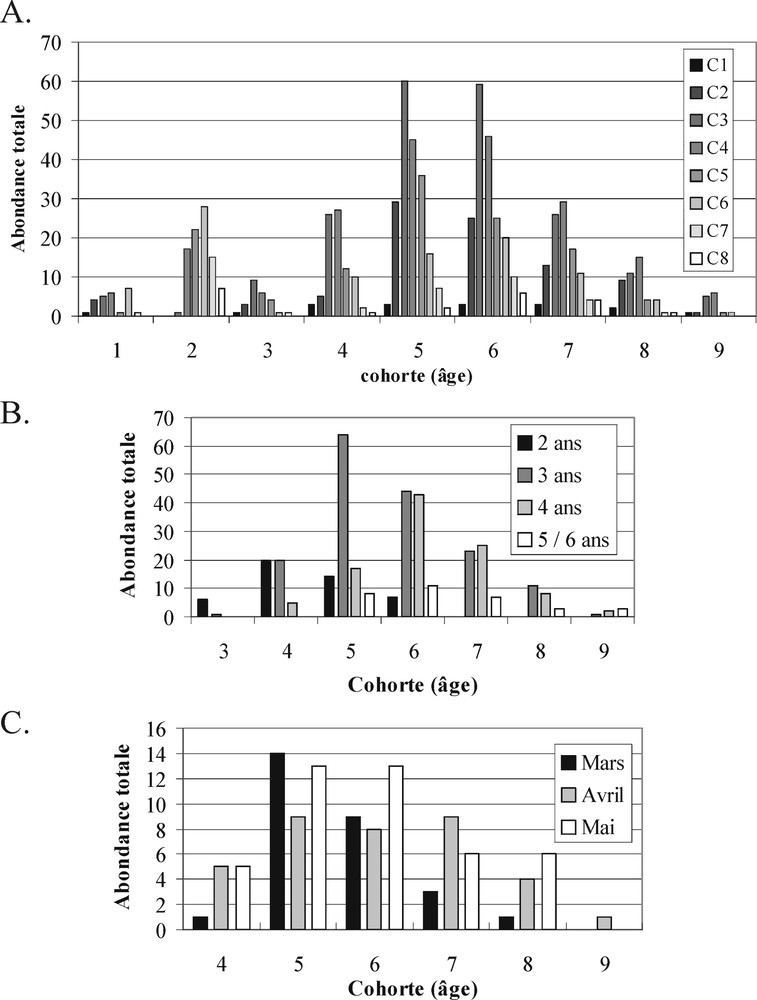
Distribution des cohortes au sein des échantillons. A. Croissance. B. Âge d'inversion du sexe. C. Date de ponte.
3.2 Âge en fonction du sexe
La relation HML en fonction de l’âge montre une augmentation significative du nombre de locus hétérozygotes chez les femelles âgées (p = 0,03) (Fig. 1C). L’hétérozygotie et les déséquilibres multilocus en hétérozygotes en fonction de l’âge sont caractérisés par des variations entre cohortes souvent différentes entre les deux sexes (excepté pour la classe d’âge quatre ans) (Fig. 1D). Les FIS sont en majorité des déficits, les seuls excès en hétérozygotes étant observés chez les individus âgés, avec une valeur trois fois plus élevée chez les femelles (FIS = –0,09). Au moins une valeur de FIS significative est présente dans huit locus. Ils correspondent aux locus cités précédemment, à l’exception de GDA*, remplacé par GPI-2*. Plus de la moitié des locus présentent des déséquilibres inverses (déficits vs excès en hétérozygotes) entre les mâles et les femelles (ADA*, AAT-2*, 6PGD*, EST-3*, ME*, GPI-2*) (Annexe 1B). Il n’existe pas de différenciation génétique entre les différents groupes (FST = –0,005 ; p = 0,08).
Distribution des FIS par locus et multilocus (* p < 0,001) de l’hétérozygotie observée (H obs), du polymorphisme à 95% (P(0,95)) et du nombre moyen d’allèle (Nb. moy. all.) pour l’âge en fonction du sexe.
| 88 | 88 | 89 | 89 | 90 | 90 | 91 | 91 | 92 | 92 | |
| F (24) | M (21) | F (60) | M (38) | F (113) | M (66) | F (108) | M (68) | F (49) | M (17) | |
| PGM* | –0,211 | 0,187 | 0,148 | 0,027 | 0,0930 | 0,142 | 0,208* | 0,272* | 0,031 | –0,180 |
| LDH* | — | — | — | — | — | — | — | 0,000 | 0,000 | — |
| ME* | –0,278 | –0,143 | 0,175 | –0,370* | –0,145 | 0,168 | 0,080 | 0,190 | 0,093 | 0,355 |
| EST-1* | –0,070 | –0,053 | 0,229 | 0,312 | 0,071 | 0,180 | 0,369* | 0,308* | –0,067 | –0,032 |
| AAT-1* | –0,022 | –0,013 | –0,063 | –0,045 | –0,034 | –0,039 | 0,084 | –0,015 | –0,032 | 0,000 |
| GPI-1* | 0,000 | — | 0,000 | –0,007 | –0,009 | –0,040 | –0,023 | –0,017 | –0,032 | –0,016 |
| GPI-2* | –0,022 | –0,034 | –0,048 | –0,072 | –0,031 | –0,075 | 0,115 | –0,032 | –0,034 | 0,660* |
| GPD* | –0,011 | –0,026 | –0,047 | –0,024 | –0,042 | –0,010 | –0,062 | –0,033 | –0,080 | –0,032 |
| AAT-2* | –0,157 | –0,164 | 0,019 | 0,095 | 0,100 | 0,079 | 0,238* | –0,040 | 0,223 | –0,333 |
| XO* | –0,172 | 0,040 | 0,039 | 0,190 | 0,005 | 0,125 | 0,070 | –0,037 | –0,118 | 0,264 |
| EST-3* | –0,030 | 0,116 | –0,023 | 0,058 | 0,055 | 0,144* | 0,189 | 0,116 | –0,163 | 0,367 |
| 6PGD* | –0,107 | 0,027 | 0,007 | 0,186 | 0,015 | 0,114 | 0,173 | –0,038 | 0,360* | –0,123 |
| IDH* | –0,243 | 0,034 | –0,016 | –0,213 | –0,138 | –0,097 | –0,006 | 0,223 | –0,066 | –0,231 |
| GDA* | –0,069 | 0,042 | –0,021 | –0,090 | 0,140 | 0,031 | 0,062 | 0,038 | –0,061 | –0,011 |
| SOD* | — | 0,000 | –0,017 | 0,000 | 0,000 | — | –0,009 | 0,000 | — | — |
| MDH* | 0,110 | –0,013 | 0,149 | –0,015 | 0,049 | 0,179 | –0,002 | –0,081 | 0,262 | –0,091 |
| ADA* | 0,009 | –0,190 | 0,262* | –0,119 | –0,054 | 0,222* | 0,161 | –0,012 | –0,020 | –0,156 |
| Multilocus | –0,090 | –0,024 | 0,068 | –0,008 | 0,019 | 0,104 | 0,115* | 0,055 | 0,021 | 0,027 |
| H obs. | 0,340 | 0,322 | 0,305 | 0,332 | 0,302 | 0,284 | 0,281 | 0,295 | 0,303 | 0,317 |
| P (0,95) | 0,71 | 0,70 | 0,82 | 0,82 | 0,65 | 0,76 | 0,82 | 0,76 | 0,76 | 0,82 |
| Nb. moy. all. | 2,71 | 2,70 | 2,94 | 3,18 | 3,18 | 3,00 | 3,29 | 3,23 | 2,88 | 2,65 |
3.3 Âge de l’inversion sexuelle
La relation HML entre le nombre de locus polymorphes et l’âge d’inversion du sexe ne présente pas de relation significative (Fig. 1E). Le suivi des FIS montre une diminution régulière des déficits des individus à inversion précoce vers les individus réalisant leur inversion tardivement (hétérozygotie plus élevée, FIS proche de l’équilibre) (Fig. 1F). Au niveau individuel, le nombre de locus en déséquilibre est plus important pour le groupe d’inversion à trois ans, qui est également le groupe présentant le plus d’individus (Annexe 2A). Il s’agit à nouveau uniquement de déficits. Les individus qui réalisent leur inversion sexuelle précocement (deux et trois ans) sont présents essentiellement dans les cohortes les plus jeunes (Fig. 2B). Il n’existe pas de différenciation génétique entre les groupes (FST = 0,0005 ; p = 0,267).
Distribution des FIS par locus et multilocus (* p < 0,001) de l’hétérozygotie observée (H obs), du polymorphisme à 95% (P(0,95)) et du nombre moyen d’allèle (Nb. moy. all.) pour l’âge d’inversion du sexe.
| F 2 ans (47) | F 3 ans (164) | F 4 ans (101) | F 5 ans + (34) | |
| PGM* | 0,041 | 0,147* | 0,135 | –0,085 |
| LDH* | — | — | — | — |
| ME* | –0,038 | –0,030 | 0,061 | –0,157 |
| EST-1* | 0,150 | 0,257* | 0,302* | 0,118 |
| AAT-1* | –0,034 | 0,037 | –0,038 | –0,031 |
| GPI-1* | –0,025 | –0,026 | — | 0,000 |
| GPI-2* | –0,036 | 0,084 | –0,030 | –0,091 |
| GPD* | –0,045 | –0,053 | –0,046 | –0,072 |
| AAT-2* | 0,398* | 0,074 | 0,061 | 0,152 |
| XO* | –0,023 | 0,057 | –0,038 | –0,129 |
| EST-3* | 0,116 | 0,001 | 0,043 | 0,074 |
| 6PGD* | –0,035 | 0,138* | 0,032 | 0,126 |
| IDH* | –0,169 | –0,023 | –0,091 | 0,039 |
| GDA* | 0,015 | 0,006 | 0,116 | 0,148 |
| SOD* | 0,000 | –0,006 | –0,005 | — |
| MDH* | 0,144 | –0,014 | 0,069 | –0,060 |
| ADA* | –0,006 | 0,168* | –0,064 | 0,010 |
| Multilocus | 0,051 | 0,054* | 0,035 | 0,015 |
| H obs. | 0,3002 | 0,3013 | 0,2964 | 0,3211 |
| P (0,95) | 0,7647 | 0,8235 | 0,7647 | 0,7647 |
| Nb. moy all. | 3,0000 | 3,4118 | 3,1176 | 2,6471 |
3.4 Date de ponte
La relation HML n’est pas significative d’une forte variance (Fig. 1G). L’hétérozygotie multilocus est maximale pour le mois d’avril. Les déséquilibres en hétérozygotes correspondent systématiquement à des déficits beaucoup plus marqués chez les individus du mois d’avril, avec un plus grand nombre de locus impliqués (FIS = 0,043, p < 0,05, PGM*, EST-1*, EST-3* et GPI-2*) que ceux des mois de mars (FIS = 0,073 ns, MDH*) et de mai (FIS = 0,014 ns) (Fig. 1H, Annexe 2B). L’indice de fixation FST sur les trois échantillons est significatif (FST = 0,01 ; p = 0,003). EST-1*, AAT-2* et MDH* sont les locus impliqués dans la différenciation. Le calcul par paire d’échantillon a permis de séparer deux groupes – d’un côté, les individus pondant en mars ; de l’autre les individus pondant en avril et mai (FST = 0,011 ; p = 0,011) – avec les locus impliqués : ME*, AAT-2* et GDA*. Le groupe « mars » est composé essentiellement d’individus âgés de cinq et six ans, alors que les autres groupes sont plus diversifiés (Fig. 2C).
Distribution des FIS par locus et multilocus (* p < 0,001) de l’hétérozygotie observée (H obs), du polymorphisme à 95% (P(0,95)) et du nombre moyen d’allèle (Nb. moy. all.) pour la période de ponte.
| Mars (41) | Avril (39) | Mai (46) | |
| PGM* | 0,060 | 0,395* | 0,051 |
| LDH* | — | — | — |
| ME* | 0,115 | 0,088 | –0,047 |
| EST-1* | 0,054 | 0,575* | –0,023 |
| AAT-1* | –0,026 | –0,041 | –0,042 |
| GPI-1* | –0,000 | –0,018 | –0,037 |
| GPI-2* | –0,065 | 0,791* | –0,026 |
| GPD* | –0,006 | –0,044 | –0,020 |
| AAT-2* | –0,013 | –0,206 | –0,052 |
| XO* | 0,271 | –0,279 | 0,055 |
| EST-3* | 0,090 | 0,211* | 0,112 |
| 6PGD* | 0,063 | –0,109 | 0,179 |
| IDH* | 0,002 | –0,143 | –0,094 |
| GDA* | 0,018 | –0,167 | –0,033 |
| SOD* | — | –0,013 | –0,000 |
| MDH* | 0,376* | 0,010 | –0,064 |
| ADA* | –0,149 | 0,086 | 0,045 |
| Multilocus | 0,073 | 0,043* | 0,014 |
| H obs. | 0,2816 | 0,3198 | 0,3095 |
| P(0,95) | 0,7059 | 0,8235 | 0,7059 |
| Nb. moy all. | 2,9412 | 2,9412 | 2,9412 |
4 Discussion
Sur l’ensemble des relations HML testées, seule l’âge des femelles apparaît significative, avec une augmentation du nombre de locus hétérozygotes avec l’âge. Des différences génétiques entre certains groupes sont observées dans le cas de la détermination du sexe et de la date de ponte. D’une part, les jeunes femelles atypiques se distinguent des autres groupes par des déficits en hétérozygotes ; d’autre part, les individus se reproduisant plus ou moins tôt dans la saison se distinguent les uns des autres par des fréquences alléliques et des déséquilibres en hétérozygotes différents. Les résultats concernant l’ensemble des caractères liés à la valeur sélective (croissance, détermination du sexe, âge d’inversion du sexe et date de ponte) mettent en évidence, comme chez les mollusques marins, la présence quasi systématique de déficits en hétérozygotes. L’analyse des paramètres décrivant la structure génétique (HML, He, FIS et FST) en fonction de la croissance et de l’âge d’inversion du sexe ne met pas en évidence de corrélation positive. La variabilité phénotypique de ces caractères ne semble pas déterminée par le patrimoine génétique.
Les résultats concernant l’âge en fonction du sexe montrent une distinction des individus femelles atypiques dont la première maturité sexuelle correspond à un développement des gonades femelles sans passage par la phase mâle. Les femelles les plus jeunes (atypiques) se distinguent par un nombre de locus hétérozygotes plus faible et des déficits en hétérozygotes plus marqués. La tendance s’inverse avec des excès en hétérozygotes chez les femelles plus âgées, même si la valeur n’est pas significative. Étant donné que le groupe des femelles âgées pouvait contenir des jeunes femelles atypiques, nous avons cherché à vérifier nos résultats avec les données concernant l’âge d’inversion du sexe. Les déficits plus marqués chez les femelles précoces confirment ce qui a été présenté précédemment. Il est possible d’interpréter ceci comme une relation de superdominance où les femelles plus âgées –et donc plus grandes– vont produire davantage de descendants. Si les hétérozygotes sont considérés comme ayant une meilleure valeur sélective, les différences de déséquilibre entre les deux types de femelles peuvent être interprétées comme un signal lié à des pressions de sélection. Le mécanisme envisagé est un contrôle génétique du sexe, ou tout du moins de l’inversion sexuelle, comme cela a pu être montré chez l’huître creuse Crassostrea gigas 〚41〛. Les auteurs montrent que certains individus naissent mâles et le restent (génotype MF), alors que d’autres individus subiront l’inversion sexuelle (génotype FF). Dans notre cas, cette différenciation est associée à des déséquilibres en hétérozygotes plus marqués chez les femelles atypiques. Concernant la superdominance, et au vu des données présentées, il est difficile de conclure entre superdominance vraie et associative. La relation HML observée et l’absence de femelles précoces dans les cohortes les plus âgées sont plutôt en faveur de la superdominance vraie avec l’existence de valeurs sélectives inégales entre les deux types de femelles. Cela a déjà été proposé entre les sexes femelle et mâle dans certains modèles mettant en jeu la sélection 〚38, 42〛. Solignac et al. 〚38〛 soulignent qu’un cas de sélection différentielle entre mâles et femelles peut conduire à des équilibres polymorphes stables et donc maintenir dans le temps des différences dans les proportions d’hétérozygotes chez les deux sexes. Pour tester la superdominance associative et donc la dépression de consanguinité, une comparaison entre individus non consanguins et descendants consanguins issus de croisements contrôlés produits au laboratoire semble être une approche indispensable. Nous pouvons également proposer une autre hypothèse qui concerne une différence dans la proportion des différents génotypes pouvant être due à un vieillissement de la cohorte en elle-même, indépendamment du sexe. Ce poisson étant d’intérêt commercial, une mortalité sélective évoluant au cours du temps du fait de l’augmentation de taille des individus est envisageable.
L’analyse des individus en fonction de leur date de ponte met en évidence des structures génétiques différentes entre individus se reproduisant plus ou moins précocement (mars vs avril/mai; FST = 0,01 ; p = 0,003). Ceci s’accompagne de forts déséquilibres en hétérozygotes et de valeurs de fréquences alléliques intermédiaires (MDH*, ME*, PGM*, EST-3* et GPI-2*) pour le groupe « avril » par rapport aux deux groupes « mars » et « mai ». Plusieurs scénarios sont envisageables. (1) Les individus se reproduisent en formant des groupes de ponte se répartissant dans l’espace et dans le temps. Si le succès reproducteur des groupes est différents, la descendance peut ne pas être systématiquement représentative du pool génétique total de la population, différenciant les groupes de ponte par effet de dérive. (2) Si les groupes de ponte sont suffisamment importants limitant les effets de dérive, il se peut qu’il existe une différence de valeur sélective entre les deux périodes de pontes. Les deux pools d’adultes posséderaient des caractéristiques biologiques intrinsèques différentes, à l’origine de cette différenciation significative. L’hypothèse de périodes de ponte génétiquement définies a déjà été proposée pour expliquer des différenciations génétiques observées entre cohortes d’un même année au sein d’une population 〚43〛. Ces deux premiers scénarios suggèrent que plusieurs cohortes seraient produites la même année. (3) Nous devons envisager une dernière hypothèse, qui serait liée à un biais de l’échantillonnage. Cette dernière est basée sur le fait que les calculs de différenciation et de déséquilibre ont été réalisés sur des groupes dont la composition en cohortes est différente (effet Wahlund temporel). Cette structuration entre cohortes d’années différentes au sein d’une population, rarement observée chez les poissons 〚44〛, a déjà été mise en évidence chez les mollusques marins, selon différents mécanismes 〚12, 43, 45, 46, 47〛. Le premier mécanisme envisagé considère que le succès reproducteur présente une forte variabilité inter-annuelle. Certaines années, une grande partie de la descendance est détruite avant d’intégrer la population adulte, et des phénomènes de dérive peuvent être envisagés, comme cela a pu être montré chez les mollusques marins 〚48, 49〛. Les auteurs ont calculé des tailles efficaces jusqu’à un million de fois plus petites que la population totale. Jorde et Ryman 〚50〛 ainsi que Laikre et al. 〚51〛 ont montré des changements importants dans les fréquences alléliques pouvant aller jusqu’à 0,24, qu’ils attribuent à un phénomène de dérive résultant d’une réduction de la taille efficace du nombre de femelles. Le second mécanisme est basé sur une différenciation génétique des cohortes par sélection résultant de la variabilité des conditions environnementales. Dans notre étude, la sélection n’agirait pas sur un seul locus, comme cela a pu être montré chez le loup, Dicentrarchus labrax, lors de son acclimatation en eau douce 〚16〛, mais sur près d’un tiers des locus. Ces résultats vont à l’encontre des phénomènes de sélection vraie, souvent limités à un seul locus. Enfin, le dernier mécanisme envisagé met en jeu la migration d’adultes de zones adjacentes. À première vue, la migration tend à homogénéiser l’ensemble des zones potentiellement colonisables et s’oppose à une différenciation génétique. La seule possibilité d’obtenir une différenciation entre cohortes d’une même population résulte de l’apport d’individus extérieur à la population via la phase pélagique (œufs, larves), comme cela a pu être mis en évidence chez la morue (Gadus morhua) 〚44〛. Ce mécanisme ne peut être envisagé que si ces apports sont ponctuels. La variabilité de la composition en cohortes de ces trois groupes ne permet pas d’éliminer l’hypothèse d’un effet Wahlund temporel.
Aucune relation ou différenciation n’a pu être mise en évidence pour la croissance. Même si ce type de relation peut paraître évident en aquaculture 〚14, 15, 52〛 où les conditions environnementales d’élevage contrôlées permettent une expression non perturbée des gènes sélectionnés, certains travaux ont réussi à le mettre en évidence en populations naturelles 〚12, 53–56〛. Les caractéristiques intrinsèques de l’espèce y jouent un rôle déterminant, même si d’autres travaux montrent que cette relation évolue d’une population à l’autre chez la même espèce. Pogson et Fevolden 〚57〛 ont mis en évidence chez la morue atlantique, Gadus morhua, une corrélation entre l’hétérozygotie et la croissance uniquement dans l’une des deux populations étudiées. Les conditions environnementales jouent un rôle dans la génération de corrélations entre l’hétérozygotie et les indices de la valeur sélective. Comme le souligne Gaffney 〚55〛 et Booth et al. 〚58〛, il faut être prudent dans la généralisation de tels résultats, puisqu’il existe presque autant de relations « hétérozygotie–croissance » positives que de relations négatives ou nulles. S’ajoute à cela la difficulté d’obtenir des résultats reproductibles permettant une validation de la régularité du phénomène. Enfin, il est important de souligner que la régression linéaire retenue dans le traitement de nos données présente deux inconvénients, soulevés par David et al. 〚10〛. D’une part, ce modèle considère que tous les locus ont le même effet sur l’hétérozygotie et, d’autre part, les homozygotes pour les différents allèles d’un même locus ont la même valeur sélective. Toutes ces remarques montrent qu’il est difficile d’affirmer qu’aucune relation génotype–phénotype n’existe dans le cas de Diplodus sargus.
En ce qui concerne la généralisation des déficits en hétérozygotes, plusieurs hypothèses ont été proposées, essentiellement à la suite de travaux sur les mollusques bivalves 〚12, 56, 59〛. En effet, ce type de résultat a souvent été rapporté mais n’a pas trouvé d’explication définitive. Les origines de tels déficits sont classées en trois groupes d’hypothèses.
(1) Les hypothèses liées à la structure non panmictique de la population. Les individus ne se reproduisent pas au hasard, mais entre individus apparentés, comme c’est le cas dans les régimes de reproduction consanguine. Les gènes hérités ont beaucoup plus de chance de se retrouver à l’état homozygote, entraînant ainsi un déficit en hétérozygote. Les déficits peuvent aussi résulter du mélange de cohortes génétiquement différenciées, comme on l’a expliqué précédemment (effet Wahlund temporel).
(2) Les hypothèses sélectives sont souvent citées pour expliquer les déficits en hétérozygotes. Le locus LAP* chez les mollusques marins dont la fréquence est influencée par la température et la salinité a fait l’objet de plusieurs études 〚56, 60〛. Toto et Vergara 〚61〛 proposent une sélection contre les hétérozygotes chez Ostrea chilensis pour les individus en post-installation. Le principe d’une sélection variable au cours du temps a également été envisagé par différents auteurs. Berrebi 〚62〛 propose une sélection cyclique saisonnière pour expliquer l’évolution de la structure génétique du flet (Platichthys flesus). Chez les invertébrés marins à déplacements limités, l’instabilité spatiale et temporelle de la structure génétique semble être potentiellement induite par ce type de sélection 〚63, 64〛. Johnson et Black 〚45〛 parlent de genetic patchiness pour traduire l’instabilité de la structure génétique observée.
(3) Les hypothèses faisant intervenir la non-détection du polymorphisme concernent les allèles nuls, l’aneuploïdie et les erreurs de lecture des gels d’électrophorèse. L’ensemble des individus ont été typés pour chaque locus et l’interprétation des zymogrammes a été réalisé par deux lecteurs, ce qui tend à réduire fortement les probabilités d’allèles nuls et d’erreur de lecture pour expliquer les déficits en hétérozygotes. L’aneuploïdie, quant à elle, ne peut être écartée.
5 Conclusion
Comme le souligne Gaffney 〚55〛, il est souvent difficile de conclure entre les différentes hypothèses par le simple suivi de populations naturelles si l’on n’a que très peu d’informations sur l’histoire de l’environnement d’une cohorte et sur le déroulement du recrutement. Il est alors nécessaire de retourner au laboratoire afin de réaliser des expérimentations sur les variables démographiques, génétiques et environnementales où elles peuvent être contrôlées plus facilement. Il paraît également important de bien replacer les individus étudiés dans leur cycle de vie, comme le montrent les différents commentaires que suscitent certains articles 〚65–67〛. En effet, étant donné que l’allocation d’énergie varie au cours de la vie de l’individu, avec par exemple une forte allocation à la croissance chez les jeunes stades et inversement une priorité à la reproduction chez les stades ayant atteint la maturité sexuelle, il est raisonnable de penser que la relation « hétérozygotie–valeur sélective » puisse évoluer au cours du temps. Dans notre cas, il serait intéressant de pouvoir analyser cette relation plus tôt dans le cycle biologique, à savoir au niveau larvaire, en prenant par exemple comme indice de croissance l’indice de condition et en réalisant des expérimentations de croisement en laboratoire telles que celles développées par Fergusson 〚68〛 sur la truite, Oncorhyncus mykiss. Enfin, on peut se poser la question de savoir si les résultats significatifs qui ont été obtenus reflètent la réalité ou correspondent à une simple corrélation. Les résultats obtenus ne permettent pas d’éliminer complètement l’action de la sélection et soulèvent le problème de la différenciation génétique entre cohortes 〚69〛.
Remerciements
L’auteur remercie R. Galzin et S. Planes et les arbitres pour leurs commentaires apportés au manuscrit. Cette étude a été financé par le Programme national sur le déterminisme du recrutement (PNDR–France Globec).
Abridged version
Surveys dealing with genotype–phenotype relationship in marine molluscs showed significant correlation between the heterozygosity of allozyme loci (MLH) and characters carrying selective forces such as survival and growth. Such a relationship, which results from variable selective mortalities, has been shown to occur both in aquaculture and in natural stocks. The common idea suggests that individuals carrying higher heterozygosity are favoured (overdominance). This hypothesis is based on evidence that the metabolic activity is reduced in heterozygote individuals and that they show a faster turnover of protein. Consequently, heterozygotes are able to allocate more energy to reproduction, this is the case of direct overdominance. A second mechanism can induce an overdominance, the inbreeding depression. The genetic load tends to be revealed with an increase of homozygotes for deleterous alleles (associative overdominance).
The present study will test genotype–phenotype relations on a natural stock of a protandrous Mediterranean fish, Diplodus sargus. We investigated whether there was a relationship between the allozyme structure and phenotypic characters linked to growth and reproduction of each individual.
A total of 842 individuals were collected, from which muscle and liver were homogenised and centrifuged. Electrophoresis was then performed on 12% starch gels and acetate gels. Otoliths (sagitta) were also removed from each fish to estimate individual age and growth computed from back-calculation. Overall, we analysed genotype–phenotype relationships with respect to growth, age distribution of each sex, age at sex reversal and spawning period. We investigate these phenotypes in relation to the number of heterozygote loci per individual (MLH), the mean heterozygosity (He), and the FIS within a sample. Finally, we looked at differentiation among the samples (FST).
A survey of 17 polymorphic loci showed significant correlations between genotype structure, the age distribution of females and the spawning periods. We observed an increase of MLH ratio in old females compared to young ones. This difference was also found in FIS values, which showed an excess of heterozygotes in old females (–0.09) compared with a significant deficit in young females (0.12). There was no significant relationship between MLH or FIS values and spawning period. However, females spawning in March showed significant allelic frequency variations from one month to the next (April and May) (FST; p = 0.011). In addition, fish spawning in April showed high heterozygosity values and a significant deficit of heterozygotes. Finally, no significant relationships appeared between genetic indexes and individual growth parameters or the age at sex reversal.
Several hypotheses can be possible regarding the relationship that links genotypic structure and the age distribution of sex. First, we can consider some variable selection between regular and non-regular selection. Such selective mechanism could arise directly from the genetic fitness or non-directly from variable fishing pressure on old and young females. An overdominance seems to be detected in favour to old females. These results suggest a sex determination for both type of female (with or without sex inversion). With our data, it is difficult to distinguish between direct overdominance at enzyme loci and associative overdominance induced by inbreeding depression.
The genetic difference between fish spawning at different times may have resulted from different evolutionary forces depending on the period the eggs and larvae are released to the pelagic environment. The difference among individuals spawning at different periods may have a genetic origin that results from genetic drift resulting from a variable reproductive success and/or different selective forces according to the spawning period. It is also possible that individuals that come from different populations have been adapted for early or late spawning and maintain their characters while mixed. The presence of heterozygotes deficiencies suggests a temporal Wahlund effect between cohorts of the population.
We could find relationship while looking at individual growth. However, such genotype–phenotype relationships may be found within the entire population of the species or spatially restricted to particular populations. This was the case for the Atlantic cod, Gadus morhua, that showed these relationships differed from one population to the next. In fact, environmental condition will also interact with individual plasticity and show different patterns.
Concerning heterozygote deficiencies, several hypotheses were proposed following study on marine molluscs. The origins of deficiencies are cluster in three groups. (1) Hypotheses linked to no panmictic structure of the population. It concerns in inbreeding and temporal Wahlund effect. (2) Selective hypotheses are often proposed but stay poorly documented. Selective phenomena are difficult to detect due to the instability of the genetic structure. Authors speak about genetic patchiness. (3) Hypotheses of no detection of polymorphism concern null alleles, the aneuploidy and a possible misscoring.
It is often difficult to arrive at one conclusion when dealing with genotype–phenotype relationships and how they apply to natural stocks. In fact, fish stocks are simultaneously affected by the environment, the history or the parental genetic through several distinct phases, each one occurring in various places. The complex life cycle of a fish, where individuals pass through different environments, makes it difficult to identify the origin of the genetic difference found among groups. Future work would need to take into account the various influence on fish during the different phase of the life cycle of most benthic species. In addition, we need to look for more informative biological indexes such as body condition in both natural and artificially controlled situations.



