1 Introduction
Parmi les 530 virus répertoriés actuellement, environ 100 arbovirus (virus transmis par des arthropodes), dont la plupart sont épizootiques (certains transmis sans le concours d’arthropodes), sont connus pour être la cause de maladies humaines 〚1〛. Ces virus forment un groupe hétérogène d’agents, liés par certaines caractéristiques épidémiologiques et faisant appel à des méthodes communes d’isolement et d’identification. Nous parlerons donc, de façon globale et pour des raisons de commodité, d’arbovirus. Les arbovirus sont enregistrés au catalogue dans une des cinq classes : arbovirus prouvé (fièvre jaune, dengue, encéphalite à tique, fièvre de la vallée du Rift, Chikungunya...), arbovirus probable (Bwanba), arbovirus possible (Birao), probablement non-arbovirus (Ebola, Marburg) et non-arbovirus (Lassa, Hantaan).
Beaucoup d’arbovirus provoquent une infection infraclinique, détectée seulement par la présence d’anticorps. La majorité des infections arbovirales se limitent à quelques jours de fièvre, avec symptômes pseudo-grippaux, mais certaines peuvent être la cause de syndromes pulmonaires, neurologiques ou hémorragiques graves. Les moyens de prophylaxie ou de traitement contre ces infections sont rares et le diagnostic rapide pour l’identification de l’agent causal demeure un élément déterminant pour limiter leur propagation en milieu hospitalier ou familial.
Nous sommes concernés depuis peu par deux facteurs d’importance sur le plan du risque infectieux que représentent plusieurs de ces virus : (1) l’émergence, dans des régions jusque-là indemnes d’infection, d'un virus inconnu ou en provenance de pays où il circule sous forme endémique ou épidémique et (2) le risque microbiologique volontaire, pour lequel le choix des virus et de leur mode de propagation au sein d’un groupe de population demeure incontrôlable.
2 Matériel d’étude
Les arbovirus appartiennent à plusieurs familles, avec, à l’intérieur de chacune d’entre elles, plusieurs genres, les espèces présentant des caractères antigéniques communs étant rassemblées en groupes. Enfin, chaque espèce peut être divisée en sous-espèces ou en types génétiques, grâce notamment aux nouvelles méthodes d’identification immunologique (réactivité des anticorps monoclonaux) ou génétique (séquençage).
Les arbovirus et virus épizootiques appartiennent à cinq familles majeures : Flaviviridae, Togaviridae, Bunyaviridae, Arenaviridae, Filoviridae. Quelques rares « arbovirus » appartiennent à d’autres familles ou genres (Poxviridae, Paramyxoviridae, Reoviridae, Rhabdoviridae...). Le Tableau 1 indique les cinq différentes familles majeures d’arbovirus importants dans le cadre du bioterrorisme, pour leur caractère morbide ou mortel et pour leur diffusion possible par aérosol ou par des animaux vecteurs.
Principaux « arbovirus et virus épizootiques » mortels pour l’homme.
| Arbovirus | Non-arbovirus |
| Flaviviridae | Bunyaviridae |
| Dengue | Hantavirus |
| Fièvre jaune | (Hantaan, Séoul, Sin Nombre, Andès...) |
| Encéphalites à tique (TBE, maladie de la forêt de Kyasanur, fièvre hémorragique d’Omsk) | |
| Filoviridae | |
| Togaviridae | Marburg |
| Encéphalite équine du Venezuela | Ebola |
| Encéphalite équine de l’Ouest | |
| Encéphalite équine de l’Est | Arenaviridae |
| Chikungunya | Lassa |
| Guanarito | |
| Bunyaviridae | Machupo |
| Fièvre de la vallée du Rift | Junin |
| Fièvre hémorragique de Congo–Crimée | Sabia |
3 Résultats
Les cinq familles majeures d’arbovirus pathogènes pour l’homme possèdent un génome composé d’ARN, associé à une capside et entouré d’une enveloppe lipidique, acquise, soit dans les membranes intracellulaires, soit par bourgeonnement à la membrane plasmique au moment de l’exocytose (Fig. 1).
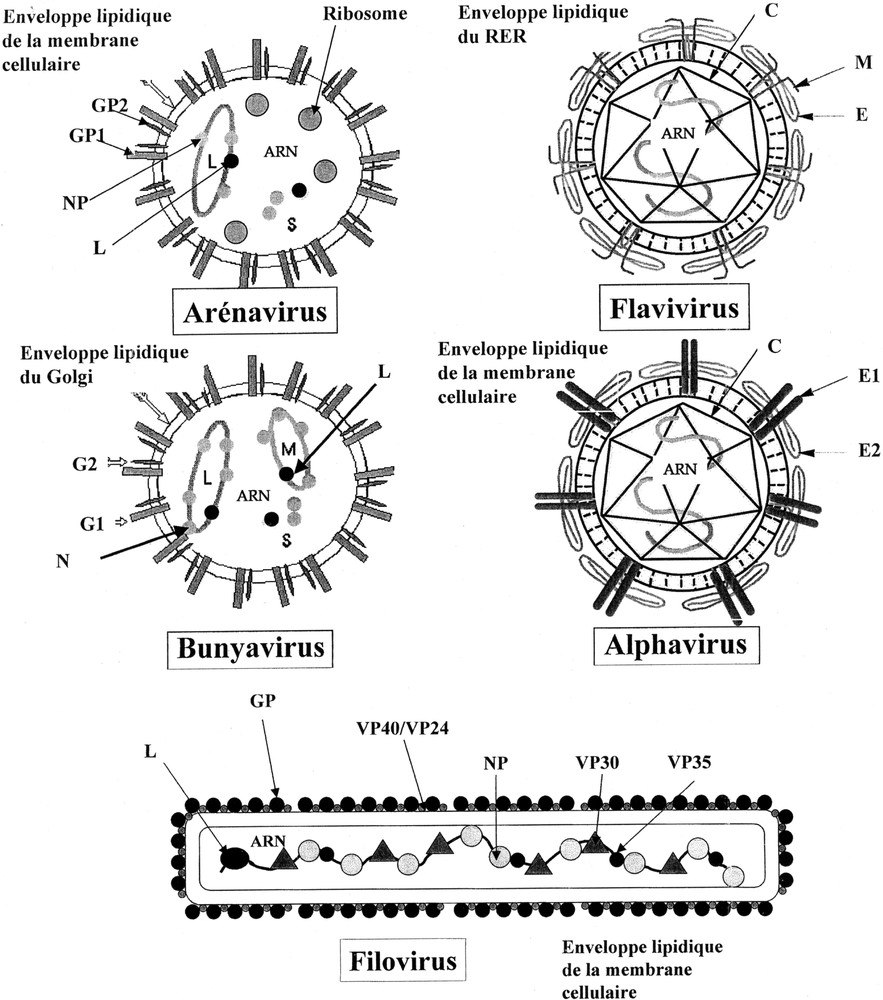
Structure des principaux arbovirus et virus épizootiques.
Leurs structures génomiques et leurs modes de réplication sont très différents (Fig. 2), mais tous ces virus se multiplient dans une grande variété de cellules, en produisant dans le surnageant cellulaire un taux important de particules virales infectieuses. Pour chaque espèce virale, il existe une grande variété de sous-types viraux, dont les séquences génétiques sont très précieuses pour suivre leur origine, leur propagation et leur évolution. Il faut noter que, dans le cas des Bunyaviridae, des Arenaviridae et des Reoviridae, l’existence de plusieurs molécules d’ARN génomique favorise la diversité génétique par réassortiment. L’existence de tels événements dans la nature a été démontrée pour les virus de la fièvre de la vallée du Rift 〚2〛. Des recombinaisons génétiques donnant naissance à de nouveaux génotypes viraux sont également possibles, comme cela a été démontré pour les virus de la dengue ou de l’encéphalite équine du Venezuela 〚3, 4〛. Enfin, des mutations ou des délétions sélectionnées au cours de l’adaptation des virus à de nouvelles conditions de leur cycle naturel (changement d’hôtes ou d’environnement) peuvent affecter des structures fonctionnelles de l’ARN ou de protéines virales.

Structure des génomes des principaux arbovirus et virus zoonotiques.
Il est également possible de fabriquer des virus chimériques, en remplaçant une partie d’un génome viral par celle d’une autre espèce, comme cela a été réalisé chez les flavivirus à des fins vaccinales. Tous ces événements naturels peuvent être reproduits au laboratoire pour étudier la fonction des protéines virales dans le tropisme, la réplication et la pathogenèse du virus, pour comprendre la physiopathologie de l’infection ou encore pour développer de nouveaux vaccins 〚5〛. La fabrication de nouveaux virus à des fins bioterroristes semble donc réalisable.
Les arbovirus et les virus zoonotiques se maintiennent dans la nature par des cycles plus ou moins complexes, dans lesquels les animaux servent, soit de réservoirs, soit d’hôtes amplificateurs, et où l’homme est le plus souvent un hôte accidentel.
Le véritable réservoir des arbovirus stricto sensu est l’arthropode qui, une fois infecté au cours d’un repas sanguin, le reste toute sa vie. Le virus est alors transmis aux hôtes amplificateurs (oiseaux, porc) ou à l’homme par piqûre au cours d’un repas sanguin, avec la possibilité de transmettre également le virus à la descendance (transmission transovarienne ou verticale). Pour les hantavirus ou les arénavirus, le réservoir est un rongeur qui transmet le virus par ses sécrétions 〚6〛. L’homme s’infecte en consommant les rongeurs ou de la nourriture souillée, ou par inhalation de poussières infectieuses.
Les réservoirs des virus Ebola et Marburg ne sont pas identifiés. La chauve-souris est sans doute un élément important dans le cycle de transmission du virus Marburg 〚7〛. Comme chez l’homme, le taux de mortalité des grands singes infectés par le virus Ebola est important, mais la source de leur infection demeure inconnue 〚8〛.
De manière générale, les arbovirus ne sont pas considérés comme transmissibles par aérosols, car leur enveloppe lipidique est très sensible à l’action de la sécheresse ou de l’humidité excessive, aux rayons X du soleil, à la chaleur, etc.
Des infections nosocomiales ou de laboratoire ont été rapportées pour plusieurs de ces virus, soit par piqûres ou coupure avec du matériel contaminé, soit par inhalation de virus concentré, soit par contact direct avec le malade ou ses sécrétions. La prise en charge des malades et les barrières sanitaires pratiquées en milieu hospitalier diminuent largement le risque de transmission et de diffusion du virus. Dans le cas de virus potentiellement transmissibles par aérosol, la protection du personnel par des masques et des respirateurs munis de filtre Hepa est recommandée 〚9〛.
Le risque biologique au cours d’un acte bioterroriste est limité, car la diffusion du virus est elle-même limitée, soit par instabilité du virus en aérosol, soit par absence de vecteur. Néanmoins, nous pouvons citer deux exemples où l’acte bioterroriste pourrait avoir un effet de surprise pour les scientifiques et un impact psychologique et médical sur la population : l’attaque individuelle par injection de virus ou la diffusion d’animaux ou d’arthropodes infectés dans une région jusque-là indemne du virus en question. L’introduction volontaire, au moyen de moustiques infectés, de souches de virus particulièrement virulentes de la dengue hémorragique à Cuba en 1981 ou de l’encéphalite de West Nile aux États-Unis en 1999, avait été soupçonnée pendant un moment.
La virulence de ces différents arbovirus varie d’une épidémie à une autre, selon les périodes et les localisations. Comme dans beaucoup de maladies virales, la virulence est multifactorielle et dépend de la réceptivité de l’hôte et de sa capacité à répondre à l’infection, liées en particulier à des facteurs génétiques, et de la structure des virus, qui détermine leur tropisme et leur niveau de réplication. Le niveau de virémie est un facteur pronostique important dans toutes les infections dues aux arbovirus 〚10, 11〛.
Plusieurs facteurs de virulence liés à la structure des génomes et des protéines ont été identifiés, grâce à des analyses comparatives de séquences virales et d’études d’effets pathogènes des virus sur des cellules infectées en culture ou chez des animaux de laboratoire, rongeurs, singes, ou sur d’autres espèces naturelles. Cependant, l’effet cytopathogène in vitro ou la mortalité d’un animal de laboratoire ne présume pas forcément de la virulence du virus chez l’homme. Par ailleurs, la virulence des virus est généralement suivie par l’analyse de souches modifiées par rapport à la souche parentale du fait de leur passage en culture ou sur l’animal. Il existe de nombreux exemples où des arbovirus qui ont acquis une virulence pour la souris se sont avérés atténués pour les primates 〚12〛.
La réponse immune à l’infection est un facteur essentiel dans les manifestations cliniques des viroses. Plusieurs arbovirus et les virus des fièvres hémorragiques, en particulier, induisent une immunosuppression qui favorise leur multiplication au cours des premiers jours de l’infection 〚13〛. Inversement, on considère que la réponse immune induite par l’infection des arbovirus chez l’homme est paradoxalement la cause d’un dérèglement des fonctions homéostasiques, par l’intermédiaire de la libération de molécules solubles produites en quantité excessives, la production d’anticorps facilitants, la formation d’immuno-complexes atteignant les reins, ou encore d’auto-anticorps 〚14〛.
Chez l’homme, les manifestations cliniques des arbovirus sont très variées. Elles peuvent être classées schématiquement en quatre catégories.
3.1 Les formes asymptomatiques
Elles sont de découverte sérologique fortuite.
3.2 Les syndromes fébriles algiques
Les infections couvrent une large gamme de symptômes, allant de la simple fièvre à une pseudo-grippe caractéristique. Le tableau clinique est représenté généralement par une fièvre, qui dure de un à trois jours, avec des céphalées accompagnées de myalgies et d’arthralgies. Les nausées avec vomissements et diarrhées sont parfois observées. Ce type de symptomatologie peut être provoqué pratiquement par tous les virus pathogènes pour l’homme, y compris ceux pouvant provoquer vers des formes beaucoup plus graves.
À ce stade, le diagnostic clinique est très difficile, sinon impossible. Il peut être confondu avec un accès palustre, une grippe, ou un banal syndrome fébrile.
Le diagnostic de certitude ne peut être apporté que par la mise en évidence du virus (isolement sur système cellulaire ou sur animal sensible, détection d’antigène viral ou de séquences virales spécifiques par RT–PCR) ou par le suivi de l’apparition des anticorps de type IgM et des anticorps neutralisants. Il y a souvent une amélioration de l’état clinique au troisième jour, suivie d’une rechute, durant laquelle quelques adénopathies et parfois un rash exanthématique apparaissent. La guérison est la règle, mais est suivie d’une asthénie prolongée.
Certains virus donnent des caractéristiques cliniques particulières, comme le virus Chikungunya, qui provoque une fièvre pouvant être récurrente, mais surtout marquée par des arthralgies des extrémités pouvant aboutir à de véritables arthrites. Le virus de la fièvre de la vallée du Rift peut provoquer des complications au niveau de la rétine de l’œil.
3.3 Les syndromes méningo-encéphalitiques
Certains arbovirus possèdent un neurotropisme marqué, pouvant provoquer des lésions le plus souvent irréversibles et parfois mortelles chez l’homme. Le syndrome commence par une maladie d’apparence bénigne ou un début brutal. Le syndrome d’encéphalite est marqué par une soudaine poussée de fièvre, des vomissements, une raideur de la nuque, des vertiges, de la somnolence, une sensation de désorientation, suivie de confusion, et une progression vers un état de stupeur et de coma. La fréquence d’apparition de ce type de symptômes varie avec les virus ; ils sont surtout observés avec les arbovirus américains (encéphalites équines, de St Louis...) et asiatiques (encéphalite japonaise, de la vallée de Murray...). Les encéphalites à arbovirus sont rares en Afrique tropicale ; cependant, le virus West Nile a été responsable d’encéphalites en Afrique du Nord au cours des cinq dernières années.
3.4 Les syndromes hémorragiques
Après une phase fébrile d’environ trois jours et une courte période de rémission, le syndrome hémorragique peut apparaître soudainement. Deux tableaux cliniques sont généralement décrits, en réalité difficiles à différencier.
Le premier tableau, principalement lié à la dengue de forme hémorragique, est caractérisé par un collapsus cardiovasculaire brutal, provoqué par la fuite extravasculaire du plasma et l’hémoconcentration qui en résulte, se traduisant par des extrémités froides et moites, des pétéchies, des hémorragies, avec un choc qui devient rapidement irréversible.
La deuxième forme est caractérisée par un début brutal, comprenant la phase congestive et une inflammation conjonctivale. Après une courte période de rémission, le syndrome caractéristique apparaît au troisième ou au quatrième jour, avec des pétéchies, des ecchymoses, des saignements du nez et des gencives, puis des hématémèses, du melaena, des méthrorragies, une oligurie, une albuminurie et une possible hématurie, avec élévation du taux d’urémie. Suit un collapsus cardiovasculaire, avec chute de tension, accélération du pouls et choc terminal. L’évolution est très rapide pour la fièvre de la vallée du Rift et porte souvent sur deux ou trois jours. Ce tableau est commun à tous les virus entraînant des fièvres hémorragiques, transmis par des moustiques (dengue, fièvre jaune, fièvre de la vallée du Rift), par des tiques (fièvre hémorragique de Congo–Crimée), par des rongeurs (fièvre de Lassa, de Bolivie, du Venezuela ou d’Argentine) ou celles dont le réservoir est encore inconnu (Marburg et Ebola).
Il faut noter que certains arbovirus sont extrêmement pathogènes pour des animaux et peuvent, soit avoir un impact économique important, soit causer des épizooties à risque pour l’homme s’il est sensible au virus. L’isolement viral ou des enquêtes sérologiques permettent de contrôler la diffusion de ces virus chez les animaux. Comme chez l’homme, ces maladies animales peuvent prendre trois aspects : infection d’évolution bénigne, encéphalite ou syndrome hémorragique. Les encéphalites sont rencontrées principalement chez les chevaux, avec souvent, pour le même virus (encéphalites équines américaines), un taux de mortalité plus élevé pour le cheval que pour l’homme. En Afrique, on retrouve des maladies atteignant les bovins et les caprins (fièvre de la vallée du Rift), les moutons (Naïrobi sheep disease, Wesselsbron), les équidés (African horse sickness) ou les porcs (African swine fever).
Mis à part les virus Lassa et de la fièvre hémorragique de Crimée–Congo, pour lesquels la Ribavirine, un analogue de nucléosides, a montré son efficacité lorsqu’elle est administrée dès les tous premiers jours de l’apparition des symptômes 〚15〛, il n’existe pas de thérapeutique spécifique pour traiter les arboviroses et les fièvres hémorragiques 〚16〛. Ce domaine de recherche doit être développé rapidement pour faire face à la survenue d’une épidémie ou d’une attaque bioterroriste. Les difficultés rencontrées sont l’apparition soudaine des symptômes et la fenêtre relativement restreinte d’action des drogues antivirales, auxquelles s’ajoute la difficulté d’un diagnostic rapide de certitude face à la diversité des virus et à l’absence de symptômes cliniques spécifiques.
Il existe plusieurs vaccins, soit à usage humain – contre les flavivirus (fièvre jaune, encéphalite japonaise, encéphalite à tique 〚17〛) et contre les arénavirus (fièvre hémorragique d’Argentine 〚18〛) –, soit à usage vétérinaire – contre les togavirus (encéphalite équine du Venezuela) et contre les bunyavirus (fièvre de la vallée du Rift). Il s’agit, soit de virus atténués, soit de virus inactivés au formol. Plusieurs vaccins non commercialisés existent contre les hantavirus, le virus de la fièvre hémorragique de Congo–Crimée, le virus Ross River, tandis que d’autres sont à l’étude contre la dengue, West Nile, Ebola, Lassa. Là encore, un effort particulier doit être développé pour aboutir à des stratégies prophylactiques destinées à protéger à la fois le corps médical et scientifique et les populations, en cas de risque avéré, contre des infections mortelles.
4 Conclusions
Les arboviroses et viroses enzootiques sont trop souvent négligées, car sporadiques, sévissant dans des régions tropicales où la couverture médicale est faible et où ces arboviroses ne représentent pas une priorité. Quelques-unes de ces maladies représentent néanmoins une menace pour notre société : il est urgent de les prendre en considération et de trouver des moyens efficaces pour nous en protéger.


