1 Introduction
La systématique du genre Mytilus pose un problème de détermination des espèces à l’échelle mondiale à cause d’une forte plasticité phénotypique génératrice d’une grande variabilité des caractères morphologiques 〚1〛, en raison de la possibilité d’hybridation à l’état naturel entre taxons différents à chaque fois qu’ils se trouvent en sympatrie 〚2–4〛 et également à cause du caractère cosmopolite de sa distribution géographique antitropicale, qui englobe en effet de larges territoires côtiers des zones médiolittorale et infralittorale des cinq continents. Sur la base des caractères morphologiques (formes de la coquille et de l’empreinte du muscle adducteur antérieur, nombre de dents cardinales), huit taxons ont été décrits. Il s’agit de M. edulis, M. galloprovincialis, M. planulatus, M. platensis, M. chilensis, M. desolationis, M. coruscus et M. californianus. Le statut taxinomique, souvent incertain, attribué à ces taxons variait entre espèces pour certains auteurs et sous-espèces pour d’autres 〚5〛. Ces controverses, dues à l’insuffisance des caractères morphométriques à établir une diagnose satisfaisante 〚5–9〛, ont conduit à la recherche d’autres critères, plus fiables, particulièrement les marqueurs allozymiques et l’ADN mitochondrial et nucléaire. En effet, les travaux pionniers acquis par la technique d’électrophorèse des protéines enzymatiques aux États-Unis 〚10〛 et en Europe 〚11, 12〛 ont contribué à revoir la systématique de ce genre, de sorte qu’actuellement, trois taxons seulement sont valides et reconnus, à savoir M. edulis, M. galloprovincialis et M. trossulus 〚3〛. Ces travaux montrent également qu’à chaque fois que deux taxons se trouvent en sympatrie, ils s’hybrident sur toute la zone de chevauchement ou de contact de leurs aires de distribution géographique, tout particulièrement M. edulis et M. galloprovincialis 〚11–15〛. Par conséquent, le problème du statut attribué à ces entités taxinomiques demeure posé. Ainsi, pour certains auteurs 〚4, 8, 16, 17〛, M. galloprovincialis représente une sous-espèce de M. edulis, qui se serait différenciée dans la partie méridionale de l’aire de distribution, notamment en Méditerranée, à la suite des événements paléoclimatiques du Pléistocène 〚18〛. Pour d’autres 〚3〛, M. edulis et M. galloprovincialis représentent deux espèces différentes, malgré l’absence de critère diagnostique total. Quoi qu’il en soit, les deux taxons sont génétiquement très différenciés, au point que certains locus allozymiques (MPI, EST-D, ODH et, à un moindre degré, GPI et LAP) sont partiellement diagnostiques 〚4〛. Les haplotypes d’ADN-mt 〚19, 20〛 et, plus récemment, les locus mac-1 〚21〛 et Glu-5’ 〚22〛 d’ADN nucléaire confirment cette divergence. Le polymorphisme à ces marqueurs constitue aujourd’hui un outil performant et par conséquent des plus utilisés dans la diagnose de ces taxons.
Au Maroc, le statut taxinomique des moules du genre Mytilus est resté pendant longtemps incertain. Les travaux antérieurs basés sur la morphologie 〚5, 23–25〛 mentionnent la présence des deux taxons M. edulis et M. galloprovincialis sur les côtes atlantique et méditerranéenne. Des résultats préliminaires obtenus à partir de quelques locus allozymiques 〚26–28〛 et à partir d’un seul locus d’ADN nucléaire 〚21〛 avaient signalé la présence de M. galloprovincialis.
Le présent travail a pour objectifs de clarifier le statut taxinomique de Mytilus galloprovincialis, des côtes marocaines depuis l’extrémité est de la Méditerranée (Nador) jusqu’aux zones les plus méridionales du Sahara marocain (baie de Dakhla), et d’appréhender le niveau de différenciation génétique entre les populations peuplant les côtes atlantiques et méditerranéennes. Les marqueurs allozymiques utilisés et un échantillonnage représentatif, tant par le nombre de locus et de stations analysés que par la taille de ces échantillons, devraient permettre d’atteindre ces objectifs.
2 Matériel et méthodes
2.1 Échantillonnage
Huit stations couvrant et représentant l’ensemble du littoral marocain depuis la zone la plus orientale de la Méditerranée jusqu’aux régions les plus méridionales du Sahara marocain ont été échantillonnées (Fig. 1). Il s’agit de Nador (NDR) en Méditerranée, de Ksar-Sghir (KSG), située au large du détroit de Gibraltar et d’Asilah (ASL), de Guy-ville (GVL), d’Essaouira (ESR), de Taghazout (TGZ), de Tantan (TNT) et de Dakhla (DKL), sur la côte atlantique. De plus, un échantillon témoin, composé de 23 individus, représentant le taxon M. galloprovincialis (SET) provenant de Sète (côte méditerranéenne française), est étudié et servira de référence dans la diagnose des populations marocaines. En effet, conformément aux travaux antérieurs (cités plus haut), le polymorphisme aux locus les plus diagnostiques (MPI, EST-D, ODH, GPI et LAP) est envisagé ici et servira d’outil dans ce sens.
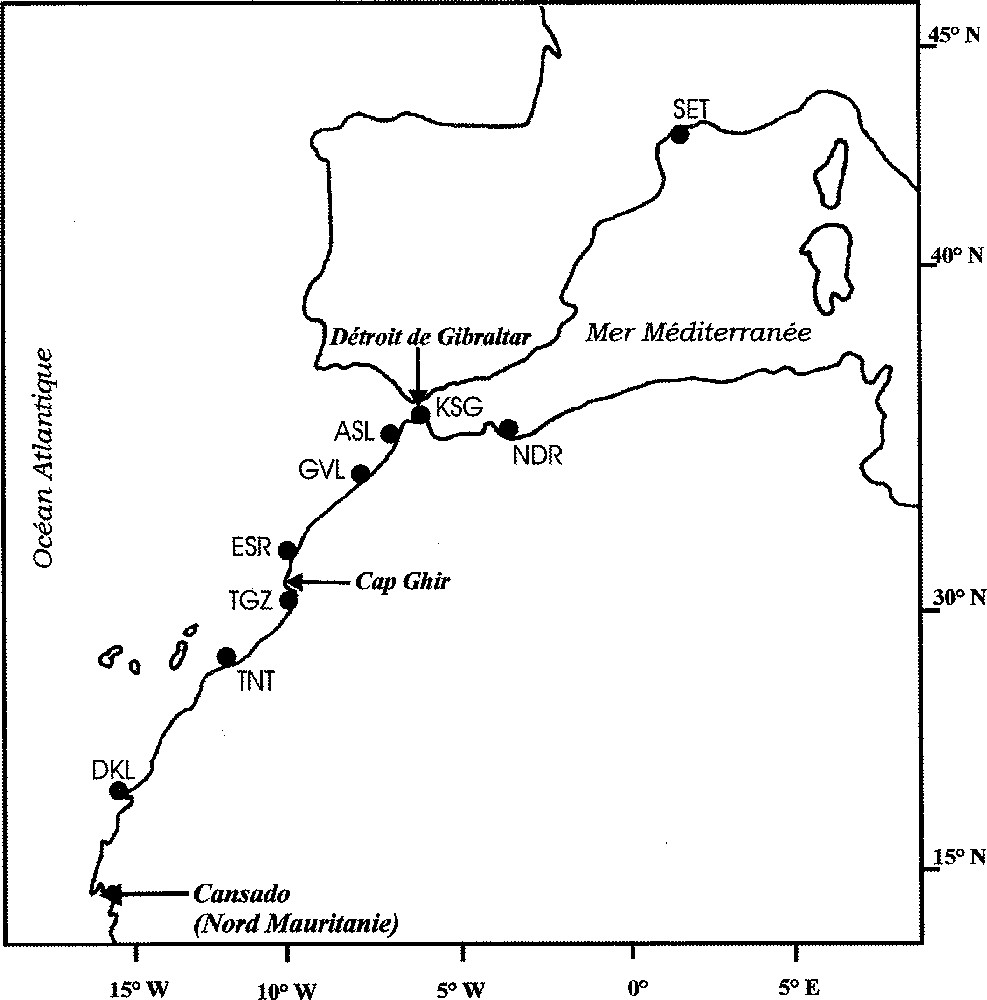
Localisation des stations d’échantillonnage des populations de moule du genre Mytilus sur les côtes du Maroc : NDR (Nador) en Méditerranée, KSG (Ksar Sghir) au large du détroit de Gibraltar, et ASL (Asilah), GVL (Guy ville), ESR (Essaouira), TGZ (Taghazout), TNT (Tantan) et DKL (Dakhla) sur le littoral atlantique, ainsi qu’un échantillon de référence (SET) représentant le taxon Mytilus galloprovincialis provenant de Sète (Méditerranée française).
Dans chaque station, un échantillon de 50 individus adultes récoltés à l’intérieur d’une large superficie de la zone intertidale exondant à marée basse a été prélevé au hasard, en évitant notamment de prélever plusieurs individus à partir d’un même agrégat ou d’échantillonner le long d’une même ligne parallèle ou perpendiculaire au niveau de marée. Les collectes ont eu lieu au cours de trois campagnes échelonnées entre janvier 1997 et juin 2000. Ainsi les échantillons DKL et GVL ont été collectés en janvier 1997, NDR, KSG et ASL, en avril 1997 et enfin ESR, TGZ et TNT en juin 2000.
2.2 Électrophorèse
Les individus prélevés ont été ramenés vivants au laboratoire dans une glacière. Dès leur arrivée, ils sont stockés au congélateur (–30 °C) jusqu’aux dissections. Sur chaque individu disséqué, des fragments de muscles adducteurs et de glande digestive ont été prélevés, homogénéisés dans du tampon Tris-HCl 0,1 M pH 6,8 et centrifugés à 12 000 tours/minute. Les surnageants contenant les extraits d’enzymes solubles ont été récupérés et conservés à –30 °C. Les électrophorèses ont été réalisées sur des gels horizontaux d’amidon à 12% et à voltage constant (100 V). Treize systèmes enzymatiques (AAT, EST-D, GPI, IDH, LAP, MDH, ME, MPI, ODH, 6-PGD, PGM, SDH et SOD) codés par 16 locus sont retenus dans la présente étude. Ces mêmes locus sont communément étudiés dans les populations naturelles du genre Mytilus, comme en témoignent les travaux antérieurs 〚3, 4, 8–15〛, ce qui offre et justifie des comparaisons avec ces derniers. Les conditions expérimentales d’électrophorèse des différents systèmes enzymatiques retenus dans la présente étude sont récapitulées dans le Tableau 1.
Conditions expérimentales d’électrophorèse des enzymes étudiées chez la moule Mytilus galloprovincialis Lmk. des côtes atlantique et méditerranéenne du Maroc.
| Système enzymatique | E.C.N.(*) | Nombre de locus | Tissu(s) | Tampon |
| AAT : Aspartate amino transférase | 2.6.1.1 | 2 | m.a., m.d. | Tris-citrate pH 7 : T.C. 7 〚29〛 |
| EST-D : Estérase-D | 3.1.1.1 | 1 | m.d. | Phospho-citrate pH 6,3 : P.C. 6,3 〚30〛 |
| GPI : Glucose-phosphate isomérase | 5.3.1.9 | 1 | m.a. | Tris-citrate pH 8 : T.C. 8 〚31〛 |
| IDH : Isocitrate déshydrogénase | 1.1.1.42 | 2 | m.a. | T.C. 7 〚29〛 |
| LAP : Leucine amino peptidase | 3.4.11.– | 1 | m.d. | P.C. 6,3 〚30〛 |
| MDH : Malate déshydrogénase | 1.1.1.37 | 1 | m.a. | Tris-citrate EDTA pH 8,6 : T.C.E. 8,6 〚32〛 |
| ME : Malico-enzyme | 1.1.1.40 | 2 | m.a. | T.C.E. 8,6 〚32〛 |
| MPI :Mannose-6-phosphate isomérase | 5.3.1.8 | 1 | m.a. | T.C. 8 〚31〛 |
| ODH : Octopine déshydrogénase | 1.5.1.11 | 1 | m.a. | T.C. 8 〚31〛 |
| 6-PGD : 6-Phosphoglucose déshydrogénase | 1.1.1.44 | 1 | m.a. | Tris-citrate pH 6,7 : T.C. 6,7 〚30〛 |
| PGM : Phosphoglucomutase | 2.7.5.1. | 1 | m.a. | T.C. 8 〚31〛 |
| SDH : Sorbitol déshydrogénase | 1.1.1.14 | 1 | m.a. | T.C.E. 8,6 〚32〛 |
| SOD : Superoxyde dismutase | 1.15.1.1 | 1 | m.a. | T.C.E. 8,6 〚32〛 |
2.3 Traitements statistiques
Les résultats bruts obtenus par électrophorèse sont soumis à des traitements statistiques permettant de calculer les fréquences alléliques aux locus polymorphes et d’analyser le degré de différenciation génétique inter-stations par :
- • le paramètre Fst 〚33, 34〛, d’après l’estimateur θ 〚35〛, permettant de tester l’hétérogénéité des fréquences alléliques entre différents échantillons pris par paires à chaque locus polymorphe ; des valeurs moyennes multilocus de θ sont ensuite calculées en prenant en considération l’ensemble des locus polymorphes analysés ; θ varie de 0 (absence totale d’hétérogénéité donc de différenciation) à 1 (divergence maximale) ; les valeurs négatives qui apparaissent parfois sont dues simplement au mode de calcul des estimateurs et sont automatiquement assimilées à 0 ; le caractère significatif des valeurs trouvées est vérifié d’après le test des permutations 〚36〛, après ajustement séquentiel de Bonferroni 〚37〛 ;
- • la distance génétique, calculée d’après l’indice de Nei 〚38〛, communément appelé distance standard (Ds) de Nei, estimée à partir des fréquences alléliques observées pour chaque locus ; des moyennes Ds tenant compte de l’ensemble des locus étudiés (y compris les monomorphes) sont ensuite calculées ; seules les valeurs Ds obtenues entre échantillons ou groupes d’échantillons dont les fréquences alléliques sont significativement différentes présentent un intérêt réel et peuvent être interprétées 〚39〛 ; dans ce cas, elles servent à établir les relations phylogénétiques entre les populations étudiées représentées sous forme de dendrogramme UPGMA.
Les traitements statistiques sont effectués par la version 4 du logiciel GENETIX 〚36〛.
3 Résultats
3.1 Locus diagnostiques
L’analyse des fréquences alléliques (Tableau 2) montre clairement que tous les échantillons marocains s’apparentent à l’échantillon témoin de Sète et, par conséquent, qu’ils appartiennent tous au taxon M. galloprovincialis. En effet, au niveau du locus MPI (le plus diagnostique), le même allèle fixé à Sète existe dans toutes les stations marocaines. En plus, au niveau des autres locus partiellement diagnostiques, ODH, EST-D, LAP et GPI, les fréquences des allèles 100 (les plus communs) pour chacun de ces locus dans l’échantillon témoin et dans ceux du Maroc sont très proches : les petites différences qui existent sont, en fait, du même ordre de grandeur que celles que l’on trouve communément entre populations conspécifiques de bivalves marins, en particulier celles de M. galloprovincialis 〚8, 9, 15, 40〛. Le caractère significatif de ces différences sera testé ci-après (§ 3.2) et servira à établir le degré de différenciation entre les populations méditerranéennes et atlantiques, appartenant toutes au taxon M. galloprovincialis.
Fréquences alléliques à 16 locus enzymatiques dans huit échantillons de moules du genre Mytilus des côtes méditerranéenne et atlantique du Maroc et un échantillon témoin de Mytilus galloprovincialis Lmk. provenant de Sète (Méditerranée française).
| SET | NDR | KSG | ASL | GVL | ESR | TGZ | TNT | DKL | ||
| AAT2 | 23* | 49 | 50 | 50 | 50 | 59 | 50 | 50 | 48 | |
| 93 | 0,024 | 0,020 | 0,040 | 0,040 | 0,040 | 0,017 | 0,010 | — | — | |
| 100 | 0,905 | 0,970 | 0,940 | 0,960 | 0,940 | 0,975 | 0,990 | 0,990 | 1,000 | |
| 110 | 0,071 | 0,010 | 0,020 | — | 0,020 | 0,008 | — | 0,010 | — | |
| EST-D | 20 | 48 | 50 | 50 | 50 | 60 | 47 | 45 | 50 | |
| 90 | — | 0,080 | 0,020 | 0,020 | 0,040 | 0,033 | 0,020 | 0,020 | 0,010 | |
| 100 | 0,976 | 0,830 | 0,860 | 0,870 | 0,830 | 0,858 | 0,950 | 0,960 | 0,970 | |
| 112 | — | 0,050 | 0,050 | 0,080 | 0,100 | 0,017 | — | — | — | |
| 120 | 0,238 | 0,040 | 0,070 | 0,030 | 0,030 | 0,092 | 0,030 | 0,020 | 0,020 | |
| GPI | 22 | 50 | 48 | 50 | 50 | 60 | 50 | 50 | 50 | |
| 75 | — | 0,020 | 0,020 | 0,020 | 0,020 | 0,017 | — | — | — | |
| 80 | 0,024 | 0,080 | 0,050 | 0,070 | 0,080 | 0,067 | 0,030 | 0,030 | 0,020 | |
| 100 | 0,786 | 0,530 | 0,540 | 0,580 | 0,580 | 0,658 | 0,730 | 0,740 | 0,760 | |
| 105 | 0,190 | 0,330 | 0,340 | 0,320 | 0,260 | 0,242 | 0,240 | 0,230 | 0,220 | |
| 110 | — | 0,040 | 0,050 | 0,010 | 0,040 | 0,017 | — | — | — | |
| 125 | — | — | — | — | 0,020 | — | — | — | — | |
| IDH1 | 21 | 50 | 50 | 47 | 50 | 60 | 58 | 48 | 50 | |
| 70 | 0,024 | 0,030 | 0,020 | — | 0,020 | 0,017 | 0,040 | 0,040 | 0,030 | |
| 75 | 0,143 | 0,140 | 0,100 | 0,100 | 0,090 | 0,208 | 0,320 | 0,300 | 0,290 | |
| 80 | — | — | — | 0,020 | 0,110 | — | — | — | — | |
| 100 | 0,833 | 0,830 | 0,870 | 0,820 | 0,760 | 0,775 | 0,630 | 0,660 | 0,680 | |
| 110 | — | — | 0,010 | 0,060 | 0,020 | — | 0,010 | — | — | |
| LAP | 23 | 50 | 50 | 50 | 50 | 60 | 50 | 50 | 46 | |
| 74 | — | 0,020 | 0,020 | 0,020 | 0,020 | — | — | — | — | |
| 80 | 0,047 | 0,020 | — | 0,060 | 0,060 | 0,017 | 0,020 | — | — | |
| 90 | 0,262 | 0,390 | 0,380 | 0,280 | 0,300 | 0,367 | 0,290 | 0,280 | 0,280 | |
| 100 | 0,667 | 0,500 | 0,510 | 0,550 | 0,540 | 0,550 | 0,650 | 0,660 | 0,700 | |
| 105 | 0,024 | 0,070 | 0,090 | 0,090 | 0,080 | 0,066 | 0,040 | 0,060 | 0,020 | |
| ODH | 23 | 47 | 49 | 50 | 50 | 60 | 50 | 50 | 46 | |
| 95 | 0,071 | 0,020 | — | — | — | 0,017 | — | — | — | |
| 100 | 0,595 | 0,680 | 0,770 | 0,750 | 0,790 | 0,808 | 0,910 | 0,920 | 0,920 | |
| 110 | 0,047 | 0,100 | 0,050 | 0,070 | 0,080 | 0,058 | — | 0,020 | — | |
| 120 | 0,287 | 0,200 | 0,180 | 0,180 | 0,130 | 0,117 | 0,090 | 0,060 | 0,080 | |
| 6-PGD | 20 | 49 | 50 | 50 | 50 | 60 | 50 | 48 | 50 | |
| 70 | 0,048 | 0,080 | 0,060 | 0,020 | 0,050 | 0,033 | — | — | 0,010 | |
| 100 | 0,904 | 0,910 | 0,900 | 0,940 | 0,930 | 0,970 | 1,000 | 1,000 | 0,990 | |
| 125 | 0,048 | 0,010 | 0,040 | 0,040 | 0,020 | — | — | — | — | |
| PGM | 23 | 50 | 49 | 50 | 50 | 56 | 50 | 50 | 45 | |
| 80 | 0,071 | 0,040 | 0,020 | — | 0,040 | — | 0,020 | — | — | |
| 90 | 0,262 | 0,250 | 0,250 | 0,260 | 0,220 | 0,267 | 0,160 | 0,090 | 0,080 | |
| 100 | 0,643 | 0,650 | 0,560 | 0,590 | 0,490 | 0,542 | 0,760 | 0,830 | 0,820 | |
| 105 | — | — | — | — | 0,060 | — | — | — | — | |
| 110 | 0,024 | 0,060 | 0,170 | 0,150 | 0,190 | 0,191 | 0,060 | 0,080 | 0,100 | |
| AAT1 | 18 | 43 | 42 | 46 | 40 | 51 | 40 | 44 | 45 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| IDH2 | 20 | 46 | 49 | 50 | 44 | 53 | 50 | 46 | 50 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| MDH | 23 | 48 | 45 | 50 | 50 | 58 | 47 | 50 | 49 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| ME1 | 23 | 50 | 49 | 50 | 50 | 60 | 50 | 48 | 50 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| ME2 | 23 | 48 | 50 | 50 | 50 | 60 | 50 | 50 | 48 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| MPI | 23 | 47 | 49 | 50 | 47 | 56 | 50 | 46 | 50 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| SDH | 22 | 50 | 47 | 48 | 50 | 59 | 50 | 50 | 50 | |
| 100 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
3.2 Paramètre Fst
Le calcul du paramètre Fst d’après l’estimateur θ en considérant à chaque fois les stations deux à deux et en testant toutes les combinaisons possibles (Tableau 3) montre (1) que l’échantillon de Sète présente une différenciation significative avec les populations du Maroc aussi bien méditerranéennes qu’atlantiques, et (2) qu’en ce qui concerne les stations marocaines, on note clairement l’existence de deux groupes génétiquement différenciés : le premier (Atlantique sud) comprend les stations qui se trouvent au sud d’Essaouira, à savoir TGZ, TNT, et DKL ; le second (Méditerranée–Atlantique nord) réunit les stations atlantiques d’Essaouira ESR et celles situées plus au Nord GVL et ASL, ainsi que celles du littoral méditerranéen KSG et NDR. En effet, les valeurs de θ obtenues entre les stations d’un même groupe sont faibles et traduisent une hétérogénéité génétique statistiquement non significative. En revanche, pour toutes les combinaisons associant une station du premier groupe à une autre du second, les valeurs du paramètre θ sont élevées et montrent une divergence significative au seuil de 1% (p < 0.01) d’après le test des permutations, établi ici sur la base de 1000 tirages aléatoires.
Moyennes multilocus du paramètre θ 〚35〛 estimées entre huit échantillons de moule (Mytilus galloprovincialis) des côtes atlantique et méditerranéenne du Maroc, plus un échantillon témoin provenant de la Méditerranée française (Sète).
| NDR | KSG | ASL | GVL | ESR | TGZ | TNT | DKL | |
| SET | 0,0132* | 0,0193* | 0,0104* | 0,0178* | 0,0190* | 0,0356* | 0,0500* | 0,0481* |
| NDR | –0,0047 | –0,0024 | 0,0028 | 0,0047 | 0,0403* | 0,0517* | 0,0564* | |
| KSG | –0,0067 | –0,0026 | –0,0019 | 0,0439* | 0,0558* | 0,0587* | ||
| ASL | –0,0061 | –0,0017 | 0,0322* | 0,0438* | 0,0464* | |||
| GVL | –0,0013 | 0,0333* | 0,0447* | 0,0477* | ||||
| ESR | 0,0204* | 0,0325* | 0,0349* | |||||
| TGZ | –0,0108 | –0,0095 | ||||||
| TNT | –0,0128 |
3.3 Distance génétique Ds
Les valeurs de Ds obtenues entre les neuf stations étudiées prises deux à deux sont reportées dans le Tableau 4. Elles confirment le résultat précédent, obtenu d’après le paramètre Fst. En effet, là aussi, les valeurs de Ds mettent en évidence les deux groupes précédemment révélés par l’indice θ. À l’intérieur de chaque groupe, ces valeurs sont très faibles, variant de 10–3 à 4 × 10–3 à l’intérieur du groupe Méditerranée–Atlantique nord, et de 0 à 10–3 à l’intérieur du groupe Atlantique sud. Entre les représentants des premier et deuxième groupe, elles sont nettement plus élevées et varient de 6 × 10–3 (ESR/TGZ) à 13 × 10–3 (KSG/DKL). Sur le dendrogramme UPGMA (Fig. 2) construit à partir de la matrice des distances Ds (Tableau 4), les deux groupes précédemment identifiés s’individualisent nettement. Le nœud représentant le point de dichotomie entre les deux groupes correspond à une valeur de Ds proche de 11 × 10–3 unité. Les branchements à l’intérieur de chaque groupe n’ont pas d’importance, car l’hétérogénéité des fréquences alléliques testée par le paramètre Fst n’est pas significative. L’échantillon témoin de Sète, malgré sa différenciation par rapport à tous les échantillons marocains, se rattache nettement au groupe Méditerranée–Atlantique nord.
Matrice des distances Ds 〚38〛 entre huit échantillons de moule (Mytilus galloprovincialis) des côtes atlantique et méditerranéenne du Maroc, plus un échantillon témoin provenant de la Méditerranée française (Sète).
| Ds × 103 | NDR | KSG | ASL | GVL | ESR | TGZ | TNT | DKL |
| SET | 8 | 9 | 7 | 9 | 8 | 10 | 12 | 11 |
| NDR | 2 | 2 | 4 | 4 | 10 | 12 | 12 | |
| KSG | 1 | 2 | 2 | 11 | 12 | 13 | ||
| ASL | 1 | 2 | 8 | 10 | 10 | |||
| GVL | 2 | 9 | 10 | 11 | ||||
| ESR | 6 | 8 | 8 | |||||
| TGZ | 0 | 1 | ||||||
| TNT | 0 |
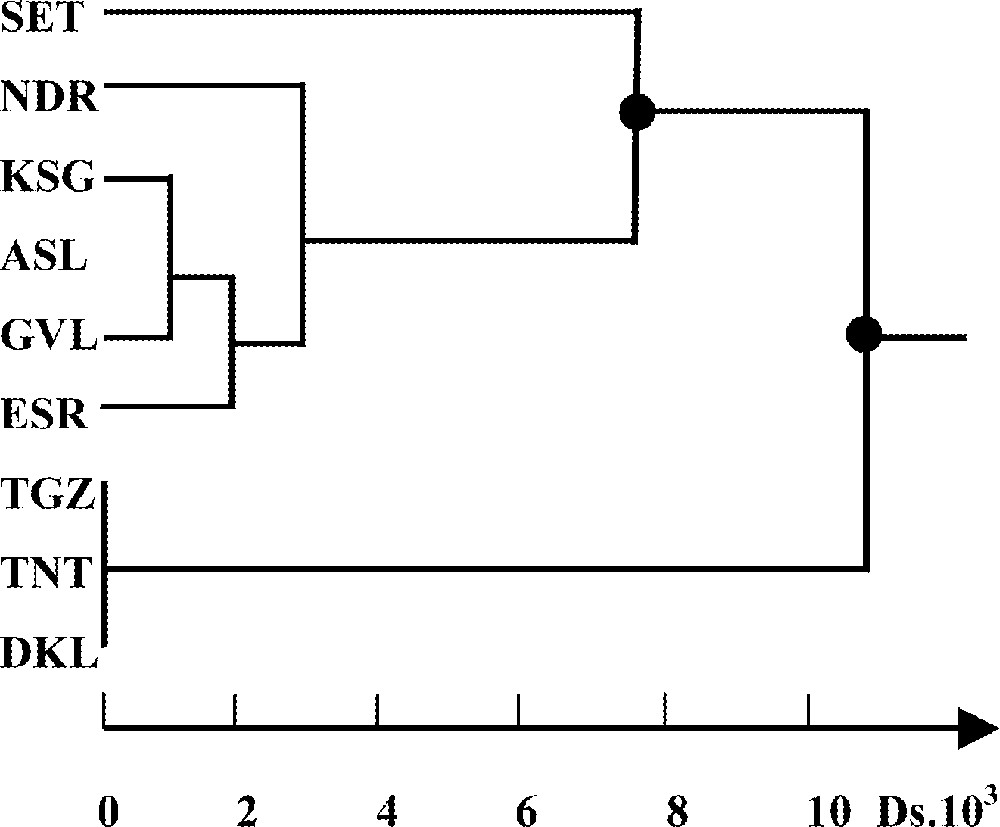
Dendrogramme UPGMA établi à partir des distances Ds 〚38〛 à 16 locus enzymatiques entre huit échantillons de moules (Mytilus galloprovincialis) des côtes atlantique et méditerranéenne du Maroc, plus un échantillon témoin provenant de la Méditerranée française (Sète). • : points de dichotomie les plus significatifs.
4 Discussion
Le résultat obtenu d’après l’analyse des locus ayant une haute valeur diagnostique comme MPI et à moindre degré ODH et EST-D montre que les populations du littoral marocain appartiennent exclusivement au taxon M. galloprovincialis, depuis l’extrémité est de la Méditerranée, représentée par Nador (NDR), jusqu’aux zones les plus confinées du Sahara marocain (baie de Dakhla) sur le littoral atlantique. Ce résultat concorde avec les données antérieures obtenues par l’analyse des marqueurs allozymiques et/ou d’ADN mitochondrial, qui montrent que M. galloprovincialis occupe une aire de distribution géographique comprenant le littoral atlantique et méditerranéen de la péninsule ibérique 〚20, 40, 41〛, la Méditerranée française 〚15〛 et également avec celles d’ADN nucléaire au locus mac-1 〚21〛, qui révèlent la présence de M. galloprovincialis, encore plus au sud de Dakhla, précisément dans la région de Cansado en Mauritanie (Fig. 2).
Les analyses statistiques (Fst) ont mis en évidence l’existence de deux groupes de populations génétiquement différenciés, répartis sur deux aires géographiques contiguës : la zone Atlantique sud, englobant l’ensemble du littoral atlantique marocain au sud d’Essaouira, d’une part, et la zone Méditerranée–Atlantique nord, comprenant la tranche du littoral atlantique allant d’Essaouira jusqu’au détroit de Gibraltar au nord et intégrant aussi la côte méditerranéenne du Maroc, d’autre part. La frontière entre ces deux zones se situe quelque part entre Essaouira et Agadir. Cette discontinuité, clairement établie par une hétérogénéité significative au niveau des fréquences alléliques, peut s’expliquer par les éléments suivants.
- • (1) Une rupture brusque du flux génique : chez la moule, comme d’ailleurs chez tous les Invertébrés marins sessiles ou sédentaires à l’état adulte, le flux génique est sous le contrôle exclusif de la phase larvaire pélagique. Cette phase du cycle biologique, pourtant de courte durée (une à trois semaines 〚5〛), contribue efficacement à la dispersion. En effet, les larves pélagiques peuvent effectuer des migrations de long trajet 〚42〛 sous l’action des grands courants marins (mouvement passif). À l’échelle locale, les larves peuvent également effectuer des déplacements grâce aux cils qui entourent leur corps (mouvement actif). Ceci permet de comprendre l’homogénéité génétique sur de longues distances, en particulier, dans notre cas, entre la Méditerranée et l’Atlantique, qui peut s’expliquer par un effet homogénéisateur du courant de surface sortant de la Méditerranée 〚43〛 et baignant la côte atlantique du Maroc, mais soulève en même temps une autre question, qui est de savoir pourquoi le flux génique s’interrompt brusquement, ou du moins fléchit considérablement, entre les populations du premier groupe et celles du second. La réponse tient vraisemblablement au fait que, justement au niveau du cap Ghir, exactement entre Essaouira et Taghazout (Fig. 1), le courant marin longeant la côte change complètement de direction et s’oriente vers l’archipel des Canaries 〚44〛, ce qui empêcherait par conséquent les larves pélagiques de la moitié nord d’atteindre les zones adjacentes situées au sud du cap Ghir, d’où la rupture brusque du flux génique observée ici.
- • (2) Un changement important au niveau des conditions écologiques du milieu : il est important de signaler à ce sujet que le cap Ghir constitue, pour bon nombre d’espèces marines, une limite méridionale infranchissable, qui délimite leur aire de répartition géographique, notamment des bivalves comme Litophaga litophaga 〚45〛 et l’huître plate Ostrea edulis 〚46, 47〛. Si de tels changements se confirmaient au niveau des variables abiotiques, telles que la température, et coïncidaient avec un dépassement des seuils de tolérance, en particulier au cours des stades de développement post-embryonnaire et juvénile, ils compromettraient les chances de survie de ces organismes dans ce type de milieu. Chez la moule, des effets sélectifs différentiels dans ces deux zones biogéographiques pourraient être à l’origine de la différenciation génétique entre les deux compartiments, révélée dans la présente étude, ou du moins y contribuer, à côté des facteurs hydrodynamiques.
- • (3) Dans la mesure où M. galloprovincialis n’est pas décrite au-delà du Nord de la Mauritanie 〚21〛, hormis sur les côtes de l’Afrique du Sud, où sa présence est expliquée par l’introduction de l’espèce dans cette région 〚48〛, le groupe Atlantique sud, mis en évidence dans le présent travail, occupe donc la limite méridionale de l’aire de distribution de M. galloprovincialis sur le littoral atlantique. Sur le plan évolutif, une telle situation s’accompagne inévitablement de changements significatifs au niveau des fréquences alléliques dans les populations périphériques, sous l’action combinée de plusieurs facteurs, les uns intrinsèques de nature génétique (mutations différentielles), les autres exogènes, liés essentiellement à des effets de sélection naturelle et de dérive génétique, surtout en présence de barrières physiques fonctionnelles s’opposant au flux génique, telles que celle soulevée ici, manifestée par le « grand courant des Canaries », que l’on peut baptiser front cap Ghir–Canaries. Ce qui accentue par conséquent le degré de différenciation génétique des populations périphériques par rapport à celles de la partie centrale de l’aire de répartition.
Concernant l’absence de discontinuité (Tableau 3) entre les populations méditerranéennes (Nador et Ksar Sghir) et leurs plus proches voisines géographiques du littoral atlantique (Asilah, Guy ville et Essaouira), ce résultat concorde parfaitement avec les données obtenues à partir du locus mac-1 d’ADN nucléaire 〚21〛 sur des populations marocaines de Méditerranée (Tétouan, se trouvant à ∼30 km à l’est de Ksar Sghir étudiée ici) et de la côte atlantique (Témara, située à moins de 3 km de la localité de Guy ville, analysée dans la présente étude). En effet, aucune divergence significative de fréquences alléliques n’a été détectée par l’utilisation du paramètre Fst (utilisé également dans la présente étude) entre Tétouan et Témara. Il concorde également avec les résultats obtenus sur les populations atlantiques et méditerranéennes (jusqu’à Almeria) de la péninsule Ibérique, par l’utilisation des marqueurs allozymiques 〚40〛 et d’ADN-mt 〚20, 41〛. Cette homogénéité génétique est expliquée par le déversement important des eaux atlantiques en Méditerranée occidentale à travers le détroit de Gibraltar, accompagné d’une dispersion massive des larves. La mer d’Alboran, délimitée par le front Almeria–Oran 〚49〛 est considérée, à ce juste titre d’ailleurs, comme une annexe de l’Atlantique. La divergence de la population de Sète par rapport aux autres populations marocaines de Méditerranée (Nador et Ksar Sghir) peut s’expliquer justement par le fait que Sète se trouve plus à l’est de cette frontière marine, qui joue le rôle de barrière à la dispersion larvaire. Toutefois, d’après les résultats obtenus au locus mac-1 〚50〛, les populations européennes de M. galloprovincialis vivant sur la côte atlantique de la péninsule Ibérique divergent sensiblement par rapport à leurs homologues méditerranéennes, sous l’effet d’une introgression possible le long du littoral atlantique d’Europe du génotype M. galloprovincialis par celui de M. edulis.
Enfin, même si la population de Sète est génétiquement différenciée par rapport à toutes ses homologues marocaines, comme le prouve le paramètre Fst (Tableau 3), elle présente néanmoins nettement plus d’affinités phylogénétiques avec le groupe Méditerranée–Atlantique nord. Ce dernier constat est illustré sur le dendrogramme UPGMA établi d’après le calcul de la distance standard Ds de Nei (Fig. 2) et peut s’expliquer vraisemblablement par une histoire commune de mise en place des peuplements en relation avec les événements paléoclimatiques qu’a connu la Méditerranée au cours du Plio-Quaternaire 〚18〛.
Remerciements
Les auteurs tiennent à remercier particulièrement F. Bonhomme (université Montpellier-2) pour ses critiques et commentaires pertinents concernant le manuscrit, P. Borsa (université Montpellier-2) pour leur avoir fourni l’échantillon de Sète, le secrétariat d’État à la Recherche scientifique (gouvernement marocain) pour le soutien financier et J. Rosa pour avoir accepté de présenter cette note.
Abridged version
In Morocco, the systematic status of the mussel populations belonging to the genus Mytilus have been for a long time uncertain and confused because of the use of only morphometric criteria in diagnosis. According to these criteria, two presumptive taxa M. edulis and M. galloprovincialis have been described along the Mediterranean and Atlantic coasts of Morocco. We report here a multilocus allozyme characterisation of eight Moroccan populations from Mediterranean Sea (Nador and Ksar Sghir) and the Atlantic coast (Asilah, Guy-ville, Essaouira, Taghazout, Tantan, and Dakhla). All these populations belong to the M. galloprovincialis species according to allelic frequencies at the most diagnostic loci MPI, EST-D, ODH, GPI and LAP using a Mediterranean sample from Sète (southern France) as a reference of the M. galloprovincialis taxis.
Allelic frequencies heterogeneity at eight polymorphic loci was tested by F-statistics and reveal no apparent discontinuity between Mediterranean populations (Nador and Ksar Sghir) and the northern Atlantic ones (Asilah, Guy ville and Essaouira) and could be explained by a high gene flow between these two areas in relationship to larval dispersal, which is exclusively under the control of marine current action. Along the Atlantic coast, a significant divergence is observed between the northern populations (Asilah, Guy ville and Essaouira) and the southern ones (Taghazout, Tantan and Dakhla). This discontinuity is probably due to hydrodynamic and/or differential selection effects in these two different geographic areas. Indeed, at Cap Ghir, exactly between Essaouira and Taghazout, the coastal sea surface current moves towards the Canaries archipelago. Thus, a gene flow breaking caused by an important larval dispersal decrease right through Cap Ghir becomes possible and could explain this divergence. Moreover, coastal ecological factors, especially water temperature, appear to be different in these two areas, and could generate differential selection impact on M. galloprovincialis population genotypes.
The reference sample (Sète) diverges significantly from the Mediterranean Moroccan ones. This result could be explained by an Almeria–Oran boundary action as a barrier to larval dispersal between the Alboran Sea, including the Moroccan stations (Nador and Ksar Sghir) and the eastern side, containing Sète.



