Abridged English version
Although all taxonomists agree to place it into its own monotypic family, the Hoatzin (Opisthocomus hoazin) appears as one of the most enigmatic birds. Its biology is still poorly known and its systematic position unclear. The few studies devoted to this species showed that it is strictly vegetarian, with a diet mainly based on young leaves. It is quite remarkable by the bacterial fermentation of plant items that takes place into foregut (crop) and lower oesophagus. The bulky foregut (crop) affects the shape of the sternum, and pectoral muscles are particularly reduced. Precise information is still lacking on how plant material is processed in the bill. Some records indicate that leaves are twisted there and rolled up into a tube before being swallowed. Foregut (crop) is usually held as the place were food items are mechanically fragmented by keratinised ridges, which work almost like ruminants' teeth. Bill would be used only and simply to tear off leaves and lead items into oesophagus. These feeding adaptations appear quite exceptional for a flying bird. Hoatzin has often been placed among Galliformes, but molecular studies link it to cuckoos and turacos.
A detailed morphofunctional analysis of bill and hyoid apparatus was conducted on two specimens. Special attention was paid not only to insertion points of muscles but also to how aponeuroses are arrayed. The spatial arrangement of aponeuroses is a determinant indicator of muscles homology and also gives the direction of forces they exert. The aim was to gain new light on the feeding adaptation of this species and suggest avenues for new field studies of its feeding behaviour.
Hoatzin shows a series of anatomical peculiarities. It has a schizognathous palate. Distal articular surface of quadrate has three condyles, with transversally oriented axes, including a small caudal condyle that Anseriformes and Galliformes lack. Basal part of the rhamphotheca shows two ridges on both upper and lower jaws, the internal ones work as scissor blades. Palate is covered by a thick layer of adipose tissue and bears four keratinised spiky ridges. M. pseudotemporalis superficialis is well developed, with a distinctive oblique portion that tends to inflect the resulting force of the dorsal adductors. Such trend is more obviously shown by the hypertrophied m. pseudotemporalis profundus. M. pterygoideus has a noteworthy small dimension. Tongue has a complex internal structure, with cavernous bodies, and is covered by several layers of connective tissue. Its caudal part is edged, with hard keratinised pointed projections. The protractors (m. branchiomandibularis) and retractors (m. stylohyoideus) of the tongue are particularly enlarged.
The morphofunctional analysis showed that bill and hyoid apparatus is highly specialised on the tearing off and splitting of plant items before ingestion. The hypothesis can be formulated that hoatzin is a ‘chewing bird’. Buccal cavity is particularly large, because of schizognathy and arched vomer. The compliant palate, with its prominent keratinised ridges, secures kneading of a voluminous vegetable dough in the bill. The thick mobile and easily distorting tongue drifted by the strong protractors and retractors plays an important role during this process as well as the external edges of the rhamphotheca, which act as mammalian lips. The action of m. branchiomandibularis is enhanced by the fact that the mandible is buttressed against the base of the skull (secondary articulation of the mandible). In spite of vertical movements of the upper jaw limited by the horizontal motion range of the vomer and because of an important bill depth, movements of the internal edges of the rhamphotheca remain efficient for a scissor-like action. The clinorhynchy of bill apparatus and the necessity to counteract the passive protraction of the upper jaw when an item is torn off require the observed slanting orientation of dorsal adductors' forces.
In Galliformes, jaws function according to the ‘separated muscular control’, where dorsal and ventral adductors act independently to control jaws' motion, because an absence of superficial articular ligament. In contrast, in the hoatzin and other neognaths (Neognathae), jaws function according to the ‘joint muscular control’, where dorsal adductors act simultaneously on both jaws, the role of ventral adductors being secondary. Because of their very important structural and thence functional differences in bill and hyoid apparatus, any close relationship between the hoatzin and Galliformes cannot be envisioned. Such a hypothesis would implicate a counter-selective evolutionary reversion.
1 Introduction
Si tous les systématiciens s'accordent pour reconnaı̂tre qu'il représente une famille monotypique, les Opisthocomidae, depuis la première description qui en a été faite par Müller en 1776 sous le nom de faisan, l'hoazin (Opisthocomus hoazin) reste une des espèces d'oiseaux actuels les plus énigmatiques et demeure mal connu tant pour sa biologie que pour sa position systématique suprafamiliale.
Les rares travaux qui lui ont été consacrés ont montré sa nidification collective et son appartenance à un groupe très peu représenté d'oiseaux spécialisés sur un régime végétarien. La plupart du temps, il est très peu mobile. Au cours de l'alimentation, le volumineux jabot est rempli d'une telle quantité de nourriture que, pour préserver son équilibre, l'oiseau est obligé de s'appuyer sur une branche au niveau d'une callosité épidermique particulière de la région thoracique. La dimension considérable du jabot retentit sur la forme du sternum et les masses musculaires pectorales sont réduites. Après Grimmer [1], qui avait déjà souligné le régime strictement végétarien, Grajal et al. [2] ont montré que son alimentation de base consiste pour 80 % en feuilles et que sont consommées préférentiellement les jeunes pousses, plus nutritives, et les bourgeons floraux. Plus encore remarquable est son aptitude à développer, dans le jabot et dans la partie inférieure de l'œsophage, une fermentation bactérienne des aliments d'origine végétale, qui produit jusqu'à 50 % du métabolisme basal [2,3]. L'efficacité de la digestion est en outre augmentée [2] par une grande capacité relative de l'œsophage, la fragmentation de la nourriture dans le jabot et la vitesse différente du transit selon la nature des aliments.
Les renseignements précis sur la nature du traitement que subit la masse végétale à l'étage buccal font toutefois défaut. Lindblad [4] a décrit comment les hoazins recherchent la base des plantes où se trouvent les jeunes pousses, puis arrachent par lambeaux les feuilles qu'ils rouleraient en tube avant de les avaler. On suppose que c'est le jabot qui joue le rôle principal dans le traitement mécanique de la nourriture, grâce à ses crêtes kératinisées qui seraient des équivalents fonctionnels des dents des ruminants. Pour Grajal et al. [2], la fragmentation et la fermentation de la nourriture s'effectueraient dans une même chambre, à un seul niveau. Ces auteurs ont montré une réduction de moitié de la taille des fragments végétaux entre la partie supérieure du jabot et l'entrée de l'estomac. Ils ont aussi montré que la durée du transit dans le tube digestif était fonction de la taille de fragments. Les longues durées des transits observées chez l'hoazin sont tout à fait remarquables chez les oiseaux où, de façon générale, elles sont très courtes. Elles semblent nécessaires au maintien des populations de bactéries symbiotiques, qui produisent, en plus des vitamines spécifiques et des aminoacides, des substances détoxiquantes pour des composés chimiques secondaires d'origine végétale, ce qui laisserait à penser que les ancêtres de l'hoazin peuvent avoir été des folivores facultatifs qui utilisaient la microflore pour se protéger contre les dérivés secondaires toxiques de la nourriture végétale [2]. L'opinion courante est donc que le broyage de la nourriture végétale s'effectue seulement dans le jabot, l'étage buccal n'accomplissant que des opérations simples, comme le détachement des feuilles par le bec et la déglutition vers l'œsophage. On remarquera que les auteurs ne se sont pas interrogés quant à l'origine des fragments végétaux qui entrent dans le jabot.
Ce rapide examen de la littérature révèle bien l'existence d'une remarquable adaptation trophique de l'hoazin, qui apparaı̂t tout à fait exceptionnelle et probablement unique parmi les oiseaux volants. Toutefois, ces données demeurent limitées. On peut donc envisager que des hypothèses fonctionnelles, élaborées à partir des caractéristiques morphologiques de cet oiseau, devraient non seulement apporter un éclairage nouveau sur cette adaptation, mais aussi inspirer aux ornithologues des observations comportementales qu'il conviendrait d'effectuer sur cette espèce dans son milieu naturel.
Par ailleurs, les diverses positions attribuées à l'hoazin dans la classification aviaire ont été décrites par Sibley et Ahlquist [5–7]. Les travaux fondamentaux de Huxley [8], Fürbringer [9] ou Gadow [10] le rapprochaient des Galliformes, bien qu'une certaine relation avec les coucous et les touracos fusse déjà évoquée. La notoriété de ces auteurs a sans doute empêché une révision, y compris jusqu'à la classification proposée par Mayr et Amadon [11], qui maintiennent cet oiseau parmi les Galliformes. Des rapprochements avec les touracos ont été affichés [12–14]. Barnikol [13], qui en a fait le compte, signale ainsi que l'hoazin a été placé dans neuf groupes systématiques différents. Il estime que cet animal, combinant des caractères généraux primitifs et une grande spécialisation de certaines parties de son organisme, mériterait de constituer à lui seul un ordre particulier, distinct des Galliformes. Néanmoins, des hybridations d'ADN [7] mènent à une position au sein des Cuculiformes, dont les touracos seraient éloignés. Cependant, le récent séquençage de six gènes mitochondriaux et d'un gène nucléaire montre que l'hoazin serait en fait plus proche des Musophagidae que des Cuculidae et des Galliformes [15]. On peut donc espérer que l'analyse morphofonctionnelle de l'appareil du bec de l'hoazin nous permettra, non seulement de mieux en comprendre les caractéristiques de l'adaptation trophique, mais aussi contribue à définir sa position systématique. Il a en effet été montré sur plusieurs groupes d'oiseaux [16–19] qu'une information de caractère fonctionnel et écologique peut être extraite de l'analyse des propriétés biomécaniques de la structure de cet appareil, et que cette information peut avoir une incidence systématique. Ce type d'approche repose sur les relations objectives entre les propriétés de tout système ostéomusculaire et les particularités de sa structure. Le fonctionnement réel, celui des conditions naturelles, ne peut se réaliser que dans la limite de ces propriétés, qui définissent ainsi les capacités écologiques de l'espèce. En l'absence de possibilité d'évaluer la capacité de survie (fitness) d'une espèce, les particularités morphologiques considérées sur le plan fonctionnel et écologique peuvent donc être des indications à valeur évolutive.
Considérant la rareté de l'hoazin et le peu de connaissances qu'on a de sa morphologie, il nous est apparu nécessaire de donner une description détaillée de ses appareils du bec et hyoı̈dien, en préalable à toute analyse de leurs particularités morphofonctionnelles.
Les abréviations utilisées dans cet article sont explicitées dans le Tableau 1.
Abréviations
| Aponévroses des muscles | |
| ace | aponeurosis caudalis |
| acg | ap. ceratoglossis |
| ado | ap. dorsalis originalis |
| ad | ap. depressoris |
| ai | ap. interna |
| ali | ap. lateralis insertionis |
| alo | ap. lateralis originalis |
| alt | ap. lateralis temporalis |
| am | ap. medialis |
| amq | ap. medioquadrata |
| amr | ap. mediorostralis |
| ams | ap. mediosuperficialis |
| ao | ap. occipitalis |
| ap | ap. posterior |
| apc | ap. pterygoidea caudalis |
| app | ap. pseudotemporalis |
| aps | ap. pseudotemporalis superficialis |
| ar | ap. rostralis |
| as | ap. superficialis |
| asa | ap. superficialis anterior |
| asp | ap. superficialis posterior |
| avi | ap. ventralis insertionis |
| avo | ap. ventralis originalis |
| Autres abréviations | |
| Aec | m. add. md. ext. profundus caudalis |
| Aem | m. add. md. ext. medialis |
| Aer | m. add. md. ext. profundus rostralis |
| Aes | m. add. md. ext. superficialis |
| Atsc | articulation secondaire mandibulaire |
| avpl | aile ventrale du palatin |
| Ap | m. add. md. posterior |
| bas | basihyale |
| bm | m. branchiomandibularis |
| cavb | cavité buccale |
| cb | ceratobranchiale |
| cc | couche de conjonctif |
| ce | condyle latéral |
| cg | m. ceratoglossus |
| cga | m. ceratoglossus posterior |
| cgp | m. ceratoglossus anterior |
| ch | m. ceratohyoideus |
| ci | condyle médial |
| clp | crête latérale du palais |
| cmp | crête médiale du palais |
| coc | corps caverneux |
| cpl | crêtes du palais |
| dm | m. depressor mandibulae |
| ent | entoglossum |
| fm | foramen magnum |
| gl | glande salivaire |
| hg | m. hypoglossus |
| jg | jugale (arcus jugalis) |
| lg | langue |
| lje | ligamentum jugomandibulare externum |
| lji | lig. jugomand. internum |
| lom | lig. occipitomandibulare |
| lp | lig. postorbitale |
| md | mandibula |
| mst | mesethmoideum |
| mh | m. mylohyoideus |
| par | paraglossalia |
| pc | m. pterygoideus caudalis |
| pdl | m. pt. dorsalis lateralis |
| pdm | m. pt. dorsalis medialis |
| pf | praefrontale |
| pcm | proc. caudalis mandibulae |
| pim | proc. internus mandibulae |
| pl | palatinum |
| plm | proc. lateralis mandibulae |
| po | proc. orbitalis (ossis) quadrati |
| pp | proc. postorbitalis |
| ppm | proc. palatinus (ossis) maxillaris |
| pr | m. protractor pterygoidei et quadrati |
| psp | m. pseudotemporalis profundus |
| pss | m. pseudotemporalis superficialis |
| ps | portion supplémentaire du m. pseudotem. superficialis |
| pt | pterygoideum |
| pvl | m. pt. ventralis lateralis |
| pvm | m. pt. ventralis medialis |
| pz | proc. zygomaticus |
| q | quadratum |
| sh | m. serpihyoideus |
| slgl | glande salivaire |
| ss | os sésamoı̈de |
| sth | m. stylohyoideus |
| vm | vomer |
| zpr | zone procinétique |
2 Matériel et méthodes
Nous avons pratiqué la dissection de deux têtes fixées au formol, l'une envoyée par le professeur V.F. Sych de l'université d'État d'Oulyanorsk, l'autre provenant des collections du Muséum national d'histoire naturelle (Paris). Ces dissections ont été effectuées sous loupe binoculaire Wild™, et les dessins réalisés à l'aide d'une chambre claire.
Une attention particulière a été portée non seulement aux limites des différentes unités musculaires, mais aussi à la disposition des aponévroses internes, lesquelles permettent d'identifier les constituants des complexes musculaires et sont riches en informations fonctionnelles. Pour ces aponévroses, nous avons suivi la nomenclature de Dzerzhinsky et Potapova [20], largement approuvée et appliquée à l'ensemble des oiseaux.
L'analyse graphique employée ici est fondée sur les principes de la recherche de l'équilibre dans les conditions de la statique. L'orientation des vecteurs introduits dans l'analyse graphique est fondée sur la direction des aponévroses des différents muscles.
3 Résultats
3.1 Le crâne (Fig. 1)
Le bec est relativement court. La distance entre la charnière procinétique et l'extrémité du bec représente quelque 46 % de la longueur totale du crâne. La partie basale de la mâchoire supérieure est très haute (près de 50 % de la longueur du bec). Le bord supérieur du bec est busqué et chaque face latérale est gonflée. Le bord ventral de l'épithèque descend beaucoup plus bas que le bord dorsal de l'hypothèque. La mâchoire supérieure, dont la rhamphothèque est percée par deux petites narines rondes, forme une voûte transversale ample.
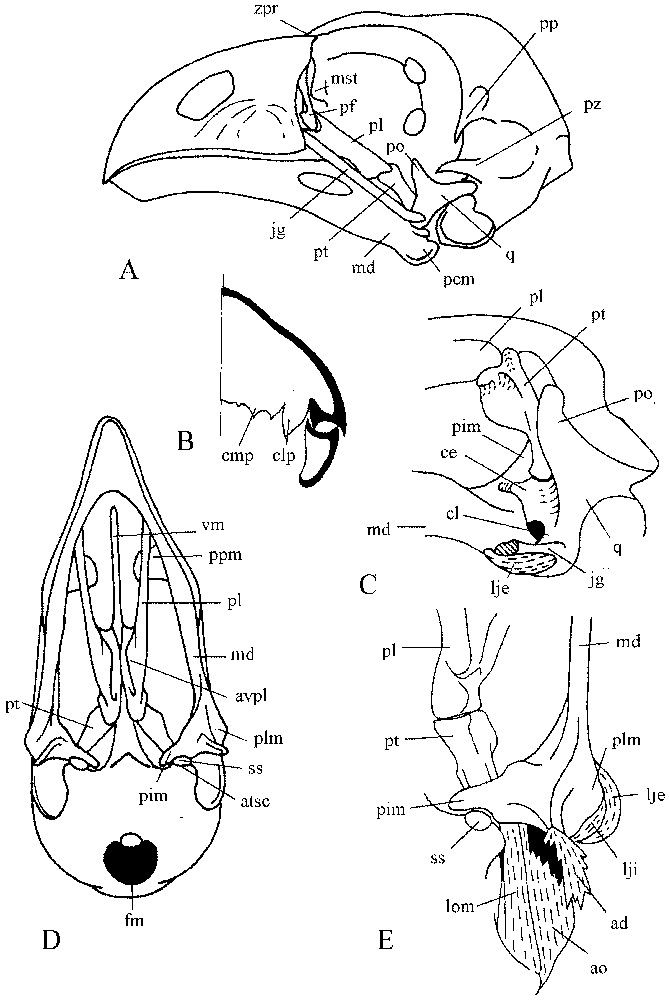
Crâne de l'hoazin. (A) Vue latérale du crâne. (B) Coupe transversale schématique du bec. (C) Vue antéro-dorsale de la région de l'os carré. (D) Vue ventrale du crâne. (E) Vue ventrale de l'articulation secondaire.
La zone procinétique est nettement marquée par une fente transversale. L'os lacrymal se situe en avant de cette zone et envoie un processus ventral qui atteint la barre jugale. L'aile latérale du mésethmoı̈de (ou ectethmoı̈de) est assez petite et n'a aucun contact avec le lacrymal. La paroi interorbitaire est continue. La partie temporale de la boı̂te crânienne est arrondie et le foramen magnum orienté ventralement. Le processus jugal du squamosal est relativement court et épais. La barre jugale, très robuste, s'attache par une syndesmose à la mâchoire supérieure, au même niveau que les palatins. Son axe longitudinal est oblique, d'arrière en avant et de bas en haut. Les os palatins sont étroits dans leurs parties antérieures, qui divergent l'une de l'autre. Dorsalement, s'appliquent les processus des maxillaires, qui ne dépassent pas le bord médial des palatins, restant séparés par un grand espace, disposition qui caractérise le palais de type schizognathe. Les parties caudales des palatins sont élargies et forment deux ailes. L'aile ventrale constitue le bord des choanes. L'aile dorsale est soudée directement à sa contralatérale dans sa portion caudale et, par l'intermédiaire du vomer, dans sa portion crâniale, formant ainsi une gouttière qui enveloppe le bord inférieur de la cloison interorbitaire. Le vomer est très long, gonflé rostralement et recourbé. Les extrémités caudales des palatins perdent tout contact direct et sont très élargies au niveau du contact avec l'extrémité rostrale du ptérygoı̈de. Cette dernière présente deux têtes. La tête dorsocaudale est située dans l'axe de l'os et s'articule avec la base du crâne et le palatin. La tête rostroventrale s'articule dans une loge caudale du palatin ; elle vient coiffer une large aile ventrolatérale du ptérygoı̈de. Cet os est disposé très obliquement par rapport à la base du crâne.
La surface articulaire (ventrale) distale du carré forme trois condyles, dont les axes sont orientés transversalement. Le plus grand est médial et glisse dans une gorge à la base du processus interne de la mandibule. Le condyle latéral est très étiré vers l'extérieur, conservant un contact important avec le bord latéral de la mandibule. Selon certains auteurs [21,22], l'hoazin, comme les Galliiformes et les Ansériformes, serait démuni de condyle caudal. Néanmoins, nous en avons trouvé un, de taille réduite, sur un exemplaire fixé au formol. Ce condyle rudimentaire s'élève au-dessus du niveau de l'articulation et ne participe pratiquement pas au contact du carré avec la mandibule. La forme de l'articulation témoigne de la simplicité des mouvements mutuels du carré et de la mandibule, dont la principale composante est un glissement étendu du condyle médial. Le processus otique du carré porte deux condyles, alignés suivant un axe presque perpendiculaire à celui du ptérygoı̈de, ce qui correspond, dans une large mesure, à la direction du mouvement dominant dans l'articulation mandibulaire. La symphyse mandibulaire est brève. En arrière de la commissure du bec, l'axe mandibulaire s'infléchit obliquement en direction ventrale, sa hauteur augmentant alors jusqu'au point d'insertion de l'aponévrose ar ; en arrière de ce point, sa hauteur décroı̂t très vite. On peut ainsi remarquer que l'aponévrose ar est dans l'axe de la portion antérieure de la mandibule. L'extrémité caudale de la mandibule présente trois processus, un latéral, sur lequel s'articule le condyle latéral du carré, un caudal infléchi ventralement, sur lequel s'attache le muscle dépresseur, et un médial, qui s'infléchit dorsalement et entre en contact avec la base du crâne (basitemporal) par son bord postérieur (articulation secondaire de la mandibule fide Bock [23]). Ce contact est renforcé par du tissu conjonctif et contient un os sésamoı̈de qui s'encastre dans une dépression du processus médial.
3.2 Les particularités de la rhamphothèque et du palais (Figs. 1A et 3A)
Dans la portion basale du bec, les bords des mâchoires supérieure et inférieure sont élargis transversalement, et la rhamphothèque est garnie de crêtes sur ses bords latéral et médial. Hypothèque et épithèque sont encastrées, les crêtes latérales et médiales de la première venant se placer sur les bords médiaux des crêtes correspondantes de la seconde. Latéralement, ces doubles lignes de crêtes, jusqu'ici non détectées par les morphologistes, s'affrontent comme des lames de ciseaux et leurs bords sont crénelés. La crénelure est très marquée sur les crêtes médiales, les dents étant dirigées légèrement vers l'avant. Le palais est parcouru sur chaque moitié par deux crêtes longitudinales. La latérale, qui est le plus en relief, suit l'os palatin et vient en contact avec l'épithèque par son versant latéral. Par sa base, cette crête est profondément enfoncée dans les couches dermiques du revêtement palatin. Elle porte de grands denticules kératinisés, dont les pointes sont dirigées vers l'arrière et qui dépassent ventralement le niveau de l'épithèque. Les crêtes médiales s'étendent le long des choanes. Caudalement, elles sont en contact avec le bord médial de l'extrémité postérieure des palatins, qui s'infléchit en direction ventrale. Sur cette extrémité s'attache un fort tendon, qui gagne vers l'avant le processus palatin du maxillaire dans la paroi du conduit des voies aériennes supérieures (sillon palatin).

(A) Particularités du plafond de la cavité buccale de l'hoazin. (B, C, D) Vue ventrale des plans successifs de la dissection du muscle ptérygoı̈de.
Sous la couche cornée du palais s'étend une épaisse couche de conjonctif riche en graisse, dans laquelle passent des aponévroses qui gagnent les crêtes longitudinales. Les aponévroses les plus superficielles sont en relation avec les fibres musculaires de l'œsophage. Les plus dorsales appartiennent au muscle m. pterygoideus.
3.3 La musculature (Figs. 2 et 3)
La portion médiale de l'adducteur mandibulaire externe passe sous la barre jugale jusqu'au niveau de la commissure du bec. L'aponévrose d'origine (am) prend naissance sur le processus jugal du squamosal. Sur le même processus s'attache aussi l'aponévrose d'origine de la portion superficielle de l'adducteur (ams), dont le bord caudal fusionne avec am. De plus, à la surface de am, une crête aponévrotique s'étend, qui participe à la composition de la portion superficielle, laquelle est bien développée. Les aponévroses d'insertion (asa et asp) forment un entonnoir fendu sur sa face ventrocaudale. La plupart des fibres musculaires de cette portion s'insèrent à l'intérieur de cet entonnoir. Le bord caudal de asa fusionne avec l'aponévrose d'insertion (ar) de la partie rostrale de la portion profonde. L'insertion de asp se prolonge vers l'avant, jusqu'à la commissure du bec. L'aponévrose ar sert d'attache aux fibres musculaires provenant de la fosse temporale et des faces internes de l'aponévrose d'origine alt, bordant la périphérie de la fosse temporale. Le bord antérieur de alt plonge en dessous de ar et se prolonge en fermant l'aponévrose amr, qui se termine près du processus jugal du squamosal, mais sans relation avec am. L'aponévrose am émet une lame le long du bord interne du processus du squamosal. Cette lame est plus dorsale que amr, dont elle est séparée par la lame de l'aponévrose ar. Les bords antérieurs de am et ar entrent parallèlement dans le muscle dont les fibres les réunissent, puis tournent en direction caudale. L'aponévrose am s'attache au processus otique de l'os carré, fermant une petite aponévrose originale de la portion profonde (amq). Cette portion pennée apparaı̂t à la surface des adducteurs en arrière de la portion médiale. L'aponévrose d'insertion de cette portion est fermée par la lame caudale de ar, comme on l'a vu plus haut. La moitié caudale de cette lame devient assez épaisse et peut être homologuée à l'aponévrose ace. Dans la portion caudale de ar se trouve encore une petite lame (aci) sur laquelle s'insèrent des fibres musculaires qui viennent de la face antérieure du processus jugal du squamosal, du processus otique du carré et de la petite aponévrose qui provient de ce processus.

Musculature crânienne de l'hoazin. (A, C, D, E) Vue latérale des différents plans de la dissection. (B) Vue antéro-dorsale. (F) Schéma des aponévroses du muscle adducteur externe.
Le m. pseudotemporalis superficialis est très bien développé. Son origine s'étend sur la paroi antérieure de la boı̂te crânienne, d'où il descend presque perpendiculairement à la partie postérieure de la mandibule, sur la face médiale de laquelle il s'insère par l'aponévrose aps. Cette dernière forme un entonnoir dans lequel s'engage l'autre aponévrose ai. Une des particularités de ce muscle est constituée par la présence d'un faisceau de fibres musculaires attaché à l'aponévrose aps. Cette portion musculaire est munie d'une aponévrose qui entre en contact avec aps, avec ar et avec asa. Elle montre la tendance à une orientation oblique de la résultante de la force des adducteurs dorsaux. Cette tendance est montrée de façon plus évidente par le m. pseudotemporalis profundus. Chez l'hoazin, ce muscle est hypertrophié, occupant la surface médiale de la mandibule jusqu'au bord ventral et s'étend très rostralement, comme cela est visible par sa face latérale. L'aponévrose d'origine (app), très bien développée, contourne l'extrémité du processus orbitaire du carré et forme un très grand entonnoir, fendu sur la face latérale, depuis lequel les fibres musculaires se dirigent vers la face médiale de la mandibule. L'insertion se fait par l'aponévrose d'insertion du m. pterygoideus.
Le m. adductor posterior prend origine sur la face latérale et médiale de la base du processus orbitaire du carré et l'extrémité caudale de l'os ptérygoı̈de. L'aponévrose d'origine apq s'attache seulement sur le carré.
Le m. depressor mandibulae s'attache par la petite aponévrose d'insertion ad sur le sillon ventrocaudal de l'extrémité postérieure de la mandibule. L'aponévrose interne d'origine de ce muscle (ao) prend naissance le long de l'extrémité latérale de l'aile otique de l'occipital (Fig. 1E). La partie médiale de cette aponévrose est fusionnée au ligament occipitomandibulaire, qui est orienté dans le plan du bord ventral de la mandibule.
Le m. pterygoideus est remarquable par ses dimensions relativement modestes. Deux aponévroses d'origine se distinguent par la direction de leurs fibres. L'aponévrose av s'attache au palatin sur toute sa largeur, tandis que sa partie médiale se perd dans le tissu conjonctif du palais. L'aponévrose d'origine de la partie latérale du muscle (alo) s'attache sur le bord latéral de la portion rostrale du palatin. Toute la partie latérale de ce muscle se perd dans le tissu conjonctif du palais jusqu'au niveau de la commissure. Il faut remarquer l'absence de fibres musculaires sur la surface latérale de la mandibule. Ce caractère souligne le faible développement et l'orientation longitudinale prédominante du muscle ptérygoı̈dien. De l'aponévrose avo, les fibres musculaires se dirigent vers le bord antérieur du processus médial de la mandibule et vers la face ventrale de l'aponévrose avi, qui s'attache au sommet de ce même processus médial. Cette aponévrose avi reçoit ainsi des fibres provenant de la paroi de la trompe d'Eustache et de la partie postérieure du palatin. Entre avi et ali s'insinue la petite lame du bord médial d'alo. L'aponévrose d'origine de la partie dorsomédiale du muscle (ado) s'attache à l'extrémité caudale du palatin et à l'extrémité rostrale du ptérygoı̈de. Cette partie dorsomédiale est complètement isolée des autres parties du muscle. L'aponévrose ado croise l'aponévrose ali sans échanger de fibres musculaires. Les fibres de cette portion se terminent sur la face médiale de la mandibule, là où généralement prennent fin les fibres latérales du ptérygoı̈de. De plus, l'aponévrose d'insertion adi, qui se trouve au-dessous du m. pseudotemporalis profundus, reçoit des fibres de la part de ce muscle. L'origine de la portion dorsomédiale se situe plus dorsalement que l'insertion. Cette portion joue comme un adducteur mandibulaire indépendant. Une aponévrose apc, plus caudale que l'insertion de ado, s'attache sur le ptérygoı̈de et reçoit un éventail de fibres musculaires insérées sur le bord antérieur du processus médial de la mandibule. Cet éventail reçoit en outre des fibres situées plus médialement que l'os ptérygoı̈de. On peut identifier ces deux parties comme la portion caudale du m. pterygoideus.
Les protracteurs du ptérygoı̈de et du carré remplissent l'espace entre la surface interne du processus orbitaire du carré et la paroi interorbitaire. Ils ne sont séparés qu'au niveau de leur origine. Le m. protractor pterygoideum prend naissance à l'extrémité caudale du ptérygoı̈de, le m. protractor quadratum au-dessus du condyle médial du carré.
Le lig. postorbitale est bien développé et pratiquement perpendiculaire au jugal. Son attache sur la mandibule est cachée sous le lig. jugomandibulare externum. Les ligaments de l'articulation mandibulaire (Lji et Lje) présentent une disposition typique de la plupart des oiseaux (mais différente de celle observée chez les Galliformes, desquels l'hoazin a été si longtemps rapproché dans la classification aviaire).
3.4 L'appareil hyoı̈dien (Fig. 4)
La langue de l'hoazin se distingue par sa structure interne complexe. Les paraglosses ossifiés se trouvent dans la moitié basale de la langue. Ils sont très hauts à la base où s'attachent de puissants denticules kératinisés. Rostralement, ils sont plus fins et plus étroits. Ils entrent en contact avec les tiges cartilagineuses des entoglosses, qui convergent en avant pour former une pièce flexible. Au-dessus, se trouvent de gros amas, formés par du tissu conjonctif poreux rempli de sang. Ces structures ont l'apparence de corps caverneux. On remarque qu'elles sont disposées dans la partie flexible de la langue, dirigée à l'aide des mm. ceratoglossi anteriores. Au-dessus de ces corps caverneux se trouve une couche de tissu conjonctif, avec des fibres orientées en avant et en haut. La couche suivante est formée par des petites plaques (d'une substance assez dense rappelant la kératine), également obliques, mais dirigées en arrière et en haut. Enfin, la langue est couverte sur sa surface dorsale par une couche plus dense et très rugueuse. Les angles caudaux de la langue sont armés de puissants denticules, entre lesquels en sont disposés d'autres, plus petits, l'ensemble formant un peigne rigide.

Appareil hyoı̈dien de l'hoazin. (A) Dissection de la cavité buccale, le plancher ayant été récliné sur la gauche de la figure. (B) Vue ventrale de la musculature hyoı̈dienne. (C) Vue latérale de l'appareil hyoı̈dien déplacé ventralement, la langue ayant été coupée longitudinalement. (D) Partie rostrale du squelette de l'appareil hyoı̈dien.
Le basihyal pénètre par son extrémité rostrale dans l'intervalle entre les paraglosses, formant avec ceux-ci des contacts glissants. En arrière du contact glissant entre basihyal et paraglosse, il y a un large espace rempli par les fibres du m. hypoglossus. Le basihyal forme caudalement une tige où s'attache l'urohyal cartilagineux. L'articulation de la corne hyoı̈dienne avec le basihyal est assez mobile. La corne hyoı̈dienne est formée essentiellement par le cératobranchial, qui est courbé et rendu rigide par son ossification. L'épibranchial se présente sous la forme d'un petit cartilage terminal élastique.
3.5 La musculature hyoı̈dienne (Fig. 4)
Le m. mylohyoideus est très bien développé. Il comprend deux parties : une antérieure, sous la très grande glande salivaire, mais qui, en avant, n'atteint qu'à peine la symphyse de la mandibule, et une postérieure, dont le bord caudal se trouve au niveau de la commissure du bec. Ce muscle est très gros, particulièrement sous la partie postérieure de la langue et forme un hamac suspendu entre les bords dorsaux des deux hémi-mandibules.
Le m. serpihyoideus est relativement mince. Sa partie rostrale passe sous le m. mylohyoideus et son bord caudal fusionne avec le constricteur de cou. Les mm. depressor mandibulae et stylohyoideus ne laissent que très peu de place pour l'insertion du m. serpihyoideus à l'extrémité caudale de la mandibule.
Le m. stylohyoideus est, chez l'hoazin, le plus puissant des muscles hyoı̈diens. Son origine recouvre la surface occupée, chez d'autres oiseaux, par le m. pterygoideus.
Le m. branchiomandibularis constitue un épais faisceau, qui s'étend jusqu'à la partie rostrale du basihyal. Il recouvre la moitié distale de la corne hyoı̈dienne à la manière d'un gros étui. Ce muscle ne montre pas de différenciation interne. Il s'attache à la face linguale de la mandibule, en avant du m. mylohyoideus.
Le m. ceratohyoideus est bien développé et aplati. Il part de la face médiale de la moitié caudale du cératobranchial et se termine par un éventail de fibres musculaires qui s'attachent au bord latéral et à la face dorsale du basihyal, en arrière de l'articulation de la corne hyoı̈dienne, et se soudent avec celles du muscle contralatéral. Le m. ceratohyoideus contient deux aponévroses : d'origine, attachée à la corne, et d'insertion, fixée le long du bord du basihyal.
Le m. ceratoglossus présente deux parties. La postérieure, m. ceratoglossus posterior, occupe la face latérale et dorsale du cératobranchial. Son aponévrose d'insertion s'attache au bord inférieur du paraglosse. Directement devant cette aponévrose commence le m. ceratoglossus anterior. Il est étendu à la surface ventrale, le long des paraglosses et de la moitié caudale de la partie cartilagineuse de l'entoglosse.
Le m. hypoglossus joint l'extrémité rostrale du basihyal et l'extrémité caudale du paraglosse. Les fibres musculaires superficielles cachent celles qui sont disposées dans l'espace séparant ces éléments. Ce muscle contient une petite aponévrose, qui s'attache sur le basihyal.
4 Discussion
4.1 Caractéristiques morphofonctionnelles de l'appareil du bec de l'hoazin
Pour se nourrir de feuilles, l'hoazin utilise son bec dans deux opérations, à première vue assez banales : l'arrachage de la feuille, ou d'une partie de celle-ci, et son traitement avant déglutition. Les données disponibles dans la littérature conduisent à penser que la principale opération est la première, le traitement étant relativement simple. D'un point de vue morphofonctionnel, le problème du détachement des objets végétaux relève d'un fonctionnement du bec placé dans le cadre du premier type de mécanisme de serrage des mâchoires de Dzerzhinsky [24], dans lequel les mouvements des deux mâchoires sont synchronisés et coordonnés. Cette coordination est particulièrement importante et critique lorsque l'objet est serré par l'extrémité du bec, dans la mesure où un excès de force exercée par l'une des mâchoires peut amener l'objet à rouler de manière incontrôlable entre les mâchoires et être par conséquent perdu. Ce type de mécanisme nécessite certes une force considérable exercée par chaque mâchoire mais surtout un équilibre entre les deux composantes (Fig. 5). Un des moyens les plus simples pour résoudre ce problème réside dans l'établissement des rapports de leviers les plus favorables au travail de la musculature crânienne. La longueur du bec n'a probablement pas été un paramètre important pour l'hoazin, bien qu'elle puisse intervenir dans l'accès aux parties les plus nutritives des plantes. En effet, cet oiseau a une taille relativement grande, un cou assez long et une bonne capacité à grimper. Son bec relativement court, en diminuant le moment de résistance, lui permet en revanche de développer un bras de levier plus avantageux pour la musculature crânienne. Une autre particularité augmente l'efficacité du travail des muscles adducteurs, à savoir l'accroissement de la hauteur de la mâchoire supérieure, dimension qui en définit le bras de levier des forces de rétraction. Dans le même temps, la clinorhynchie détermine une disposition plus favorable des bras de leviers pour la mandibule, dans la mesure où l'augmentation du degré de flexion du crâne crée un changement d'orientation dans l'espace de la ligne d'action de la force qui serre l'objet, diminuant ainsi considérablement le bras de levier de la force résistante, alors que celui des forces musculaires reste inchangé. Pour maintenir l'équilibre entre les forces agissant sur la mandibule et sur la mâchoire supérieure, la clinorhynchie implique aussi une modification de l'orientation des adducteurs, qui sont alors plus obliques qu'en l'absence de flexion du crâne [24]. De fait, chez l'hoazin, les aponévroses principales de l'adducteur externe sont orientées très obliquement en se rapprochant de l'alignement du bord tranchant du bec. Cette importance de l'inclinaison des composantes de forces est particulièrement manifeste dans le complexe des adducteurs dorsaux ; ainsi, chez l'hoazin, le m. pseudotemporalis profundus est hypertrophié et sa force très inclinée passe au travers de l'articulation entre l'os carré et le crâne (Fig. 5). Même le m. pseudotemporalis superficialis, qui, de façon générale chez les oiseaux, contribue aux composantes les plus verticales dans l'éventail des forces des adducteurs dorsaux, comporte chez l'hoazin une partie supplémentaire caractéristique, montrant une tendance à une action beaucoup plus oblique de ce muscle. Or, le degré d'obliquité de la force des adducteurs dorsaux joue aussi un rôle favorable, dans le cas de la configuration clinorhynque du crâne, en raison de la nécessité de résister à la force qui tend à protracter la mâchoire supérieure au moment où l'animal détache la feuille. C'est au moment où les efforts de serrage des mâchoires sont les plus intenses que la mâchoire supérieure doit être particulièrement stable. L'objet serré entre les mâchoires est alors dans sa position la plus éloignée du centre de rotation de l'articulation des mâchoires et, par conséquent, dans la condition la plus défavorable aux leviers résistants.

Représentation graphique des conditions d'équilibre des forces au cours du serrage d'une feuille par l'extrémité du bec avant le détachement. Les forces sont énumérées dans l'ordre de la construction. A, vecteur force des adducteurs de la mandibule, dont la valeur est ici choisie arbitrairement ; F, composante responsable du serrage de la mandibule ; K, composante passant par le centre de rotation (Q) de l'articulation quadrato-mandibulaire ; M composante de pression de la force K, qui passe par l'axe du carré ; R, composante de la force K, responsable de la rétraction de la mâchoire supérieure (transmis par la barre jugale) ; F′ composante de la force R, responsable du serrage de la mâchoire supérieure ; N, composante de pression de la force R, passant par la charnière procinétique (b). Les deux forces de pression M et N donnent une résultante A à partir de leur point d'intersection. A′ est le vecteur force résultant de l'action des adducteurs sur le crâne ; il est égal en module à A, mais sa direction est opposée. L'état d'équilibre de l'ensemble est dû à l'égalité des forces opposées F et F′, A et A′ et n'est pas influencé par la valeur choisie pour A. Le détachement de la feuille provoque la protraction passive de la mâchoire supérieure (Fr). Dans ces conditions, le retour à l'état d'équilibre implique que la force des adducteurs s'exerce selon une direction plus oblique, qui la fait passer sous le point Z. L'examen de la direction des trois composantes musculaires principales (Ae, adducteur externe, Pss, pseudotemporal superficiel, Psp, pseudotemporal profond), déterminée par le direction de leurs anonévroses, montre que le vecteur du muscle pseudotemporal profond, et peut-être même du muscle adducteur externe, passent au-dessous du point Z. Ainsi sont réunies les conditions nécessaires pour produire la force plus oblique.
Les particularités morphofonctionnelles de l'appareil du bec de l'hoazin répondraient donc aux contraintes liées au détachement des feuilles, en créant temporairement une supériorité des forces de rétraction de la mâchoire supérieure sur celles d'adduction de la mandibule (Fig. 5). Toutefois, les avantages en force de la mâchoire supérieure sont encore plus évidents à la base qu'à l'extrémité du bec. Lorsque la mâchoire supérieure est en position protractée, l'avantage biomécanique que lui confère sa hauteur lui permet d'être utilisée pour fragmenter les feuilles par cisaillement, à l'aide des denticules de la rhamphothèque, au cours d'un glissement longitudinal mutuel des mâchoires. En effet, les adducteurs dorsaux sont capables de produire, en raison de leur orientation, une force supplémentaire de rétraction, qui est absorbée par les appuis caudaux (articulation secondaire de la mandibule au niveau de la base du crâne). À ces appuis sont associés les ligaments occipito-mandibulaires, qui empêchent la pointe de la mandibule de se déplacer latéralement, favorisant l'utilisation du bec comme une paire de ciseaux (Fig. 6). L'articulation secondaire avec la base du crâne ne se limite pas à cette fonction. Nous verrons plus loin qu'elle intervient aussi dans la capacité que doit posséder l'hoazin de traiter le matériau végétal à l'intérieur de la cavité buccale. L'amplitude verticale de la rétraction active de la mâchoire supérieure est limitée par celle du déplacement longitudinal du vomer, dont l'extrémité caudale en creux vient butter contre la partie rostrale de la cloison interorbitaire. La manipulation de préparations syndesmologiques de cadavres montre que la limite de rétraction se trouve très peu au-dessous de la position neutre, en raison de la faible distance séparant le bord crânial de la cloison interorbitaire de l'échancrure du vomer. Si l'on admet que l'appareil du bec de l'hoazin fonctionne selon le régime du premier type du serrage des mâchoires de Dzerzhinsky [24], cela signifie que les deux mâchoires se rencontrent sous l'action des muscles adducteurs dorsaux et que le m. pterygoideus joue un rôle auxiliaire en rejetant la force de rétraction de la mandibule vers la mâchoire supérieure. Nous avons remarqué plus haut que le m. pterygoideus était remarquablement faible chez l'hoazin. Cette faiblesse est probablement liée au rôle important que peut jouer la particulièrement épaisse barre jugale dans la transmission de la force de rétraction (Fig. 5). Au cours de l'abaissement de la mâchoire supérieure à partir de son état protracté, le m. pseudotemporalis profundus, très bien développé, joue un rôle important en rétractant l'os carré. Cet os peut glisser librement par rapport à la mandibule, dont le mouvement est bloqué vers l'arrière par son articulation secondaire avec la base du crâne. La protraction de la mâchoire supérieure, qui constitue une partie du cycle masticateur de l'appareil, dépend des mm. protractor quadratum et protractor pterygoideum. Bien que les mouvements verticaux de rétraction et de protraction de la mâchoire supérieure soient de faible amplitude, la grande hauteur de sa base détermine des mouvements longitudinaux importants, qui contribuent à la fragmentation du feuillage par un effet de cisaillement. On peut signaler d'autres détails caractéristiques, qui appuient l'hypothèse d'une capacité de fragmentation de la nourriture dans la cavité buccale. Ainsi, les crêtes internes de la rhamphothèque jouent probablement un rôle déterminant dans ce processus. On peut en effet remarquer que les bords internes du bec sont séparés de ces crêtes par un intervalle considérable qui, par analogie, fait penser à la joue et aux lèvres des mammifères qui maintiennent les particules alimentaires entre les arcades dentaires et les empêchent de tomber hors de la cavité buccale. La mobilité articulaire par syndesmose entre le jugal et la mâchoire supérieure facilite des mouvements de va-et-vient fréquents. La Fig. 7 nous montre comment la disposition clinorhynque du crâne assure un déplacement beaucoup plus réduit de l'extrémité ventrale de l'os carré au cours des mouvements de protraction et de rétraction, ce qui a pour effet de nécessiter un glissement longitudinal de l'os carré par rapport à la mandibule moindre que dans le cas des crânes de type orthocrânique, où la barre jugale est dans le prolongement du bord tranchant du bec. Néanmoins, il ne faut pas sous-estimer la nécessité de la réduction de ce déplacement longitudinal dans le crâne de type clinorhynque parce que, chez l'hoazin, la mandibule est bloquée dans ce sens par l'articulation secondaire avec la base du crâne. La simplification des surfaces articulaires et la réduction du condyle caudal du carré sont à mettre en relation avec l'immobilisation de la mandibule.

Rôle de l'articulation secondaire et du ligament occipito-mandibulaire dans la stabilité transversale de la mandibule. Fext, force produite par l'objet serré par le bec ; Fpr, force de pression dans l'articulation secondaire ; Frart, force de réaction au niveau de l'articulation ; Flom, force de tension du ligament occipito-mandibulaire ; Frlom, force de réaction de ce ligament ; Frart et Frlom constituent le couple de forces qui contrebalance la force Fext.

Coupe schématique de la cavité buccale de l'hoazin. (A) Vue latérale. (B) Vue ventrale. En grisé est figurée la masse végétale. Les forces exercées au cours de la protraction de la langue à travers la masse végétale sont schématisées : Fr, force de résistance de la masse végétale ; Fbm, force du muscle branchio-mandibulaire s'appliquant d'un côté à l'appareil hyoı̈dien et de l'autre à la mandibule.
Grajal et al. [2] ont certes souligné l'importance du degré de fragmentation de la nourriture pour obtenir une bonne efficacité de la fermentation bactérienne ; ils attribuent ce rôle aux crêtes kératinisées des parties supérieures de l'œsophage, sans même envisager que le bec ou l'appareil hyoı̈dien puissent intervenir dans cette fonction. De même, Barnikol [13] affirme que l'hoazin ne couperait pas les feuilles après les avoir arrachées, mais les froisserait seulement avant de les déglutir. Toutefois, l'ensemble des caractéristiques que nous avons décrites permet de suggérer que des observations de terrain devraient montrer que l'hoazin utilise un mouvement des mâchoires de faible amplitude dans le traitement préliminaire du matériau végétal avant ingestion. Bien que cette hypothèse de travail ne puisse pas être démontrée par les données existantes, il est intéressant d'en chercher des appuis en examinant d'autres particularités morphofonctionnelles de l'appareil du bec et de l'appareil hyoı̈dien.
4.2 Caractéristiques morphofonctionnelles de l'appareil hyoı̈dien de l'hoazin
On peut remarquer qu'une feuille lisse ou un fragment de cette feuille ne constituent pas des objets faciles à manipuler dans la cavité buccale. Il semble plus efficace pour les traiter ou les déglutir d'en former une boule imbibée de salive plutôt qu'un tube. À notre avis, ces tâches particulières liées au traitement d'objets végétaux sont à rechercher dans le domaine fonctionnel des glandes salivaires, de l'appareil hyoı̈dien et de la langue proprement dite. La langue de l'hoazin comporte deux parties fonctionnelles : une antérieure, avec un squelette formé par l'entoglosse, tige cartilagineuse flexible, et une postérieure, avec les paraglosses, ossifiés et rigides. La mobilité de la partie distale susceptible de manipuler les aliments est particulièrement accrue par des corps caverneux, à pression contrôlée, qui peuvent ainsi non seulement changer le volume de cette partie, mais aussi en régler le degré de flexibilité. On a décrit une sorte de corps caverneux chez d'autres oiseaux, dont la langue joue un rôle important dans la cueillette et le traitement de la nourriture [25–31]. Ces structures sont supposées jouer le rôle d'un squelette hydrostatique en se remplissant de sang veineux [27,31,32] et servent pour une meilleure adaptation de la surface de la langue à celle du palais ou, en rendant la langue plus turgescente, pour pousser les grains en avant pendant leur traitement par le bec chez les espèces granivores [29,30]. Les mouvements de la partie pourvue de corps caverneux sont assurés chez l'hoazin par le m. ceratoglossus anterior. La moitié proximale de la langue peut assurer la fonction de transport du bol ou de particules dans l'œsophage. Dans ce cas, les mm. ceratoglossi posteriores interviennent pour plier la langue, ce qui a pour effet d'élever une série de denticules proximaux qui assurent la prise de l'objet au cours de son déplacement. Le développement exceptionnel des rétracteurs (m. stylohyoideus) ainsi que des protracteurs (m. branchiomandibularis) laisse à penser que la langue et l'ensemble de l'appareil hyoı̈dien travaillent avec des efforts considérables en traitant une masse alimentaire très dense qui comble la cavité buccale (Fig. 8). Le m. branchiomandibularis de l'hoazin ne possède pas de portion caudale, mais la portion qui subsiste montre un développement tout à fait remarquable. Il faut rappeler que, chez plusieurs Néognathes, la portion caudale constitue une partie importante du mécanisme d'élévation de la langue [33]. Cette portion assure la rigidité de la corne hyoı̈dienne en agissant comme une corde vis-à-vis de l'arc flexible que constitue cette corne. Cette fonction intervient lorsque cette portion caudale s'appuie sur la surface des dépresseurs mandibulaires, ce qui crée une réaction faisant tourner l'hyoı̈de en dedans et vers le haut, c'est-à-dire en élevant la langue vers le palais. L'absence de cette portion chez l'hoazin n'est pas étonnante, puisqu'elle n'est nécessaire qu'à la manipulation d'objets de faible masse, alors que, chez cet oiseau, la montée de la langue vers le palais s'effectue quand la cavité buccale est remplie par une masse végétale très résistante. Cette montée est réalisée par l'ensemble du très volumineux muscle mylohyoı̈dien, qui comprime alors la grosse glande salivaire. On doit noter que l'interprétation des glandes salivaires comme squelette hydrostatique chez les perroquets [31] est en grande mesure applicable à l'hoazin. Le m. branchiomandibularis, peu différencié chez l'hoazin, est réduit au rôle de protracteur de la langue à travers la masse végétale emplissant la cavité buccale. Il est capable de prendre appui sur la mandibule, dans la mesure où celle-ci est bloquée en arrière par l'articulation secondaire avec la base du crâne (Fig. 8). En revanche, chez les oiseaux qui possèdent un crâne généralisé, il n'y a pas de mécanisme empêchant la rétraction de la mandibule et permettant un point d'appui pour le m. branchiomandibularis. Enfin, on peut noter que la rugosité particulière de la surface de la langue est très importante pour assurer la manipulation de feuilles lisses et glissantes.

Schéma des mouvements effectués au cours de la rétraction de la mâchoire supérieure. En grisé, état neutre de la mâchoire supérieure dans le crâne de type orthocrânique (1) et de type clinorhynchique (2). En blanc, état rétracté de la mâchoire supérieure. L'extrémité distale du carré se déplace dans l'articulation mandibulaire du point a au point b dans le crâne de type 1, et du point a′ au point b′ dans le crâne de type 2. On remarque que ab>a′b′.
4.3 Particularités de la cavité buccale de l'hoazin
Dans la perspective d'un traitement mécanique des aliments végétaux au niveau de la cavité buccale, nous devons envisager les particularités structurales de la voûte du palais. Chez les oiseaux néognathes, les aspects du fonctionnement de l'appareil hyoı̈dien s'intègrent de façon coopérante au palais mobile et à la langue. Chez l'hoazin, les caractéristiques des surfaces qui coopèrent à cette fonction ne se limitent pas seulement à la rugosité et à leur mobilité respective. Ces structures ont des propriétés élastiques : la langue grâce à la présence de corps caverneux et parce qu'elle est recouverte par plusieurs couches différenciées, le palais en raison de son recouvrement par une épaisse couche de tissu conjonctif très riche en graisse. Il s'agit vraisemblablement d'un mécanisme permettant de retenir la surface lisse des feuilles au cours de leur arrachage ainsi que des petites touffes de petites tiges de diamètres divers, les surfaces en présence étant capables de s'adapter à des objets de dimensions variables (variées). La flexibilité relative des épaisses couches qui recouvrent le palais assure, en outre, la capacité d'augmenter le volume de la cavité buccale pour l'importante masse végétale en cours de traitement. On peut noter que le volume du bec est aussi augmenté par l'élargissement particulier de sa base. Les profondes fentes verticales situées de chaque côté des crêtes élevées du palais permettent à ces dernières de rester plongées dans la masse végétale et, par conséquent, d'avoir un bon contact avec elle durant son traitement, même quand le plafond buccal recule au fur et à mesure que le bol végétal augmente en volume. Ceci permettrait d'expliquer le faible développement, chez l'hoazin, des processus palatins des maxillaires qui forment le palais rigide chez les desmognathes, par exemple chez les touracos et les coucous, apparentés à l'hoazin. Cette réserve d'augmentation passive du volume de la cavité buccale est avant tout liée aux capacités d'extensibilité de son fond, mais le recul de ce dernier présente une limite, au-delà de laquelle la langue et le palais, qui coopèrent dans la manipulation de la masse végétale, seront séparés par une zone morte, qui leur est inaccessible. De ce qui précède, on peut supposer qu'une tendance à gagner du volume supplémentaire dans la cavité buccale aux dépens du palais répond à une nécessité. En effet si, chez l'hoazin, les processus palatins des maxillaires et le bord inférieur de la cloison nasale étaient développés, ils limiteraient la capacité du plafond souple de cette cavité dans son recul sous la pression du bol alimentaire. Les mêmes raisons peuvent être avancées pour expliquer la courbure vers le haut du vomer ainsi que sa position dorsale, ce qui limite la rétraction de la mâchoire supérieure. L'utilisation du bec comme une paire de ciseaux demande une rigidité transversale des mâchoires pour assurer un contact continu entre les lames coupantes. À cet égard, la présence d'une liaison transversale osseuse entre les maxillaires qui caractérise le palais de type desmognathe répond à cette contrainte. Cependant, l'absence de cette liaison chez l'hoazin peut paraı̂tre paradoxale. Elle est compensée par la robustesse de la mâchoire supérieure et l'épaisseur des os qui la constituent. D'autres particularités du crâne sont probablement à mettre en relation avec la présence prolongée de masses végétales dans la cavité buccale, tel le développement des ailes ventrales des palatins qui entourent les choanes, les protégeant d'une obstruction sous l'effet de la pression de la nourriture et assurant la permanence de la ventilation alors que le bec est rempli. Les extrémités rostrales des palatins qui subissent aussi cette pression considérable résistent grâce à leur orientation parasagittale.
L'analyse morphofonctionnelle permet ainsi, malgré l'absence d'observations directes, de considérer que l'hoazin a toutes les caractéristiques d'un oiseau capable de mastication, chez qui le bec jouerait un rôle important dans la fragmentation des objets végétaux, à laquelle participerait en plus le jabot. Cette hypothèse doit bien sûr être soumise à l'épreuve des observations dans la nature.
4.4 Implications sur la position systématique de l'hoazin
La plupart des travaux sur le sujet ont tendu vers un rapprochement de l'hoazin et des Galliformes. Pour cette raison, la comparaison avec les représentants de ce groupe est intéressante, d'autant plus que récemment ont été mis en évidence certains aspects de l'adaptation trophique des Galliformes [18,34]. Il a été montré [18] que l'adaptation trophique clé au cours de l'évolution des Galliformes est constituée par une capacité à détacher les parties végétatives des plantes. Cette adaptation apparaı̂t étroitement liée à la réalisation du deuxième type de serrage des mâchoires de Dzerzhinsky [24], dont le principe réside dans la coordination du travail des deux mors de serrage de l'objet. En effet, dans l'appareil utilisant ce deuxième type, chaque mâchoire est contrôlée séparément du point de vue musculaire, le m. pterygoideus jouant un rôle indépendant du rétracteur de la mâchoire supérieure en raison de l'absence, au niveau de l'articulation mandibulaire, du ligament jugomandibulaire externe. L'orientation des lignes d'action des adducteurs dorsaux n'est efficace que pour assurer le contrôle de la mandibule [18,24]. Chez les Galliformes, cette disposition est associée à un déplacement vers l'avant des muscles élévateurs de la mandibule, leur assurant un plus grand bras de levier. Ainsi, le m. pseudotemporalis superficialis s'attache très en avant, sous l'œil, et la portion médiale de l'adducteur externe a déplacé son origine, du processus jugal du squamosal au processus post-orbitaire, permettant la formation entre ces deux processus d'un arc jugal supérieur ligamentaire. L'espace ainsi libéré est occupé par la portion caudale profonde, très développée, qui est découverte. La capacité du m. pterygoideus à jouer le rôle de rétracteur de la mâchoire supérieure est renforcée par l'immobilisation du carré à l'aide du ligament occipito-mandibulaire et d'un très puissant muscle adducteur postérieur qui stabilise l'articulation mandibulaire. On aurait pu penser qu'une adaptation à un régime végétarien rapprocherait l'hoazin des Galliformes. Cependant, une analyse morphologique, même superficielle, de chaque groupe révèle d'importantes différences structurales. L'appareil du bec de l'hoazin fonctionne avant tout selon le premier type de fermeture des mâchoires. Ce type est si largement répandu parmi les oiseaux que cette observation n'est pas remarquable, elle peut simplement surprendre compte tenu de la spécialisation trophique de cette espèce. On peut considérer que le premier type de fermeture est apparu au cours de l'évolution comme un élément de l'adaptation à la cueillette des objets de petite taille, y compris d'objets mobiles. Il s'agit donc de caractéristiques structurales relativement spécialisées dans l'ensemble des Diapsides. Cependant, un grand potentiel adaptatif a été conservé malgré cette spécialisation au « becquetage ». En effet, ce premier type permet de moduler diversement les efforts musculaires entre les deux mâchoires. Cette capacité adaptative aurait permis aux ancêtres de l'hoazin d'utiliser comme ressources alimentaires les parties végétatives des plantes, ce qui implique de surmonter la protraction passive de la mâchoire supérieure au moment de l'arrachage. On remarquera que, du point de vue strictement biomécanique, un appareil du bec fonctionnant selon le deuxième type est plus « optimisé » pour accomplir cette tâche. C'est le cas des Galliformes. C'est pourquoi il ne nous paraı̂t pas envisageable que l'hoazin soit passé, au cours de son histoire évolutive, par le deuxième type, directement mieux adapté à un régime végétarien, pour revenir au premier type. L'analyse morphofonctionnelle s'oppose de façon manifeste au rapprochement avec les Galliformes et ce d'autant plus que cela impliquerait une réversion vers une organisation structurale théoriquement bien moins avantageuse. La capacité à accomplir une même activité à partir de deux modalités structurales distinctes, c'est-à-dire l'existence d'équivalents fonctionnels, traduit manifestement une histoire évolutive différente pour les Galliformes et l'hoazin. Des résultats récents sur les coucous permettent d'envisager l'évolution de l'appareil du bec, les touracos comme l'hoazin relevant d'une adaptation trophique commune. Les touracos et les coucous formeraient un groupe naturel, bien différent des Galliformes et dans lequel s'insérerait l'hoazin [35]. Ce résultat est en accord avec de récentes données de phylogénie moléculaire [15], bien que la position de l'hoazin au sein des autres Néognathes demeure irrésolue [36].
5 Conclusion
Sans toutefois sortir du cadre général d'organisation propre aux Néognathes, la structure des appareils du bec et hyoı̈dien de l'hoazin est ainsi caractérisée par une série de particularités spécifiques et parfois uniques chez les oiseaux : par exemple, particularités de la rhamphothèque, présence des couches flexibles et des crêtes du palais, forme du vomer, faible développement des processus palatins des maxillaires, articulation secondaire de la mandibule, hypertrophie du m. pseudotemporalis profundus, structure et orientation oblique du m. pseudotemporalis superficialis, faiblesse étonnante du m. pterygoideus, développement exceptionnel des rétracteurs (m. stylohyoideus) ainsi que des protracteurs (m. branchiomandibularis) de la langue, structure interne complexe de cette dernière. Vu sous l'angle morphofonctionnel, le rapprochement entre les Galliformes et l'hoazin n'apparaı̂t pas légitime, tant les différences qui les séparent témoignent de trajectoires évolutives différentes.
Tout cela demande à être affiné et expliqué, en particulier par la recherche des relations entre la structure de ces appareils et le rôle qu'ils jouent dans l'exercice de fonctions importantes du point de vue sélectif. Tel est le rôle de l'approche morphofonctionnelle. Ainsi, il est probable que certains aspects de l'adaptation trophique de cette espèce ont échappé à l'attention des ornithologistes non-anatomistes. En effet, les observations de toutes sortes actuellement disponibles sont encore par trop insuffisantes pour élaborer une véritable hypothèse évolutive réunissant l'ensemble des données et qui, vérifiée, démontrerait la réalité d'une adaptation trophique spécifique. Cela augmente l'opportunité et l'intérêt d'une analyse morphofonctionnelle et de ses implications écologiques.
Remerciements
Les auteurs remercient le professeur V.F. Sych de l'université d'État d'Oulyanorsk de leur avoir fourni une tête d'hoazin fixée au formol. Cette étude a été permise grâce au soutien du Grant du RFRF N°99-04-48136 et FCP N A0084.


