Abridged English version
One explanation of the heavy metal phytotoxicity is that it results in the inhibition of the absorption and assimilation of nutrient minerals such as nitrogen. The studies undertaken in this field have remained however rather limited. The GS/GOGAT pathway is now assumed to ensure ammonium assimilation in higher plants, whether the origin of ammonia is nitrate reduction or photorespiration. Under abnormal stress situations, internal ammonium concentrations can be increased, and the GDH-NADH pathway is suspected of facilitating ammonia detoxification by catalysing glutamate synthesis. Previous studies have shown that cadmium negatively affected soluble proteins contents as well as some enzyme activities such as Rubisco, nitrate and nitrite reductase or glutamine synthetase. In contrast, this metal increased some enzyme activities involved in the intermediary metabolism, such as isocitrate dehydrogenase (ICDH) and glutamate dehydrogenase (NADH-GDH). Experiments presented in this paper emphasise the reversibility of cadmium effects. The hypothesis of the dilution of the heavy metal pool previously accumulated in plants by the increase of biomass is proposed. The obtained results show that the removal of cadmium from nutritive solutions results in resumption of growth activity in all organs, particularly in roots. Such results have been confirmed by the measurement of the stimulation of speed of growth (VCR).
While the content of nitrate remained steady in the roots of control plants, it rose progressively with age in shoots. Once cadmium had been removed, the nitrate contents as well as the NR, NiR, GS, GDH-NAD+ activities, that had been substantially affected by stress, recovered levels similar to the control. Furthermore, from the results obtained with GDH-NADH, it is clear that this enzyme is affected in opposite ways.
Finally, as suggested by our results, the reversibility of deleterious effects of cadmium on plants is possible. This conclusion stresses that a transient contamination of the culture medium by pollutants is not necessarily followed by a significant depreciation in product yield or quality.
Abréviations
Cd, cadmium ; EDTA, acide éthylène diamine tetracétique ; GDH, glutamate déshydrogénase ; GOGAT, glutamate syntase ; GS, glutamine synthétase ; MF, matière fraı̂che ; MS, matière sèche ; NR, nitrate réductase ; NiR, nitrite réductase ; γ-GHM, glutamylhydroxamate ; Rubisco, ribulose biphosphate carboxylase ; ICDH, isocitrate déshydrogénase.
1 Introduction
L'inhibition des processus d'absorption et d'assimilation de l'azote minéral constitue l'une des causes auxquelles peut être attribuée à la phytotoxicité des métaux lourds, mais des études entreprises dans ce domaine restent encore assez limitées. On peut citer à titre d'exemple celles de plusieurs auteurs [1–8]. Chez les végétaux supérieurs, la voie GS/GOGAT constitue, dans des conditions normales, la principale voie d'assimilation de l'ammonium, notamment celui qui provient de la réduction du nitrate [9–12]. Toutefois, lorsque, pour une raison ou pour une autre, la concentration interne en ammonium augmente, une seconde voie, contrôlée par la GDH-NADH dépendante, entre en jeu pour contribuer à faire baisser cette concentration interne.
Certaines études ont montré l'existence d'un effet inhibiteur du cadmium sur la teneur des tissus en protéines solubles et les activités de certaines enzymes comme la Rubisco [13], la NR, la NiR [1–5,7] ainsi que la GS [1,3,7]. À l'opposé, ce métal peut stimuler l'activité d'autres enzymes impliquées dans le métabolisme intermédiaire, comme l'isocitrate déshydrogénase (ICDH) et la GDH-NADH dépendante [1,5,7]. Il reste cependant que ces effets ne doivent pas être les mêmes, selon que les organismes vivants sont exposés d'une façon permanente ou transitoire à des concentrations élevées de polluants dans leurs milieux.
Les expériences présentées dans cet article s'inscrivent dans le cadre de la vérification de l'hypothèse d'une dilution éventuelle du polluant préalablement accumulé par la croissance.
2 Matériel et méthodes
2.1 Matériel végétal et conduite des cultures
Le matériel végétal utilisé dans ce travail est la tomate (Lycopersicon esculentum. Mill. CV. 63/5 F1). Les graines sont désinfectées à l'eau oxygénée 10 % (v/v) pendant 20 minutes, puis rincées abondamment à l'eau distillée. Elles sont ensuite mises à germer dans des boı̂tes de Pétri, dont le fond est recouvert d'une double couche de papier filtre imbibé d'eau distillée. La germination est faite à l'obscurité à une température de 25 °C environ. Après sept jours, les plantules sont repiquées sur des seaux de 6 l (10 plantules par seau) contenant une solution nutritive de base ayant au départ un pH de 5,8 à 6 et composée de KNO3 3 mM, Ca(NO3)2 0,5 mM, KH2PO4 0,5 mM, Fe–K2–EDTA 100 μM, H3BO3 30 μM, MnSO4 5 μM, CuSO4 1 μM, ZnSO4 1 μM et (NH4)6Mo7O24 1 μM. La culture est faite en salle conditionnée, avec une photopériode de 16 h, une température diurne de 28 °C et une période d'obscurité de 8 h à la température de 18 °C. L'éclairement est assuré par des lampes à mercure apportant une densité de flux quantique de 150 μmol de photons au niveau de l'étage foliaire supérieur. À l'âge de 10 jours, les plantules sont d'abord transférées pendant une période de sept jours sur milieu de culture enrichi de 20 μM de cadmium, puis replacées pendant neuf jours sur milieu de culture de base sans cadmium. Les plantules sont récoltées trois heures après le début de photopériode et subdivisées en feuilles, tiges + pétioles et racines. Les racines sont rincées rapidement dans trois bains successifs d'eau distillée, puis les échantillons sont placés dans l'azote liquide pour des analyses ultérieures ou desséchés dans l'étuve à 70 °C pendant au moins trois jours, pour la détermination de la matière sèche, des teneurs ioniques et de la vitesse de croissance relative. Celle-ci est exprimée de la façon suivante :
La vitesse de croissance relative est exprimée en .
2.2 Dosage du nitrate
Pour le dosage du nitrate la matière sèche est placée dans des piluliers et soumise à une extraction à froid par une attaque acide (H2SO4 N/10). Le nitrate est dosé par colorimétrie à l'aide d'une chaı̂ne automatique après passage à travers une colonne réductrice de cadmium et diazotation du nitrite formé [14].
2.3 Dosage de cadmium
Pour le dosage des métaux lourds (Cd), la matière végétale sèche est placée dans un matras de Kjeldahl et soumise à une extraction à chaud par une attaque nitroperchlorique (HNO3/HClO4, 3:1, v/v). Le mélange est amené à sec sur une rampe de minéralisation. Après refroidissement, un volume standard (25 ml) d'une solution d'acide nitrique (N/13) est ajouté au résidu sec, d'aspect blanchâtre. Le cadmium est dosé ainsi sur l'extrait nitrique par spectrophotométrie d'absorption atomique, à l'aide d'un appareil Perkin-Elmer Analyst 300.
2.4 Dosage de l'ammonium
Le matériel végétal, préalablement congelé dans l'azote liquide, est broyé à 4 °C dans un mortier en présence de 2 ml de H2SO4 et 0,5 % (p/v) de polyclart AT. Le broyat est centrifugé pendant 15 min à . L'ammonium est dosé dans le surnageant selon la réaction de Berthelot modifiée par Weatherburn [15].
2.5 Extraction et mesures d'activités enzymatiques
2.5.1 NR
L'activité de la nitrate réductase est mesurée par la méthode de Robin [16]. Cette méthode consiste à extraire l'enzyme du tissu végétal par broyage dans un tampon d'extraction (8 ml par gramme de matière fraı̂che) en présence d'EDTA 1 mM, de cystéine 7,5 mM et de caséine 2,5 % p/v. Le broyage est effectué à 4 °C dans un mortier en présence d'un milieu d'extraction de pH 7,4 composé de phosphate de potassium 100 mM, de KOH 1 N, de caséine et d'EDTA. Le broyat, filtré sur une toile de Bultex, est centrifugé pendant 15 min à . Le surnageant qui constitue l'extrait enzymatique est conservé dans la glace jusqu'au moment des mesures. L'activité NADH-NR est mesurée par détermination du nitrite formé dans le milieu réactionnel [17]. La diazotation des nitrites formés est réalisée par l'addition de sulfanilamide et de N-naphtyl-éthylène-diamine-dichlorure. La densité optique du surnageant est lue à 540 nm après 20 min de développement de la coloration.
2.5.2 NiR
L'extraction de l'enzyme nitrite réductase est réalisée dans les mêmes conditions que celles décrites pour la nitrate réductase. L'activité de la NiR est déterminée par mesure de la disparition du nitrite du milieu réactionnel [18] par dosage colorimétrique, utilisant le méthyl viologène comme donneur d'électrons. La réduction du nitrite se déroule dans un milieu tamponné à pH 7,4, de volume total 1,0 ml. La densité optique du surnageant est lue à 540 nm après 20 min de développement de la coloration.
2.5.3 GS
Le matériel végétal, préalablement congelé dans l'azote liquide, est broyé à 4 °C dans un milieu d'extraction ( MF) contenant 25 mM de tampon tris-HCl (pH 7,6), 1 mM d'EDTA, 1 mM de MgCl2, 14 mM de β-mercaptoéthanol et de 1 % de polyclart AT (p/v). Le broyat est ensuite centrifugé pendant 20 min à à 4 °C. Le surnageant, qui constitue l'extrait enzymatique, est conservé dans la glace jusqu'au moment des mesures. L'activité GS est déterminée en utilisant l'hydroxylamine comme substrat et la formation de γ-glutamylhydroxamate (γ-GHM) est quantifiée par un agent ferrique [19].
2.5.4 GDH
Les échantillons préalablement congelés sont broyés dans un tampon d'extraction contenant 100 mM de β-mercaptoéthanol et de 1 % de polyclart AT (p/v). L'homogénat est centrifugé pendant 10 min à à 4 °C. Le surnageant, qui constitue l'extrait enzymatique, est conservé dans la glace jusqu'au moment des mesures. L'activité GDH dans les deux réactions, amination et désamination, est déterminée par l'observation de changement de l'absorbance à 340 nm [20].
3 Résultats
Croissance. L'élimination du cadmium du milieu de culture se traduit par une reprise de l'activité de croissance au niveau des trois types d'organes, et plus particulièrement au niveau des racines (Fig. 1). Ceci est montré encore par la stimulation observée de la vitesse de croissance relative (VCR) (Fig. 2). En outre, cette VCR diminue, en particulier pour les plantes témoins, probablement du fait d'un épuisement du milieu, mais la diminution de cette même vitesse pour des plantes maintenues dès le début sur milieu enrichi en cadmium s'explique par la phytotoxicité de ce métal.
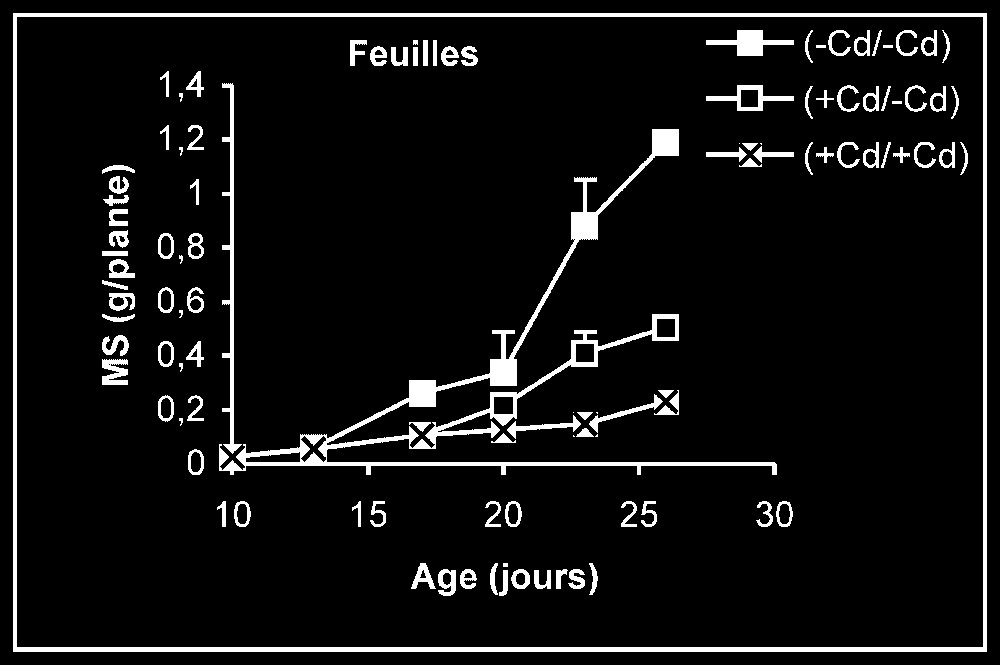

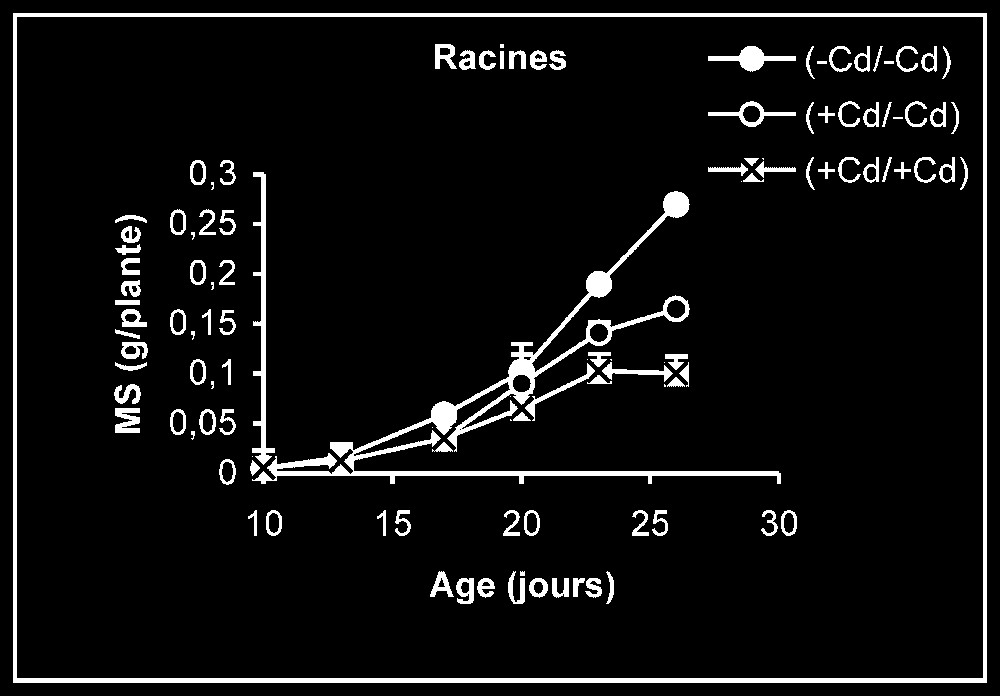
Évolution de la production de matières sèches des feuilles, des tiges plus pétioles et des racines après transfert sur milieu nutritif de base, des plantes de tomate soumises ou non à un pré-traitement de sept jours avec le cadmium (20 μM). Symboles noirs : plantes maintenues constamment sur milieu témoin ; symboles blancs : plantes traitées pendant sept jours par Cd 20 μM, puis replacées pendant 9 j sur milieu témoin. Symboles hachurés : plantes constamment maintenues sur 20 μM de Cd.
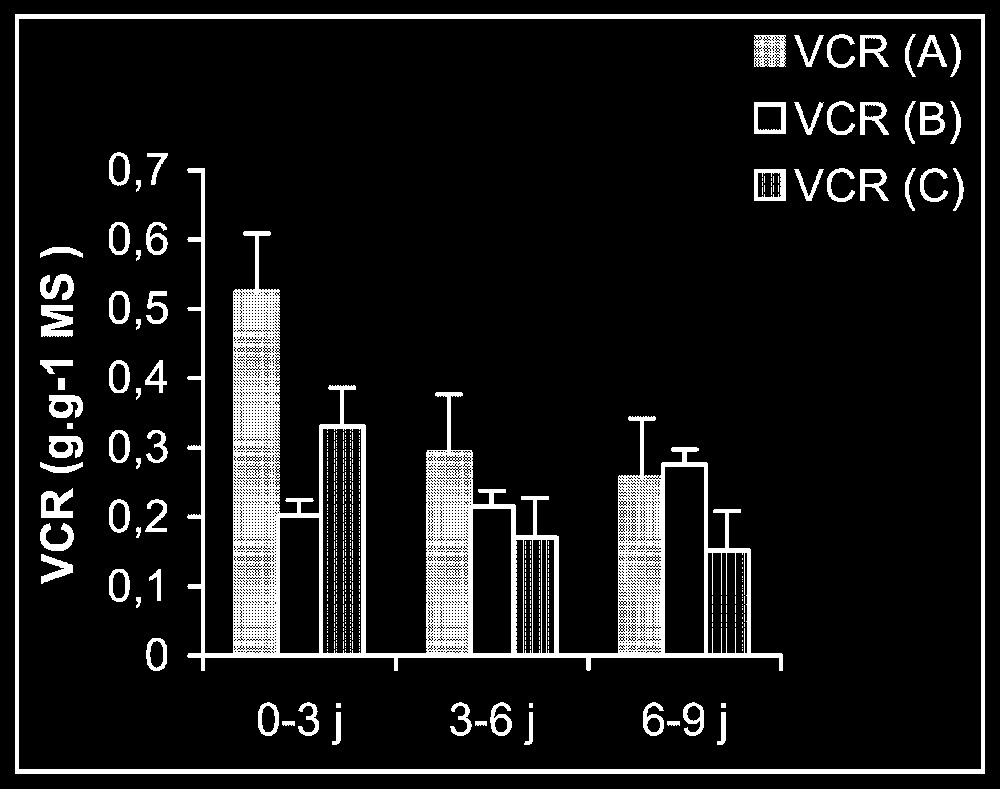
Vitesse de croissance relative (VCR) pour les plantes maintenues dès le début sur milieu témoin (A), les plantes traitées par Cd puis replacées sur milieu témoin (B) et les plantes maintenues toujours sur milieu enrichi de cadmium (C).
Teneur en cadmium. Chez les plantes maintenues d'une manière permanente sur milieu additionné de cadmium (Fig. 3), les tissus racinaires s'enrichissent plus en cadmium que ceux des feuilles et des tiges + pétiole. Comme le montrent les données du Tableau 1, la quantité de cadmium incorporée dans la plante au terme de la période de traitement reste par la suite sensiblement constante pendant le reste de la période de culture, alors que la masse de tissus augmente sensiblement.

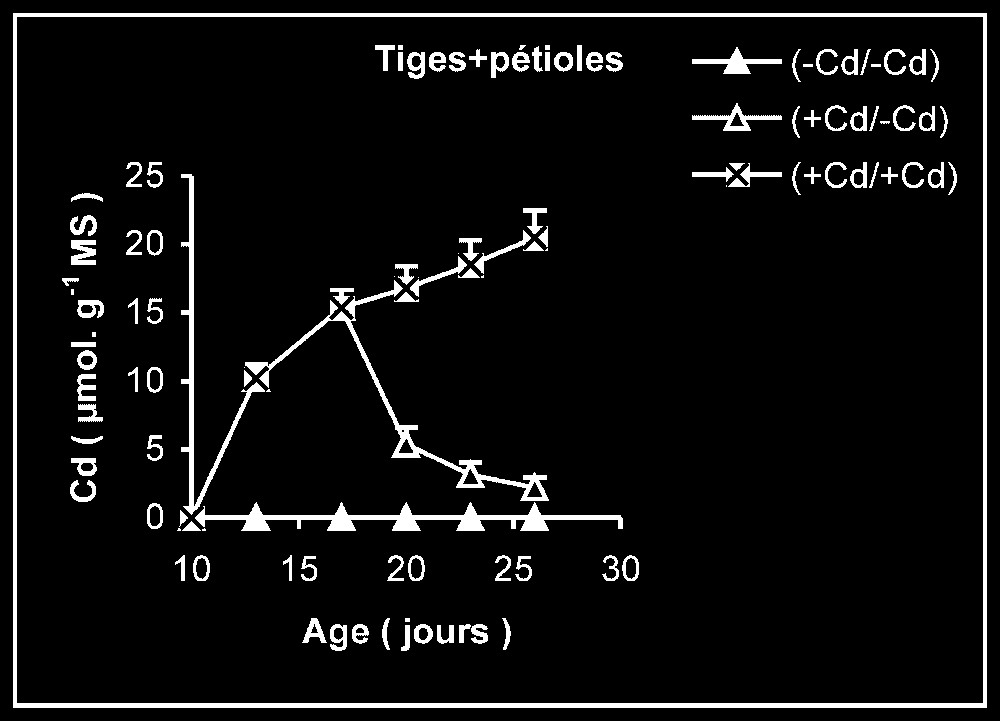
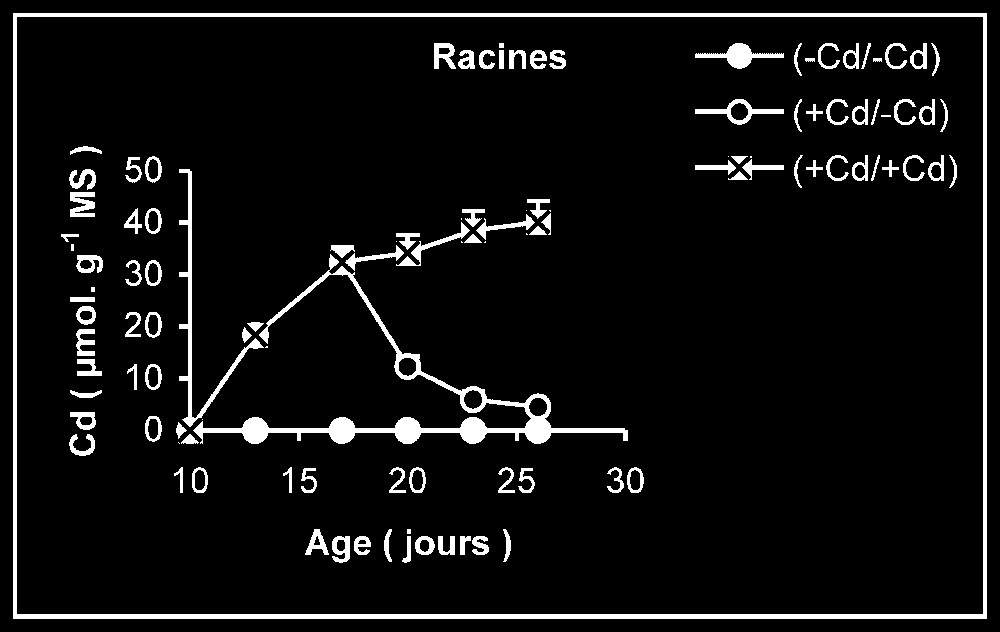
Variation de la teneur en cadmium dans les feuilles, les tiges plus pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou enrichi de cadmium (symboles hachurés) et de plantes traitées pendant 7 jours sur un milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs).
Variations de la masse de la plante entière et de la quantité de cadmium dans la plante entière (ensemble : feuilles + tiges plus pétioles + racines), au cours de la période qui suit l'élimination de ce polluant du milieu de culture
| Période après la suppression de Cd | 0 j | 3 j | 6 j | 9 j |
| MS (g/plante) | 0,181 | 0,416 | 0,787 | 1,055 |
| Cd (μmol/plante) | 9,95 | 9,12 | 9,05 | 8,87 |
Teneur en nitrate. Chez les plantes témoins, la teneur en nitrate dans les racines se maintient à des valeurs sensiblement constantes (Fig. 4). En revanche, cette teneur augmente progressivement au niveau des feuilles en fonction de l'âge. Chez les plantes stressées, nous pouvons constater que, dès l'élimination du métal lourd du milieu de culture, la teneur en nitrate augmente progressivement, notamment dans les feuilles.
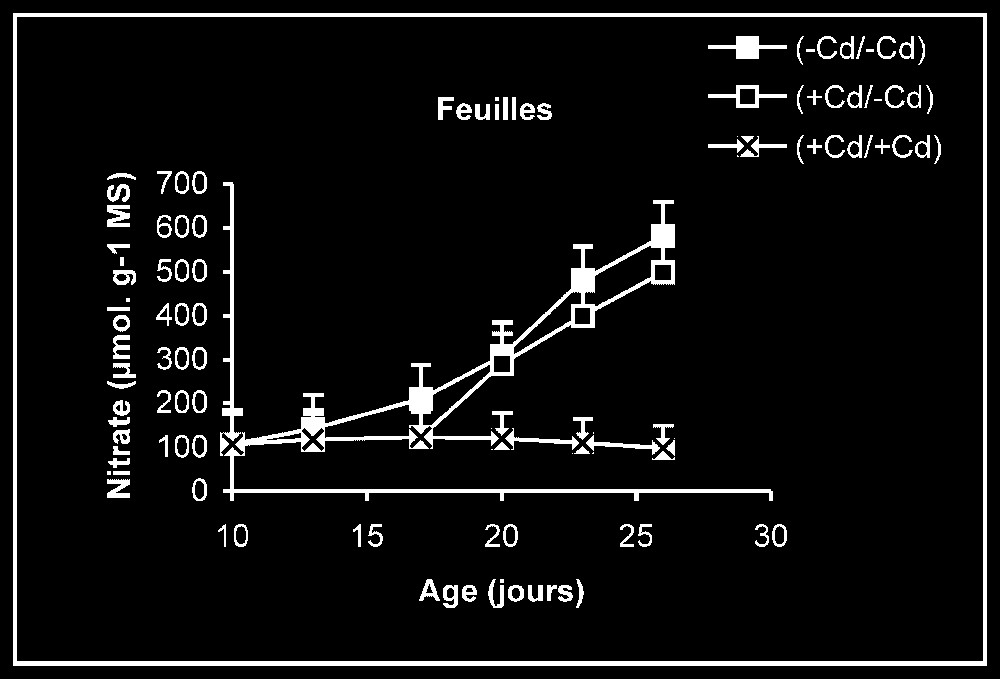
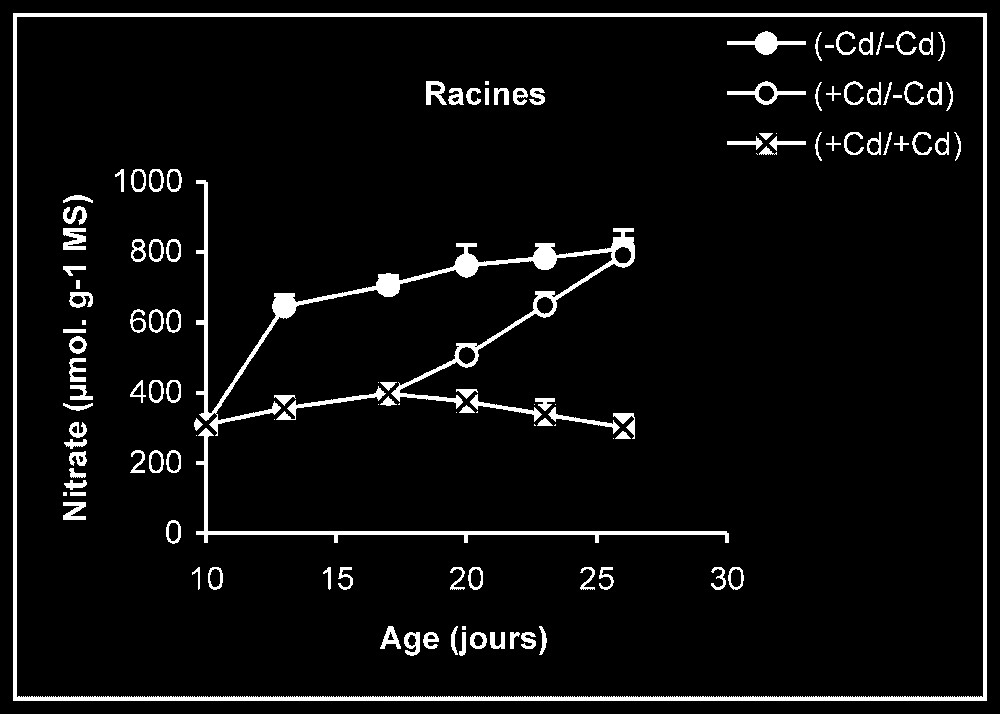
Évolution de la teneur en nitrate dans les feuilles et les racines après transfert sur milieu nutritif de base, des plantules de tomate soumises ou non à un pré-traitement de sept jours avec le cadmium (20 μM). Symboles noirs : plantes maintenues constamment sur milieu témoin; Symboles blancs : plantes traitées pendant sept jours par Cd 20 μM puis replacées pendant neuf jours sur milieu témoin. Symboles gris : plantes constamment maintenues sur 20 μM de Cd.
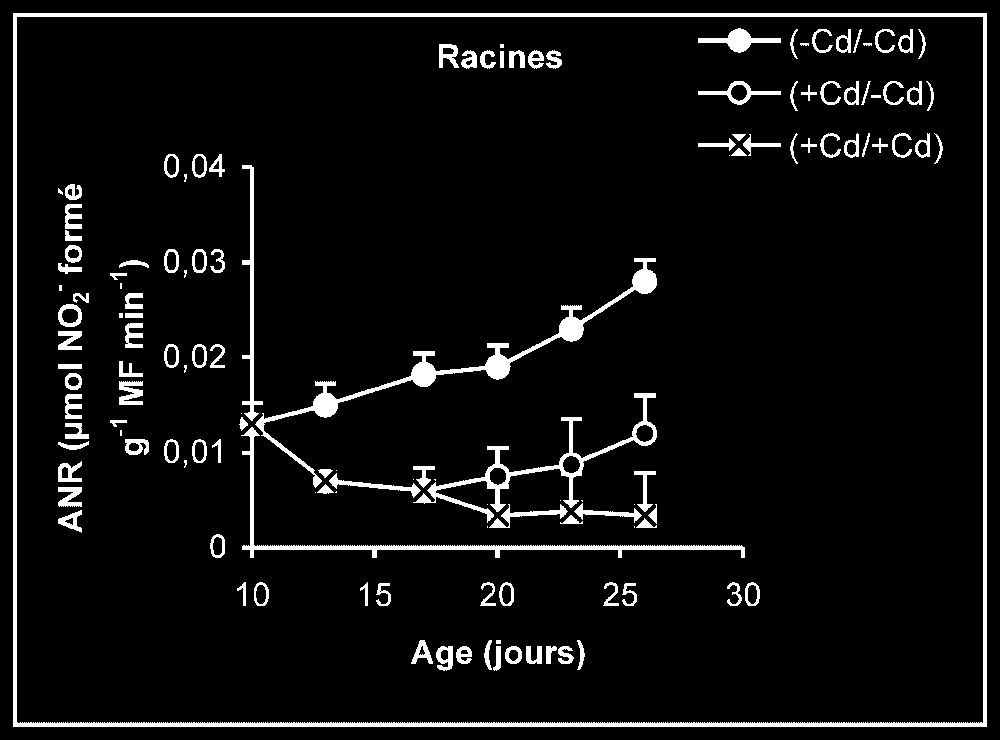
Activités enzymatiques. Les résultats relatifs à l'étude de la réversibilité des effets du cadmium sur l'activité de certaines enzymes impliquées dans le métabolisme azoté : NR, NiR, GS, GDH-NADH, et GDH-NAD+ ont été regroupés dans les Figs. 4–8. Pour les NR, NiR, GS et GDH-NAD+, dans les résultats obtenus (Figs. 5–8), nous constatons que le maintien du cadmium d'une façon permanente dans le milieu de culture (traitement +Cd/+Cd) se traduit par une forte inhibition de leurs activités dans tous les organes. L'élimination du cadmium du milieu de culture au-delà de sept jours de traitement (traitement +Cd/−Cd) s'accompagne d'une levée progressive de cet effet inhibiteur et, dans certains cas, les valeurs obtenues au terme de l'expérience se rapprochent fortement de celles obtenues pour les témoins.
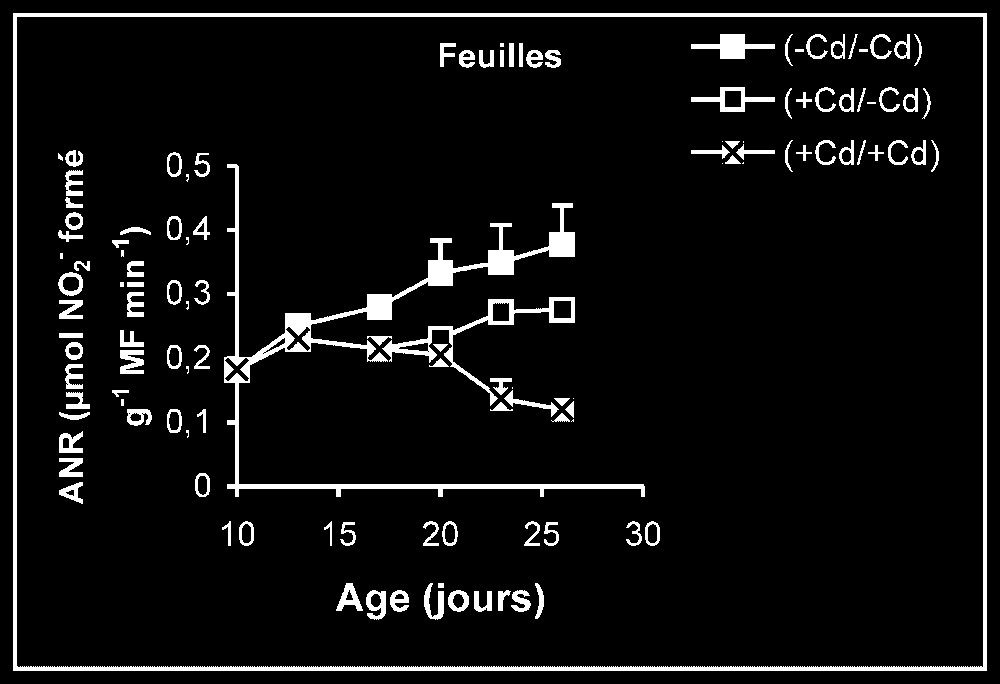
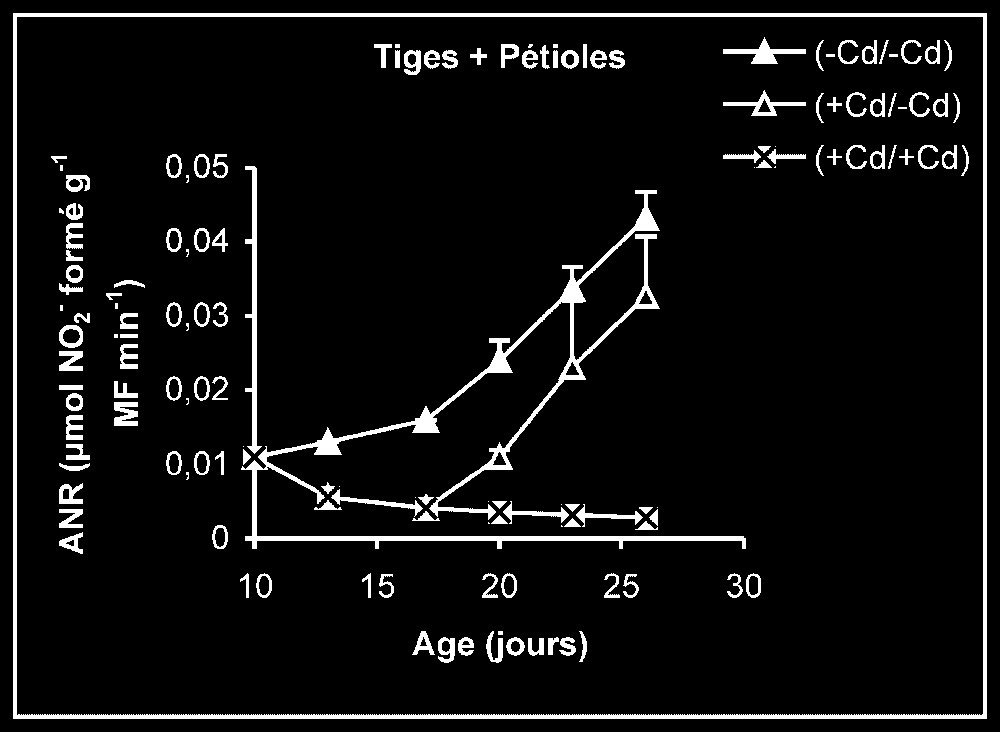
Activités de la nitrate réductase dans les feuilles, les tiges plus pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou sur milieu enrichi de cadmium (symboles hachurés) et de plantes traitées pendant sept jours sur milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs).

Activités de la nitrite réductase dans les feuilles, les tiges plus pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou sur milieu enrichi de cadmium (symboles hachurés) et de plantes traitées pendant sept jours sur milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs).
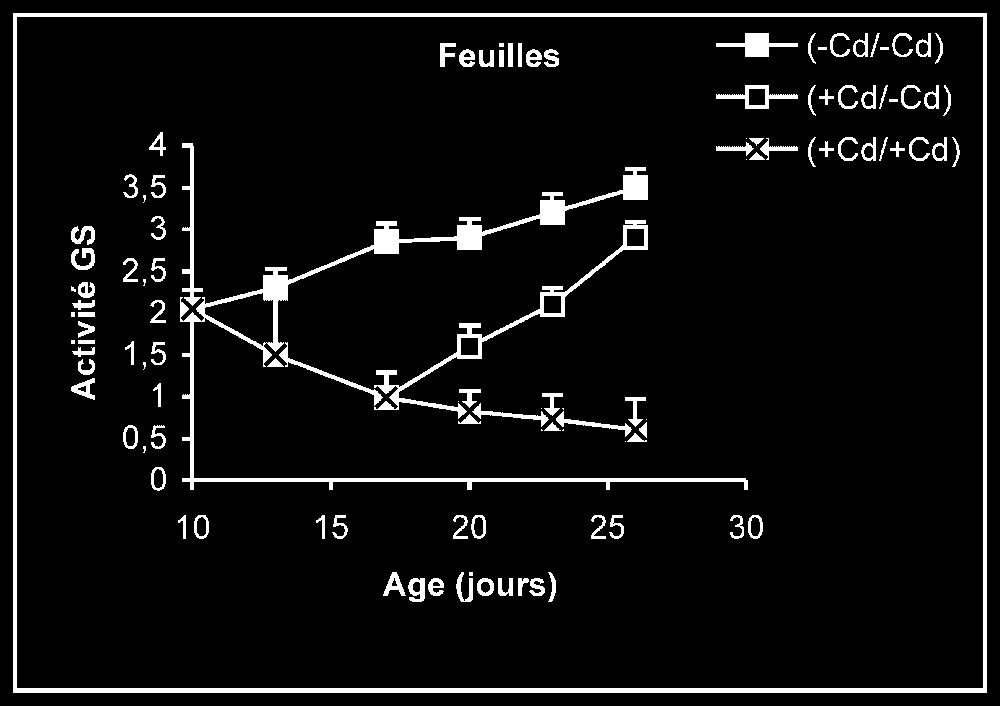

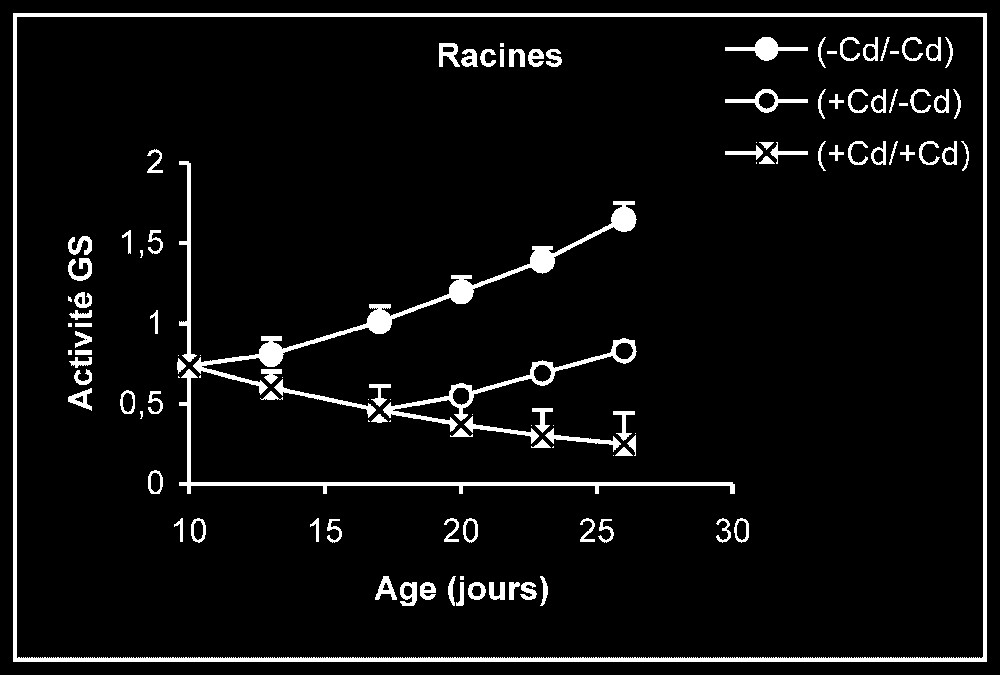
Activités de la glutamine synthétase dans les feuilles, les tiges + pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou sur milieu enrichi de cadmium (symboles hachurés) et de plantes traitées pendant sept jours sur milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs). L'activité GS est exprimée en γ-GHM .
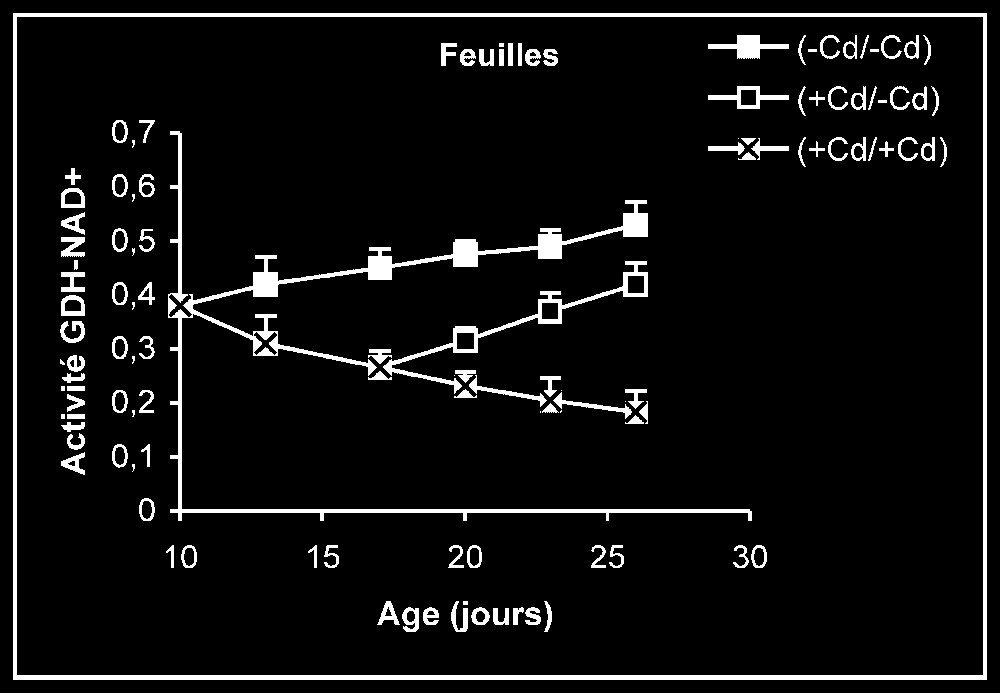

Activités de la glutamate déshydrogénase dans les feuilles, les tiges + pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou sur milieu enrichi de cadmium (symboles hachurés) et de plantes traitées pendant sept jours sur milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs). L'activité GDH-NAD+ est exprimée en μmol NAD+ réd .
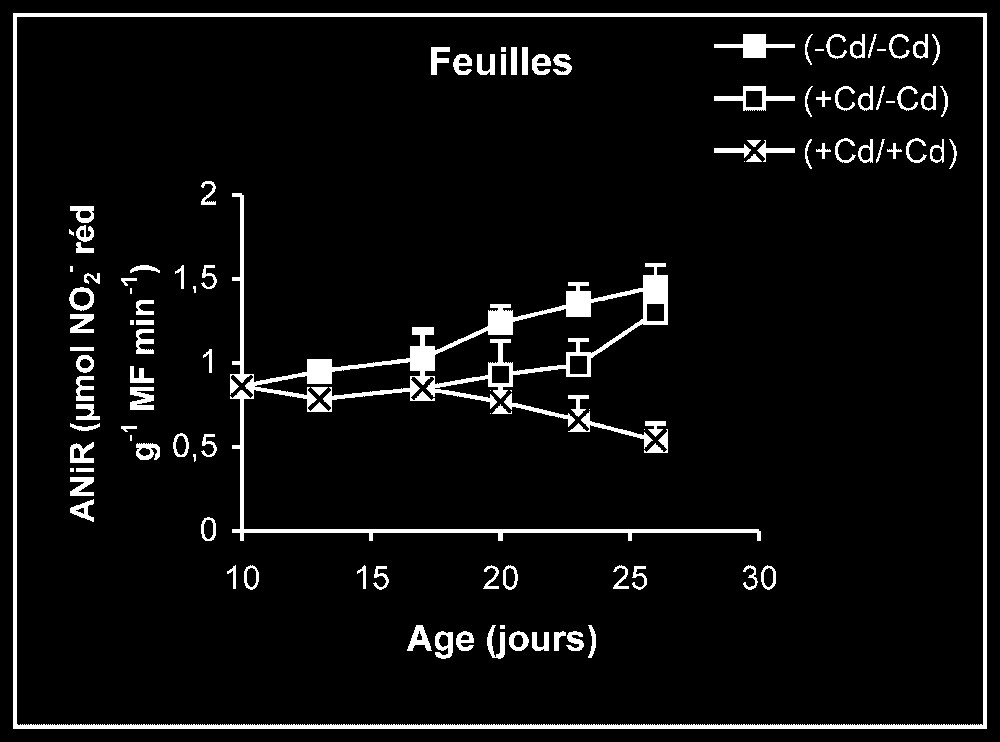
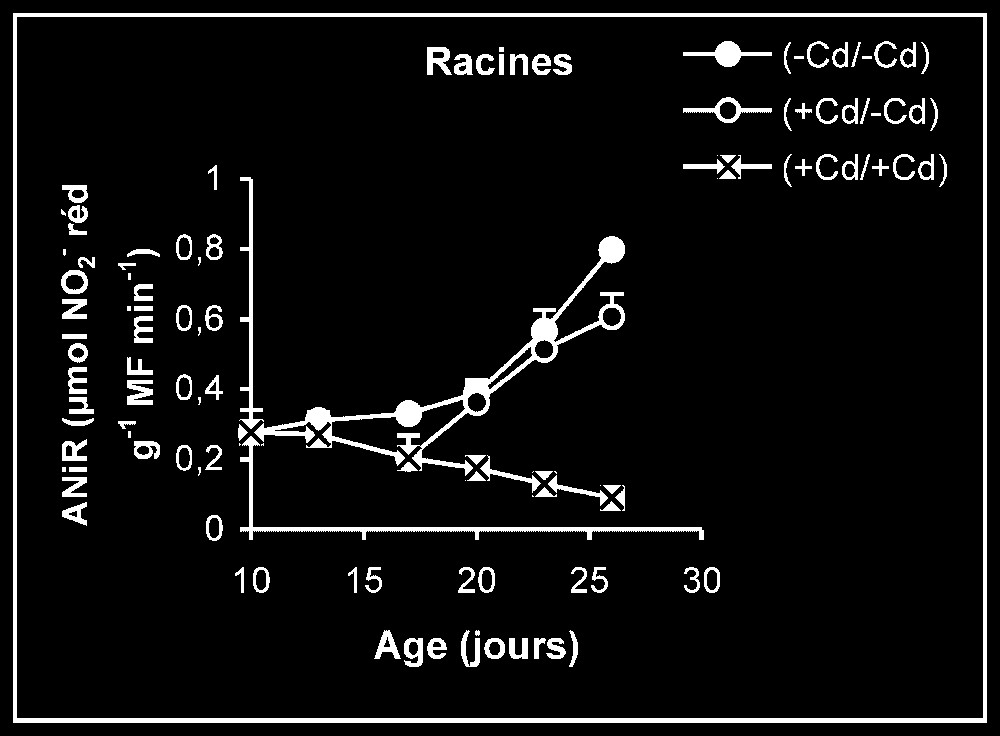
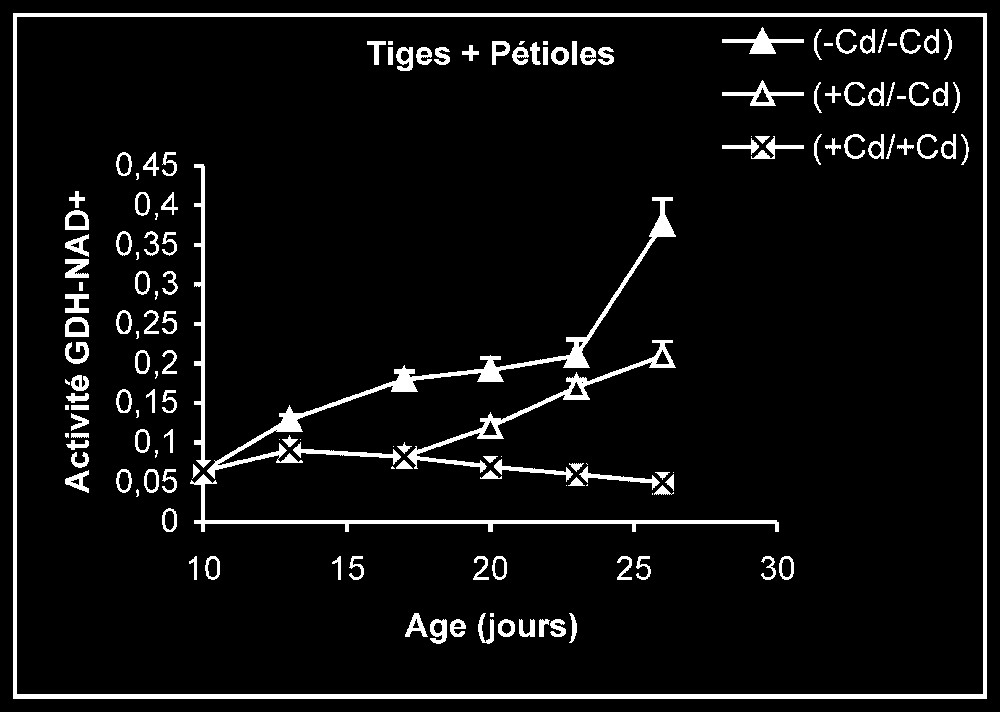
Ces résultats contrastent nettement avec ce que nous avons obtenu pour l'activité de la GDH-NADH (Fig. 9). Dans ce cas, par rapport aux témoins, le traitement par le cadmium exerce un effet stimulateur, qui se trouve partiellement inversé lorsque le métal lourd est supprimé du milieu de culture. Comme l'activité aminatrice de la GDH ne peut être stimulée qu'en présence de fortes concentrations d'ammonium, ceci signifie que le traitement des plantes par Cd conduit à un surplus de production d'ammonium d'origine endogène par rapport aux témoins. Les résultats de la Fig. 10 viennent à l'appui de cette hypothèse. Ils permettent aussi de constater que l'élimination du Cd du milieu de culture se traduit par une diminution progressive du taux d'ammonium dans les tissus.
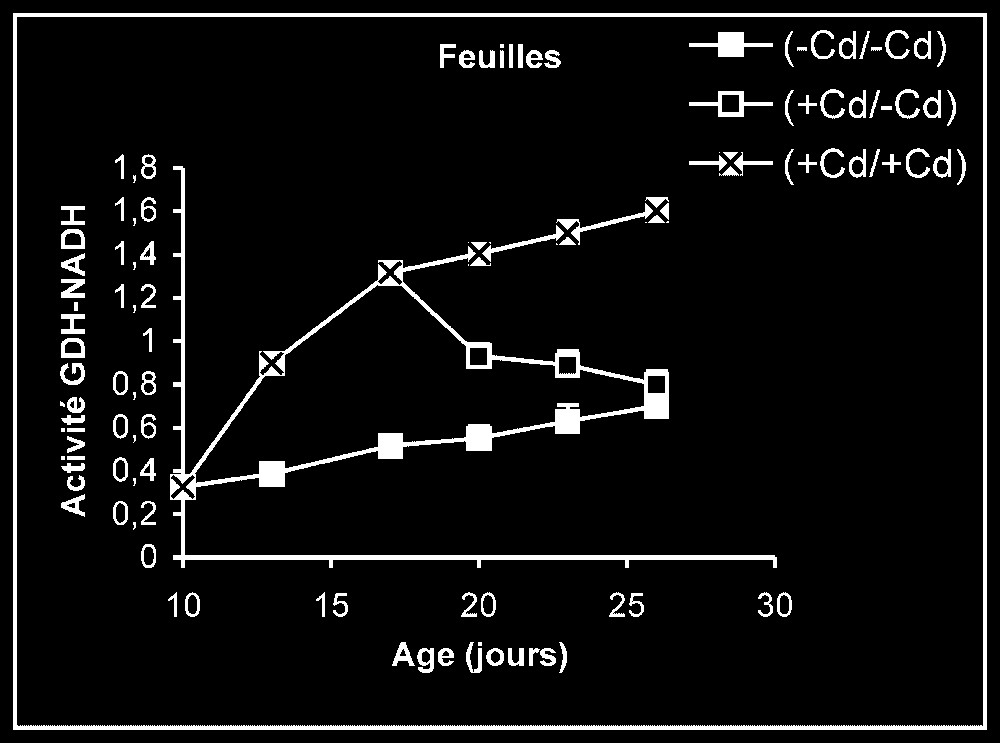
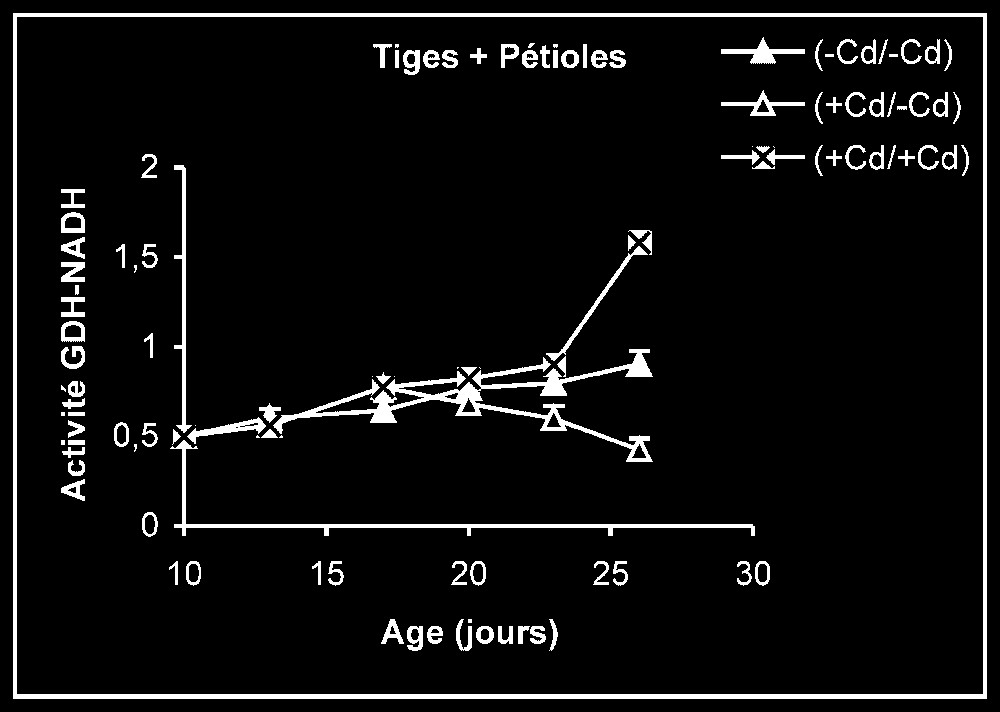

Activités de la glutamate déshydrogénase dans les feuilles, les tiges + pétioles et les racines des plantes maintenues constamment sur milieu de base (symboles noirs) ou sur milieu enrichi de cadmium (symboles hachurés) et de plantes traitées pendant sept jours sur milieu enrichi de cadmium, puis replacées sur milieu de base (symboles blancs). L'activité GDH-NADH est exprimée en μmol NADH oxy .


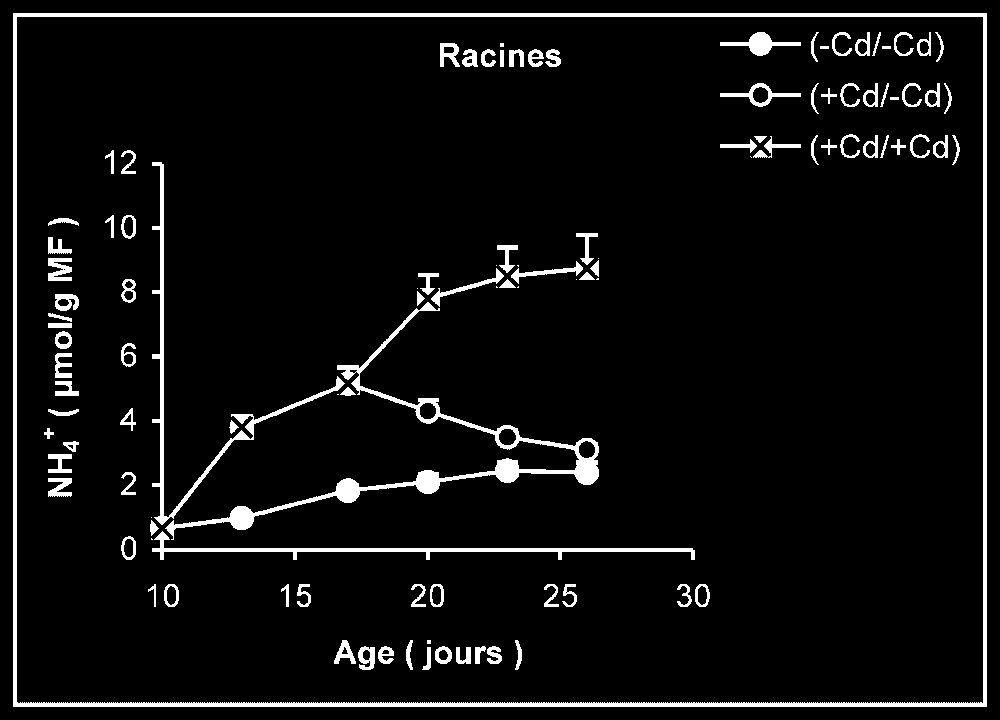
Évolution de la teneur en ammonium dans les feuilles, les tiges plus pétioles et les racines après transfert sur milieu nutritif de base, des plantules de tomate soumises ou non à un pré-traitement de sept jours avec le cadmium (20 μM). Symboles noirs : plantes maintenues constamment sur milieu témoin. Symboles blancs : plantes traitées pendant sept jours par Cd 20 μM, puis replacées pendant neuf jours sur milieu témoin. Symboles hachurés : plantes constamment maintenues sur 20 μM de Cd.
4 Discussion
Le nitrate constitue, dans les conditions normales, la principale source d'azote minéral pour les végétaux supérieurs et, plus particulièrement, les plantes cultivées. Son assimilation, conduisant à la biosynthèse des acides aminés, s'effectue en plusieurs étapes, contrôlées chacune par une enzyme particulière (Fig. 11). Les résultats que nous avons présentés dans les Figs. 5–7 montrent que les activités de la NR, de la NiR et de la GS des plantes maintenues sur milieux témoins sont toujours plus importantes dans les feuilles que dans les racines. L'addition de cadmium au milieu de culture à une dose de 20 μM se traduit toujours par une diminution progressive des niveaux d'activité pour ces enzymes, dans des proportions variables selon l'enzyme et l'organe. Ce type de résultats peut être la conséquence d'une limitation dans la disponibilité du nitrate, dont l'accumulation est, comme le montre la Fig. 4, fortement réduite en présence de cadmium. Il est également possible, comme le suggèrent les résultats de la Fig. 3, que le traitement des plantes par une dose de 20 μM de Cd conduit à l'accumulation de ce métal lourd dans les compartiments endocellulaires à un niveau supérieur à celui qui correspond aux capacités de régulation des systèmes de bioprotection endogènes, conduisant à la présence de ce métal à l'état libre, notamment dans l'environnement immédiat des systèmes enzymatiques impliqués dans les conditions normales dans l'assimilation du nitrate. Ce métal pourrait alors interférer avec les groupements fonctionnels des enzymes comme les groupements SH ou entrer en compétition avec des métaux de transition tels que Fe et Mo présents dans certaines métalloenzymes [1–4] et perturber ainsi leurs activités catalytiques. Dans le cas des plantes traitées pendant sept jours par Cd, puis replacées dans des conditions normales en l'absence de cet élément, la reprise progressive de l'activité de ces enzymes traduit alors, soit une dilution du polluant préalablement accumulé dans la plante dans une masse de tissu de plus en plus importante, résultant elle-même de la reprise de l'activité de croissance, comme le montrent la Fig. 1 et le Tableau 1, soit d'un surplus d'efficacité pour des systèmes de bioprotection endogènes, conduisant à une diminution significative de l'activité ionique de ce polluant dans l'environnement immédiat des systèmes enzymatiques préalablement cités, soit enfin d'une néosynthèse de nouvelles entités enzymatiques mises à l'abri de tout effet délétère du cadmium. Des résultats similaires à ceux obtenus pour la NR, la NiR et la GS et pouvant être interprétés de la même façon ont été observés pour l'isoforme de la GDH-NAD+ dépendante (Fig. 8). Mais, à l'inverse de ce qui est observé avec toutes ces enzymes, l'isoforme de la GDH-NADH dépendante voit son niveau d'activité stimulé en présence de cadmium, et le retrait de ce dernier du milieu de culture après sept jours de traitement s'accompagne d'une baisse progressive de son niveau d'activité (Fig. 9). La stimulation de l'activité de la GDH-NADH, qui catalyse la fixation de l'ammonium sur un acide α-cétonique issu du cycle de Krebs [12], et dont la contribution dans le métabolisme azoté peut être considérée, dans les conditions normales, comme marginale chez les végétaux supérieurs, peut constituer en condition de stress, notamment celui induit par les métaux lourds, une réponse de type adaptatif lui permettant, outre de se débarrasser de l'excédent d'ammonium, de pouvoir obtenir du glutamate nécessaire pour la synthèse de biomolécules impliquées dans la lutte contre ce type de stress, comme le glutathion et les phytochélatines [21]. L'élévation de la teneur tissulaire en ammonium serait la conséquence d'une stimulation de l'activité protéolytique, dont la signification physiologique pourrait correspondre à la nécessité de débarrasser la cellule des protéines inactivées ou anormales produites en conditions de stress métallique et dont l'accumulation pourrait avoir des effets cytotoxiques [22]. L'élévation de la teneur endogène pourrait elle-même conduire, comme l'ont suggéré certains auteurs [23,24] à la synthèse de nouvelles isoformes de la GDH-NADH dépendante absentes chez les témoins, la GDH étant réputée capable de présenter un nombre élevé d'isoformes [23,25–27]. L'augmentation de l'activité anabolisante de la GDH qui en résulte conduit à la production de glutamate, dont la disponibilité aurait autrement diminué à la suite des interférences du cadmium avec les enzymes impliquées, dans les conditions normales, dans l'assimilation du nitrate (NR, NiR et GS notamment). Le retrait du cadmium du milieu de culture, qui s'accompagne, comme nous l'avons précédemment indiqué, d'une reprise de l'activité des enzymes impliquées dans le processus d'assimilation de nitrate (NR, NiR et GS notamment), doit aussi être suivi d'une diminution de l'activité protéolytique génératrice d'ammonium dans les espaces intracellulaires, conduisant à son tour à une réduction progressive dans l'activité aminatrice de la GDH, comme le montre la Fig. 9.

Représentation schématique de la voie d'assimilation du nitrate chez les végétaux supérieurs. Symboles : GLN, glutamine ; α-C.G, α-cétoglutarate ; Fd, ferredoxine; GLU, glutamate ; A.A, acides aminés.
La reprise progressive d'un niveau normal pour tous les paramètres physiologiques et métaboliques étudiés chez la tomate est accompagnée d'une diminution des niveaux d'accumulation endogène de Cd (exprimés en μmol MS). Cette diminution de la teneur en cadmium n'est pas due à une exsorption du métal dans le milieu (Tableau 1). Ceci nous permet de conclure à la réversibilité des effets délétères des métaux lourds une fois que ces derniers se trouvent éliminés du milieu, probablement par un effet de dilution par la croissance.
Cette conclusion est importante et signifie en particulier qu'une contamination transitoire des cultures par de tels polluants par une dose plus ou moins importante peut ne pas être suivie de conséquences trop négatives au niveau de certains paramètres qui en contrôlent la production.
Remerciements
Les auteurs remercient la DGRST pour son soutien technique et financier.


