Abridged English version
The proliferation of cyanobacteria, linked to lake and river eutrophication, generates various harmful effects in terms of ecology, tourism and human health. Many studies are currently being undertaken, using classical limnology sampling: sampling with a Van Dorn bottle and counting under inverted microscope according to Utermöhl's technique. However, these methods appear often unsuited to cyanobacteria such as Microcystis aeruginosa in view of their colonial aspect, the friability and buoyancy of their colonies and their seasonal development cycle.
Our study was conducted on the Grangent reservoir, located on the river Loire near Saint-Etienne (France). New methods of sampling and of enumeration of colonial cyanobacteria were developed and compared. Sampling was carried out weekly during 2000–2002, at a station located 40 m deep in a downstream part of the reservoir.
The new sampling protocol specifically adapted to the characteristics of M. aeruginosa involves using a ‘filtering pump’. This device is composed of a Plexiglas tube containing an electric pump with a removable net (50 μm) and a metal collector above. This enabled a large volume (300 l) of water to be sampled from a given depth. After each filtration, the sample was collected in a bottle with 250 ml of water and then brought back to the laboratory. The cyanobacteria count was also modified so as to count small numbers of colonies. Each water sample was filtered twice with a 50-μm filter. Cyanobacteria were counted on this filter under epifluorescence microscope at 510–560 nm.
With these methods, M. aeruginosa colonies were counted in the epilimnion over the whole year, even in winter, whereas no cyanobacteria were obtained with Van Dorn bottle sampling. The first significant increase appeared at the beginning of June, in both 2000 and 2001, with values ranging between 30 and 50 colonies l−1 at 0.5 m. In parallel, cyanobacterium colonies were found in the hypolimnion. Then, in summer, our sampling method showed two different patterns, depending on the year, whereas no cyanobacteria were observed in 2000 with the classical limnology protocol. In reality, in the year 2000, cyanobacterium concentrations remained relatively weak, unlike in 2001 when M. aeruginosa developed abundantly with a maximum at the end of August (16 500 colonies l−1). In the same way, in autumn, our new method found that cyanobacterium concentrations varied differently according to the year. In 2000, a weak development occurred around mid-September on the water surface, whereas in 2001 epilimnic concentrations fell and the highest values were measured at the bottom of the water column, because of water column mixing. Lastly, in the winter, only a few colonies remained (0.2 colonies l−1), whatever the year.
Our study revealed that standard sampling methods used in limnology badly underestimate colonial cyanobacteria. Moreover, the newly adapted protocol cyanobacteria development to be monitored exactly throughout the year, in both epilimnion and hypolimnion. It was thus possible to study particular processes of M. aeruginosa's annual cycle, such as benthic recruitment in spring or seasonal distribution of the colonies on the water column.
This work could contribute to improving sampling techniques adapted to colonial cyanobacteria, of particular importance at a time when such species' toxicity is causing ever-greater concern.
1 Introduction
L'eutrophisation anthropique des lacs et rivières d'eau douce est un problème maintenant connu depuis plusieurs décennies [1–5].
Cette dystrophie est principalement causée par des apports excessifs en nutriments, à partir de rejets d'eau usée ou suite au lessivage de sols agricoles. L'enrichissement accéléré des eaux conduit souvent à la prolifération, puis à la dominance de cyanobactéries. Ces procaryotes forment généralement, en période d'efflorescence, d'épaisses couches à la surface de l'eau, qui posent aujourd'hui des problèmes croissants aux usagers et aux gestionnaires des milieux aquatiques. En effet, la plupart des cyanobactéries sont capables de synthétiser des toxines [6–12] représentant un danger pour la santé humaine et animale [13,14]. De plus, les fleurs d'eau cyanobactériennes peuvent engendrer des déséquilibres sévères dans les réseaux trophiques aquatiques et induire des nuisances visuelles et olfactives gênant le tourisme [15].
Actuellement, les cyanobactéries font donc l'objet d'une plus grande attention de la part des autorités sanitaires, notamment en matière de potabilité de l'eau [16]. La plupart des études concernant leur prolifération font appel à des méthodes de prélèvement et d'échantillonnage en routine pour le suivi du phytoplancton global. Ces méthodes consistent généralement à prélever le phytoplancton suivant un pas mensuel ou bimensuel, pendant la période estivale, à une station et à l'aide d'une bouteille de type Van Dorn. Certains auteurs mentionnent également l'utilisation de filet à plancton de mailles variables (entre 40 et 250 μm) ainsi que de système de trappe à sédimentation [17–19]. La biomasse est alors le plus souvent estimée par comptage cellulaire sous microscope inversé d'après la méthode d'Utermöhl [27] ou dans des cuves à sédimentation sous microscope à épifluorescence [20–22]. Ce type d'étude permet de détecter la présence de fleurs d'eau cyanobactériennes, mais est insuffisant pour suivre l'invasion progressive de la colonne d'eau par ces procaryotes et de comprendre les mécanismes de formation des blooms [23]. Ceci est en partie lié aux caractéristiques de la cyanobactérie dominante dans la retenue de Grangent : Microcystis aeruginosa (Fig. 1). Son aspect colonial, la grande friabilité de ses colonies, sa capacité de flottaison, le cycle saisonnier migratoire de cette espèce, la localisation des zones d'accumulation rendent inadaptés les suivis phytoplanctoniques standard appliqués en limnologie. Actuellement, de nouveaux outils commencent à être utilisés, comme les sondes fluorométriques immergeables [24], afin d'estimer la biomasse phytoplanctonique. Ce matériel reste toutefois relativement onéreux et l'importante dispersion des colonies de M. aeruginosa dans la masse d'eau induit une forte sous-estimation de la biomasse rendant l'utilisation d'une telle sonde particulièrement efficace qu'en période de fleur d'eau cyanobactérienne.
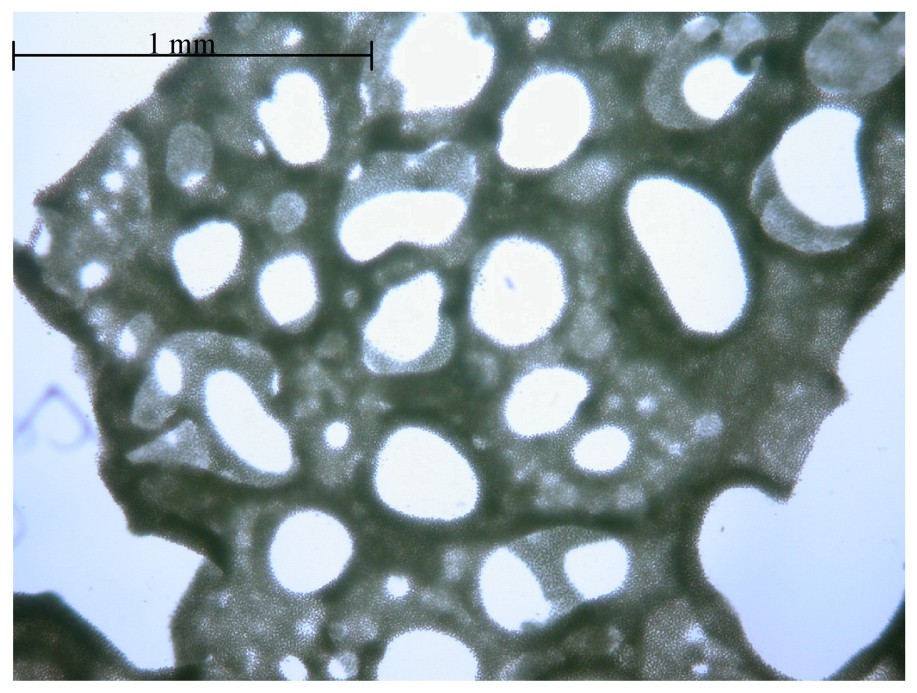
Photographie d'une colonie planctonique de M. aeruginosa vue au microscope optique (×50).
Dans le cadre d'une étude sur le cycle annuel de Microcystis aeruginosa dans la retenue de Grangent, nous avons donc comparé plusieurs méthodes de prélèvement et de dénombrement des cyanobactéries planctoniques coloniales. Le but est ici d'élaborer un protocole permettant un suivi précis de la dynamique de cette espèce cyanobactérienne, c'est-à-dire permettant d'évaluer sa biomasse tout au long de l'année, en surface et dans l'hypolimnion, avant la formation de fleur d'eau.
2 Matériel et méthodes
2.1 Site d'étude
La retenue de Grangent, mise en eau en 1957, est située dans le Sud-Est du Massif central, sur le cours amont de la Loire, à environ 15 km à l'ouest de Saint-Étienne. Cette retenue constitue une importante réserve d'eau de 57,4×106 m3, avec une longueur de 21 km et une profondeur maximale de 50 m au droit du barrage. Ses principales fonctions sont la production d'énergie et l'irrigation de la plaine du Forez. Avec la base nautique de Saint-Victor-sur-Loire, une importante activité touristique s'y développe également. Depuis la fin des années 1970, l'apport excessif de phosphore par les affluents est à l'origine de l'hypereutrophisation du site [25]. Cette dystrophie aboutit aujourd'hui à la formation de fleur d'eau à M. aeruginosa en fin de période estivale [4,23].
Les fleurs d'eau étant essentiellement observées à l'aval de la retenue, où des zones d'accumulation benthiques constituant un véritable stock de cyanobactéries ont été mises en évidence, les prélèvements ont eu lieu uniquement dans cette zone, à la station Camaldules, où la hauteur d'eau atteint 45 m (Fig. 2), selon un pas hebdomadaire, de 2000 à 2002.
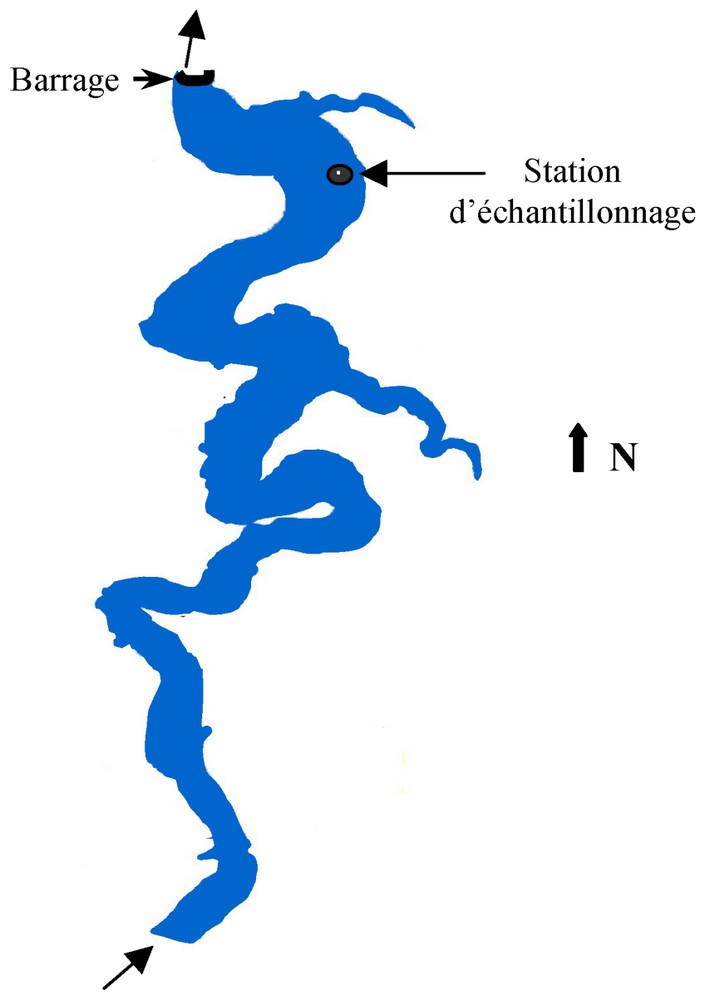
Localisation du point de prélèvement sur la retenue de Grangent.
3 Échantillonnage et dénombrement
3.1 Méthode « classique »
Depuis de nombreuses années, le phytoplancton de la retenue de Grangent est étudié selon les méthodes classiques employées en limnologie. Les prélèvements sont alors réalisés à l'aide d'une bouteille opaque de type Van Dorn, d'un volume de 8 l. L'échantillonnage a lieu aux profondeurs suivantes : 0,5 et 10 m la première année, et 0,5, 10, 20, 30 et 40 m la seconde année.
Des volumes de 150 ml d'eau brute sont rapidement fixés au lugol [26] et stockés. À partir de ces échantillons fixés, des volumes de 25 à 100 ml, selon la densité phytoplanctonique, sont répartis dans des chambres à sédimentation pendant une durée d'au moins 24 h. Les concentrations cellulaires en diatomées et en chlorophycées ainsi que le nombre de colonies cyanobactériennes ont été estimées à l'aide d'un microscope inversé (Wild 40) suivant la méthode d'Utermöhl [27], modifiée par Legendre et Watt [28].
La teneur en chlorophylle a est également mesurée à partir du phytoplancton global prélevé à la bouteille fermante. Après filtration d'un volume de 0,5 l d'eau sur membrane Whatman GF/C, de porosité 1,2 μm, le filtre est conservé au congélateur à −20 °C jusqu'au dosage. La teneur en chlorophylle a est ensuite déterminée suivant la méthode spectrophotométrique de Lorenzen [29].
3.2 Méthode « adaptée »
Lors des suivis de la dynamique du phytoplancton des années 1998 et 1999 [30], le problème de la représentativité de l'échantillonnage « classique » a été soulevé en période estivale. Effectivement, les observations visuelles de terrain mettaient en évidence une large domination de la cyanobactérie M. aeruginosa, alors que les dénombrements semblaient sous-estimer cette espèce. Cette sous-estimation empêche toute vision de l'arrivée des cyanobactéries sous forme d'inoculum au printemps dans la colonne d'eau et tout suivi précis du cycle saisonnier de M. aeruginosa. Il paraissait donc indispensable de prélever des volumes d'eau plus importants afin d'obtenir une meilleure représentativité de la composition du peuplement phytoplanctonique. Pour cela, l'utilisation d'un filet à plancton a été envisagée [17–19]. Toutefois, cette technique ne permet que des prélèvements sur une verticale de la colonne d'eau et non à une profondeur donnée, ce qui limite l'interprétation des résultats à une vision globale de la cinétique des cyanobactéries. Le moyen retenu ici pour obtenir des échantillons de volumes conséquents à une profondeur donnée, a été une « pompe filtrante » immergeable. Il s'agit d'un tube en plexiglas d'environ 1 m de hauteur et 30 cm de diamètre, percé de 10 orifices dans sa partie supérieure, pour l'entrée d'eau, et muni d'un tube de sortie à l'autre extrémité (Fig. 3). Cette enceinte renferme une pompe électrique surmontée d'un filet amovible de maille 50 μm, terminé par un collecteur en métal. L'ensemble de ce dispositif est assemblé à un cordon d'alimentation de 45 m de long, lui-même relié à une batterie placée sur le bateau. Le temps de fonctionnement de la batterie détermine le volume d'eau filtré, à raison d'une filtration de 50 l min−1. En tenant compte du colmatage du filet et du temps de prélèvement, des volumes de 300 l, ajustables selon la biomasse, sont filtrés aux profondeurs de 0,5, 10, 20, 30 et 40 m. La pompe filtrante est maintenue fixe pendant le prélèvement et, du fait de sa faible puissance, elle n'aspire l'eau que dans une zone restreinte autour des orifices d'entrée d'eau (environ 50 cm de diamètre), ce qui permet une bonne précision d'échantillonnage. Après chaque filtration, le dispositif est remonté sur le bateau où le filet est rincé à l'aide d'une pissette de 250 ml d'eau préfiltrée sur un filtre de 50 μm (voir discussion). Son contenu est ainsi concentré dans le collecteur puis récolté dans un flacon d'un litre.
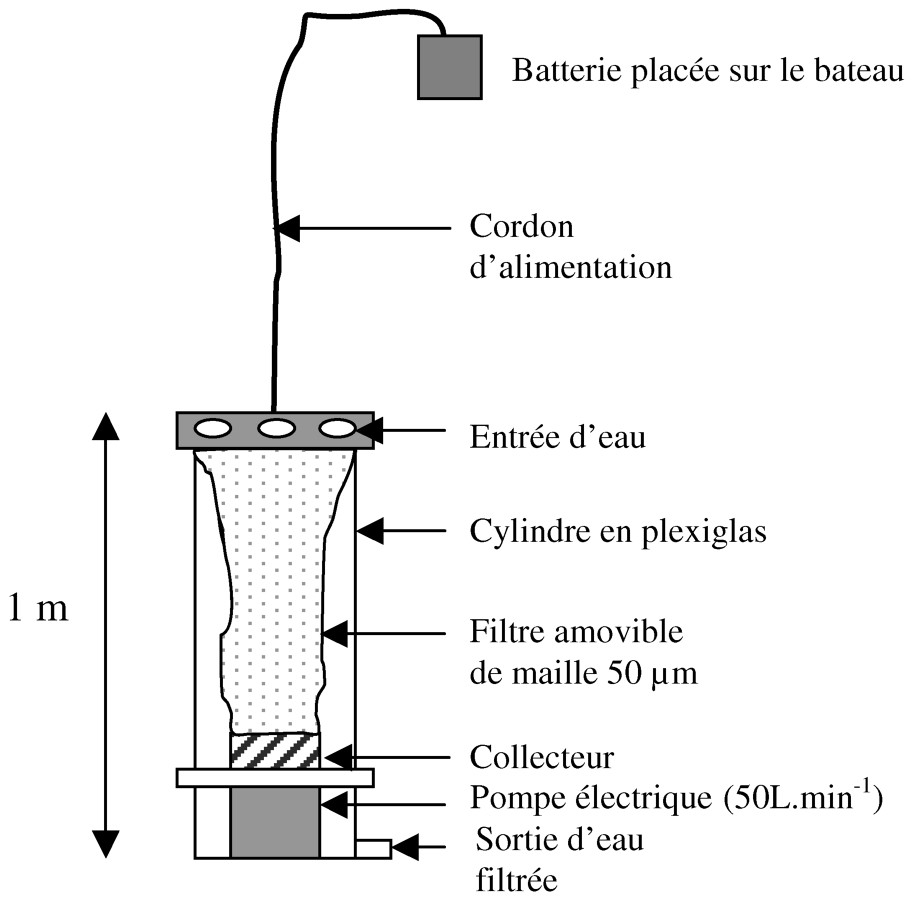
Schéma de la “pompe filtrante ”.
Les prélèvements sont ensuite ramenés au laboratoire pour dénombrement. Le mode de dénombrement a également été ajusté afin de pouvoir compter de faibles quantités de cyanobactéries, ce qui n'était pas possible dans des chambres à sédimentation de 25 ml. La solution retenue a été celle d'une seconde filtration des prélèvements de terrain sur un filtre de maille 50 μm, d'un volume variable selon la biomasse (de 1 l en hiver à seulement 10 ml en période de bloom). Pour chaque échantillon, ce filtre a ensuite été observé sous microscope à épifluorescence à une longueur d'onde de 510–560 nm, correspondant à l'excitation de la chlorophylle [20–22]. L'identification et le dénombrement des colonies de M. aeruginosa, apparaissant alors en rouge, ont été réalisés sur 20 champs aléatoires du filtre (d'après la méthode de Got et al. [31]). Les résultats sont exprimés en colonies par litre d'eau brute, en tenant compte des différents volumes filtrés in situ et au laboratoire.
4 Résultats
4.1 Méthode de suivi « classique » : chlorophylle a et phytoplancton global
Les teneurs en chlorophylle a sont très variables au cours des saisons : faibles en hiver et au printemps, elles augmentent fortement en été. En période estivale, les valeurs maximales à 0,5 m de profondeur ont été légèrement supérieures en 2000, n'atteignant 66,4 mg m−3 qu'en 2001 (40,1 mg m−3) (Fig. 4). Plus en profondeur, les teneurs en chlorophylle a suivent la même évolution qu'en surface, mais avec des valeurs moindres (sauf rares exceptions, en octobre 2001).
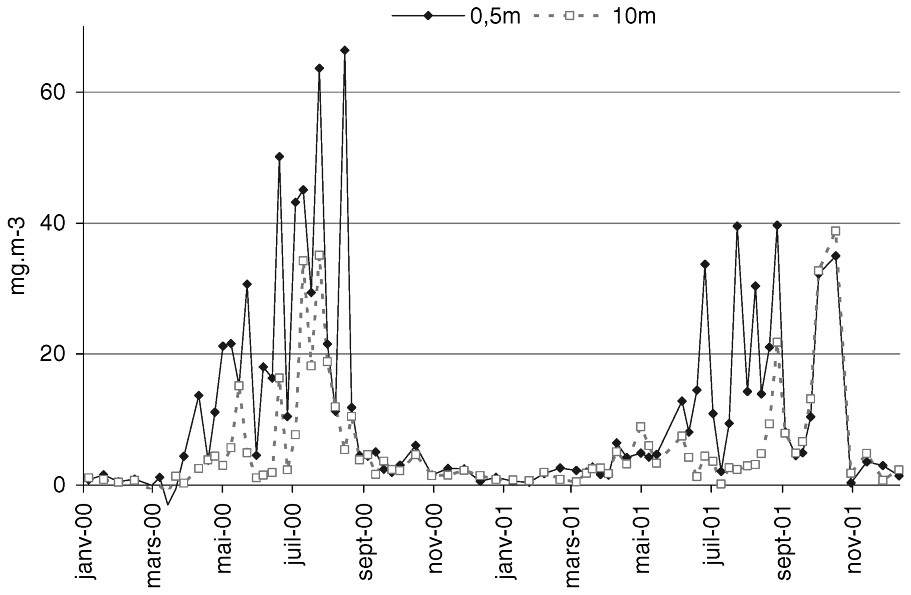
Évolution spatio-temporelle des teneurs en chlorophylle a à 0,5 et 10 m.
En 2000, la cinétique générale du phytoplancton diffère du schéma traditionnellement observé sur la retenue de Grangent. Après un hiver relativement pauvre en biomasse, les Diatomées (Cyclotella sp., Navicula sp. et Aulacoseira italica) ne se développent qu'au printemps. Puis, ces Diatomées printanières se maintiennent simultanément à une forte prolifération de Chlorophycées, essentiellement représentées par Scenedesmus crassus, Pediastrum duplex, Chlamydomonas sp., Chroomonas sp. En revanche, en 2001, la cinétique est plus classique avec un peuplement hivernal composé de petites Diatomées, telles Cyclotella sp. et Navicula sp., renfermant peu de chlorophylle a. Puis au mois de juin, les Chlorophycées Pediastrum et Scenedesmus prolifèrent, suivies, en été, du développement de Cyanobactéries fixatrices d'azote atmosphérique, telles Anabaena spiroides, et surtout Anabaena flos aquae (Fig. 5).
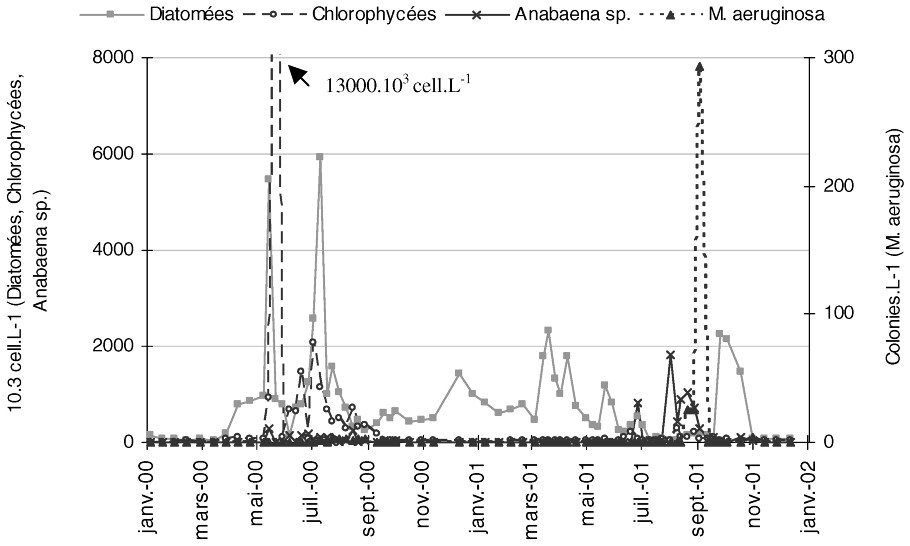
Évolution spatio-temporelle du phytoplancton à 0,5 m, obtenue avec la méthode “classique ” (bouteille fermante).
Concernant la cinétique de M. aeruginosa, en 2000, aucune colonie n'a été comptée par cette méthode de dénombrement classique, laissant supposer la disparition de cette espèce de la retenue de Grangent. Ces résultats de dénombrement vont toutefois à l'encontre des observations visuelles de terrain, qui ont mis en évidence la présence de colonies de M. aeruginosa dans la partie aval de la retenue, au moins en surface.
En revanche, en 2001, M. aeruginosa est à nouveau décomptée dans les dénombrements « classiques », mais uniquement dans l'épilimnion. Les premières colonies planctoniques sont alors détectées à partir de mi-août en faible concentration. Puis, les valeurs maximales sont atteintes début septembre, avec un maximum d'environ 300 colonies l−1 (Fig. 5). Cette prolifération cyanobactérienne est très brève et, dès la semaine suivante, l'espèce est absente des dénombrements « classiques ».
Le suivi classique permet donc ici une observation globale des successions phytoplanctoniques. En revanche, le suivi de M. aeruginosa avec la méthode classique semble plus problématique : seul le développement maximum de la fleur d'eau de septembre 2001 a été ici décelé. La limite de cette méthode étant déjà soupçonnée au cours des suivis précédents, un second protocole de dénombrement spécifiquement adapté aux caractéristiques de M. aeruginosa a été développé et appliqué dès le printemps 2000, révélant une dynamique tout à fait différente.
4.2 Méthode « adaptée » au suivi de M. aeruginosa
Avec le protocole « adapté » au suivi de M. aeruginosa, en 2000 comme en 2001, les colonies planctoniques sont décelées en très faible quantité tout au long de l'année et montrent une légère augmentation dès le printemps. Rapidement, les colonies se trouvent plus concentrées dans l'épilimnion (Fig. 6).
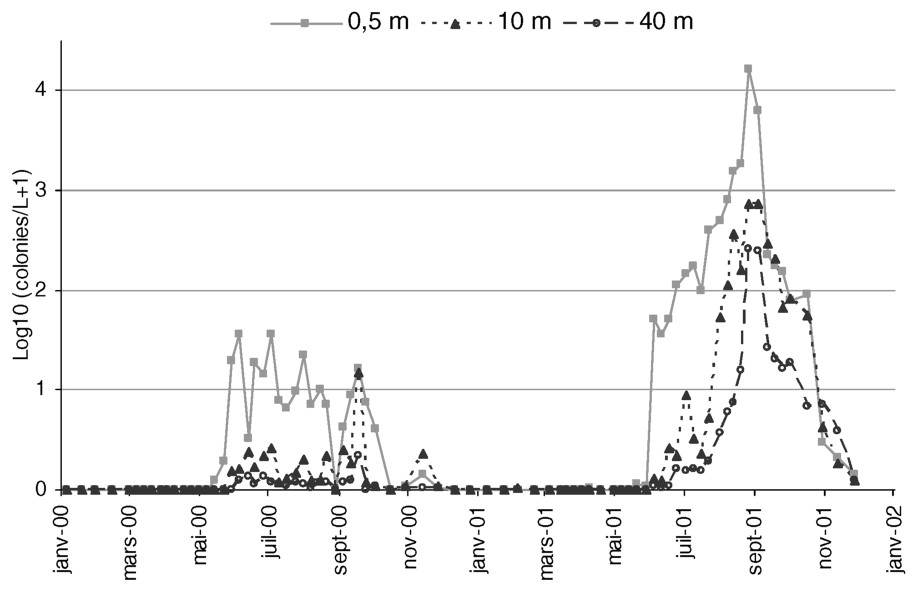
Évolution spatio-temporelle des colonies de M. aeruginosa, obtenue avec la méthode “adaptée” (pompe filtrante).
Le premier développement significatif a lieu début juin au cours des deux années étudiées, avec des valeurs comprises entre 30 et 50 colonies l−1 (Fig. 6).
Pendant la période estivale, en 2000, les concentrations de M. aeruginosa restent relativement faibles et les teneurs fluctuent de façon irrégulière en relation avec les changements climatiques. Les concentrations sont maximales en périodes calmes et ensoleillées, mais chutent rapidement après un orage. Des pics moindres, ne dépassant jamais 40 colonies l−1, sont atteints les 5 juillet et 2 août (Fig. 6).
Parallèlement, en 2001, M. aeruginosa entame une phase de croissance exponentielle à partir de fin juillet. Les concentrations maximales sont observées fin août, avoisinant 1,65×104 colonies l−1 en surface. Ces valeurs sont 800 à 1000 fois supérieures à celles mesurées en 2000 et indiquent que cette année-ci la retenue a été le siège d'une véritable fleur d'eau à M. aeruginosa. Par ailleurs, cette espèce cyanobactérienne est également présente dans l'hypolimnion, ce qui n'apparaı̂t pas dans les résultats fournis par la méthode « classique » en 2001.
En automne 2001, les concentrations épilimniques montrent une forte diminution et les colonies de M. aeruginosa se trouvent alors plus concentrées au fond de la colonne d'eau. Par exemple, le 22 octobre 2001, on compte deux à trois fois plus de cyanobactéries à 40 m de profondeur qu'en surface (Fig. 6). Ceci s'explique en partie par le passage d'une crue qui, en déclenchant l'homogénéisation de l'ensemble de la colonne d'eau, a entraı̂né les colonies de surface vers le fond. Cette sédimentation n'était pas visible à l'automne 2000, probablement à cause du nombre très réduit de colonies cette année-là et du pas d'échantillonnage, sans doute insuffisamment fin par rapport à la rapidité du phénomène.
Pendant toute la période hivernale, quelques colonies subsistent dans la colonne d'eau, de l'ordre de 0,2 colonies l−1, en 2000 comme en 2001.
4.3 Discussion et conclusion
Parmi les méthodes classiquement utilisées en limnologie pour suivre la cinétique du phytoplancton, le prélèvement à l'aide d'une bouteille de type Van Dorn et le dénombrement sous microscope inversé d'après la méthode d'Utermöhl sont les plus fréquemment cités [32–36]. Dans notre cas d'étude, ce protocole a montré ses limites en révélant une importante sous-estimation de la biomasse de M. aeruginosa, en 2000 comme en 2001. L'exemple le plus probant s'est produit en 2000, où le seul dénombrement via la méthode classique aurait conclu à la disparition complète de l'espèce sur notre retenue. Ceci illustre bien les difficultés d'échantillonnage in situ et de comptage au laboratoire des cyanobactéries comme M. aeruginosa. L'importante différence obtenue ici entre les deux méthodes est essentiellement due aux petits volumes d'eau brute (de 25 à 100 ml) utilisés dans les chambres à sédimenter. Effectivement, la grande hétérogénéité de la répartition des colonies de M. aeruginosa dans la masse d'eau ne permet pas d'obtenir, même avec un volume de 100 ml, des échantillons représentatifs de cette biomasse cyanobactérienne. Les dénombrements du protocole « classique », réalisés à partir d'eau brute, s'avèrent donc inadaptés à l'étude de la cinétique de cette espèce cyanobactérienne et à la mise en évidence de certains processus, tels le recrutement printanier, où de faibles concentrations cyanobactériennes sont mises en jeu [37].
Le protocole « adapté » a donc été développé pour faire face à cette problématique et permettre un suivi plus fin de M. aeruginosa tout au long de l'année, même en situation de faible concentration, et à une profondeur donnée de la colonne d'eau. L'utilisation de la « pompe filtrante » s'est alors révélée efficace et a permis le dénombrement de colonies en hiver comme en été, aussi bien dans l'épilimnion que dans l'hypolimnion (40 m). La mise au point de la méthode adaptée a permis de révéler la présence de cette cyanobactérie en hiver (4 °C) dans la colonne d'eau et d'observer le phénomène de recrutement printanier dans certaines zones de la retenue [23].
Toutefois, des phénomènes très ponctuels, tels le passage des premières colonies planctoniques printanières de l'hypolimnion à la surface ou le déclin des efflorescences, sont peu perceptibles au cours de notre étude. Ceci est vraisemblablement davantage lié au pas d'échantillonnage qu'à la méthode de prélèvement en elle-même. En effet, la fréquence hebdomadaire convient bien à un suivi annuel, mais s'avère insuffisante au suivi de processus aussi particuliers et ponctuels. Ces derniers nécessiteraient un pas d'échantillonnage beaucoup plus réduit, probablement de l'ordre de la journée. Le choix de la station de prélèvement s'avère également important et, suivant sa situation (hauteur d'eau, proximité des berges, zone d'accumulation benthique, zone de marnage…), les divers processus annuels ne pourront être observés [23]. En effet, le développement des colonies planctoniques dépend en partie du stock en cyanobactéries benthiques. Ces dernières représentent un inoculum potentiel et constituent des zones de recrutement privilégiées [17,32,37,38]. Afin de bien positionner les stations de prélèvement pour étudier l'ensemble des processus, il semble alors nécessaire, avant tout suivi annuel, de réaliser une cartographie préliminaire concernant la répartition des colonies benthiques de M. aeruginosa [39].
L'utilisation de la « pompe filtrante » montre néanmoins certaines limites, notamment liées à la présence du filtre de maille 50 μm. En effet, la concentration d'importants volumes d'eau via ce filtre induit encore une sous-estimation de la biomasse de M. aeruginosa, en ne retenant que les colonies de taille supérieure à 50 μm et en laissant passer celles de taille inférieure, qui ne sont donc pas dénombrées. Toutefois, dans une population naturelle, le pourcentage de cellules isolées et de colonies de petite taille n'est estimé qu'à 5 % [40]. Enfin, des essais avec des filtres de maille inférieure (10 et 25 μm) ont mis en évidence un colmatage très rapide par d'autres espèces phytoplanctoniques (notamment par la diatomées Aulacoseira granulata), induisant une sous-estimation encore plus importante. La maille de 50 μm s'avère donc être le meilleur compromis, même si, en période de fleur d'eau cyanobactérienne, ce filtre peut également être colmaté au cours du prélèvement. Dans ce cas, l'échantillonnage est réitéré avec un volume inférieur (100 l).
Par ailleurs, compte tenu de la friabilité des colonies de grande taille (supérieure à 5 mm), la filtration de l'eau par notre dispositif peut engendrer un éclatement en colonies plus petites et donc induire une surestimation du nombre de colonies mais non de la biomasse cyanobactérienne totale (entre 5 et 10 %, selon la proportion de colonies de grande taille). Le palliatif serait donc de convertir le nombre de colonies en cellules, ce qui n'est pas aisé compte tenu de l'aspect aéré des colonies de l'espèce M. aeruginosa et de leur volume. Cette conversion est actuellement en cours de réalisation via une méthode de cytométrie en flux : les premiers résultats indiquent que les colonies de taille moyenne (entre 1 et 3 mm, représentant environ 60 % de la population) comprennent environ 50 000 cellules ; les colonies de très grande taille (>5 mm) atteindraient jusqu'à un million de cellules.
Parmi les différents outils de surveillance et d'estimation de la biomasse cyanobactérienne, la méthode employée ici s'avère donc pertinente pour le suivi de l'espèce M. aeruginosa et demande à être appliquée à d'autres espèces. Au moment où les autorités sanitaires se préoccupent de plus en plus des problèmes liés aux toxines cyanobactériennes et essaient de normaliser à l'échelle européenne les méthodes de détection et de dosage des microcystines, cette étude pourrait contribuer au choix de techniques d'échantillonnage peu coûteuses adaptées aux cyanobactéries coloniales.


