Abridged English version
One recognized explanation of the impact of heavy metals on the plant physiology is that it results in several nutritional disturbances. Breakdown of storage compounds is among the crucial events that govern seed germination following imbibition. The interference of heavy metal with this process is not well documented. The purpose of the present study is to contribute to the understanding of the biochemical changes in germinating seed subjected to heavy-metal stress. Seeds of pea were germinated for four days over two sheets of filter paper moistened with distilled water and 5 mM cadmium nitrate or copper sulphate. The relationship between Cd and Cu accumulation in seed tissues and reserves mobilization from cotyledons was emphasized. The obtained results suggest that the decline of germination rate cannot be due to deficiency in water uptake, as evidenced by the non-alteration of seeds water content after exposure to heavy metals. However, excessive accumulation of Cd and Cu in cotyledons may compromise the seeds germination through a negative interference of pollutants with mineral and organic reserves mobilization. In fact, metal treatments induce a pronounced restriction in transport of micronutrients (Fe, Mn, Zn) and of soluble sugars from cotyledons, and in the freeing of amino acids. Moreover, the activities of α-amylase and acid phosphatase were also markedly inhibited, while the β-amylase and alkaline phosphatase ones were unchanged after exposure to Cd and Cu. However, when cadmium and copper ions were incubated, in vitro, with protein extracts obtained from control seeds, the activity of α-amylase was decreased, but not modification was seen in the case of acid phosphatase. Thus, it seems that heavy-metal stress can operate in more ways than one with regard to the process of reserves mobilization during the seed germination. These results, together, are discussed in relation to drastic delay in the growth of embryo radicles.
1 Introduction
La germination est l'ensemble des événements qui commencent par l'étape cruciale d'absorption de l'eau par la graine [1] et se terminent par l'élongation de l'axe embryonnaire et l'émergence de la radicule à travers les structures qui entourent l'embryon [2]. À l'échelle cellulaire, elle se caractérise, essentiellement, par (a) la reprise de l'activité respiratoire à travers la réactivation de la glycolyse, du cycle de Krebs et de la chaîne respiratoire [3,4], (b) la mobilisation des réserves par la sécrétion d'enzymes hydrolytiques [5,6], la dépolymérisation des réserves et le transport des métabolites libérés vers les cellules embryonnaires en croissance [5,7] et (c) la diminution de la résistance mécanique imposée par les tissus qui entourent l'embryon, principalement par l'augmentation de l'activité de plusieurs hydrolases pariétales [2,5,8].
Nombreuses sont les contraintes environnementales qui peuvent compromettre l'aptitude des graines à germer ; salinité [9], stress hydrique [1], humidité et température inadéquates [8,10,11]. Cependant, rares sont les travaux qui ont étudié l'impact du stress par les métaux lourds sur la germination. L'inhibition de ce processus semble dépendre, toutefois, du métal et de sa concentration, de la durée d'exposition des graines, de l'espèce végétale, voire même de la variété et de la graine, notamment la nature de ses téguments [12–16], et a été le plus souvent imputée à des perturbations dans le métabolisme respiratoire [17–19].
Les expériences présentées dans cet article s'inscrivent dans le cadre de la vérification de l'hypothèse d'un désordre dans la mobilisation des réserves minérales et organiques, qui serait associé à la diminution du pouvoir germinatif et de la croissance radiculaire au cours de la germination des graines de petit pois stressées par Cd ou Cu.
2 Matériel et méthodes
2.1 Matériel végétal et conditions de germination
Le matériel végétal utilisé est le petit pois (Pisum sativum L. var. douce Provence). Les graines sont désinfectées à l'hypochlorite de sodium 2 % pendant 10 min, puis rincées abondamment à l'eau distillée. Elles sont ensuite mises à germer dans des cristallisoirs, dont le fond est recouvert d'une double couche de papier filtre imbibé avec H2O ou des solutions de concentration 5 mM en Cd(NO3)2 ou CuSO4. La germination est faite à l'obscurité à une température de 25 °C. Le nombre des graines ayant germé est noté jusqu'à l'obtention du maximum de germination du lot témoin (eau distillée). Le taux de germination est calculé, ainsi, comme pourcentage par rapport au témoin (100 %). Chaque jour, les jeunes germinations sont récoltées et rincées rapidement dans trois bains successifs d'eau distillée. Après élimination des téguments de la graine et de la plumule de l'axe embryonnaire, les échantillons sont subdivisés en cotylédons et radicules. La longueur de ces dernières est mesurée et les cotylédons sont pesés, pour la détermination de la matière fraîche (MF), puis placés dans l'azote liquide ou desséchés dans l'étuve à 70 °C pendant au moins huit jours pour la détermination de la matière sèche (MS).
2.2 Dosage des éléments minéraux
Cd, Cu, Fe, Mn et Zn sont extraits à partir de la matière sèche [20], puis dosés par spectrophotométrie d'absorption atomique (Perkin Elmer, modèle 2380).
2.3 Dosage des acides aminés libres et des sucres solubles
La matière fraîche est homogénéisée dans l'éthanol 80 % (1 g pour 10 ml) sous agitation au bain-marie à 70 °C pendant 30 min. Les homogénéisats sont, ensuite, centrifugés à 8000 g pendant 10 min à 5 °C. Le culot est soumis à une deuxième extraction dans les mêmes conditions et les surnageants issus des deux centrifugations sont réunis et conservés à −20 °C. Les acides aminés libres et les sucres solubles sont dosés par les méthodes de Moore et Stein [21] et Savouré [22], respectivement.
2.4 Mesures des activités amylase et phosphatase
L'extraction des protéines et les mesures des activités hydrolytiques sont réalisées selon les techniques suivantes : α- et β-amylases [23], phosphatases acides [24] et alcalines [25]. L'impact direct des ions cadmium et cuivre sur les protéines à activités amylasique ou phosphatasique a été étudié in vitro : avant de mesurer les activités enzymatiques, les extraits protéiques issus des cotylédons des graines témoins (imbibées avec l'eau distillée) sont préalablement incubés, sous agitation pendant 30 min à 4 °C, en présence de concentrations adéquates de Cd(NO3)2 ou CuSO4.
2.5 Analyse statistique
Les expériences décrites sont répétées au moins une fois et les résultats présentés sont obtenus à partir d'un essai représentatif. La signification des différences, au seuil de probabilité inférieur ou égal à 95 %, est analysée par la variance des moyennes des répétitions (ANOVA), dont le nombre est mentionné dans le Tableau 1 et les Figs. 1–5.
Taux de germination des graines de petit pois (%) imbibées avec H2O (0) ou 5 mM Cd et Cu. Les valeurs représentent la moyenne de deux expériences indépendantes. Chaque expérience est réalisée avec 80 graines
| Temps (j) | 1 | 2 | 3 | 4 |
| 0 | 17 | 88 | 98 | 100 |
| Cd | 6 | 39 | 40 | 40 |
| Cu | 2 | 44 | 62 | 62 |
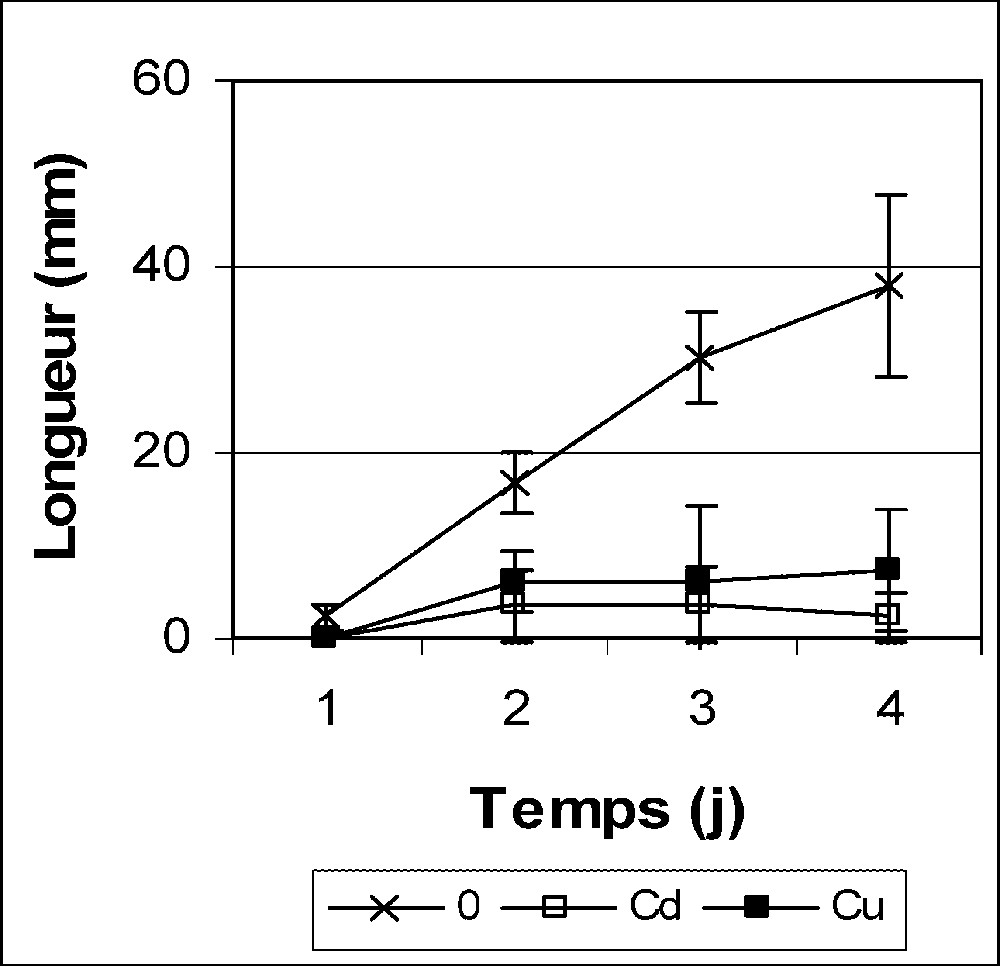
Longueur des radicules des graines de petit pois en germination après imbibition avec H2O (0) ou 5 mM Cd et Cu. Les valeurs représentent la moyenne de 16 mesures individuelles (±SD).
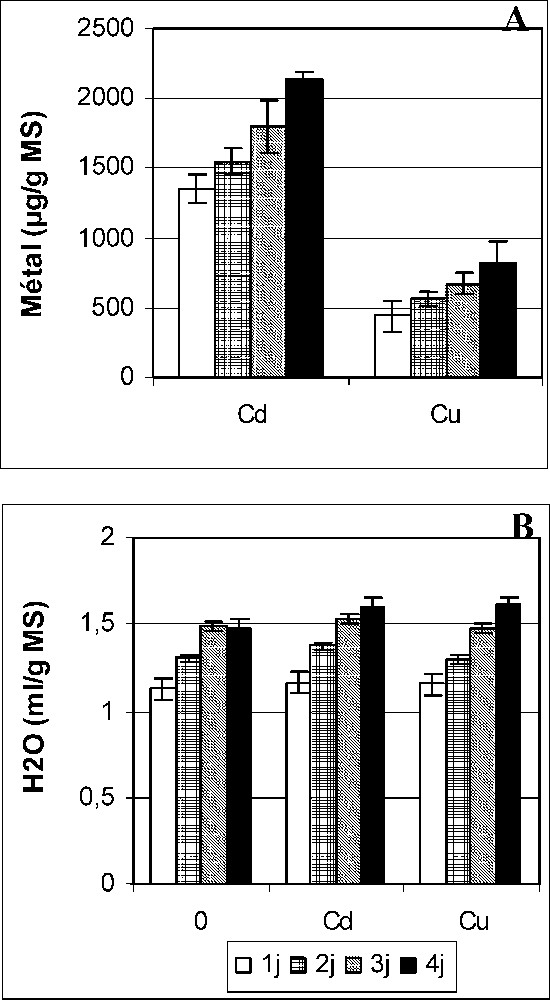
Teneurs en Cd et Cu (A) et teneurs en eau (B) des cotylédons des graines de petit pois en germination après imbibition avec H2O (0) ou 5 mM Cd et Cu. Les valeurs représentent la moyenne de 16 mesures individuelles (±SD).
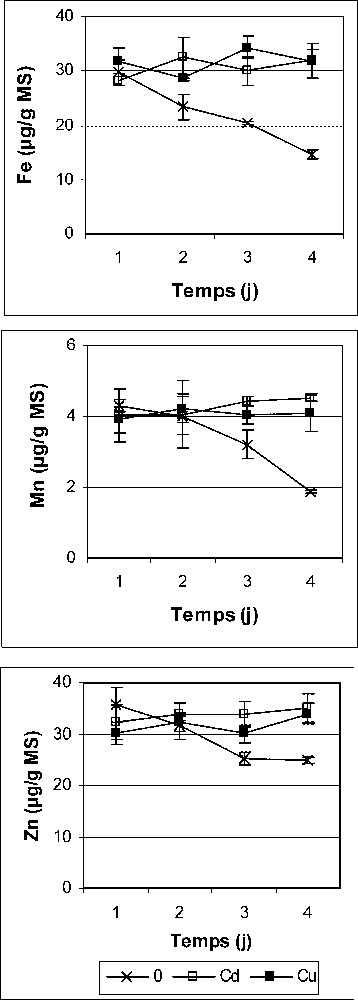
Teneurs en Fe, Mn et Zn des cotylédons des graines de petit pois en germination après imbibition avec H2O (0) ou 5 mM Cd et Cu. Les valeurs représentent la moyenne de 12 mesures individuelles (±SD).
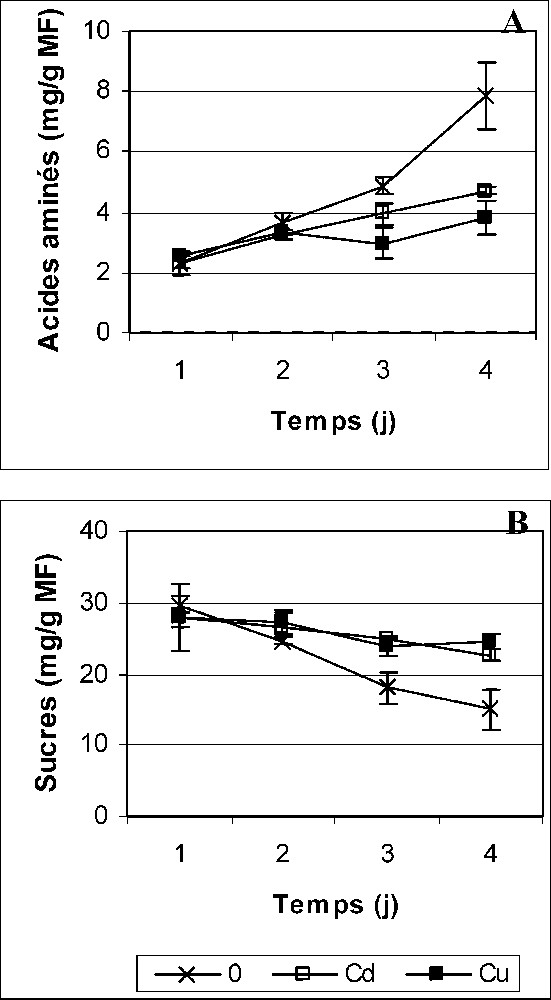
Teneurs en acides aminés libres (A) et en sucres solubles totaux (B) des cotylédons des graines de petit pois en germination après imbibition avec H2O (0) ou 5 mM Cd et Cu. Les valeurs représentent la moyenne de six mesures individuelles (±SD). Chaque mesure correspond à un extrait obtenu à partir d'un lot de quatre graines.
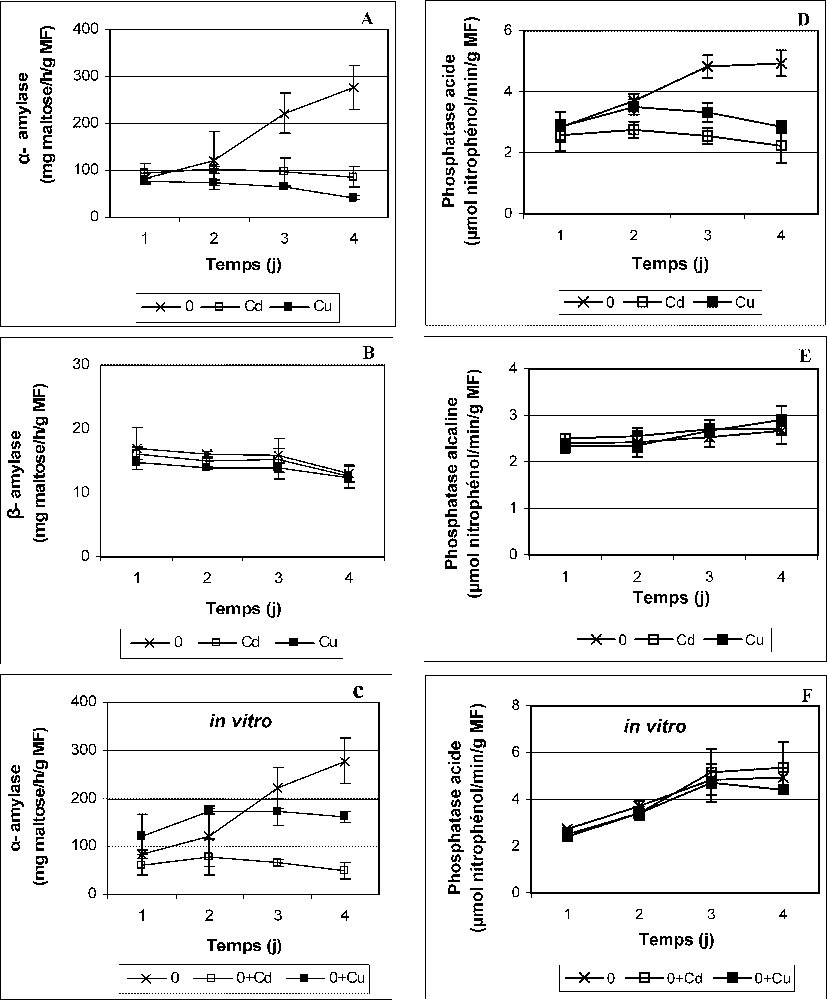
Activités α-amylase (A), β-amylase (B), phosphatase acide (D) et phosphatase alcaline (E) des cotylédons des graines de petit pois en germination après imbibition avec H2O (0) ou 5 mM Cd et Cu. (C) et (F) : effets in vitro de Cd et Cu sur les activités α-amylase et phosphatase acide ; aux extraits protéiques issus des cotylédons des graines témoins (0) sont ajoutées des quantités adéquates de Cd(NO3)2 (0 + Cd) et CuSO4 (0 + Cu) correspondant aux teneurs réelles en métaux lourds dans les graines (les quantités incubées de Cd et Cu sont déterminées à partir des résultats de la Fig. 2A). Les valeurs représentent la moyenne de six ou quatre (essais in vitro) mesures individuelles (±SD). Chaque mesure correspond à un extrait obtenu à partir d'un lot de quatre graines.
3 Résultats et discussion
La cinétique de germination des graines, exprimée en pourcentage du nombre total des germinations témoins, est présentée dans le Tableau 1. Cd et Cu provoquent une importante diminution du pouvoir germinatif dès le premier jour après le début de l'imbibition. Les résultats de la Fig. 1 montrent aussi une forte inhibition de l'élongation radiculaire après imbibition avec Cd et Cu. La simulation des effets de la pollution métallique sur les plantes cultivées a été le plus souvent réalisée avec des expériences utilisant des concentrations faibles [26]. Cependant, lorsqu'il s'agit de la germination, ces doses ont été le plus souvent revues à la hausse [16]. En analysant l'impact des métaux lourds sur une multitude de fonctions physiologiques vitales de la plante, Ernst [26] admet que la germination est un processus certes vulnérable au stress métallique, mais qui serait des plus résistants parmi les autres phases du développement de la plante. L'auteur a suggéré que les barrières tégumentaires des graines y empêcheraient une forte accumulation des métaux lourds. Par ailleurs, pour tout processus physiologique ou métabolique, ce sont les seuils critiques de phytotoxicité, définis en terme d'accumulation tissulaire qui déterminent la sensibilité aux métaux lourds [27,28]. L'évolution des teneurs en Cd et Cu des graines au cours de la germination est présentée dans la Fig. 2A. Les charges endogènes en métaux lourds augmentent graduellement pendant les quatre jours de germination, mais une forte proportion des deux métaux s'accumule dès le premier jour après le début de l'imbibition. Ceci peut expliquer la diminution du pouvoir germinatif après un jour de traitement (Tableau 1). Après 1 j de traitement par Cd et Cu, les graines accumulent, respectivement, 1349 et 436 μg/g MS (Fig. 2A). Ces valeurs, comparées aux résultats d'autres travaux, sont inférieures ou égales aux teneurs accumulées dans les tissus racinaires, par exemple, chez plusieurs espèces manifestant une sensibilité à l'égard de Cd [29–33] ou de Cu [34,35]. Ainsi, il est suggéré que la germination ne doit pas être considérée comme processus tolérant ou résistant aux métaux lourds. La vulnérabilité de la germination devrait être associée aux niveaux d'accumulation réelle des polluants qui interfèrent avec les voies métaboliques dans les tissus de la graine.
Au métabolisme germinatif préside l'absorption de l'eau, qui déclenche le processus créateur de la nouvelle plantule [1,2,8]. L'ampleur de l'hydratation des graines a été évaluée par la mesure de leur teneur en eau sur la base de la matière sèche. Les résultats obtenus montrent qu'au cours de la germination, la teneur en eau des graines n'est affectée ni par Cd, ni par Cu (Fig. 2B). Ceci est en contraste avec les perturbations des paramètres hydriques largement signalées chez les plantes exposées au stress métallique [36]. Cependant, nos résultats laissent supposer que l'inhibition de la germination par Cd et Cu ne serait pas la conséquence d'une limitation de l'approvisionnement en eau des graines.
La mobilisation des réserves est la résultante, au moins, des activités hydrolytiques qui libèrent les nutriments à partir des tissus de réserve, d'une part, et des mécanismes de leur transport vers les tissus embryonnaires, d'autre part. Dans les Figs. 3–5 sont présentés les résultats relatifs à la cinétique des teneurs de quelques réserves minérales et organiques, ainsi que la variation de certaines activités hydrolytiques au cours de la germination des graines.
Les teneurs en micronutriments des cotylédons manifestent une baisse significative chez les témoins ; plus de 51, 56 et 33 % de diminution au quatrième jour par rapport au premier jour après le début de l'imbibition, respectivement, pour Fe, Mn et Zn (Fig. 3). Cependant, aucune diminution significative de ces teneurs n'est observée dans les graines stressées, même après 4 j de germination, temps au bout duquel l'écart des niveaux d'accumulation entre graines imbibées avec H2O et celles traitées par Cd et Cu est significativement important (Fig. 3). Il paraît ainsi que le transport des substances minérales oligodynamiques à partir des cotylédons est nettement inhibé à la suite de l'imbibition par les métaux lourds. Au niveau de la plante entière, nombre de travaux ont montré une compétition des métaux lourds vis-à-vis des mécanismes de transport ionique [37–39]. Il en serait de même pour la germination des graines ; les rapports très élevés des teneurs de Cd et Cu (Fig. 2A) par rapport à celles de Fe, Mn et Zn militent en faveur de cette hypothèse (Fig. 3).
Une augmentation très importante de la teneur en acides aminés libres est observée dans les cotylédons après imbibition des graines avec H2O : quatre fois plus au quatrième jour par rapport au premier jour après le début de l'imbibition (Fig. 4A). Cette tendance est nettement réduite par Cd et Cu ; les cotylédons des graines traitées ne disposent, au quatrième jour, que de la moitié des teneurs en acides aminés libres des graines imbibées avec H2O (Fig. 4A). La stimulation de l'activité protéasique étant l'événement amorce de la libération des acides aminés, il serait probable que les effets de Cd et Cu soient la conséquence d'une action inhibitrice, directe et/ou indirecte sur la protéolyse. Ayaz et Kadioglu [40] ont montré aussi que Cd et Cu peuvent perturber le métabolisme des protéines au cours de la germination des graines de lentille.
Du premier au quatrième jour après le début de l'imbibition, la moitié de la teneur en sucres solubles est mobilisée à partir des cotylédons des graines témoins, ce qui n'est pas le cas de celles traitées par Cd et Cu (Fig. 4B). Ces derniers semblent, en effet, réduire le transport des sucres des tissus de réserve vers les cellules embryonnaires en croissance. Une inhibition similaire des mécanismes de transport des carbohydrates à l'échelle de la plante entière a été suggérée par Samarakoon et Rauser [41].
Les résultats de la Fig. 5 montrent, d'abord, des niveaux contrôles de l'activité α-amylase beaucoup plus élevés que ceux de l'activité β-amylase. Cette dernière ne varie pas significativement sous l'impact du stress métallique (Fig. 5B). Cependant, l'imbibition avec H2O stimule énormément l'activité α-amylase ; au quatrième jour, elle est deux fois supérieure par rapport à son niveau au premier jour (Fig. 5A). Cette augmentation est nettement ralentie par Cd et Cu (Fig. 5A). Quant aux phosphatases, celles alcalines montrent une activité témoin faible et insensible au stress, comparativement à celle des phosphatases acides (Fig. 5B). Cependant, l'imbibition avec Cd et Cu réduit complètement, à un niveau pratiquement constant, l'activité des phosphatases acides (Fig. 5A). Les résultats d'autres travaux ont montré aussi une inhibition des activités hydrolytiques au cours de la germination des graines exposées aux métaux lourds [14,42]. Il semble, toutefois, que Cd et Cu n'affectent pas de la même manière les activités hydrolytiques. En effet ; les résultats des effets in vitro des ions cadmium et cuivre laissent suggérer que l'inhibition de l'activité α-amylase (Fig. 5A) se fait, au moins en partie, directement sur les protéines enzymatiques déjà synthétisées (Fig. 5C), alors que le stress métallique affecte, probablement, le processus de néosynthèse des phosphatases acides (Figs. 5D et F).
Il importe de signaler que la radicule de l'embryon de petit pois possède des tissus de réserve (parenchyme cortical) contenant des structures semblables aux grains d'amidon [43] et corps protéiques [44]. Les étapes précoces de la croissance de l'axe embryonnaire dépendraient, d'abord, de ses propres réserves puis, ensuite, essentiellement de la mobilisation des réserves cotylédonaires [7,45,46]. Cependant, les expériences décrites dans ce travail et conduites sur des germinations de quatre jours sont focalisées sur cette dernière composante du processus de la mobilisation des réserves. Ainsi, la diminution du taux de germination (Tableau 1) et de la croissance radiculaire (Fig. 1) après imbibition avec Cd et Cu pourrait être, au moins en partie, la conséquence des effets précédemment décrits sur la mobilisation des réserves des cotylédons vers l'axe embryonnaire : (1) réduction de la mobilisation des microéléments (Fig. 3), très sollicités comme groupements prosthétiques pour la néosynthèse des métalloenzymes ; (2) diminution de l'activité phosphatase acide (Fig. 5D), responsable de la libération du phosphate, lui-même très important pour la production de l'énergie (ATP) ; (3) réduction du transport des sucres et inhibition de l'activité α-amylase, qui peuvent affecter, respectivement directement (Fig. 4B) et indirectement (Fig. 5A), la production d'énergie ; (4) restriction de la libération des acides aminés (Fig. 4A), indispensables pour la synthèse des protéines au niveau des cellules embryonnaires de la radicule.
En conclusion, la vulnérabilité de la germination des graines de petit pois au stress par le cadmium ou le cuivre ne peut pas être associée à une limitation dans l'approvisionnement en eau des graines, mais serait due, au moins, à un désordre nutritionnel consécutif à une défaillance dans le processus de mobilisation des réserves à partir des cotylédons.


