Abridged English version
The clementine appeared around the end of the 19th century in a seedling of mandarin's seed realised by Father Clement in the orphanage of Messerghine (Algeria). Recent studies with molecular markers attest that the clementine is the result of a natural crossing between mandarin (Citrus reticulate Blanco) and sweet orange (Citrus sinensis (L.) Osb.). Although the clementine appeared relatively recently, it took a very important place in the Mediterranean basin since the second half of the 20th century, and especially during the last 20 years, when it took the first place in the mandarin group, between end-September and January. It is the most preferred citrus within the consumers, due to its particular characteristics. One of the main appreciated characters in clementine is the absence of seeds. It is due to the gametophyte auto-incompatibility and parthenocarpic fruit development.
Clementines have been multiplied by grafting and the new cultivars are obtained after careful selection of spontaneous somatic mutations affecting traits of agronomic interest such as extension of fruit ripeness, the fruit size, and the productivity. Morocco's annual citrus production is about 1.4 million tons, out of which the group of easy peelers, which is mainly made of various clementine selections, represents 30%. The country is thus ranked as the second largest producer of this specialty fruit behind Spain. Furthermore, the breeding of clementine is based on commercial characters, such as earliness, size, productivity, and internal and external attributes of the fruit (aspect, flavour, aroma, texture, etc.). This group is very diverse in terms of period of internal maturity, which starts in late September and extends to late January, but the majority of the production occurs in mid-season (i.e. November–December), and great efforts are continuously made at the research level in the main clementine-producing countries to find selections that mature much earlier (September–October) or much later (January–February).
In addition, the horticultural names of the clementine cultivars were often confused with local and/or commercial names that may vary from a country to another. Some of these may be the same cultivar, but under different names. Thus, it is advisable to make sure of the use of the same names for the same cultivars. The development of molecular tools of identification is therefore necessary for the characterisation of the different commercially important cultivars of clementine.
Of course, the description and characterisation of cultivars is essentially based on morphological and physiological parameters. However, the contribution of molecular markers in this process is considerable. The isozymes were actually the first genetic markers studied in citrus. Since then, other markers gave interesting results in describing genetic diversity such as RAPD (Random Amplified Polymorphic DNA), and AFLP (Amplified Fragment Length Polymorphism) as well as the molecular markers aiming at the variation of repetition of the microsatellite sequences or ISSR.
The aim of the present study is to evaluate the impact of the somatic mutations on the variability of the fruit quality attributes during maturation in three clementine cultivars (‘Caffin’, ‘Nules’ and ‘Guerdane’, with early, in-season and late maturation, respectively). The different cultivars are compared at the level of the foliar morphology as well as at the DNA level. Different techniques of polymorphism revelation were used (isozymes, RAPD and ISSR). The objective is to have tools that allow early identification of the cultivars (authenticity and originality). These tools must be independent of the environmental conditions.
As part of their physical and chemical characterisations, we observed that the majority of fruit quality attributes used in selection varied with time (successive stages of fruit development) and from a cultivar to another. Many of those characters intervene in the assessment of the fruit qualities and are used as indicators of the maturity threshold. It is also very useful to discriminate between different clementine cultivars grown in one area. Among those quality attributes, we have: internal maturity period, coloration, fruit rind firmness, while leaf morphology does not seem to be that useful, even if some differences were observed.
On another hand, the development of molecular markers remains essential in this process of characterisation. RAPD and ISSR markers revealed polymorphism for the ‘Guerdane’ cultivar, in which many DNA fragments are lacking. Probably, the mutations at the origin of this cultivar generated more modifications in different points of the genome than in the two other cultivars, where no polymorphism was observed. Moreover, the use of more and more primers may provide much more markers.
The results obtained in this work suggest that these molecular marker techniques are adapted to the characterisation of mutant cultivars in orchard and can also be used to evaluate new citrus cultivars for trueness-to-type and commercial potential.
1 Introduction
Les agrumes représentent la première production fruitière mondiale (110 millions de tonnes par an), et le Maroc est l'un des principaux pays producteurs, avec environ 1,4 million de tonnes par an [1]. La clémentine représente environ 20% de la production annuelle en agrumes des pays du Bassin méditerranéen (30% au Maroc), ce qui la classe en seconde position derrière les oranges (55%). L'apparition du clémentinier est relativement récente (∼100 ans). En effet, le clémentinier (Citrus clementina Hort. Ex. Tan.) est apparu à la fin du XIXe siècle à partir d'un semis de pépins de mandarinier réalisé par le père Clément, à l'orphelinat de Messerghine (Algérie) [2]. Des travaux récents de marquage moléculaire attestent qu'il est le résultat d'un croisement naturel entre un mandarinier (Citrus reticulata Blanco) et un oranger (Citrus sinensis (L.) Osb.) [3,4].
La majorité des cultivars de clémentinier actuellement exploités sont des variants somaclonaux. Ils sont obtenus par multiplication végétative (greffage), à partir de bourgeons ayant subi des mutations spontanées [5]. La mutation spontanée ou induite est la voie privilégiée par les sélectionneurs pour l'amélioration génétique des espèces fruitières. Elle est particulièrement utilisée chez les genres regroupant des variétés cultivées ayant une hétérozygotie élevée comme les Prunus, Malus, Vitis, Citrus, Olea, etc. [6]. Des séquences de rétrotransposons pourraient être impliquées dans la diversification du clémentinier dont la mobilité au sein du génome serait activée sous l'effet d'un stimulus environnemental [7].
Les appellations horticoles des cultivars de clémentinier ont été souvent mêlées avec des dénominations locales ou commerciales. Il n'est pas rare, par conséquent, que le même nom désigne des cultivars différents (homonymie), mais aussi des noms différents sont attribués à un même cultivar (synonymie). Dans tous les cas, il convient alors de s'assurer de l'utilisation d'une même dénomination pour un même cultivar présentant des caractères phénotypiques décrits dans un environnement donné. Cette confusion dans la dénomination des cultivars est également une problématique chez d'autres espèces, comme le fraisier [8], l'olivier [9] et la vigne [10], où les variations phénotypiques entre cultivars sont souvent infimes. Toutefois, compte tenu de la faible diversité génétique engendrée par les mutations, le développement d'outils d'identification variétale est nécessaire pour décrire, caractériser et authentifier les cultivars économiquement importants.
L'évaluation et la description du matériel végétal se font essentiellement aux niveaux morphologique et biochimique. Cependant, les marqueurs moléculaires ont été d'un apport considérable. En effet, les isozymes ont été les premiers marqueurs génétiques étudiés chez les agrumes [11]. D'autres marqueurs moléculaires ont par la suite fait leur preuve dans la description de la diversité génétique tels que les marqueurs RAPD (Random Amplified Polymorphic DNA) [12,13] et les marqueurs AFLP (Amplified Fragment Length Polymorphism) [13]. Une autre catégorie de marqueurs moléculaires permettant l'étude de la variation de répétition des séquences microsatellites ou ISSR (Inter Simple Sequence Repeat) [14,15].
Les fruits du clémentinier possèdent des caractéristiques très attrayantes pour le consommateur, comme la facilité à éplucher le fruit, le jus et la pulpe à arôme très parfumé, et l'absence de pépins. Cette absence de pépins (aspermie) n'est valable que dans les vergers monoclonaux, où l'auto-incompatibilité gamétophytique du clémentinier peut s'exprimer. Cependant, les pollinisations croisées (par d'autres agrumes) engendrent le développement de pépins dans les clémentines. Par ailleurs, le développement des fruits chez les agrumes est le plus souvent assuré par la parthénocarpie [16].
Les cultivars de clémentinier sont sélectionnés sur la base de caractères d'intérêt commercial, tels que la précocité, la tardivité, le calibre des fruits et la productivité [17], ainsi que la qualité des fruits (aspect externe et interne du fruit, saveurs, arômes, texture, etc.). Trois catégories de cultivars sont définies : les cultivars précoces dont les fruits mûrissent à partir de septembre/octobre ; les cultivars de saison, représentant la majorité des clémentiniers dont la maturité se situe en novembre/décembre ; et les cultivars à maturité tardive en janvier/février [18,19]. Il est donc très important d'avoir des informations sur les différences de qualité entre cultivars et les changements éventuels pouvant se produire au cours du temps. De plus, l'évaluation agronomique permettrait de repérer de nouveaux génotypes possédant des caractéristiques agronomiques intéressantes et permettant l'élargissement de la campagne de production et de commercialisation par de nouveaux cultivars plus précoces ou beaucoup plus tardifs [20].
L'objectif de cette étude est donc d'évaluer l'impact de la variation clonale (les mutations somatiques) sur la variabilité des critères de la qualité organoleptique des fruits au cours de la maturation. Trois cultivars de clémentinier sont étudiés ( « Caffin », « Nules » et « Guerdane », respectivement précoce, de saison et tardif). Dans le souci de la recherche de critères d'évaluation précoces et stables (indépendant des conditions environnementales), nous avons comparé ces trois cultivars par leur morphologie foliaire et l'ADN avec différentes techniques de révélation du polymorphisme (isozymes, RAPD et ISSR).
2 Matériel et méthodes
2.1 Matériel végétal
Les fruits ont été prélevés sur trois cultivars de clémentinier « Caffin », « Nules » et « Guerdane ». Ils sont greffés sur le citrange « Carrizo », dans la collection du domaine Abbès Kabbage à El Guerdane, dans la vallée du Souss, dans le Sud du Maroc. La région est caractérisée par un climat semi-aride, avec une moyenne de précipitation de 200 mm/an. Les arbres sont sains et ne montrent aucun signe de carences nutritionnelles.
« Caffin » est un clone découvert en 1968 par M. Caffin dans la région d'Azemour, au Maroc.
« Nules » est un mutant naturel de la clémentine ‘Fina’, apparu en 1953 dans un verger du village de Nules, dans la région de Castellon en Espagne.
« Guerdane » est un mutant détecté sur un arbre de la clémentine Fine en 1987, au niveau du domaine Abbès Kabbage, dans la vallée du Souss, dans le Sud du Maroc. Il a été récemment enregistré dans le catalogue national.
2.2 Analyse de la qualité des fruits
Le prélèvement des fruits a été effectué pendant deux saisons de production (2004–2005 et 2005–2006). Il a débuté au mois d'octobre, correspondant au commencement de la saison de déverdissage des fruits, et s'est poursuivi jusqu'au mois de janvier suivant, qui correspond à la dernière date de récolte du cultivar tardif. Un intervalle de deux à trois semaines sépare chaque prélèvement. Les fruits analysés (15 par arbre) ont été récoltés à l'extérieur de la frondaison et dans les quatre orientations (est, ouest, nord, sud), avec une répétition de trois arbres et trois lots de cinq fruits par arbre pour chaque cultivar. Au laboratoire, leurs poids et leurs diamètres ont été mesurés, la fermeté des fruits a été obtenue à l'aide d'un pénétromètre de marque Minarik SL 15, gradué de 0 à 1000 gramme-force, l'épaisseur de la peau à l'aide d'un pied à coulisse, tandis qu'un chromamètre (Minolta CR 200) a été utilisé pour la mesure de l'indice de coloration [21] ; la teneur en jus, l'acidité titrable (en utilisant une solution de NaOH à 0,1 N), l'extrait sec soluble – à l'aide d'un réfractomètre – et le pH ont été également déterminés.
2.3 Morphologie des feuilles
La grille de description utilisée s'appuie sur le descripteur des agrumes publié par l'IPGRI [22]. Pour évaluer la stabilité des caractères phénotypiques observés, nous avons tenu compte de certains paramètres physiologiques et environnementaux : (1) la nature de la pousse (végétative ou fructifère) et (2) l'orientation des secteurs de la canopée où les prélèvements ont été effectués (est, ouest, nord, sud). Les caractères mesurés ou estimés sont : la longueur du pétiole, la largeur de l'aile du pétiole, la longueur et la largeur du limbe de la feuille, le rapport longueur/largeur du limbe de la feuille et le nombre de feuilles. Trois arbres ont été observés par clone. Trois rameaux ont été prélevés dans les quatre secteurs définis – nord, sud, est et ouest – soit 12 rameaux végétatifs et 12 rameaux floraux, soit 24 rameaux au total par arbre. Les rameaux ont été prélevés en périphérie de l'arbre, sur la circonférence la plus longue de la frondaison.
2.4 Marquage moléculaire
2.4.1 Isozymes
Un total de 13 systèmes enzymatiques a été analysé sur les feuilles des trois cultivars de clémentinier : estérase (Est), glutamate-oxaloacétate-transaminase (Got), amylase (Amy), leucine-amino-peptidase (Lap), alcool-déshydrogénase (Adh), malate-déshydrogénase (Mdh), super-oxyde-dismutase (Sod), phosphatase acide (Pa), shikimate-déshydrogénase (Skd), ménadione réductase (Mnr), alanine amino peptidase (Aap), phosphoglucoisomérase (Pgi) et phosphoglucomutase (Pgm).
2.5 Extraction de l'ADN
De jeunes feuilles fraîchement cueillies sont utilisées pour extraire l'ADN [23]. La quantité d'ADN obtenue est mesurée au fluorimètre (DyNAquant 200, Hoefer). L'absence de traînée, signe de dégradation de l'ADN est vérifiée par migration pendant environ une heure à 130 V et 230 mA. Un gel d'agarose 0,8% est utilisé dans du tampon TAE 1x (40 mM Tris-Base, 25 mM EDTA (acide éthylènediamine tétraacétique), 20 mM d'acide acétique). L'ADN est visualisé sous lumière UV après coloration dans une solution de bromure d'éthidium (BET) à 2 μg/ml pendant 15 min [24].
2.5.1 RAPD
La composition du mélange réactionnel et les conditions thermiques de la réaction d'amplification sont les mêmes que celles décrites par [25], avec quelques modifications. Le volume final du milieu réactionnel est de (25 μl) : 25 ng d'ADN ; 2,5 μl du tampon 10x (Tris-HCl pH 9.0, KCl 50 mM, Triton X-100 0,1%) ; 0,8 μM d'amorces, onze paires d'amorces ont été utilisées (N19, N06, Z04, S11, OP4, Op11, Op17, Op15, Op17, OP18 et OP20) ; 200 μM de (dATP, dGTP, dCTP, dTTP) ; 1,5 mM de MgCl2 ; 1 unité de Taq polymérase (GoldStar, Eurogentec). L'amplification se fait en 45 cycles : à 94 °C pendant 5 s, à 36 °C pendant 30 s et à 72 °C pendant 60 s. Les produits d'amplification de la PCR sont séparés par électrophorèse sur gel d'agarose (1,5%) dans un tampon TBE 0,5x et sont visualisés sous lumière UV après coloration au bromure d'éthidium.
2.5.2 ISSR
La méthode utilisée est celle décrite par Fang et Roose [14]. Dix amorces ont été synthétisées et combinées entre elles deux à deux en PCR (20 combinaisons testées). Le volume final du milieu réactionnel est de 20 μl : 25 ng ADN ; 1x tampon 10x (Eurogentec) ; 2 mM MgCl2 ; 200 μM dNTP ; 1 μM de chaque amorce ; 2% v/v formamide ; 1 unité de Taq polymérase (GoldStar, Eurogentec). Le programme du thermocycleur est le suivant : un cycle à 94 °C pendant 4 min, suivi de 27 cycles (à 94 °C pendant 30 s, à 52 °C pendant 45 s et à 72 °C pendant 2 min), puis un cycle à 72 °C pendant 7 min. Les produits d'amplification sont séparés par électrophorèse sur gel de polyacrylamide 6% non dénaturant, contenant l'urée 3 M et le tampon TBE 1x à 60 W, jusqu'à ce que le bleu de bromophénol arrive en bas du gel, puis sont visualisés par coloration au nitrate d'argent.
2.6 Analyse statistique
L'analyse statistique des résultats de l'étude de la qualité des fruits et de la description morphologique des feuilles a été effectuée à l'aide du logiciel statistique SAS [26]. Une analyse de variance a été réalisée, avec l'évaluation, dans le cas de l'analyse des paramètres de qualité des fruits, de l'effet cultivar, de l'effet « date de récolte » et de l'interaction cultivar–date de récolte. Le test de Scheffé a été utilisé pour comparer les moyennes entre elles. Ce test présente l'avantage, par rapport au test de Duncan, de tenir compte des éventuels déséquilibres entre facteurs (lorsque les tailles des échantillons pour lesquels les moyennes sont calculées sont différentes).
3 Résultats
3.1 Qualité des fruits
Seuls les paramètres de qualité qui montrent des différences significatives entre les cultivars sont présentés (Fig. 1).
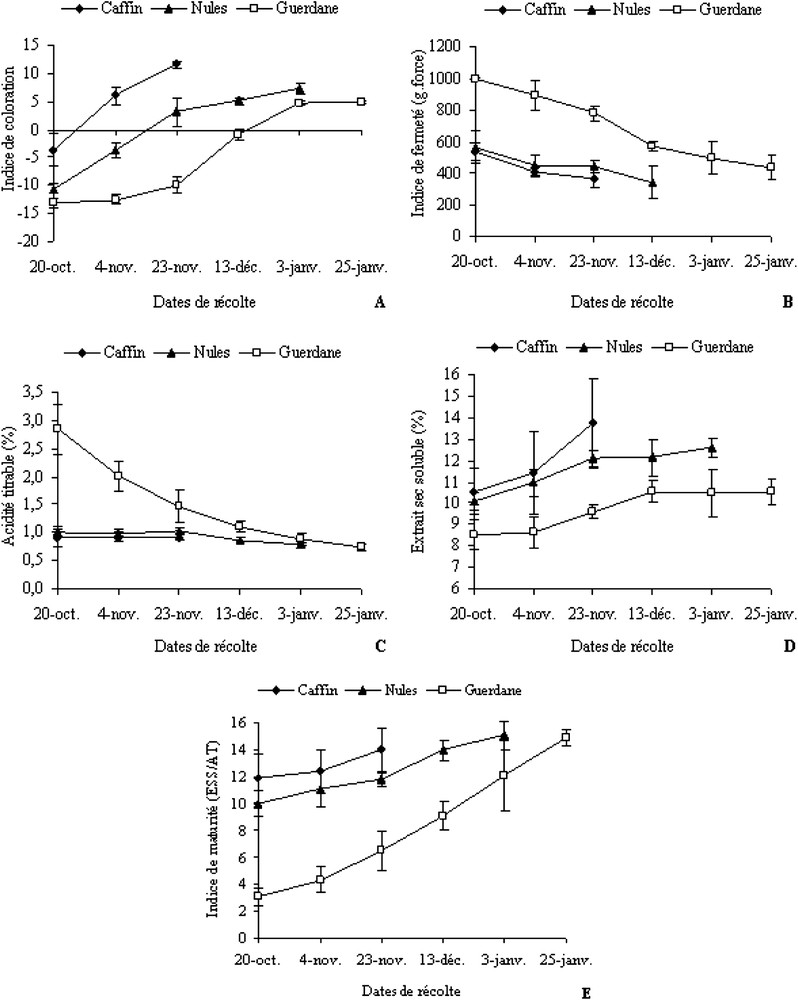
Évolution des paramètres de la qualité des fruits de trois cultivars de clémentinier (« Caffin », « Nules » et « Guerdane ») au cours de la maturation (moyennes de deux saisons de production, 2004–2005 et 2005–2006). (A) Indice de coloration ; (B) Fermeté ; (C) Acidité titrable (AT) ; (D) Extrait sec soluble (ESS) ; (E) Indice de maturité (ESS/AT).
L'indice de coloration mesuré au cours du temps et du mûrissement des fruits montre qu'il y a une évolution de la couleur de la peau (du vert foncé à l'orange foncé) chez les trois cultivars (Fig. 1A). Pour ce paramètre, l'effet date de récolte, l'effet cultivar et l'interaction cultivars × date de récolte sont très hautement significatifs. On note qu'à la première date de récolte (mi-octobre), l'indice de coloration varie de (−3) pour « Caffin », correspondant à une coloration jaune verdâtre avec des taches oranges, à (−13) pour « Guerdane », correspondant à une coloration vert foncé. Alors que les fruits du cultivar « Nules » présentent un indice de coloration (−10). Le cultivar « Caffin » se distingue par une coloration de l'écorce d'un indice supérieur à celui des deux autres cultivars.
L'indice de fermeté des fruits diminue significativement avec le temps pour les trois cultivars. « Guerdane » se singularise par les valeurs les plus élevées à la première date de récolte (994 g.force) et durant toute la période d'expérimentation (Fig. 1B).
Pour l'acidité titrable dans le jus, aucune différence significative n'a été observée entre « Caffin » et « Nules » (environ 0,9%). En revanche, l'acidité titrable de « Guerdane » est significativement plus élevée du mois d'octobre (2,8%) au mois de décembre (1,1%) (Fig. 1C). La diminution de l'acidité avec le temps et le mûrissement des fruits n'est significative que chez le cultivar « Guerdane ».
L'extrait sec soluble augmente progressivement en fonction du temps et de la maturité des fruits (Fig. 1D). La comparaison des différents cultivars montre que « Caffin » présente un extrait sec soluble significativement plus élevé en octobre (11%) et en novembre (14%). Tandis que « Guerdane » se distingue par un extrait sec soluble significativement plus faible (8%) à la première date de récolte et durant toute la période d'expérimentation. Les effets « cultivar » et « date de récolte » sont hautement significatifs, alors que leur interaction est non significative.
À la première date de récolte, l'indice de maturité (ESS/AT) est de (12) pour « Caffin », (10) pour « Nules », et (3) pour « Guerdane » (Fig. 1E). Chez les trois cultivars, il y a augmentation de ce rapport avec le temps et la maturation des fruits. Cette évolution est très hautement significative chez le cultivar « Guerdane ».
3.2 Morphologie des feuilles
L'analyse statistique a montré que la nature de la pousse (végétative ou fructifère) et l'orientation (sud, est, ouest, nord) n'ont pas d'effet sur les critères descriptifs de la morphologie foliaire. Toutefois, les caractères examinés (longueur du pétiole, largeur de l'aile du pétiole, longueur et largeur du limbe des feuilles, rapport longueur/largeur du limbe des feuilles et nombre de feuilles par pousse) permettent d'établir quelques distinctions entre les trois cultivars. En effet, le pétiole est significativement plus long chez « Guerdane » (Fig. 2A). L'aile du pétiole est étroite et presque absente chez « Nules », alors qu'elle est large chez « Guerdane » (Fig. 2B). « Nules » et « Guerdane » ont des feuilles plus longues par rapport à « Caffin » (Fig. 2C). Les feuilles sont plus larges chez « Nules » comparé aux deux autres cultivars (Fig. 2D). Le rapport longueur/largeur des feuilles distingue le cultivar « Guerdane » avec le rapport le plus élevé (Fig. 2E). Enfin, le nombre de feuilles par pousse est significativement plus élevé chez « Nules », alors qu'il est le plus faible chez « Guerdane » (Fig. 2F).
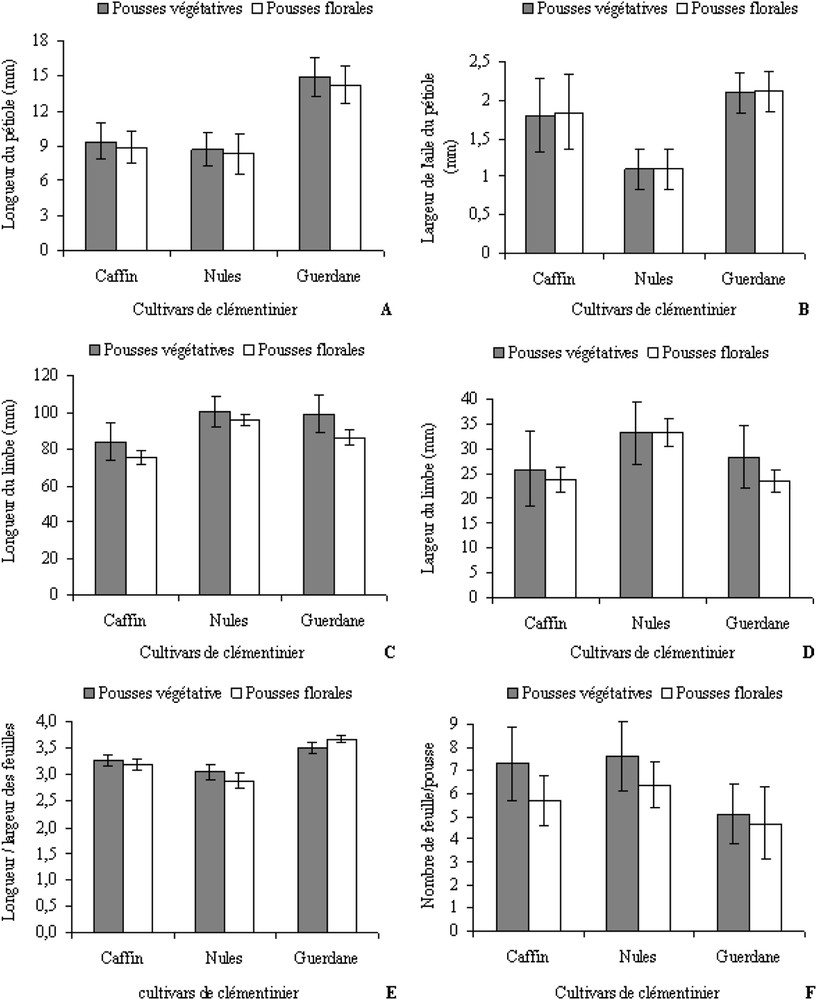
Variation de la morphologie des feuilles des pousses végétatives et florales chez trois cultivars de clémentinier (« Caffin », « Nules » et « Guerdane »). (A) Longueur du pétiole ; (B) Largeur de l'aile du pétiole ; (C) Longueur du limbe ; (D) Largeur du limbe ; (E) Rapport longueur/largeur du limbe ; (F) Nombre de feuilles par pousse.
3.3 Marquage moléculaire
Les trois cultivars de clémentinier étudiés ne présentent pas de polymorphisme isoenzymatique. En revanche, parmi les onze amorces RAPD utilisées, l'amorce opéron N19 révèle un polymorphisme chez le cultivar « Guerdane » (Fig. 3), caractérisé par l'absence d'un fragment d'ADN amplifié (un fragment absent parmi quarante amplifiés). La technique ISSR révèle également un polymorphisme avec trois combinaisons différentes de couples d'amorces identifiant le cultivar « Guerdane » par l'absence de trois fragments d'ADN amplifiés sur un total de quatre-vingt-dix obtenus (Fig. 4A, B et C). Aucun fragment d'ADN supplémentaire n'a été observé, pas plus que de polymorphisme entre les variétés « Caffin » et « Nules ».
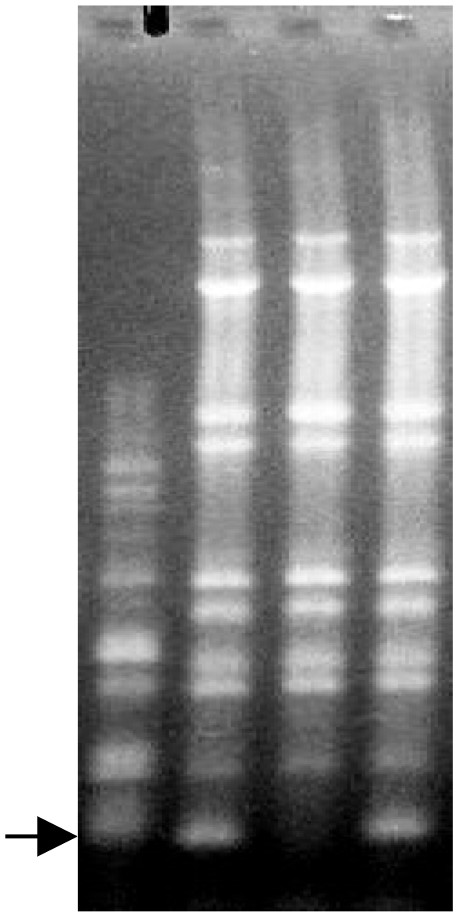
Profils d'amplification de l'ADN de trois cultivars de clémentinier par RAPD obtenus avec l'amorce N19 comme amorce de PCR (de gauche à droite : marqueur de taille, « Caffin », « Guerdane » et « Nules »).
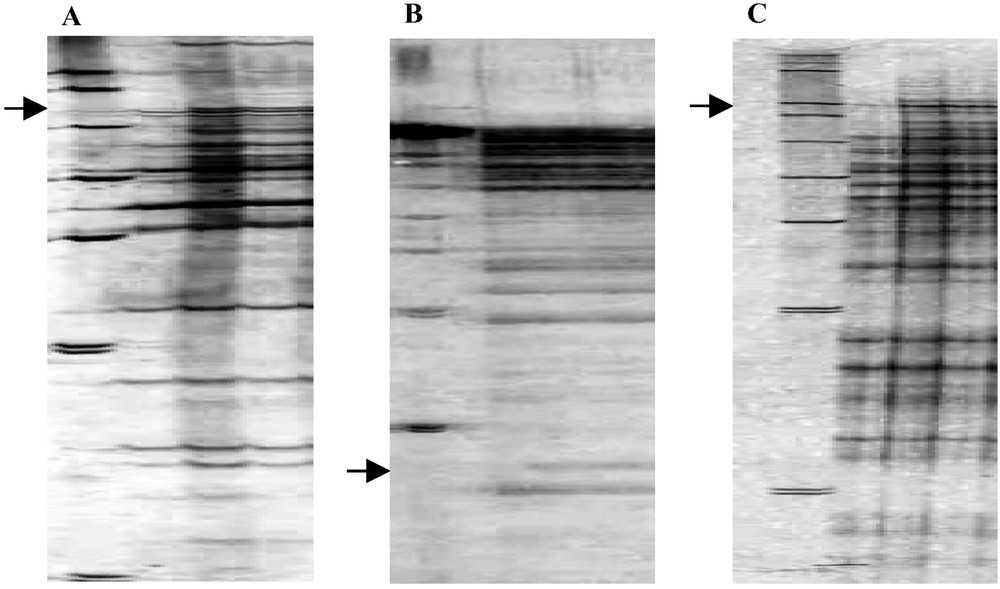
Profils obtenus avec la combinaison de deux amorces ISSR comme amorce de PCR, de trois cultivars de clémentinier (de gauche à droite : marqueur de taille, « Guerdane », « Nules » et « Caffin »). (A) ISSR 1+4 ; (B) ISSR 2+3 ; (C) ISSR 5+8.
4 Discussion
4.1 Qualité des fruits
Le cultivar « Caffin » se distingue par les fruits les plus colorés ; des résultats similaires ont été rapportés en Corse [27] et en Nouvelle-Zélande [28], tandis que « Guerdane » se caractérise par une coloration verte qui persiste longtemps (jusqu'au mois de décembre). Il est certain que la coloration des fruits d'agrumes est le facteur de qualité externe le plus important, puisque les consommateurs se basent sur l'apparence des fruits pour faire leur choix [29]. Néanmoins, à la récolte, la coloration n'est pas un facteur limitant, puisque le déverdissage des fruits mûrs par exposition à l'éthylène permet d'obtenir une coloration orange [20,30,31].
L'indice de fermeté minimal pour lequel les fruits gardent une bonne qualité est voisin de 350 g [32]. Au-dessous de cette valeur, le fruit n'est plus assez ferme et perd de son élasticité. C'est le cas du cultivar « Caffin » à la fin novembre et du cultivar « Nules » un peu plus tard (début décembre). En revanche, les fruits de « Guerdane » restent plus fermes, même après le mois de janvier. Ceci pourrait être expliqué en partie par une
plus grande épaisseur de l'écorce des fruits. Ce paramètre est connu pour être corrélé positivement avec la fermeté des fruits [20,33]. De plus, une écorce peu épaisse est sujette aux altérations, meurtrissures et pourritures [34,35], ce qui rend le fruit impropre à la consommation. L'indice de fermeté des fruits est également un paramètre important permettant d'évaluer la qualité des fruits mûrs. Il a été efficacement utilisé comme indice de maturité chez le clémentinier [36] et chez l'oranger [37]. Ce paramètre est aussi pris en compte pour évaluer la qualité de la pêche [38] et celle de la mangue, dont la fermeté constitue l'un des principaux indicateurs de maturité des fruits à la cueillette et de leur degré de maturation en cours de conservation [39].
L'acidité titrable est un élément important pour définir la qualité du jus ou pour la détermination de la date de la récolte. En effet, c'est un indicateur de la maturité des fruits en relation avec les sucres (ESS/AT). En général, la teneur en acides organiques diminue durant la maturité [40] ; c'est le cas du cultivar « Guerdane », qui se distingue par des fruits les plus acides. Toutefois, une clémentine avec une acidité inférieure à 0,8% est de moindre qualité, puisque les sucres dominent, donnant au fruit un goût insipide [41,42], et rendant les fruits plus sensibles à l'attaque des microorganismes en post-récolte [34].
L'extrait sec soluble évolue en fonction de la maturité [43]. La teneur minimale (9%) exigée pour les clémentines exportables [44,45] est atteinte par les différents cultivars à la mi-octobre, à l'exception de « Guerdane », pour laquelle l'accumulation des sucres est plus lente.
L'indice de maturité (ESS/AT) permet de classer les cultivars selon leurs dates d'arrivée à maturité. « Caffin » et « Nules » atteignent la maturité physiologique (ESS/AT > 7) [45] dès la mi-octobre. En revanche, « Guerdane » ne l'atteint qu'au mois de décembre, ce qui est lié à son acidité élevée et supérieure à celles des autres cultivars durant les mois d'octobre et novembre.
De manière générale, les différents paramètres de la qualité des fruits permettent de distinguer les trois cultivars. Toutefois, il faut tenir compte des conditions environnementales [46] et des pratiques culturales, qui ont un effet sur l'expression de la plupart des caractères de la qualité des agrumes (coloration interne et externe, teneur en jus, acidité et teneur en sucres) [47]. Par ailleurs, la période de récolte des trois cultivars est variable ; elle est assez courte chez « Caffin », un peu plus longue chez « Nules », et plus étalée chez « Guerdane ».
4.2 Morphologie des feuilles
Les trois cultivars de clémentinier peuvent être différenciés selon la morphologie de la feuille (longueur du pétiole, largeur de l'aile du pétiole, longueur et largeur du limbe, rapport longueur/largeur du limbe des feuilles et nombre de feuilles par pousse). La description morphologique des feuilles a servi préalablement à la caractérisation de différentes variétés de bigaradiers (Citrus aurantium) ayant le même processus de diversification que les clémentiniers [48]. On peut également citer les travaux sur la caractérisation à l'aide de la morphologie foliaire des hybrides somatiques issus de la fusion entre protoplastes d'espèces différentes [49,50], bien que, dans ces cas, la variabilité phénotypique entre les différents agrumes est beaucoup plus importante que celle des bigaradiers ou des clémentiniers. Des chercheurs brésiliens ont rapporté que la largeur de l'aile du pétiole est un bon marqueur, qui permet d'identifier efficacement les hybrides du bigaradier (C. aurantium) et de l'oranger doux (C. sinensis) [51]. Le rapport longueur sur largeur des feuilles est utilisé pour distinguer les plants d'origine zygotique des plants d'origine nucellaire des cultivars et hybrides de mandarinier (C. reticulata) [52].
4.3 Marquage moléculaire
L'analyse du polymorphisme morphologique est souvent accompagnée de l'étude du polymorphisme isoenzymatique ou moléculaire [51,53]. Les isozymes sont relativement simples, peu coûteux et très utiles pour la diversité interspécifique et la sélection zygotique ou nucellaire [16]. Toutefois, ils se sont révélés inefficaces pour la détection de polymorphisme entre les cultivars étudiés. Des résultats similaires ont été trouvés chez d'autres cultivars d'agrumes issus de mutations [54–56].
Les marqueurs RAPD sont peu polymorphes, seul le cultivar « Guerdane » a pu être identifié. Des auteurs ont rapporté que ces marqueurs n'ont permis d'identifier à chaque fois qu'un seul cultivar de clémentinier parmi 24 ( « Loretina » ou « Arrufatina ») [13].
Enfin, les marqueurs ISSR ne sont polymorphes que pour le cultivar « Guerdane », mais avec plusieurs combinaisons d'amorces (ISSR , ISSR et ISSR ). Ce type de marqueur avait révélé un polymorphisme plus important chez Poncirus trifoliata [14] et chez Citrus aurantium L. [57]. On suppose que la reproduction sexuée chez ces deux espèces a joué un rôle dans leur diversification, contrairement au cas des clémentiniers (multiplication végétative). Par ailleurs, ces deux espèces existent depuis bien plus longtemps que le clémentinier (plusieurs milliers d'années, contre tout juste un siècle pour le clémentinier) et auraient par conséquent accumulé beaucoup plus de mutations.
Compte tenu du mode de diversification du clémentinier, très peu de travaux, jusqu'à ce jour, ont permis de révéler un polymorphisme moléculaire entre les cultivars de clémentiniers [13]. Nous supposons que l'utilisation de techniques révélant le polymorphisme de séquences ou de position d'éléments transposables – AFLP, SSAP (Sequence-Specific Amplified Polymorphism), IRAP (Inter-Retrotransposon Amplified Polymorphisms) – pourraient avoir une efficacité plus élevée que les marqueurs utilisés dans cette étude.
5 Conclusion
Dans le cadre de la caractérisation physicochimique, nous avons noté que la plupart des caractères organoleptiques de la qualité des fruits utilisés en sélection ou en production sont variables dans le temps (en fonction des stades de développement du fruit) et selon le cultivar. La plupart d'entre eux interviennent dans la définition de la qualité du fruit et sont utilisés comme indicateurs du seuil de maturité. On peut également avancer que certains de ces caractères sont très discriminants pour les variétés de clémentiniers cultivés dans un même lieu et un même environnement. On peut citer : l'indice de maturité interne, la coloration, la fermeté de l'écorce des fruits.
La morphologie de la feuille, même si des différences ont été observées, n'est pas propice à la discrimination des clémentiniers : d'une part, parce que la sélection est plus ciblée sur le fruit ou sur la production fruitière en général, et d'autre part, parce que la description phénotypique, même si elle est nécessaire, présente de nombreux inconvénients. En effet, elle nécessite de travailler sur un arbre adulte qui a complété son développement. Car l'expression de certains caractères est dépendante de l'organe, du stade de développement, ainsi que de l'interaction génotype–environnement, etc. Par conséquent, le développement de marqueurs moléculaires est indispensable pour contourner ces difficultés et pour caractériser les différents cultivars de clémentinier de manière précoce.
Les techniques RAPD et ISSR ont révélé un polymorphisme pour le cultivar « Guerdane », mais l'efficacité de distinction de ces marqueurs reste néanmoins faible. Il est à noter toutefois que plusieurs fragments d'ADN sont déficitaires chez le clémentinier « Guerdane », suggérant que plusieurs zones génomiques auraient été la cible de mutations. Il est également très probable que l'expérimentation d'un grand nombre d'amorces finisse par générer un important lot de marqueurs des différents cultivars de clémentinier. Les résultats obtenus dans ce travail suggèrent que ces techniques de marquage aléatoires de l'ADN sont adaptées à la caractérisation de mutants performants en vergers et peuvent aussi être utilisées dans la protection des obtentions variétales.
Remerciements
Les auteurs sont très reconnaissants à H. Talhi, M. Goumari et G. Costantino pour l'aide apportée à la réalisation de ce travail, réalisé dans le cadre d'un projet PRAD entre l'Inra de San Giuliano (France) et l'IAV Hassan-II, complexe horticole d'Agadir (Maroc).


