Abridged English version
Considering the importance of the worker bee in the reproduction field, its ovary deserves to be well studied. We tried to solve the problem of the classification of the ovarian stages through the ultrastructure of the basal follicle. The bees incipient from the Apis mellifera mellifera were provided by the French National Institute of the Agronomic Research (INRA) of Bures-sur-Yvette, near Paris. Experiments were made at the Laboratory of Physiology of the Insects of the Pierre-and-Marie-Curie University, Paris-6. The bees were maintained in constant conditions of breeding: small cage of , temperature °C, relative humidity , permanent food of Candy (honey + powder sugar + pollen) and water. Natural mortalities throughout breeding are lower than 10%. The workers were anaesthetized using CO2. The ovaries were dissected and fixed for 40 min at 4 °C with 2% glutaraldehyde in a 0.1 M cacodylate buffer, pH 7.3. These ovaries were post-fixed with 1% osmium tetroxide in the same 0.1 M buffer during 60 min, dehydrated in a series of graded ethanol, and embedded in Epon 812. Sections were coloured with blue toluidine for light microscopy, for orientation. For electronic microscopy, thin sections were coloured with uranyl acetate and lead citrate. Thin sections were examined with a Philips 201 transmission electronic microscope.
The results reveal that the first basal follicle constitutes stage 1. This follicle is surrounded by a basal lamina of 1-μm thickness. The perioocytar follicular cells, well provided in mitochondria, pile up the oocyte, which is very rich in proteinic granules and lipidic globules osmiophiles (Fig. 1). In the ooplasm, the dilated cylinders of the rough endoplasmic reticulum (RER) surround entirely dense ranges of granules (Fig. 2) and decondensate proteinic granules and lipidic globules, thus forming multivesicular bodies (Fig. 3). The third basal follicle constitutes stage 2; its bunch of trophocytes is twice as long as that of the oocyte. At the end of the previtellogenesis, or stage 3, the length of the bunch of trophocytes is higher, or merely equal to that of the oocyte. The basal lamina remains a little thicker and the follicular cells are quite deeper. In the cortex of the oocyte, the accessory cores are comparatively numerous (Fig. 4). The tubules generate at one end a multivesicular body, which becomes a lysosome (Fig. 5). In a zone of the ooplasm, the tubules are numerous. The lysosomes could mean the outline of future vitelline granules (Fig. 6). At the beginning of vitellogenesis, or stage 4, the length of the oocyte becomes higher than that of the bunch of trophocytes. The appearance of small vitelline granules contiguous to many tubules shows the beginning of vitellogenesis. The intercellular space between the oocyte and the follicular perioocytar cells becomes important. A dense hemolymphatic material settles on the external face of the plasmic membrane of the oocyte (1); then a covered well is formed (2), which generates a pinocytosis vesicle (3) that separates (4) and integrates in the young vitelline granule (5) (Fig. 7). The apical pole of the follicular cells is enriched with mitochondria and reinforced with dictyosomes of the Golgi complex and of RER fragments. The core equipped with nucleoles is bulky. The glycogen is important (Fig. 8). At the end of the vitellogenesis, or stage 5, the saturation of the ooplasm by the vitelline granules and the appearance of the vitelline membrane characterize essentially this phase; the lipidic globules are semi-osmiophiles (Fig. 9). In certain zones of the ooplasm, the vitelline granules and accessory cores are contiguous to the secretion vesicles. The lipidic globules in full being not osmiophiles, they are thus only equipped with saturated lipids (Fig. 10). The basal lamina is reduced to the tenth of its initial thickness. The follicular cells of many lysosomic vesicles are contiguous to the external nuclear membrane and to the cylinders of the RER. The secretion vesicles are accompanied by fragments of RER to the plasmic membrane (Fig. 11). The ends of the parallel spans of the RER and the mitochondria are transformed into lysosomes: myelinic bodies and large lysosomic vesicles (Fig. 12). In the apical pole of the follicular cells, the dense granules, attacked by lysosomic vesicles, generate microvesicles of secretion 160 to 330 Å in diameter, which are contiguous to the plasmic membrane of the oocyte. The intercellular space between the follicular cells and the oocyte is very important. In the cortex of the oocyte, the vesicles of pinocytoses and the glycogen can constitute the glycoproteic reserve of the oocyte and the synthesis equipment of the vitellin envelopes (Fig. 13). The microvillar labyrinths of the oocyte are occupied by vesicles of endocytose containing glycogen grains (Fig. 14). The end of the maturation of the oocyte, or stage 6, is marked by the dissolution of the vitelline granules and the appearance of tubules (Fig. 15). The vitelline reserve appears, finally, in the form of fragments of microfilament and glycoproteic granules. The reduced microvilli of the oocyte are inserted in the very fine vitelline membrane. The chorion is composed of an endochorion and an exochorion (Fig. 16). The follicular cells in degeneration present very circonvolutional plasmic membranes, strongly dilated cylinders of RER, and numerous lysosomes (Fig. 17).
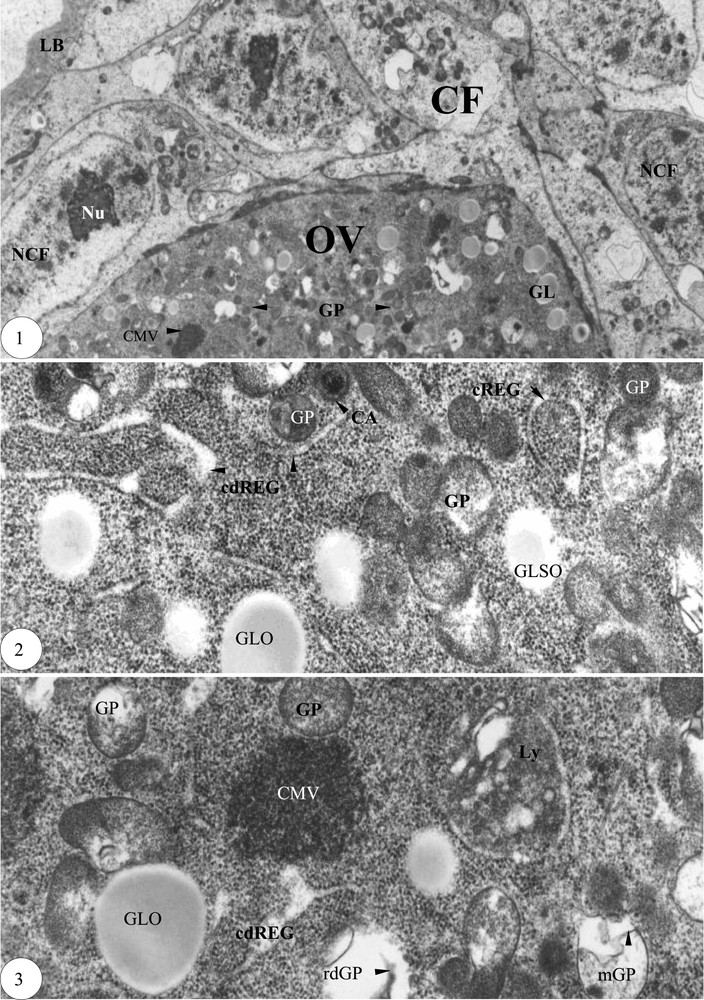
Début de la prévitellogenèse. (1) Zone du pôle apical ovocytaire enveloppée de cellules folliculaires (×6000). (2) Encerclement de plages de granules par le réticulum endoplasmique granulaire (×30 000). (3) Contiguïté du réticulum endoplasmique granulaire avec les inclusions paraplasmiques (×30 000). Légende : AmpREG, ampoule du réticulum endoplasmique granulaire ; CA, corps annulaire ; CMy, corps myélinique ; cREG, cylindre du réticulum endoplasmique granulaire ; cdREG, cylindre dilaté du réticulum endoplasmique granulaire ; CF, cellule folliculaire ; CMV, corps multivésiculaire ; eic, espace intercellulaire ; EndoCH, endochorion ; Endoth, endothelium ; ExoCH, exochorion ; fREG, fragment du réticulum endoplasmique granulaire ; G, appareil de Golgy ; gd, granule dense ; GL, globule lipidique ; GLNO, globule lipidique non osmiophile ; GLO, globule lipidique osmiophile ; GLSO, globule lipidique semi osmiophile ; GLy, glycogène ; GP, granule protéique ; GV, granule vitellin ; jGV, jeune granule vitellin ; LB, lame basale ; Ly, lysosome ; M, mitochondrie ; MCi, membrane circonvolutionnée ; mf, microfilament ; mGP, membrane du granule protéique ; mv, membrane vitelline ; MVO, microvillosité ovocytaire ; NA, noyau accessoire ; NCF, noyau de la cellule folliculaire ; Nu, nucléole ; OV, ovocyte ; pic, pont intercellulaire ; REG, réticulum endoplasmique granulaire ; rdGP, résidu dense du granule protéique ; rGLy, rosette de glycogène ; Tu, tubule ; VEndo, vésicule d'endocytose ; VL, vésicule lysosomique ; VP, vésicule de pinocytose ; VS, vésicule de sécrétion.
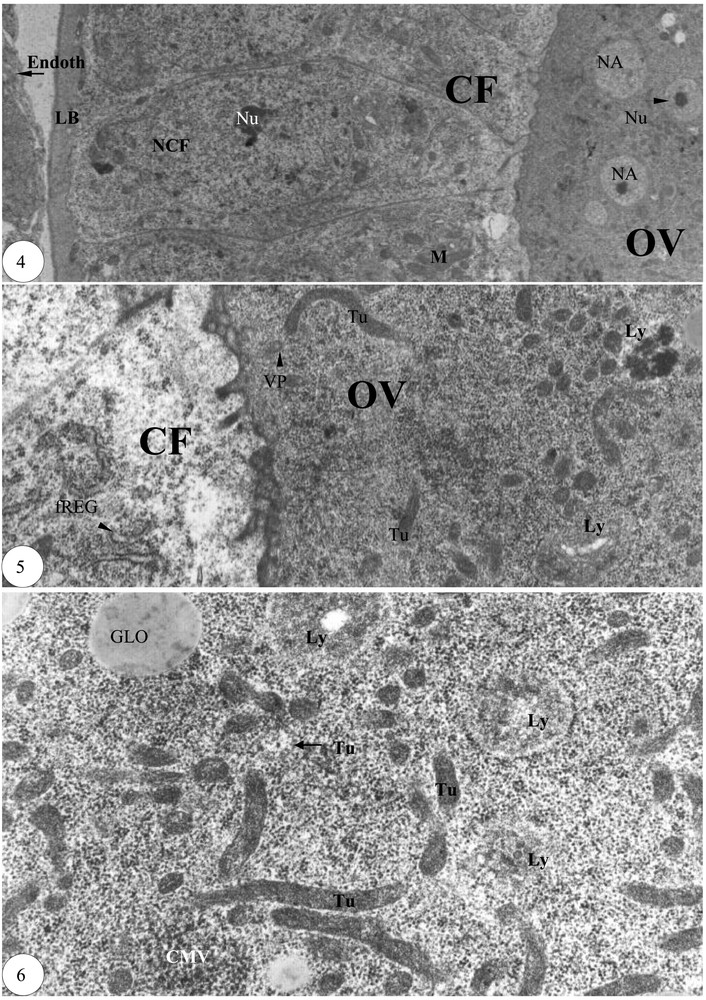
Fin de la prévitellogenèse. (4) Cortex de l'ovocyte entouré de cellules folliculaires périovocytaires (×6000). (5) Détail du cortex de l'ovocyte et d'une cellule folliculaire périovocytaire (×20 000). (6) Détail des tubules d'une zone ovocytaire (×30 000). Légende : cf. Figs. 1–3.
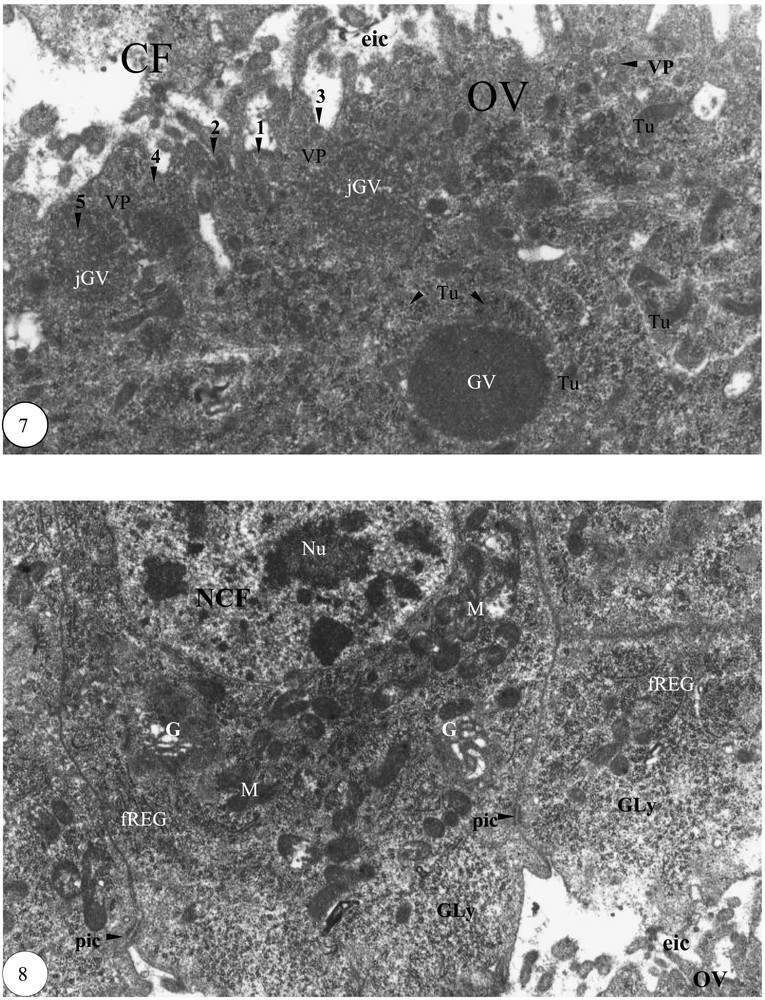
Début de la vitellogenèse. (7) Formation des granules vitellins dans le cortex ovocytaire (×20 000). (8) Partie apicale de quelques cellules folliculaires périovocytaires (×14 000). Légende : cf. Figs. 1–3.
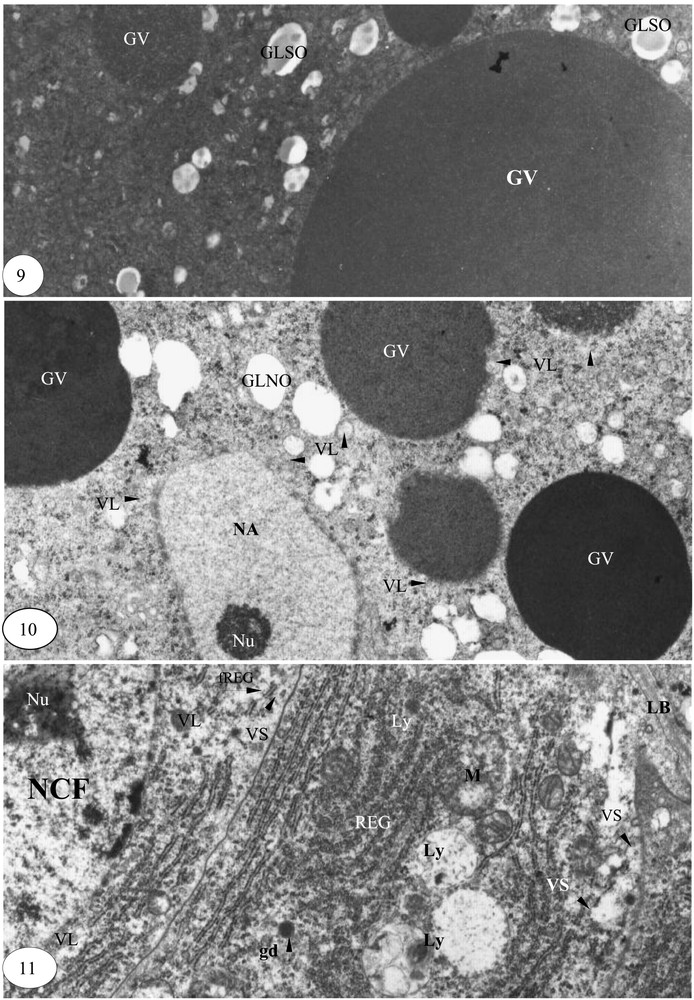
Fin de la vitellogenèse. (9) Granules vitellins mûrs de taille maximale (×14 000). (10) Granules vitellins et noyau accessoire en régression de taille (×14 000). (11) Cellule folliculaire en phase de production de matériel de sécrétion (×14 000).
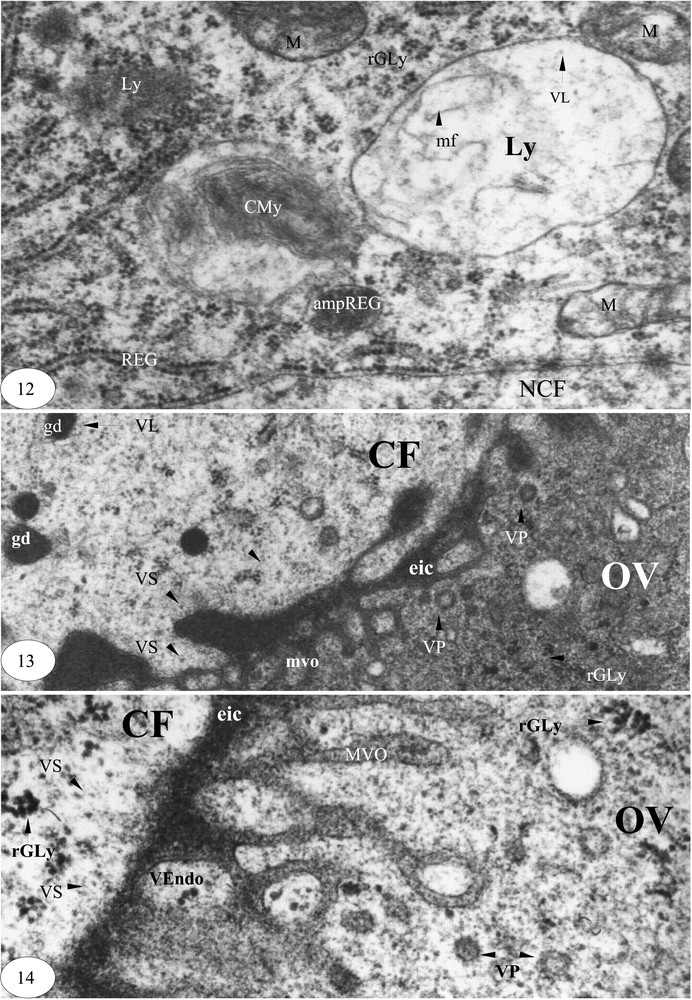
Fin de la vitellogenèse. (12) Lyse mitochondriale et lysosomes (×40 000). (13) Sécrétions d'une cellule folliculaire et pinocytose ovocytaire (×30 000). (14) Sécrétion d'une cellule folliculaire et endocytose et pinocytose ovocytaire (×60 000). Légende : cf. Figs. 1–3.
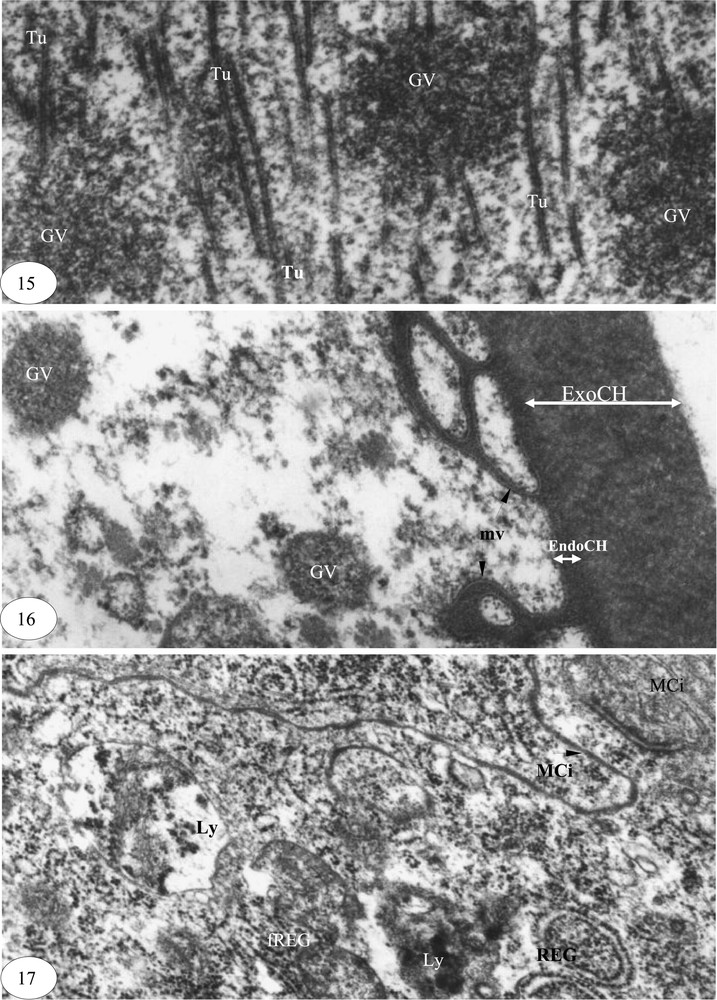
Maturation ovocytaire. (15) Dissolution des granules vitellins (×30 000). (16) Ovocyte mûr chorionné (×60000). (17) Dégénérescence d'une cellule folliculaire (×30 000). Légende : cf. Figs. 1–3.
1 Introduction
Les abeilles ouvrières, jusqu'ici négligées, forment un domaine de recherches intéressant pour l'ovaire. Influencées par la présence de la reine et du couvain, ces ouvrières restent stériles. Néanmoins, chez certaines abeilles, les ovaires se développent jusqu'à la ponte des œufs. Ces ovaires sont de type méroïstique polytrophique. Le follicule comporte un ovocyte accompagné de 47 trophocytes et une assise de cellules folliculaires qui enveloppent l'ensemble ovocyte–trophocytes [1,2]. À l'éclosion, l'ouvrière adulte comporte 2 à 20 ovarioles par ovaire, alors que la reine en compte 160 à 180 par ovaire [3,4]. L'inhibition ovarienne est maintenue par la phéromone mandibulaire de la reine [5] et la phéromone de couvain [6–9]. L'absence de contact avec ces deux types de phéromones pourrait entraîner un développement précoce des abeilles [10,11]. Ainsi, 72% des ouvrières développent leurs ovaires [12]. Le cycle de développement ovarien dépend de l'âge de l'ouvrière. Il consiste en des stades de développement complet et parfois de régression et de dégénérescence finale.
La classification des stades ovariens est abordée par appréciation de la taille et l'observation de la forme de l'ovaire [1,13,14], la forme des œufs des abeilles ouvrières [3] et l'évolution du volume de l'ovocyte chez la reine Apis mellifica [15]. Cette classification reste imprécise, voire même ambiguë dans certaines phases critiques du développement. C'est la raison pour laquelle nous avons été amenés à étudier l'ultrastructure de l'ovaire de l'abeille mellifère de l'Europe occidentale, Apis mellifera mellifera, pour mieux définir les stades évolutifs. De plus, une description cytologique plus complète et plus approfondie de l'ovaire est nécessaire, en particulier chez Apis, pour laquelle il n'existe aucune donnée récente.
2 Matériel et méthodes
2.1 Matériel biologique
Les abeilles naissantes de la race Apis mellifera mellifera ont été fournies par l'Institut national de la recherche agronomique (Inra) de Bures-sur-Yvette, Paris. Les expériences ont été menées au laboratoire de physiologie des insectes de l'université Pierre-et-Marie-Curie, Paris-6.
2.2 Élevage
Vingt-quatre heures après l'émergence, huit cagettes de 100 abeilles chacune sont maintenues en conditions constantes d'élevage : cagette de dimension , température °C, humidité relative , nourriture permanente de Candy (miel + sucre glace + pollen) et de l'eau. L'élevage est effectué aux mois de mars et d'avril. Les mortalités naturelles pendant la durée d'élevage sont inférieures à 10%.
2.3 Microscopie optique et électronique
Les ouvrières sont anesthésiées au CO2. Leurs ovaires sont fixés pendant 40 min à 4 °C avec 2% de glutaraldéhyde dans un tampon phosphate de sodium 0,1 M, pH 7,3, additionné de 0,01% de chlorure de calcium. Ces pièces sont post-fixées avec 1% de tétroxyde d'osmium dans le même tampon 0,1 M pendant 60 min, déshydratées progressivement dans l'éthanol de degré croissant et imprégnées dans l'Epon 812.
Pour les examens au microscope optique, les coupes sont colorées au bleu de toluidine. Les coupes ultrafines sont colorées à l'acétate d'uranyle et au citrate de plomb [16]. Ces coupes sont examinées à l'aide du microscope électronique Philips 201.
3 Résultats
3.1 Ovaire en début de la prévitellogenèse ou stades 1 et 2
Le premier follicule constitue le stade 1 dans la partie antérieure du vitellarium, dénommée zone de prévitellogenèse. Ce follicule est entouré d'une lame basale de 1 μm d'épaisseur. Les cellules folliculaires périovocytaires, bien pourvues en mitochondries, sont entassées au pôle apical de l'ovocyte, lequel est très riche en granules protéiques et globules lipidiques osmiophiles (Fig. 1). Dans l'ooplasme, les cylindres dilatés du réticulum endoplasmique granulaire cernent entièrement des plages de granules denses (Fig. 2) et décondensent des granules protéiques et des globules lipidiques, formant ainsi des corps multivésiculaires (Fig. 3). Les granules protéiques, limités par une membrane et décondensés, présentent parfois un corps dense résiduel d'aspect annulaire (Fig. 3). Le troisième follicule basal constitue le stade 2 ; sa grappe de trophocytes est deux fois plus longue que celle de l'ovocyte.
3.2 Ovaire en fin de la prévitellogenèse, ou stade 3
Au niveau du septième follicule basal, la longueur de la grappe de trophocytes est supérieure, ou approximativement égale, à celle de l'ovocyte. La lame basale demeure un peu moins épaisse et les cellules folliculaires sont assez profondes. Dans le cortex de l'ovocyte, les noyaux accessoires sont relativement nombreux (Fig. 4). Les tubules engendrent à l'une de leur extrémité un corps multivésiculaire, qui se résout en un lysosome (Fig. 5). Dans une zone de l'ooplasme, les tubules de 0,1 à 0,13 μm de largeur et de 1,3 μm de longueur sont nombreux. Les lysosomes pourraient signifier l'ébauche du futur granule vitellin (Fig. 6).
3.3 Ovaire en début de la vitellogenèse, ou stade 4
La longueur de l'ovocyte devient supérieure à celle de la grappe de trophocytes. L'apparition dans l'ooplasme de granules vitellins de 1 à 2 μm de diamètre caractérise le début de la vitellogenèse. De nombreux tubules de forme annulaire sont contigus aux granules vitellins. L'espace intercellulaire entre l'ovocyte et les cellules folliculaires périovocytaires devient important. Un matériel dense hémolymphatique se dépose sur la face externe de la membrane plasmique de l'ovocyte (1), puis se forme un puits recouvert (2), qui engendre une vésicule de pinocytose liée à la face interne de la membrane plasmique (3) ; cette vésicule se détache (4) et s'intègre dans le jeune granule vitellin (5) (Fig. 7). Le pôle apical des cellules folliculaires est enrichi de mitochondries et renforcé de quelques dictyosomes de l'appareil de Golgi et de fragments de cylindres de REG. Le diamètre des ponts intercellulaires est de 0,3 μm en moyenne. Le noyau, pourvu de nucléoles, est volumineux. Le glycogène est important (Fig. 8).
3.4 Ovaire en fin de la vitellogenèse ou stade 5
La saturation de l'ooplasme par les granules vitellins de 1 à 8 μm de diamètre et l'apparition de la membrane vitelline caractérisent essentiellement la fin de la vitellogenèse ; les globules lipidiques sont semi-osmiophiles (Fig. 9). Dans certaines zones de l'ooplasme, les granules vitellins et les noyaux accessoires, en régression de volume, sont contigus aux vésicules de sécrétion de 0,03 à 0,08 μm de diamètre. Ces vésicules, synonymes de lysosomes, semblent attaquer ce matériel ooplasmique ; les globules lipidiques sont totalement non osmiophiles, donc pourvus uniquement de lipides saturés (Fig. 10).
La lame basale est réduite au dixième de son épaisseur initiale. Les cellules folliculaires sont en pleine activité. Leur nucléoplasme est riche en matériel d'aspect ribosomique. De nombreuses vésicules lysosomiques sont contigües à la membrane nucléaire externe et aux cylindres du réticulum endoplasmique granulaire. Les vésicules de sécrétion sont accompagnées par des fragments de REG jusqu'à la membrane plasmique. Les extrémités des travées parallèles du REG et les mitochondries sont transformées en lysosomes (Fig. 11).
Deux types de lysosomes peuvent être générés : les corps myéliniques et les grosses vésicules lysosomiques d'aspect clair contenant des microfilaments (Fig. 12).
Dans le pôle apical des cellules folliculaires, les granules denses sont de plus petite taille. Attaqués par des vésicules lysosomiques, ces granules engendrent des microvésicules de sécrétion de 160 à 330 Å de diamètre, lesquelles sont contiguës à la membrane plasmique du coté de l'ovocyte. L'espace intercellulaire entre les cellules folliculaire et l'ovocyte est très important. Dans le cortex de l'ovocyte, les vésicules de pinocytoses sont nombreuses, et le glycogène est présent. Ceci peut constituer la réserve glycoprotéique de l'ovocyte et le matériel de synthèse des enveloppes vitellines (Fig. 13). Les labyrinthes microvillositaires de l'ovocyte sont occupés par des vésicules d'endocytose contenant des grains de glycogène. Dans le cortex de l'ovocyte apparaissent des rosettes de glycogène et des vésicules de pinocytose d'aspect clair ou dense, de 0,07 à 0,13 μm de diamètre (Fig. 14).
3.5 Maturation de l'ovocyte ou stade 6
La fin de la maturation de l'ovocyte est marquée par la dissolution des granules vitellins et l'apparition de tubules (Fig. 15). Les granules qui persistent encore ont un diamètre de 0,1 à 0,4 μm. La réserve vitelline apparaît enfin, sous forme de fragments de microfilaments et de granules glycoprotéiques. La microvillosité réduite de l'ovocyte s'enfonce dans la membrane vitelline, très fine. Le chorion de 0,76 μm d'épaisseur est composé d'un endochorion et d'un exochorion (Fig. 16). Les cellules folliculaires en dégénérescence présentent des membranes plasmiques très circonvolutionnées, des cylindres de réticulum endoplasmique granulaire fortement dilatés et de nombreux lysosomes (Fig. 17).
4 Discussion
Pendant la maturation des ouvrières orphelines, période de prévitellogenèse, la croissance folliculaire demeure constante. C'est ainsi que l'ovaire est qualifié de stade I [1], de degré zéro ou rudimentaire [13] et presque inactif [3]. Le stade II est défini comme un niveau de développement de degré 1 [13] et de classe 2, puisque les ovocytes ont la forme de haricots et apparaissent entourés d'une couche claire [1,3]. Durant cette phase, les inclusions paraplasmiques figurées de l'ovocyte peuvent avoir une origine trophocytaire. En effet, chez Apis, les trophocytes produisent l'acide ribonucléique (ARN), les ribosomes, les mitochondries, les gouttelettes lipidiques et les vésicules, qui migrent vers l'ovocyte à travers les canaux circulaires [17]. Chez les insectes holométaboles (drosophile, hyménoptères), ce processus de migration se poursuit même pendant la vitellogenèse, avec le maintien des noyaux au centre des cellules nourricières par les éléments cytosquelettiques (filaments d'actine ou microtubules) [18]. Dans l'ovaire télotrophique, la migration des organites semble se produire principalement pendant la phase prévitellogénétique chez Sialis mitsuhashii [19].
Le stade III est qualifié d'ovaire appartenant à la classe 3, puisque les œufs ont la forme d'une saucisse [1] et sont plus allongés [3]. Les ovocytes, étant distincts, sont considérés de degré II [7].
Vers la fin de la première semaine de l'âge adulte des ouvrières, la précision du stade III est si délicate, qu'une phase critique s'implique entre la maturation et le développement de l'abeille. Ainsi, l'apparition des tubules dans le cortex ovocytaire semble préciser la fin de la prévitellogenèse. Ces tubules interviennent dans la formation des granules vitellins. Ainsi, chez le Grillon, Gryllus capitatus, les polysaccharides hémolymphatiques, sans doute liés à des protéines, pénètrent dans le cytoplasme de l'ovocyte à travers les vésicules de pinocytose qui déversent leur contenu dans des tubules. Ces tubules servent de voie de cheminement au matériel polysaccharidique qu'ils transfèrent aux granules vitellins en formation [20]. La présence de deux types de vésicules de pinocytose de différente taille semble conférer une spécialisation dans l'incorporation de matériaux hémolymphatiques. La présence d'un résidu de matériel dense dans les granules protéiques révèle l'utilisation des réserves par le réticulum endoplasmique granulaire.
La réduction de la taille des granules protéiques et l'apparition de nombreux lysosomes peuvent être les indicateurs d'un engagement dans la vitellogenèse. Le processus vitellogénétique peut être initié quand la longueur de l'ovocyte atteint 30% de sa longueur finale [21]. Les trophocytes, très pauvres en réticulum endoplasmique et en appareil de Golgi, ne peuvent s'impliquer activement dans la synthèse vitelline [22,23].
Durant la vitellogenèse, la dissolution des réserves lipoprotéiques, au début de cette phase, peut servir à la synthèse vitelline propre de l'ovocyte. Ainsi, chez la fourmi ouvrière Formica ants, l'accroissement des particules vitellines de l'ooplasme s'accomplit avec de nombreuses granules protéiques et gouttelettes lipidiques [23]. Le volume de l'ovocyte s'accroît rapidement par le transport de protéines vitellines hétérosynthétiques de l'hémolymphe par capture pinocytosique [2]. Les digitations et les vésicules de pinocytose témoignent donc de l'activité extracellulaire de l'ovocyte. La fusion des vésicules de pinocytose produit des granules vitellins à aspect perforé. Leur tissage se réalise peut être sous l'action d'une enzyme spécifique. Les noyaux accessoires ayant atteint leur taille maximale, ils semblent fournir eux aussi des petites quantités d'ARN. Ainsi, le matériel qui parait franchir leurs pores nucléolaires serait produit par le nucléole.
À la fin de la vitellogenèse, les trophocytes évacuent leur contenu dans l'ovocyte [15]. Les ovaires ayant atteint le stade V sont placés dans la classe 5 [1]. Les granules vitellins et les noyaux accessoires en régression de taille sont solubilisés par les vésicules lysosomiques qui seraient parvenues de l'injection terminale des trophocytes. Il résulte de cette solubilisation une structure granuleuse très fine et l'apparition du glycogène. Les vésicules de sécrétion dans le pôle apical des cellules folliculaires contiennent de la vitellogénine, qui est incorporée par l'ovocyte [24]. La migration de ces vésicules exige des interactions entre les microfilaments et les microtubules [25].
La couleur noire des granules denses, des granules vitellins et du matériel hémolymphatique est due au traitement des coupes histologiques par le nitrate de plomb. Ce matériel se fixe sur les structures de nature glycoprotéique. S'agissant de lipides saturés, les globules lipidiques non osméophiles ne sont pas denses aux électrons. Le dépôt des granules denses en une fine ligne dans le cortex ovocytaire peut constituer d'abord la membrane vitelline, et éventuellement le chorion.
Au moment de la maturation de l'ovocyte, la vésicule germinative, les noyaux accessoires et les granules vitellins, envahis par les vésicules lysosomiques, disparaissent. Pendant cette dernière phase du cycle reproducteur de l'abeille ouvrière, l'inhibition ovarienne chez les autres abeilles peut s'expliquer par la présence d'un certain nombre d'ouvrières ayant développé leurs ovaires de façon optimale. Étant donné le caractère fortement social de l'abeille, la décision collégiale est susceptible d'avoir une influence profonde sur le succès reproducteur de la colonie [26]. Ainsi, la présence de dopamine dans la nourriture provoque une activation des ovaires, d'où son rôle dans le statut reproducteur des abeilles ouvrières mellifiques orphelines [27]. C'est probablement la catégorie des ouvrières pondeuses qui peut avoir une influence d'inhibition sur le développement ovarien des autres ouvrières. La régression de la taille ovarienne est observée chez Apis cerana en présence des ouvrières pondeuses [28], lesquelles inhibent le développement ovarien chez les autres ouvrières [12,28–32]. Chez Apis mellifica capensis, le taux de 28% d'abeilles aboutissant au stade 5 diminue après 13 jours d'orphelinage [33]. Ainsi, la population de pseudo-clone d'ouvrières pondeuses de cette race peut atteindre ovaires entièrement actifs [34]. L'inhibition ovarienne est due à l'augmentation de la quantité de 2-heptanone produite par les glandes mandibulaires de l'ouvrière de 3 μg par tête à 13 jours à 11,4 μg par tête à 20 jours [35]. Ainsi, les têtes des ouvrières pondeuses de l'abeille mellifique du cap Apis mellifica capensis contiennent de l'acide trans-9-oxo-décénoïque [36]. Durant les quatre premiers jours de la vie imaginale [37], la phéromone de la glande mandibulaire est dominée par la substance royale, l'acide 9-oxo-2-(E)-décénoïque [38], qui persiste pendant quelques jours chez cette race d'abeille [37]. On observe une corrélation significative entre la quantité de la substance royale des glandes mandibulaires (9-oda) produite et l'activité ovarienne [39].
Remerciements
Nous tenons à remercier vivement M. G. Arnold et Mme C. Masson, chercheurs à l'Inra de Paris, pour les dons des échantillons d'abeilles, Apis mellifera mellifera.


