Abridged English version
The freshwater planarian Schmidtea mediterranea, Benazzi et al. 1975, has functioned as a biological model in a variety of studies but its reproduction is poorly documented. The present article represents the first ultrastructural investigation on the oogenesis of this species, collected in Tunisia.
At the light microscopical level it can be observed that the female gonad of S. mediterranea is of the heterocellular type, consisting of two ovaries and numerous vitellaria, which are connected to the oviducts and produce yolk cells. From the periphery to the interior, each ovary contains accessory cells as well as oocytes at sequential stages of maturation. Ultrastructural studies revealed that accessory cells surround the oocytes and produce cytoplasmic projections around oocytes. These cells have an elongated nucleus with a sub-spherical nucleolus measuring about 4 μm in diameter. Oogonia and young oocytes are situated at the periphery of the ovary and have an irregular nucleus with large chromatin patches, particularly adjacent to the nuclear envelope. The dense cytoplasm these cells contains lipid droplets. Growing oocytes are rounded cells with a large nucleus, surrounded by an envelope that is very rich in pores. The perinuclear ooplasm is characterized by a considerable number of endoplasmic reticulum cisternae, containing a fibro-granular material and electron-dense materiel. The latter probably originates from the nucleus and is here interpreted as consisting of chromatoid bodies that may participate in the synthesis of yolk by fusion with young yolk globules. The cytoplasm increases in volume and is characterized by an increase in number of mitochondria, short endoplasmic reticulum cisternae, as a well as a considerable development of Golgi complexes. The latter are involved in the production of small vesicles containing an electron-dense material. The coalescences of these vesicles give rise to young yolk globules. Mature and sub-mature oocytes measure about 60 μm in diameter and are characterised by a remarkable increase in volume of the ooplasm, due to the accumulation of a large number of spherical yolk globules (about 5 to 6 μm in diameter), which show a paracrystalline structure. The oogenesis described above represents the usual type for a neoophoran flatworm and thus represents an ancestral character state for S. mediterranea. The presence of spermatozoa between oocytes indicates that fertilization may occur inside the ovary, which is considered as an uncommon feature in triclads, in which oocytes are usually fertilized after they have entered the proximal, anteriormost section of the oviduct.
1 Introduction
Chez les Plathelminthes Turbellariés, la morphologie de la gonade femelle et la structure des œufs produits permettent de définir deux niveaux d’organisation : Archoophora et Neoophora [1]. Les Archoophoriens sont les plus primitifs et possèdent une gonade dite homocellulaire (ovaire). Elle est composée d’ovocytes qui produisent des globules vitellins, et d’autres substances de réserve tels que des gouttelettes lipidiques et des granules de glycogène. De plus, ces ovocytes produisent des granules coquilliers qui sont les précurseurs de l’enveloppe de la ponte ou cocon. Ce type d’œuf ou ovocyte est qualifié d’endolécithe.
L’état néophorien, comportant un ovaire ou germarium et des glandes vitellogènes ou vetellarium, se traduit par l’apparition d’un type de gonade complexe dite hétérocellulaire. La ponte des néophoriens, formée dans ce type de gonade contient des ovocytes accompagnés par un très grand nombre de cellules vitellines ou vitellocytes. Les ovocytes sont alécithes et produits dans l’ovaire, et durant leur descente dans les oviductes, ils reçoivent les cellules vitellines produites dans les glandes vitellogènes. Ces cellules vitellines ont déjà synthétisé et accumulé le matériel de réserve qui sera utilisé lors du développement des embryons, ainsi que les globules coquilliers pour la constitution de la coque ovigère (caractère apomorphe). L’œuf est donc de type ectolécithe.
Le passage de l’état Archoophora à l’état Neoophora, a permis à l’ovocyte de se libérer de la production et de l’accumulation des substances de réserve et des précurseurs des enveloppes des œufs. Ces fonctions ont été transférées aux cellules vitellines. Ce passage représente donc une étape très importante dans l’histoire de l’évolution des Plathelminthes. Pour cette raison, plusieurs recherches se sont intéressées à l’étude ultrastructurale et cytochimique des ovocytes et des vitellocytes d’un grand nombre d’espèces de Turbellariés. Ces investigations ont permis d’une part de conduire à de nouveaux résultats et d’enrichir les connaissances sur la biologie de reproduction, et d’autre part, de suggérer que certaines de ces données peuvent être utilisées pour la reconstitution des relations phylogénétiques entre les différents taxons des Plathelminthes [2–9].
Malgré les études moléculaires avancées sur la phylogénie des planaires [10,11], les critères phylogénétiques basés sur des caractéristiques morphologiques de la gonade femelle restent encore d’une importance majeure [12–14]. Ces caractéristiques ont été subdivisées par Gremigni et Falleni [9] en trois niveaux différents. Dans le premier niveau ils ont pris en considération des caractères morphologiques basés sur des études macroscopiques (le nombre de gonades, leur position etc.). Dans le deuxième niveau, ils ont pris en considération des caractéristiques microscopiques à savoir l’organisation cellulaire, présence ou absence de cellules accessoires et d’une tunique cellulaire et/ou une lame extracellulaire. Le troisième niveau prend en considération des critères ultrastructuraux basés sur la composition des trois types de cellules, les ovocytes, les vitellocytes et les cellules auxiliaires.
Chez les Triclades d’eau douce (Paludicoles) qui sont reparties en trois familles (Dugesiidae, Planariidae et Dendrocoeliidae), les caractères ultrastructuraux des ovocytes et des cellules vitellines ont été étudiés chez un certain nombre d’espèces et de familles [1,15–17]. Ces études ont permis de distinguer deux groupes de Triclades : les uns possédant des ovocytes contenant des quantités plus ou moins importantes de vitellus, alors que les autres en sont dépourvus. Au sein de la famille des Dugesiidae, malgré la présence de glandes vitellogènes, les ovocytes synthétisent au cours de leur croissance des globules vitellins et les accumulent dans leur cytoplasme, à l’intérieur des vacuoles. Les granules corticaux n’ont pas été observés. Chez les deux autres familles considérées comme plus évoluées (Planariidae et Dendrocoeliidae), les ovocytes sont dépourvus de globules vitellins, mais renferment des petits granules corticaux qui sont disposés régulièrement dans une couche périphérique de l’ooplasme cortical [3,18].
L’espèce S. mediterranea est devenue à l’heure actuelle un modèle biologique de choix en raison des caractéristiques bien particulières qu’elle possède, notamment sa capacité de se reproduire par les deux voies, sexuée et asexuée, et la facilité avec laquelle elle s’élève au laboratoire. Elle a fait l’objet de différentes études qui touchent à la régénération [19,20] et à la biologie de développement [21,22]. Son génome est actuellement complètement séquencé [23], et par conséquent le nombre de laboratoires qui travaillent avec cette espèce augmente d’un jour à un autre [23,24]. Mais aucun travail sur la biologie de sa reproduction n’a été réalisé jusqu’à présent. Les objectifs du présent travail sont : d’examiner la structure de l’ovaire chez cette planaire modèle, en accordant une attention particulière à l’étude de l’ovogenèse en microscopie photonique et électronique à transmission afin de connaître les particularités de cette espèce, notamment la structure et la constitution de ses ovocytes ; et de comparer les résultats obtenus avec ceux des études antérieures consacrées aux autres Triclades d’eau douce, et plus particulièrement avec les caractères observés chez les espèces de la famille des Dugesiidae. Cette étude contribue à enrichir les données disponibles et à confirmer l’intérêt de l’ultrastructure de la gonade femelle pour reconstituer la phylogénie des Triclades Paludicoles en particulier et des Plathelminthes en général.
2 Matériel et méthodes
2.1 Matériel
Les spécimens de S. mediterranea ont été récoltés dans la retenue d’eau du barrage Lebna dans le Nord-Est de la Tunisie, approximativement à 2 km de la mer Méditerranée (36° 44’ N et 10° 56’ E). Les prélèvements ont été réalisés pendant la période située entre décembre et mai, période correspondant à la maturité sexuelle de l’espèce [25].
2.2 Méthodes d’étude en microscopie photonique
Les planaires matures (12–20 mm de longueur) sont fixées au Bouin Hollande pendant 24 heures puis incluses dans la paraffine. Elles sont ensuite débitées en coupes sériées de 5 à 7 μm d’épaisseur et colorées à l’éosine et au bleu de Toluidine. Les coupes semi-fines de 1 μm d’épaisseur, sont obtenues avec un ultramicrotome de type LKB Bromma 8800 à partir de fixations et d’inclusions réalisées pour l’étude ultrastructurale. Ces coupes sont colorées au bleu de toluidine 1 %, au bleu de méthylène 1 % et au teraborate de soduim 1 % puis observées avec un microscope photonique Optec équipé d’un appareil photo numérique de type Nikon (Coolpix 4500).
2.3 Méthodes d’étude en microscopie électronique
Des fragments antérieurs contenant des ovaires de spécimens matures de S. mediterranea sont préfixés dans le glutaraldéhyde à 4 % dans le tampon cacodylate de sodium (0,1 M) ajusté avec HCl à un pH = 7,2 et à une température de 4 °C. Les échantillons sont ensuite rincés dans deux bains d’une solution tampon et postfixés dans l’OsO4 à 1 % pendant une à deux heures à la température ambiante. La déshydratation des pièces est faite dans des bains d’éthanol de concentrations croissantes. Les échantillons sont ensuite passés dans l’oxyde de propylène puis dans le milieu d’inclusion qui est l’Epon. Les coupes ultrafines sont exécutées à l’aide d’un ultramicrotome de type LKB Bromma 8800 équipé de couteaux en verre. Elles sont colorées à l’acétate d’uranyle-Reynolds et observées au microscope électronique à transmission de type Jeol 100 SX.
3 Résultats
3.1 Structure de l’ovaire en microscopie photonique
Les observations en microscopie photonique ont montré que S. mediterranea possède deux ovaires qui sont situés juste en arrière du cerveau, du côté ventral, au dessus des deux cordons nerveux. À maturation, ils mesurent environ 260 μm suivant leur axe dorsoventral et 150 μm suivant leur grand axe antéropostérieur. Le tube oviductaire s’ouvre du côté postérodorsal de l’ovaire (Fig. 1).
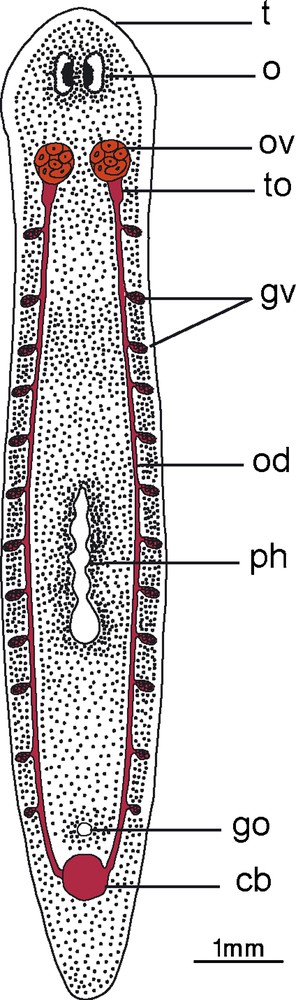
Disposition des ovaires (germarium) et des glandes vitellogènes (vitellarium) chez Schmidtea mediterranea mature.
De la périphérie vers le centre, dans la direction ventrodorsale, on observe différents types de cellules qui se distinguent par leur taille et leur affinité aux colorants (Fig. 2). Leurs noyaux montrent des chromosomes plaqués contre la paroi nucléaire (stade pachytène). Toutes ces cellules sont donc au même stade de la méiose (prophase I).
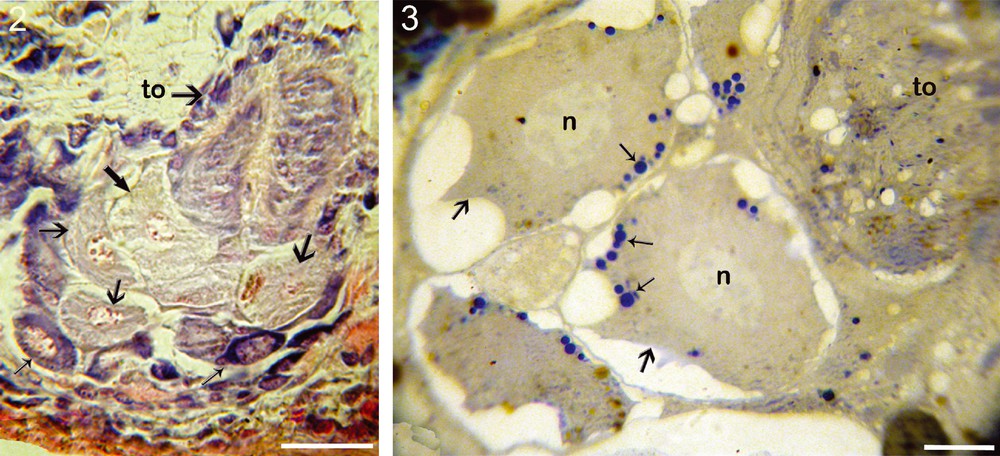
2. Structure d’un ovaire mature: les ovogonies à la périphérie (flèches grêles), les ovocytes très jeunes et en cours de maturation (flèches moyennes), les ovocytes sub-matures ou matures près du tube oviductaire (to) (deux flèches plus grosses) (Barre d’échelle = 30 μm). 3. Coupe semi-fine d’ovaire, montrant la zone de croissance qui renferme des ovocytes matures (grandes flèches) à gros noyaux (n), et à cytoplasme riche en globules vitellins basophiles (petites flèches) et, dans l’angle supérieur droit, une partie du tube oviductaire (to) renfermant des spermatozoïdes, où se produit la fécondation (Barre d’échelle = 15 μm).
Les cellules les plus jeunes occupent une position périphérique. Elles sont interprétées comme des ovogonies. Elles mesurent 10 × 15 μm environ, et sont caractérisées par un noyau très volumineux (8–10 μm) et clair par rapport au cytoplasme. Ce dernier est réduit et fortement basophile.
Les très jeunes ovocytes I se distinguent des ovogonies par leur taille un peu plus grande et par un cytoplasme moins basophile. Le noyau occupe environ les 3/4 de la cellule, et mesure environ 25 μm.
Les ovocytes à différents stades de croissance sont disposés suivant un gradient axial d’évolution de taille, en direction ventrodorsale. La basophilie du cytoplasme diminue au fur et à mesure que la taille de l’ovocyte augmente (Fig. 2). On peut distinguer des ovocytes moyens et des ovocytes submatures et matures. Les premiers sont caractérisés par un cytoplasme peu basophile et clair ; des inclusions cytoplasmiques commencent à y apparaître (Fig. 3). Les ovocytes matures, de grande taille (50 μm), sont situés prés des tubules (Fig. 2). En coupes semi-fines ils montrent un cytoplasme acidophile riche en inclusions sphériques très basophiles (Fig. 3). Par ailleurs, l’observation des chromosomes confirme que ces différentes catégories d’ovocytes sont bien au même stade de la division méiotique.
3.2 Étude de l’ovogenèse en microscopie électronique à transmission
En plus des cellules germinales à différents stades de croissance, on peut distinguer des cellules accessoires (Fig. 4).
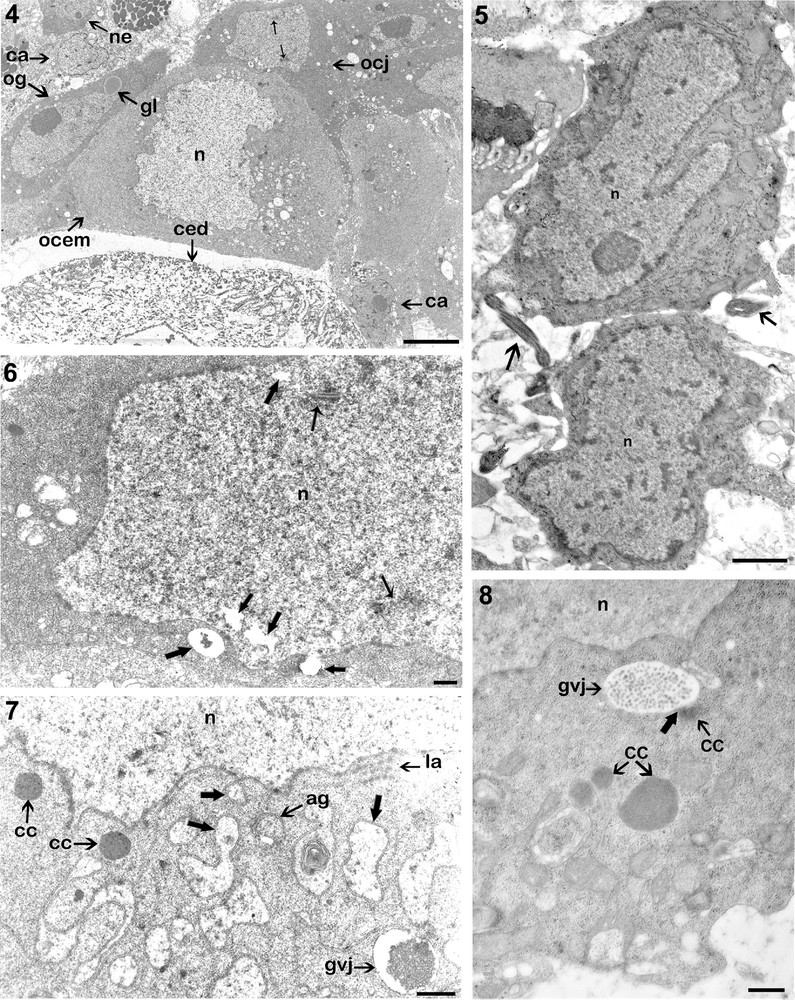
4. L’organisation ultrastructurale de la périphérie de l’ovaire : présence de plusieurs types de cellules : des cellules accessoires (ca), des ovogonies (og), des ovocytes jeunes (ocj) (Barre d’échelle = 5 μm). 5. Coupe de deux ovogonies montrant le contour irrégulier du noyau (n), et la présence des sections de spermatozoïdes (flèches) (Barre d’échelle = 1 μm). 6. Organisation ultrastructurale d’un très jeune ovocyte. La première division méiotique (prophase I) est marquée par l’apparition des complexes synaptonémaux dans le noyau (petites flèches). On remarque la présence de petites vacuoles provenant du noyau (grosses flèches) (Barre d’échelle = 1 μm). 7. Détail d’un ovocyte en cours de maturation montrant la présence des corps chromatoïdes (cc), des lamelles annelées (la) et des saccules du réticulum endoplasmique dans l’espace périnucléaire délimitant un matériel fibro-granulaire (grosses flèches) (Barre d’échelle = 1 μm). 8. Portion de coupe d’un ovocyte en cours de maturation montrant un des corps chromatoïdes (cc) en cours de fusion (grosse flèche) avec un globule vitellin jeune (gvj), en haut et près du noyau (n), et d’autres corps chromatoïdes en évolution vers le centre de l’ooplasme (Barre d’échelle = 1 μm).
3.2.1 Les cellules accessoires
Ces cellules, aussi appelées cellules auxiliaires ou tout simplement cellules folliculeuse sont à la périphérie de l’ovaire et entre les ovocytes, et peuvent émettre entre ces derniers de longs prolongements cytoplasmiques. Elles sont caractérisées par leur taille plus petite que celles des cellules germinales et un rapport nucléoplasmique élevé. Leur noyau de forme irrégulière renferme un nucléole compact de forme sub-sphérique d’environ 4 μm de diamètre (Fig. 4). La chromatine granulaire montre parfois des amas denses.
3.2.2 Différents stades de croissance ovocytaire
3.2.2.1 Ovogonies et très jeunes ovocytes
Les ovogonies et les très jeunes ovocytes se rencontrent dans la partie périphérique de l’ovaire, du côté ventral. Ils sont morphologiquement similaires aux cellules indifférenciées ou néoblastes. Ils renferment dans leur cytoplasme dense des gouttelettes lipidiques (Fig. 4), ce qui témoigne de la précocité du processus de formation des lipides.
Le noyau montre un contour irrégulier et une chromatine éparpillée dans le nucléoplasme avec quelques petits amas d’hétérochromatine plaqués le plus souvent contre la membrane nucléaire (Fig. 5). Le nucléole sub-sphérique est excentrique et très dense ; il présente une structure granulaire et fibrillaire. Entre ces cellules, on note la présence de spermatozoïdes (Fig. 5).
Dans les très jeunes ovocytes, on note la présence des complexes synaptonémaux dans le noyau marquant la première division méiotique (prophase I). À ce stade, l’enveloppe nucléaire est percée de nombreux pores, et émet des vésicules à contenu très clair (Fig. 6).
3.2.2.2 Ovocytes à des stades intermédiaires
Ce sont des cellules plus volumineuses que les précédentes. L’enveloppe nucléaire, très riche en pores, émet par le phénomène de délamination des lamelles annelées. De courts saccules de réticulum endoplasmique sont abondants dans l’espace périnucléaire, et se trouvent parfois en continuité avec la membrane nucléaire. Ces saccules délimitent un matériel fibrogranulaire semblable à celui observé dans le noyau (Fig. 7).
De petites masses d’un matériel finement granulaire dense aux électrons, les corps chromatoïdes, sont très souvent observés près du noyau (Fig. 7), d’où leur origine probablement nucléaire. Ces agrégats mesurent environ 1,5 μm de diamètre et peuvent fusionner près du noyau avec les jeunes globules vitellins ou migrer vers le centre de l’ooplasme (Fig. 8).
À un stade plus avancé le cytoplasme, qui devient de plus en plus abondant, renferme occasionnellement des mitochondries à matrice dense, des dictyosomes en nombre considérable et surtout des citernes de réticulum endoplasmique granulaire qui deviennent plus nombreuses et plus volumineuses (Fig. 9).
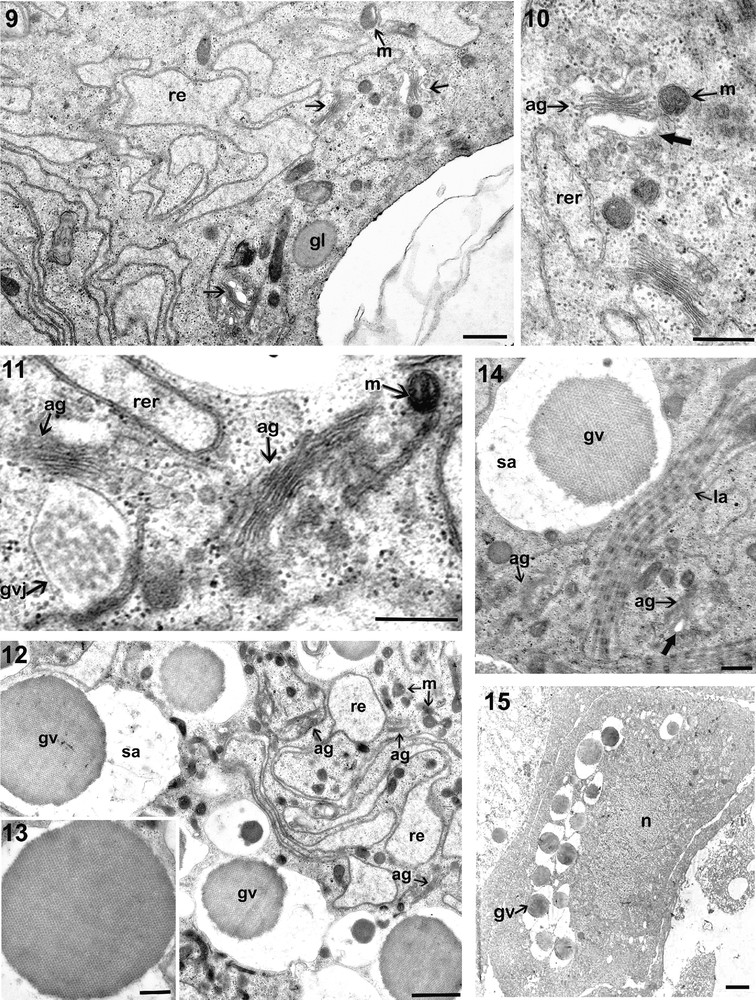
9. Portion de coupe montrant l’apparition dans le cytoplasme d’un ovocyte moyen d’un grand nombre de dictyosomes (flèches) souvent associés à des vésicules claires (Barre d’échelle = 1 μm). 10. les vésicules synthétisées par les dictyosomes sont rassemblées dans des vacuoles à contenu clair (grosse flèche) (Barre d’échelle = 1 μm). 11. Globule vitellin jeune (gvj) ou vacuole dans laquelle on distingue déjà des accumulations de réserves (Barre d’échelle = 0,5 μm). 12. Cytoplasme d’un ovocyte moyen montrant la prolifération des dictyosomes, des mitochondries, du réticulum endoplasmique et surtout des globules vitellins (Barre d’échelle = 1 μm). 13. Globule vitellin ovocytaire, sphérique, et présentant une structure cristalline (Barre d’échelle = 1 μm). 14. Portion d’un ovocyte sub-mature montrant des lamelles annelées (la) associées à des globules vitellins (gv) (Barre d’échelle = 1 μm). 15. Répartition des globules vitellins dans l’ooplasme d’un ovocyte mature (Barre = 4 μm).
Abréviations: ag : appareil de Golgi (dictyosomes) ; ca : cellules accessoires ; Cb: canal de la bourse ; cc : corps chromatoïdes ; ced : cellule en dégénérescence ; gl : gouttelette lipidique ; Go : gonopore ; gv : globule vitellin ; Gv : glandes vitellogènes ; gvj : globule vitellin jeune ; ocem : des ovocytes en cours de maturation ; la : lamelle annelée ; m : mitochondrie ; n : noyau ; ne : néoblaste ; O : œil ; Od : oviducte ; ocj : ovocytes jeunes ; og : ovogonies ; Ov : ovaire ; Ph : pharynx ; re : vésicules du réticulum endoplasmique; rer : réticulum endoplasmique rugueux; sa : substance amorphe ; T : tête ; to : tube oviductaire.
Les complexes de Golgi se trouvent parfois associés au réticulum endoplasmique rugueux et libèrent de petites vésicules moyennement denses aux électrons (Fig. 10) et fusionnent en une seule structure qui augmente de taille formant des globules vitellins jeunes (Fig. 11).
3.2.2.3 Ovocytes submatures et matures
À ce stade, l’ooplasme devient très riche en mitochondries à matrice dense (Fig. 12). Le réticulum endoplasmique agranulaire devient de plus en plus abondant. Il forme des citernes très développées, remplies d’un matériel clair. Le nombre de ribosomes ainsi que le nombre de dictyosomes augmentent.
Les jeunes globules vitellins ainsi que les vésicules issues de l’appareil de Golgi, fusionnent dans des vacuoles claires et forment des globules vitellins de taille plus grande. Le nombre des globules vitellins dans le cytoplasme augmente avec la croissance de l’ovocyte. Dans l’ovocyte mature, ces globules deviennent nombreux et acquièrent une forme régulière sphérique et une structure cristalline. Ils mesurent chacun de 5 à 6 μm de diamètre (Fig. 13).
Des lamelles annelées associées à des gouttelettes lipidiques et à des globules vitellins sont observées dans l’ooplasme périphérique (Fig. 14 et 15).
La taille maximale atteinte par l’ovocyte mûr est de l’ordre de 60 à 70 μm ; ce stade est caractérisé par un rapport nucléplasmique bas.
4 Discussion
La présente étude de l’ovogenèse réalisée sur la gonade femelle de S. mediterranea a révélé, d’une part, des modalités qui sont identiques à celles déjà observées chez d’autres espèces du même genre, et d’autre part, certains phénomènes nouveaux.
Cette étude a montré que, même si S. mediterranea soit est de type néophorien, l’ovaire présente une caractéristique apomorphe à savoir la présence de globules vitellins dans le cytoplasme ovocytaire. Le processus de formation du vitellus est identique à celui rencontré chez Dugesia (= S.) lugubris et D. benazzii [26]. En effet, l’appareil de Golgi, associé au réticulum endoplasmique, et éventuellement au matériel fibrogranulaire, est impliqué dans la formation de petites vésicules vitellines moyennement denses aux électrons. L’implication du matériel fibrogranulaire provenant du noyau au cours de l’ovogenèse n’a été observée que chez la planaire marine Sabussowïa dioica [27]. Des petits amas de matériel fibro-granulaire traversent la membrane nucléaire et s’associent avec des lamelles annelées et des vésicules nucléaires, qui perdent progressivement leurs pores en allant vers le centre de l’ooplasme. Ces formations, par la coalescence avec des substances synthétisées par les polysomes libres et le réticulum endoplasmique, participeraient à la formation des globules vitellins, entourés par une double membrane.
La présence de globules vitellins dans le cytoplasme ovocytaire est caractéristique des espèces de la famille des Dugesiidae à laquelle appartient l’espèce S. mediterranea [26,28,29]. en revanche, chez les familles des Planariidae et des Dendrocoelidae, on note l’absence de ces globules vitellins, et la présence des granules corticaux dans le cytoplasme ovocytaire [18,30]. Par ailleurs, en se basant sur des données morphologiques et caryologiques [31–33], la famille des Dugesiidae a été divisée en neuf genres dont le plus répandu est le genre Dugesia. Ce dernier a été subdivisé en trois sous-genres : Dugesia, Girardia et Schmidtea. Le sous-genre Schmidtea renferme trois espèces seulement, D.S. lugubris, D.S. polychroa et D.S. mediterranea. Mais les études phylogénétiques réalisées plus récemment [34,35] montrent que Schmidtea et Girardia doivent être considérés comme deux genres qui s’ajoutent aux autres genres de la famille des Dugesiidae. Gremigni [3], en étudiant la forme, le nombre et la taille des globules vitellins chez certaines espèces de cette famille, montre que les différences qui existent entre les trois genres Dugesia, Girardia et Schmidtea, sont en parfaite corrélation avec la classification basée sur les données morphologiques et caryologiques. En effet, chez les espèces étudiées du genre Schmidtea, les globules vitellins immatures sont de forme irrégulière ; ces globules ne deviennent réguliers qu’après maturation ; à ce moment ils prennent une structure cristalline, entourée d’une vaste vacuole renfermant une substance amorphe ; leur taille est de 4–5 μm de diamètre. En revanche, chez les espèces étudiées du genre Dugesia, les globules vitellins gardent au cours de leur maturation une forme régulière et ne présentent jamais une structure cristalline. Ils sont entourés d’une substance amorphe et peuvent atteindre une taille maximale de 7 à 8 μm. Les espèces du genre Girardia montrent dans leur cytoplasme un grand nombre de petits globules vitellins qui, à la maturité, mesurant environ 2–3 μm de diamètre sans aucune structure cristalline ; la substance amorphe est limitée à une aire périphérique autour du globule.
S. mediterranea possède des globules vitellins qui sont identiques à ceux trouvés chez les deux autres espèces sœurs S. lugubris et S. polychroa. Ces globules présentent, cependant, des similitudes avec la forme immature de ceux des espèces étudiées du genre Cura. Ce fait est certainement d’une grande importance phylogénétique car Ball [32] a considéré dans un premier temps que Schmidtea était un groupe très proche de Dugesia. Un peu plus tard, il considère que Cura et Schmidtea pourraient être les descendants d’un même ancêtre Triclade Paludicole [36]. Les résultats de la présente étude ultrastructurale de l’ovaire chez S. mediterranea associés a ceux trouvés précédemment [3,14,26], viennent confirmer la proposition donnée par Ball [36] et Sluys [35] qui considère Schmidtea un genre distinct et non pas comme un sous-genre du genre Dugesia.
Un autre point qui mérite d’être souligné est l’activité nucléaire qui se manifeste pendant le début de la croissance des ovocytes. Le noyau émet dans le cytoplasme périnucléaire des masses denses aux électrons d’une taille proche de 1,5 μm : les corps chromatoïdes. Des structures identiques aux corps denses ont été observées dans le cytoplasme des spermatocytes [37] et des néoblastes des planaires [38] et dans beaucoup d’autres cellules germinales et en cours de différenciation. Ce matériel périnucléaire dense aux électrons est connu sous le nom de « corps nucléaire » ou « corps chromatoïde ». Il a été observé pour la première fois chez les Plathelminthes par Gremigni et Sciurpa [29] au niveau du cytoplasme ovocytaire de D. dorocephala, et on a pensé alors qu’il pourrait jouer un rôle indirect dans la formation et l’accumulation du vitellus. Ce corps peut fusionner, au niveau du cytoplasme ovocytaire de certaines espèces, avec de nombreuses mitochondries formant à la périphérie de l’ovocyte ce que les auteurs appellent « corps de Balbiani » ou « vitellus nucléaire » [39]. Chez les Amphibiens [40], il est formé par l’assemblage de nombreuses mitochondries et de certaines vésicules. Chez certains Oursins [41], Mollusques [42] et certains Mammifères [43], il est constitué par l’implication des lamelles et des vésicules du réticulum endoplasmique ou de l’appareil de Golgi. Très récemment des études moléculaires ont montré que la formation de ces corps chromatoïdes dans les cellules germinales constitue un mécanisme de traitement post-transcriptionel de plusieurs types d’ARN [44]. Chez D. japonica le transcrit du gène Djnos est l’un des ARN qui constituent le corps chromatoïde des cellules souches germinales [45]. D’autres études [46] ont montré que chez S. polychroa ce corps chromatoïde présent dans les néoblastes renferme des protéines comme la Spoltud-1, qui s’exprime dans les cellules de la lignée germinale et du système nerveux central, et pendant le développement embryonnaire.
À la lumière de ces résultats et compte tenu de la bibliographie, nous confirmons l’hypothèse émise par Gremigni [28] sur l’implication du corps chromatoïde dans la synthèse du vitellus dans l’ovaire de S. mediterranea. Cette structure n’a pas été observée dans l’ovocyte mature comme dans le cas de D. dorotocephala [28].
La présence de spermatozoïdes au niveau du tube oviductaire est un phénomène répandu chez les Prosériates et les Triclades [47,48]. Certaines études [48,49] ont attribué pour ce tube un rôle de résorption des spermatozoïdes en excès. La présence de spermatozoïdes autour des ovocytes chez S. mediterranea suggère que la fécondation a lieu très probablement à l’intérieur de l’ovaire, ce qui constitue un deuxième cas original, compte tenu de ce qui se passe communément chez les Triclades. Le premier avait été signalé chez Sabussowia dioica [49,50] où l’ouverture de l’oviducte dans l’ovaire est obstruée par un massif de cellules à l’intérieur de la gonade, empêchant les gamètes mâles de pénétrer à l’intérieur de cette dernière.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Nous sommes très reconnaissants à Monsieur Vittorio Gremigni, Professeur à l’Université de Pise (Italie) et Directeur du Laboratoire de Biologie Humaine et Appliquée, qui a chaleureusement accueilli en stage l’un de nous (A. H. H.) dans son Laboratoire, et mis à sa disposition tout le matériel nécessaire et a suivi avec patience l’avancement de la gamétogenèse en microscopie électronique. Les auteurs lui sont reconnaissants pour ses conseils et ses remarques judicieuses concernant les différents aspects de ce travail. Nous remercions aussi les reviseurs anonymes de ce travail pour leurs conseils et leur patience.


