1 Introduction
Les plantes utilisent l'oxygène, via le métabolisme aérobie, pour fournir l'énergie nécessaire à leur croissance et à leur développement. Cependant, la réduction de l'oxygène par les cytochromes de la chaîne respiratoire s'accompagne inévitablement d'une production de radicaux oxygénés. En effet, lorsque cette réduction est incomplète, des molécules hautement réactives, dérivées de l'oxygène sont produites, parmi lesquelles des radicaux libres comme le radical superoxyde (), le radical perhydroxyle (), le radical hydroxyle (), le radical peroxyle () et le radical alkoxyle (), ainsi que des formes non radicales comme le peroxyde d'hydrogène (H2O2). Parallèlement, les chaînes de transfert d'électrons au niveau de l'appareil photosynthétique sont capables de produire de grandes quantités de ces formes réactives de l'oxygène (ROS : Reactive Oxygen Species).
Même si la majeure partie de l'oxygène cellulaire subit une réduction tétravalente conduisant à la production de l'eau, une partie des électrons peut s'échapper et réduire de manière monoélectronique l'oxygène, conduisant à la formation du radical . La toxicité de ce radical envers les substrats bioorganiques est directe, mais aussi indirecte, car il peut réagir avec H2O2 et ainsi donner naissance à des ou des peroxynitrites, radicaux du monoxyde d'azote (NO). Le radical a une durée de vie de l'ordre de quelques secondes, qui lui permet de diffuser au-delà de son lieu de production pour atteindre ses cibles. Il peut cependant être éliminé par une des superoxydes dismutases (MnSOD ; FeSOD ; Cu/ZnSOD), métallo-enzymes qui catalysent la dismutation du radical en H2O2. Le peroxyde d'hydrogène ainsi formé n'est pas un radical libre, car tous ses électrons sont appariés, mais c'est malgré tout un intermédiaire réduit toxique qui possède une durée de vie relativement longue (quelques minutes). Comme le radical , il possède la capacité de diffuser loin de son site de production et peut traverser les membranes en utilisant les canaux aqueux (aquaporines), grâce à sa grande similitude chimique avec H2O [1,2]. Sa concentration est régulée par des enzymes telles que l'ascorbate peroxydase (APX), la catalase (CAT) ou bien la glutathion peroxydase (GPX). H2O2 peut également être produit lors de la réduction biélectronique de l'oxygène en présence d'oxydases telles que la glycolate oxydase ou encore l'amine oxydase. La toxicité d'H2O2 est principalement liée à sa capacité à produire le radical durant les réactions de Fenton et d'Haber–Weiss. Ce radical, comme les autres ROS, est particulièrement délétère vis-à-vis de tous les constituants cellulaires (ADN, protéines, lipides...), mais sa durée de vie est de l'ordre de la microseconde.
Pour ces raisons, les ROS sont généralement considérées comme des molécules phytotoxiques. Cependant, il est aujourd'hui reconnu que leur synthèse, liée aux métabolismes respiratoire et photosynthétique, joue un rôle essentiel dans la vie et la mort de la cellule végétale. En effet, elles peuvent jouer un rôle opposé à celui de molécules délétères qu'on leur connaît bien, et agir comme molécules de la signalisation cellulaire pour mettre en place des mécanismes de défense vis-à-vis d'un stress, qu'il soit d'origine biotique ou abiotique.
2 Importance des formes réactives de l'oxygène dans la vie d'une plante
Les ROS sont depuis longtemps reconnues pour leur importance dans la réponse des plantes aux contraintes environnementales. Certains symptômes observés en situation de stress d'origine biotique ou abiotique (par exemple, blanchiment des feuilles, nécroses) sont la conséquence d'une forte accumulation de radicaux libres oxygénés et d'une altération de l'homéostasie cellulaire. Ces symptômes traduisent à la fois une oxydation de la chlorophylle au niveau des feuilles, mais aussi la mort par nécrose de cellules isolées ou de groupements de cellules dans les différents tissus végétaux (Fig. 1). Ainsi, même si les ROS sont formées au cours du métabolisme normal de la plante, l'augmentation de leur concentration intracellulaire est souvent synonyme de stress. La plupart des symptômes liés aux conditions de stress est amplifiée par l'effet des ROS. Par exemple, une forte augmentation du taux de peroxyde d'hydrogène dans les chloroplastes et les peroxysomes est observée en réponse à une exposition à de fortes intensités lumineuses [3]. Lors d'un stress hydrique ou salin, l'inhibition de la photosynthèse, et plus précisément la fuite d'électrons due à la diminution de la fixation du CO2, entraîne une forte accumulation de ROS [4]. C'est cette même inhibition de la cascade photosynthétique qui est à l'origine de la production de formes réactives de l'oxygène lorsque la plante subit des fluctuations importantes de température [5]. De nombreuses autres contraintes abiotiques s'accompagnent également d'un stress oxydatif. On observe ainsi, en présence de métaux lourds, une peroxydation lipidique due à l'accumulation des ROS, les UV entraînant la formation de radicaux superoxydes ; il en est de même pour l'ozone ou encore les stress mécaniques [4].

Feuille de chêne montrant (a) les symptômes d'oxydation de la chlorophylle et (b) les nécroses liées à la mort de cellules.
Cependant, malgré leur nature extrêmement réactive, les ROS ne sont pas uniquement impliquées dans des réponses délétères chez les végétaux.
De nombreuses études ont montré que les ROS peuvent aussi intervenir dans les cascades de signalisation responsables de l'induction et de la régulation de nombreux gènes de défenses (protéines chaperonnes, Heat Shock Proteins ; enzymes antioxydantes, ascorbate peroxydase (APX), gluthatione-S-transferase (GST) ; gènes liés à la pathogenèse (PR) ; [6–9]). Les ROS sont désormais aussi considérées comme agents régulateurs de la mort cellulaire programmée (PCD : Programmed Cell Death) chez les plantes [10,11]. Ce processus de mort cellulaire, actif et contrôlé génétiquement, se retrouve tout au long de la vie des plantes. En effet, différents types cellulaires ou organes sont éliminés, au moment approprié, au profit de l'organisme et de la population ; ils constituent des modèles de la PCD végétale. Au cours du développement, la PCD est impliquée dans de nombreux phénomènes comme la germination (couche aleurone), la différenciation des vaisseaux conducteurs de la sève brute et élaborée, la croissance (coiffe racinaire), la reproduction (tube pollinique), ou bien encore la sénescence (feuilles). Par ailleurs, les plantes ont aussi recours à cette mort contrôlée pour s'adapter et résister aux conditions adverses de leur environnement, comme durant des déficiences en alimentation minérale ou hydrique, les extrêmes de température, l'hypoxie ou encore l'attaque pathogène.
Lors de l'établissement de la réponse hypersensible (RH), une des réponses les plus étudiées entre un pathogène et une plante hôte [12–14], le développement d'une lésion nécrotique localisée autour des sites d'infection du pathogène permet à la plante d'isoler l'agent infectieux. Ce processus est initié par la production rapide et transitoire de ROS autour du site d'infection. Cette forte accumulation se déroule en deux phases distinctes. La première est commune aux interactions compatibles et incompatibles ; la seconde débute environ 6 à 12 h après le début du stress et n'est observée que lorsque l'interaction est incompatible [12]. Ce second burst oxydatif est impliqué dans la cascade de signaux nécessaire à l'induction de nombreux gènes de défense (par exemple, protéines de la pathogenèse, PR), dans la fortification des parois cellulaires (par exemple, lignification, subérisation...), et il joue sans doute aussi un rôle antimicrobien.
Après le premier burst de ROS, la biosynthèse de nombreuses hormones végétales est stimulée (acide jasmonique, éthylène...) et notamment l'acide salicylique (AS), dont l'accumulation précède la seconde production de ROS lors d'interactions incompatibles [12]. D'ailleurs, dans de nombreux cas étudiés à ce jour, l'accumulation de l'AS et des ROS est nécessaire pour l'induction de la PCD durant la réponse hypersensible.
3 Origine des formes réactives de l'oxygène durant le stress
Comme indiqué précédemment, la production de formes réactives de l'oxygène est une réponse cellulaire commune à de nombreux stress chez les végétaux qui se localise au niveau de différentes sources, selon, notamment, qu'il s'agisse d'un stress d'origine biotique ou abiotique [4,11]. Chez les animaux, les mitochondries constituent la source principale de ROS. Chez les plantes, la production de ROS par les mitochondries a été historiquement minimisée par rapport à celle des chloroplastes. Cependant, avec l'identification de l'alternative oxydase (AOX), la mitochondrie pourrait devenir un acteur important dans la régulation du stress oxydatif chez les plantes [15–17]. En effet, cette enzyme agit comme une « soupape de sécurité », contrôlant la réduction du pool d'ubiquinone, source importante de ROS [18]. Pour cette raison, la mitochondrie a été proposée comme médiateur entre les changements métaboliques, la production de ROS et l'induction de gènes. Cependant, la contribution de la mitochondrie à la production de ROS lors de la réponse au stress reste encore mal définie.
Dans la plupart des situations où les conditions environnementales sont modifiées, une forte augmentation de la production des ROS est observée au niveau des chloroplastes (Fig. 2) [4,19,20]. En effet, de nombreuses situations de stress abiotiques entraînent une inhibition de la photosynthèse et les électrons qui ne participent plus à la fixation du CO2 vont entraîner la production et l'accumulation de ROS. Durant les conditions de photoinhibition, la carboxylation du ribulose 1,5-biphosphate (RuBP) est inhibée, favorisant son oxygénation et entraînant la production de phosphoglycolate. Celui-ci est transporté vers le peroxysome où il est converti en glyoxylate par la glycolate oxydase, produisant ainsi le peroxyde d'hydrogène. Les chloroplastes et les peroxysomes sont ainsi considérés comme « sensors/capteurs » des changements environnementaux. Les ROS se comportent donc comme signaux « rédox », dérivés des chloroplastes, et sont susceptibles de réguler l'expression de gènes de la réponse et de l'adaptation au stress [21,22].
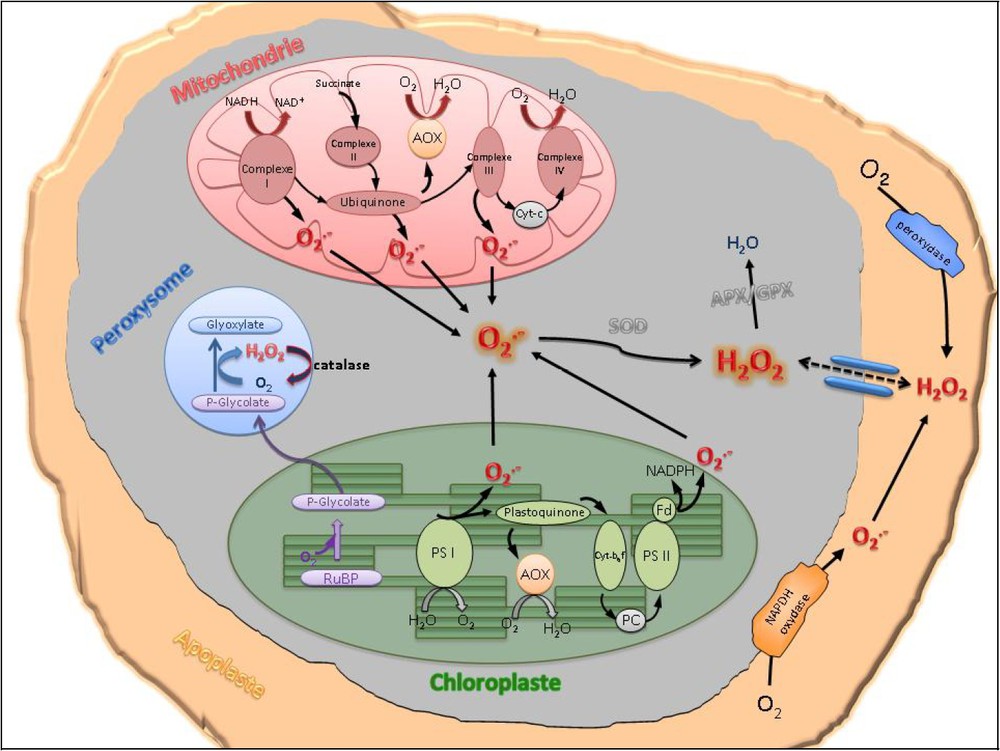
Sites de production intra-organites des formes réactives de l'oxygène (ROS) dans la cellule végétale.
Lors de la réponse à un stress d'origine biotique, la production de radicaux oxygénés est généralement attribuée à un complexe NADPH-oxydase associé à la membrane plasmique (Fig. 2) [23]. Cependant, des études récentes indiquent que, lors d'une attaque par un pathogène incompatible, la production de ROS par les chloroplastes participe activement au blocage de la progression de la maladie [21,24]. Ceci est illustré par la réponse du tabac à une agression pathogène, où deux profils différents de peroxydation des lipides sont observés selon la présence ou l'absence de lumière [24]. Toutefois, l'origine de la production de ROS ne se limite pas au chloroplaste, à la NADPH-oxydase et à la mitochondrie. La grande variété des types de stress nécessite la mobilisation de multiples mécanismes de production des ROS, parmi lesquels les amines oxydases ou les peroxydases jouent certainement un rôle important (Fig. 2) [25].
4 Rôle des formes réactives de l'oxygène dans la signalisation et la mort cellulaire programmée
Dans le règne animal, les ROS sont depuis longtemps reconnues comme des molécules de la signalisation, en particulier durant le processus de mort cellulaire [26–29]. Chez les plantes, l'hypothèse selon laquelle les ROS pourraient avoir une fonction autre que celle de simples molécules toxiques dérivées du métabolisme respiratoire et/ou photosynthétique est assez récente. Cependant, de nombreuses études ont récemment démontré que la balance entre production et détoxication des ROS peut être considérée comme essentielle pour de nombreux processus cellulaires [4,19,30–33].
La capacité signalétique des ROS a été mise en évidence lors de premières expériences démontrant la possibilité pour le peroxyde d'hydrogène (H2O2) de traverser les membranes biologiques et de modifier l'activité de la glutathion peroxydase (GPX) [34]. En effet, grâce à la présence dans les membranes cellulaires végétales d'aquaporines, capables de laisser diffuser de petites molécules non spécifiques, H2O2 peut oxyder des protéines distantes de son lieu de synthèse [35,36].
En plus de cette action directe, les ROS sont aussi impliquées dans une cascade régulant l'expression génique. En effet, la plante adapte ses réponses selon un mécanisme de régulation génique qui dépend de la concentration cellulaire en ROS [6,7,9,37–41]. Ainsi, la production systématique et régulière de ROS durant de nombreux processus métaboliques, associée à des pics de production durant des conditions environnementales défavorables, aurait permis aux cellules d'exploiter l'effet négatif des radicaux oxygénés en un système de « veille environnementale ». Dès que la concentration en ROS dépasse un certain seuil, celle-ci servirait de signal capable d'induire et de réguler l'expression de gènes de défense.
Les données scientifiques actuelles laissent supposer que cette voie de régulation pourrait jouer un rôle essentiel dans la PCD chez les plantes [9–11,24,42,43]. Ce processus hautement conservé au cours de l'évolution, participe à une multitude d'événements qui illustrent parfaitement son caractère universel au sein des différents phylums du monde vivant. Chez les végétaux, la PCD a été particulièrement bien décrite durant la réponse hypersensible qui caractérise la réponse incompatible d'une plante soumise à l'attaque d'un pathogène [44]. La PCD a aussi été observée au cours de nombreuses phases du développement végétal et dans la réponse à certains stress d'origine abiotique. Elle intervient depuis la germination [45,46] jusqu'à la sénescence [47], en passant par la formation des éléments de vaisseaux conducteurs de la sève brute et élaborée [48]. Elle est aussi rencontrée à chaque épisode de stress d'origine abiotique comme l'ozone [49], les stress thermiques (températures extrêmes) ou anaérobies (hypoxie et anoxie, [50]). Le rôle des ROS dans la PCD n'est pas limité à la phase d'exécution, mais concerne également la phase d'induction [9,11,24].
Comme chez les animaux, dès que la production de ROS dépasse la capacité antioxydante des cellules végétales, plusieurs symptômes sont observés. Cette hyperaccumulation se traduit le plus souvent par un blanchiment des feuilles lié à une oxydation de la chlorophylle [4] ou, à terme, par une mort cellulaire de type nécrotique [51]. L'orientation de la mort cellulaire vers un type nécrotique ou programmée est aussi corrélée à la concentration et à la durée d'exposition aux ROS [11,52–55].
Ainsi, les premiers résultats qui ont mis en avant le rôle essentiel des ROS dans la régulation de la PCD ont été obtenus grâce à des expériences consistant à traiter des cultures de cellules de soja avec du peroxyde d'hydrogène [34,43]. La production endogène d'H2O2 peut aussi conduire à une PCD, comme cela a été démontré sur des plants de tabac transgéniques, déficients en catalase (Cat1AS, [56]). Lorsque ces plantes, Cat1AS, sont exposées à de fortes intensités lumineuses (>500 μmol m−2 s−1), H2O2 s'accumule et entraîne la mort des cellules. Ce processus létal peut être bloqué par l'injection de cycloheximide (inhibiteur de la synthèse de protéines), d'inhibiteurs de flux ioniques ou bien encore par celle d'inhibiteurs de la phosphorylation [10]. Ainsi, la production de ROS in planta peut entraîner une PCD, et cette cascade signalétique implique non seulement la synthèse de novo de protéines mais aussi des flux d'ions [10]. Le rôle d'H2O2 dans la PCD a également été observé dans plusieurs autres modèles d'études végétaux [10,37,40,57,58]. Il faut également noter que le peroxyde d'hydrogène participe à l'initiation de la PCD lors d'infections par un pathogène incompatible (Pseudonomas syringae pv syringae) et lors d'une exposition à l'ozone [33,49,59]. L'utilisation de tabacs Cat1AS a d'ailleurs permis de démontrer que la PCD induite par une accumulation importante, mais transitoire, d'H2O2 présente la même signature en acides gras hydroxylés que celle obtenue lors de l'induction de la PCD par un éliciteur d'origine pathogène, comme la cryptogéine [24]. En revanche, lorsque les plantes sont exposées à une production continue d'H2O2, la PCD présente les mêmes caractéristiques d'oxydation lipidique que celles observées lors de « nécroses » ou d'infection pathogène en présence d'une forte intensité lumineuse [10,24]. Enfin, remarquons que H2O2 n'est pas la seule espèce réactive de l'oxygène capable de réguler l'expression génique (par exemple, et 1O2 ; [60,61]). À ce jour, cependant, peu de données existent sur la spécificité de ces autres formes réactives de l'oxygène.
5 Conclusion
Les ROS sont impliquées non seulement dans le développement de symptômes, mais aussi dans la signalisation lors de la réponse des plantes aux stress. Le rôle prépondérant des ROS dans l'initiation et l'exécution de la mort cellulaire a déjà été démontré pour de nombreux processus du développement végétal, comme la germination ou la sénescence. Cependant, les acteurs clés de l'induction de la PCD restent encore mal connus à ce jour. Le séquençage du génome de plantes modèles ainsi que les approches génomiques et protéomiques globales couplés à l'utilisation des outils de la transgénèse devraient rapidement permettre d'identifier les acteurs de l'initiation et de l'exécution de la PCD, mécanisme essentiel du développement, aussi bien chez les plantes que chez les animaux.


