Abridged English version
Mediterranean wetlands, which harbour numerous rare habitats and biological communities, constitute a remarkable natural wealth and assume a number of functions. Because of their ephemeral character and their small size, these vulnerable ecosystems decline rapidly along with the expansion of human activities (draining, agriculture, grazing, pollution…). Despite these threats, phytodynamic studies are still limited, particularly on the southern side of the Mediterranean where the situation of wetlands is extremely worrying.
Tunisia presents diversified wetlands, essentially localised in the northern part of the country. While studied in the 1950s notably by Pottier-Alapetite, temporary wetlands of Tunisia are today largely unknown, weakly investigated and their biodiversity value not yet established. Following the recent discovery of several new species for Tunisia in Mogods region (northwest Tunisia), the study of temporary wetlands has been undertaken with the aim of evaluating their present-day state, specifying the influence of human activities and better understanding their functioning. This article aims at:
- • characterising the vegetation of temporary wetlands of Mogods;
- • defining the factors controlling the composition and the distribution of these habitats;
- • and discussing their value in terms of conservation, both at the regional scale and the North African scale.
Systematic surveys have been conducted from 2007 to 2009 and phytosociological relevés have been realised in 36 sites, which were characterised by their morphology (size, shape, and water depth) and the nature of their substrate (organic, mineral). Sediment samples were taken in the central part of each site in order to achieve sedimentological analyses, pH and loss-on-ignition measurements. Two hundred and forty-four species were recorded during our botanical investigations, among which 128 species are hydrophytic and 38 are rare and endangered. The last ones include 6 new species for Tunisia: Pilularia minuta, Crassula vaillantii, Eleocharis uniglumis, Isolepis pseudosetacea, Chara braunii and Nitella opaca. Seven types of habitats were defined on physiognomical and hydrological criteria: peatlands, semi-permanent lakes, flooded fields, temporary marshes, temporary pools, wades (temporary streams) and wet meadows.
A correspondence analysis (CA) and an ascendant hierarchical classification (AHC) were performed on the abundance coefficients of the phytosociological relevés in order to evidence the relationships between hydrophytic species. These analyses allow defining five plant communities:
- • peat-forming community of Erica scoparia, Pteridium aquilinum and Osmunda regalis;
- • helophytic community of Phragmites australis, Bolboschoenus glaucus and Schoenoplectus lacustris;
- • hydrophytic community of Myriophyllum alterniflorum and Elatine alsinastrum;
- • amphibious community of Isoetes velata and Myosotis sicula (Myosotido siculae-Isoetetum velatae Pottier-Alapetite 1952);
- • and wet-meadows community of Isoetes histrix and Radiola linoides (Isoeteto histricis-Radioletum linoidis Chevassut & Quézel 1956).
Wades are not distinguished by specific communities despite the abundance of some species such as Isolepis cernua, Lythrum portula and Cotula coronopifolia.
Peat-forming community appears highly characteristic of peatlands, whereas other communities are distributed along a continuum from wetter habitats (semi-permanent lakes) to drier ones (wet meadows). Multivariate analyses point to substrate nature (organic/inorganic) and hydrology (water depth, submersion duration) as the main factors controlling the distribution and structuration of wetland plant communities in Mogods region. The substrate nature influences notably the quantity and availability of nutrients, and hydrological conditions control rhythms of germination, development, flowering and fruiting, as well as availability of nutrients and redox potential of soils. Other mesological parameters (pH, size, elevation, latitude, longitude, granulometry) appear to have negligible influences. Our data provide some insights concerning the role of ecological factors. First, the ecological range of species appears to be lower for semi-permanent habitats than for temporary ones. This could translate a selection of biodemographic strategies based on the degree of environmental stability: specialists dominate the more stable habitats and opportunists the less foreseeable ones. These elements underline a particularity of hydroseral succession, which unlike classical ecological successions, is characterised by unpredictability increasing with time and thus by the replacement of K-selected species by r-selected ones. This difference may be attributed to the fact that hydroseral succession is mainly controlled by the progressive modification of the environment and not by biotic processes. Second, the link between species richness and surface area/between-wetland distance postulated by the Theory of Island Biogeography is tested. Our data demonstrate that this link is not verified for a heterogeneous set of wetlands (considered as water islands in a terrestrial matrix): the largest environments (marshes) are also the poorest ones. Moreover, the smallest sites, although harbouring individually few species, contribute significantly to the regional biodiversity by providing a wide range of microhabitats of different ages.
These results present several implications for conservation purpose. First, they highlight the richness and diversity of wetlands of Mogods, which appears as one of the richest regions for temporary wetlands at the scales of Tunisia and of North Africa. According to our botanical surveys, Mogods harbours a high richness in hydrophytes, including a number of rare species among which some are new for Tunisia (C. vaillantii, C. braunii, E. uniglumis, I. pseudosetacea, P. minuta and N. opaca). However, several species previously recorded in the most extended wetland area (Garâa Sejenane) have not been found again: Alternanthera sessilis, Butomus umbellatus, Persicaria amphibia, Rumex tunetanus, Utricularia gibba, U. vulgaris, Myriophyllum alterniflorum, Potamogeton lucens, Exaculum pusillum, and Nymphaea alba. The 6 first species were known only from Sejenane and are now probably extinct in Tunisia. These presumed extinctions can be directly attributed to recent human activities, and more specifically to the draining and cultivation of Garâa Sejenane, covered until the 1950s by vast swamps and I. velata meadows. Most of wetland species however persisted in that area within small isolated habitats and some of them (P. minuta, C. vaillantii) even could have benefited from anthropogenic activities. At the scale of Mogods, agropastoral practices have induced fragmentation of habitats and modification of communities (flooded crops, springs, streams…) by favouring opportunist species such as C. coronopifolia and Crassula helmsii, and triggering the destruction of many sites (parcelling, dam construction…).
However, traditional practices (e.g. extensive grazing), which help maintaining open areas, are clearly compatible with conservation of high biocoenotic and specific diversities. The strongest threats for rare species and rare environments appear to be the intensification and modernisation of agropastoral practices. These threats are particularly worrisome at Garâa Sejenane, which although degraded still displays an exceptional diversity of environments and wetland species. Majen Chitane Lake is the only protected wetland of Mogods. Despite these measures, its plant communities have been significantly impoverished over the past 50 years, probably because of the cultivation of the peatland constituting the source of the water supply of the lake.
This study shows that about 30% of the hydrophytic species of Mogods are uncommon, rare or very rare, and thus threatened by human activities likely to degrade or destroy their habitat.
The current situation of wetlands in Mogods in particular and in Tunisia in general requires the urgent implementation of restoration and conservation measures. Otherwise, the growing pressure exerted by local populations on these fragile hydrophytic ecosystems will inexorably lead to their progressive degradation and disappearance on the more or less short term. Although local political authorities and territorial administrations are aware of this problem, the lack of scientific data and the complexity of legal and societal contexts (lack of specific laws and institutional frameworks, land status not well-defined, usage conventionally granted to local populations…) constitutes barriers for developing the sustainable conservation management of wetlands.
1 Introduction
Les zones humides méditerranéennes sont classées parmi les écosystèmes les plus riches de la planète [1,2] : elles hébergent en particulier de nombreux habitats et espèces rares ou menacés [3,4]. Plus de 80 % des espèces protégées inscrites dans la directive européenne 92/43/CEE dite « Directive Habitats » sont réparties autour de la Méditerranée et nombre d’entre elles sont liées aux zones humides [5]. La flore et la végétation des zones humides méditerranéennes ont fait l’objet de nombreux travaux et synthèses récents [1–3,6–13], qui ont mis en évidence leur intérêt et leur originalité, tant biogéographiques qu’écologiques. En raison de leur caractère éphémère et de leur petite taille, ces milieux fragiles et vulnérables régressent rapidement sous l’influence des activités humaines (drainage, aménagement agricole, pâturage, pollution [9,14,15]). En dépit des menaces qui pèsent sur ces écosystèmes et sur leur flore, les études phytodynamiques les concernant demeurent peu nombreuses, particulièrement au sud de la Méditerranée où leur situation est extrêmement préoccupante [13,15,16].
Bien que située sur la marge septentrionale du Sahara, la Tunisie abrite des zones humides très diversifiées, parmi lesquelles de nombreux habitats temporaires [17,18]. Ces derniers sont essentiellement concentrés dans le nord du pays : en Kroumirie, dans les Mogods, sur le Cap Bon et sur le littoral nord-est [8]. Les travaux scientifiques récents se sont surtout focalisés sur les grands écosystèmes, comme le parc national de l’Ichkeul [19,20], le lac de Bizerte [21] ou la sebkha Kelbia [22]. Les écosystèmes temporaires ont, quant à eux, été très peu étudiés, et les seuls travaux les concernant sont anciens [17,18,23–25]. Suite à la découverte récente dans les Mogods (nord-ouest de la Tunisie) de plusieurs espèces nouvelles pour la Tunisie (dont certaines très rares à l’échelle de la Méditerranée [8,26]), une étude concernant les milieux humides temporaires de cette région a été entreprise, dans le but d’évaluer leur état actuel, de préciser l’influence des activités humaines et de mieux comprendre leur fonctionnement actuel et passé [27]. Les premiers résultats obtenus permettent de réactualiser l’inventaire floristique de ces milieux et d’estimer la diversité des cortèges floristiques qui les constituent. Ces informations constituent des éléments majeurs pour évaluer le niveau de menace des différents habitats et pour proposer des mesures de conservation appropriées. Le présent article s’attache plus particulièrement :
- • à caractériser la végétation des milieux humides temporaires des Mogods ;
- • à identifier les variables environnementales qui contrôlent la distribution de ces milieux ;
- • et à discuter leur importance en termes de conservation, à la fois à l’échelle régionale, nationale, mais également à l’échelle de l’Afrique du Nord.
2 Matériels et méthodes
2.1 Zone d’étude
La région des Mogods est une région collinaire située au nord-ouest de la Tunisie (Fig. 1). Il s’agit d’une chaîne littorale de reliefs gréseux, qui constitue l’extrémité orientale de la Numidie (zone montagneuse située à cheval sur la frontière algérotunisienne). La physiographie, liée à la présence d’un substratum gréseux et de dépôts argileux, est caractérisée par une alternance de reliefs et de plaines issues d’anciens bassins lacustres [28]. Les versants sont marqués par la présence de colluvions gréseuses et sont caractérisés par des sols lessivés, acides et toujours plus ou moins hydromorphes en profondeur. Le régime hydrique des sols est très contrasté en cours d’année [29]. Les Mogods sont situés dans l’étage thermoméditerranéen [30] et comportent des formations littorales à Quercus coccifera, des formations de fond de vallon à Olea europaea et Pistacia lentiscus, des formations de versant à Quercus suber et Pistacia lentiscus, ainsi que des ripisylves à Quercus canariensis, Alnus glutinosa et Fraxinus angustifolia [28]. Le bioclimat est méditerranéen humide à hiver doux avec une petite zone à hiver tempéré sur les reliefs de Hedhil. La pluviométrie est caractérisée par une forte irrégularité interannuelle (moyenne annuelle de 800 mm), la hauteur totale annuelle restant 9 années sur 10 supérieure à 350 mm [31].
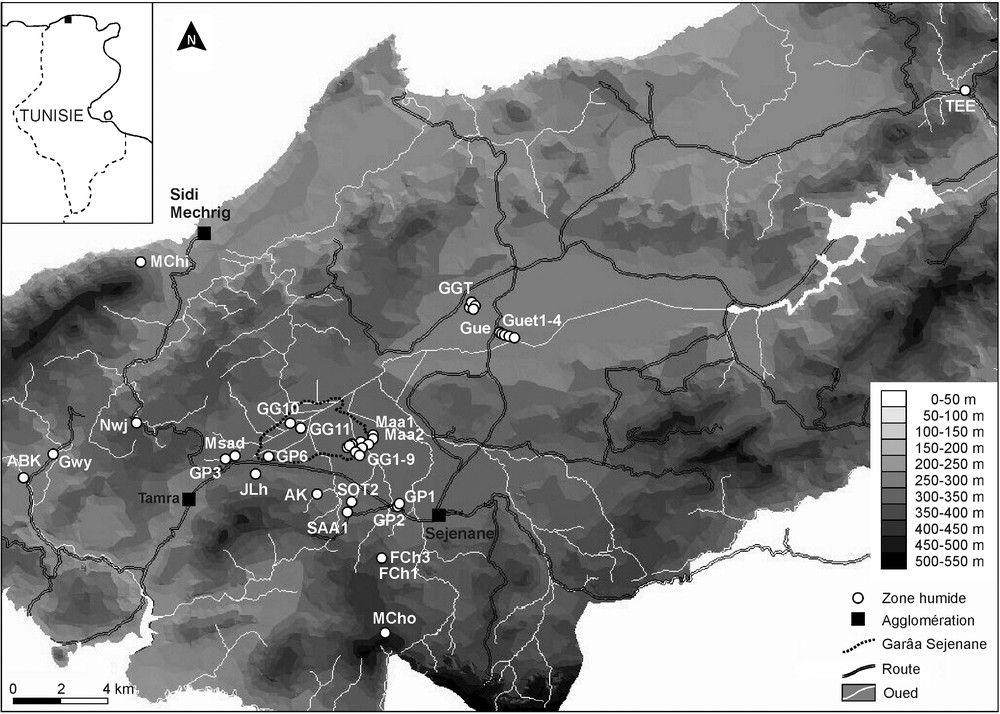
Carte de localisation des 36 sites étudiés dans la région des Mogods (Tunisie du Nord).
Location map of the 36 studied sites in Mogods region (northern Tunisia).
2.2 Étude de la végétation et du milieu
L’acquisition des données a été réalisée sur 3 années (2007–2009), durant les périodes optimales de développement de la végétation (entre mars et mai). Elle a porté sur un total de 36 milieux humides temporaires, intégrant tous les types d’habitats présents dans la zone d’étude. Pour chaque milieu, nous avons caractérisé la morphologie (superficie, forme), la profondeur maximale de l’eau et la nature du substrat (organique, minéral) (Tableau 1). Un inventaire détaillé des espèces rencontrées a été établi (Annexe S1) et la nomenclature des taxons a été révisée à l’aide de Le Floc’h et Boulos [32]. Des relevés phytosociologiques ont été réalisés sur l’ensemble des milieux humides prospectés (méthode de Braun-Blanquet [33]) en attribuant à chaque espèce un indice d’abondance-dominance allant de 1 à 5. La surface des relevés correspond généralement à la surface du milieu, excepté pour les milieux de grande taille pour lesquels une aire minimale a été calculée. Dans ce cas, les relevés ont été complétés par un inventaire exhaustif des espèces présentes sur l’ensemble du milieu humide (Annexe S1). Au centre de chaque site, un échantillon de sédiments de surface a été prélevé pour l’analyse pédologique (granulométrie, pH, carbonates et matière organique). Deux lacs semi-permanents sont présents dans la région étudiée : Majen Chitane et Majen Choucha (Fig. 1). Seul le lac de Majen Choucha (MCho) a fait l’objet de relevés phytosociologiques intéressant les communautés aquatiques et amphibies. La profondeur et la turbidité des eaux de Majen Chitane (MChi), et l’absence de ceinture externe bien définie, n’ont pas permis d’y réaliser des relevés comparables ; un seul relevé sur un ruisseau temporaire en amont du lac y a été réalisé. Cinq sites présentant différentes communautés végétales clairement individualisées ont fait l’objet de plusieurs relevés : GGT, GP6, Gue, Maa2 et MCho (Tableau 1).
Mesological parameters for the 36 studied temporary wetlands.
| Code | Site | Nature/Type | Altitude (m) | Longitude E | Latitude N | Surface du site (ha) | Argile (%) | Limon (%) | Sable (%) | Profondeur eau (cm) | pH | Carbonates (%) | Matière organique (%) |
| Alti | Long | Lati | Surf | Arg | Lim | Sab | Prof | pH | Carb | Morg | |||
| ABK | Aïn Bou Khatem | Marécage tourbeux | 92 | 09°02’40″ | 37°04’16″ | 0,002 | 4,85 | 59,41 | 35,74 | 0 | 4,5 | 5,1 | 8,8 |
| AK | Aïn el Karma | Pelouse tourbeuse | 157 | 09°10’53″ | 37°03’52″ | 0,005 | 2,60 | 46,83 | 50,57 | 0 | 4,3 | 2,9 | 8,3 |
| FCh1 | Dwahriia 1 | Mare temporaire | 300 | 09°12’46″ | 37°02’21″ | 0,004 | 18,23 | 9,43 | 72,34 | 5 | 3,8 | 4,8 | 14,1 |
| FCh3 | Dwahriia 3 | Mare temporaire | 290 | 09°12’48″ | 37°02’26″ | 0,15 | 71,29 | 24,50 | 4,21 | 0 | 3,4 | 5,0 | 7,2 |
| GG1 | Grande Garâa 1 | Culture inondable | 99 | 09°11’57″ | 37°05’11″ | 0,1 | 18,95 | 37,36 | 43,69 | 15 | 5,0 | 5,7 | 8,6 |
| GG2 | Grande Garâa 2 | Culture inondable | 100 | 09°11’55″ | 37°05’09″ | 0,02 | 10,04 | 25,16 | 64,80 | 20 | 5,2 | 4,9 | 9,3 |
| GG3 | Grande Garâa 3 | Culture inondable | 100 | 09°11’50″ | 37°04’57″ | 0,08 | 23,75 | 60,01 | 16,13 | 30 | 4,5 | 3,8 | 11,3 |
| GG4 | Grande Garâa 4 | Culture inondable | 101 | 09°12’05″ | 37°05’06″ | 0,5 | 10,73 | 74,86 | 14,41 | 0 | 5,0 | 6,4 | 4,1 |
| GG5 | Grande Garâa 5 | Culture inondable | 101 | 09°12’02″ | 37°05’03″ | 0,04 | 10,22 | 64,56 | 25,22 | 0 | 5,0 | 8,0 | 4,3 |
| GG6 | Grande Garâa 6 | Mare temporaire | 105 | 09°12’12″ | 37°04’59″ | 0,2 | 8,31 | 79,70 | 11,99 | 5 | 4,8 | 5,0 | 6,7 |
| GG7 | Grande Garâa 7 | Marais temporaire | 110 | 09°12’07″ | 37°05’17″ | 0,01 | 26,24 | 50,70 | 23,06 | 0 | 5,0 | 7,9 | 8,2 |
| GG8 | Grande Garâa 8 | Culture inondable | 100 | 09°11’59″ | 37°05’16″ | 0,006 | 10,06 | 73,85 | 16,09 | 0 | 5,5 | 6,6 | 3 |
| GG9 | Om Zitouna | Mare temporaire | 107 | 09°12’07″ | 37°04’47″ | 0,001 | 9,87 | 76,97 | 13,16 | 0 | 4,8 | 4,9 | 5,3 |
| GG10 | Grande Garâa 10 | Mare temporaire | 99 | 09°10’16″ | 37°05’29″ | 10 | 4,04 | 15,59 | 80,37 | 0 | 5,1 | 8,1 | 4,4 |
| GG11 | Grande Garâa 11 | Mare temporaire | 100 | 09°10’28″ | 37°05’24″ | 15 | 26,85 | 58,29 | 14,85 | 0 | 4,7 | 5,9 | 4,6 |
| GGT1 | Garâa Guetma 1 | Marais temporaire | 97 | 09°15’06″ | 37°07’59″ | 0,002 | 16,10 | 36,58 | 47,32 | 0 | 4,9 | 7,4 | 4,6 |
| GGT2 | Garâa Guetma 2 | Marais temporaire | 96 | 09°15’07″ | 37°07’59″ | 0,002 | 9,23 | 71,29 | 19,48 | 0 | 5,0 | 7,6 | 4,6 |
| GGT3 | Garâa Guetma 3 | Marais temporaire | 96 | 09°15’08″ | 37°08’00″ | 2 | 9,17 | 68,36 | 22,47 | 10 | 5,0 | 8,2 | 5,2 |
| GGT4 | Garâa Guetma 4 | Marais temporaire | 96 | 09°15’11″ | 37°08’01″ | 0,2 | 7,21 | 60,04 | 32,75 | 15 | 5,0 | 8,2 | 9 |
| GP1 | Piste Sidi Othmen 1 | Ruisseau temporaire | 135 | 09°13’04″ | 37°03’40″ | 0,001 | 3,40 | 44,27 | 52,33 | 0 | 5,0 | 4,5 | 6,5 |
| GP2 | Piste Sidi Othmen 2 | Ruisseau temporaire | 138 | 09°13’12″ | 37°03’43″ | 0,007 | 0,06 | 14,68 | 85,26 | 5 | 5,6 | 2,3 | 10,9 |
| GP3 | Route de Nefza | Mare temporaire | 117 | 09°08’36″ | 37°04’40″ | 0,04 | 8,96 | 70,97 | 20,07 | 25 | 5,2 | 5,7 | 2,2 |
| GP6-E | Tourbière Sejenane 1 | Marécage tourbeux | 118 | 09°09’31″ | 37°04’41″ | 0,04 | 2,45 | 40,23 | 57,32 | 5 | 4,8 | 5,8 | 19,8 |
| GP6-I | Tourbière Sejenane 2 | Pelouse tourbeuse | 114 | 09°09’31″ | 37°04’41″ | 0,04 | 7,94 | 67,09 | 24,97 | 5 | 5,0 | 5,8 | 8,3 |
| Gue-c | Guetma - centre | Mare temporaire | 98 | 09°15’59″ | 37°07’37″ | 0,04 | 2,98 | 40,44 | 56,58 | 15 | 4,8 | 8,2 | 9,1 |
| Gue-p | Guetma - périphérie | Pelouse humide | 98 | 09°15’59″ | 37°07’37″ | 0,015 | 5,47 | 57,77 | 36,76 | 0 | 5,0 | 7,2 | 8,4 |
| Guet1 | Guetma est 1 | Culture inondable | 94 | 09°16’07″ | 37°07’32″ | 0,0016 | 3,60 | 42,50 | 53,90 | 0 | 5,0 | 2,3 | 2,3 |
| Guet2 | Guetma est 2 | Pelouse humide | 93 | 09°16’14″ | 37°07’31″ | 0,002 | 11,35 | 37,08 | 51,57 | 0 | 5,4 | 1,7 | 8,5 |
| Guet3 | Guetma est 3 | Marais temporaire | 94 | 09°16’19″ | 37°07’30″ | 0,002 | 17,97 | 47,38 | 34,65 | 60 | 5,3 | 7,1 | 12,5 |
| Guet4 | Guetma est 4 | Marais temporaire | 94 | 09°16’25″ | 37°07’29″ | 0,002 | 17,14 | 42,76 | 40,10 | 10 | 5,5 | 0,7 | 12,5 |
| Gwy | El Gwayliya | Pelouse humide | 94 | 09°03’30″ | 37°04’45″ | 0,05 | 0,02 | 45,57 | 54,41 | 0 | 4,6 | 1,4 | 4,5 |
| JLh | Jbel Lahrich | Mare temporaire | 195 | 09°09’11″ | 37°04’18″ | 0,08 | 12,23 | 77,34 | 10,44 | 10 | 5,0 | 4,4 | 6,7 |
| Maa1 | Maachar1 | Mare temporaire | 103 | 09°12’27″ | 37°05’10″ | 0,15 | 4,54 | 54,73 | 40,72 | 15 | 5,0 | 1,2 | 5,3 |
| Maa2-c | Maachar 2 -Centre | Mare temporaire | 103 | 09°12’25″ | 37°05’07″ | 0,001 | 7,59 | 75,83 | 16,59 | 15 | 4,8 | 3,2 | 9 |
| Maa2-i | Maachar 2 -Interm. | Mare temporaire | 103 | 09°12’25″ | 37°05’07″ | 0,01 | 2,78 | 45,91 | 51,31 | 5 | 4,8 | 1,2 | 5,4 |
| Maa2-p | Maachar 2 -Périph. | Pelouse humide | 103 | 09°12’25″ | 37°05’07″ | 0,05 | 2,03 | 34,83 | 63,14 | 0 | 4,8 | 0,8 | 5,4 |
| MCho-c | Majen Choucha -Centre | Lac semi-permanent | 445 | 09°12’42″ | 37°00’38″ | 0,15 | 8,42 | 71,32 | 20,26 | 100 | 4,8 | 3,9 | 14,2 |
| MCho-i | Majen Choucha -Interm. | Lac semi-permanent | 445 | 09°12’43″ | 37°00’38″ | 0,3 | 4,65 | 57,26 | 38,09 | 50 | 4,5 | 3,4 | 15,5 |
| MCho-p | Majen Choucha -Périph. | Lac semi-permanent | 445 | 09°12’43″ | 37°00’38″ | 0,1 | 1,62 | 21,97 | 76,41 | 0 | 4,6 | 1,5 | 15,7 |
| MChi | Majen Chitane | Ruisseau temporaire | 166 | 09°05’53″ | 37°09’09″ | 0,01 | 0,04 | 21,44 | 78,52 | 0 | 5,5 | 0,7 | 4,3 |
| Msad | Msaddar | Pelouse humide | 120 | 09°09’00″ | 37°04’41″ | 0,015 | 4,56 | 33,28 | 62,16 | 0 | 5,2 | 1,2 | 5,4 |
| Nwj | Ragoubat Nwaja | Marécage tourbeux | 215 | 09°05’58″ | 37°05’31″ | 0,02 | 0,93 | 18,53 | 80,55 | 0 | 4,5 | 2,6 | 11,5 |
| SAA1 | Sidi Ali el Ajmi | Mare temporaire | 156 | 09°11’50″ | 37°03’41″ | 0,003 | 9,97 | 76,18 | 13,85 | 0 | 5,0 | 6,3 | 6,4 |
| SOT2 | Sidi Othmen | Ruisseau temporaire | 141 | 09°12’08″ | 37°03’43″ | 0,005 | 3,99 | 54,13 | 41,88 | 0 | 5,0 | 3,8 | 6,4 |
| TEE | Taïebet el Esm | Pelouse humide | 82 | 09°29’07″ | 37°13’10″ | 0,01 | 0,06 | 29,66 | 70,28 | 0 | 6,2 | 1,5 | 3,8 |
2.3 Analyse des données
Les 45 relevés de végétation réalisés sur les 36 zones humides étudiées, qui comprennent 138 espèces, ont fait l’objet d’une analyse factorielle des correspondances (AFC) et d’une classification hiérarchique ascendante (CHA) basée sur la distance euclidienne. Afin de focaliser l’étude sur les interactions entre espèces hydrophiles, les espèces transgressives des zones sèches adjacentes (champs agricoles, pelouses sèches à thérophytes…) et les espèces arborescentes des milieux environnants (Q. suber, P. lentiscus, Erica arborea…) ont été exclues des analyses.
3 Résultats
3.1 Flore
Un total de 244 espèces a été trouvé dans les 36 zones humides temporaires étudiées. Parmi les 128 espèces caractéristiques de ces habitats, 38 sont considérées comme peu répandues, rares et\ou très rares (Annexe S1 [8]). Ces dernières incluent 6 espèces nouvelles pour la Tunisie : Pilularia minuta, Crassula vaillantii, Eleocharis uniglumis, Isolepis pseudosetacea, Chara braunii et Nitella opaca [8,26].
3.2 Typologie des milieux humides temporaires
Sept types de milieux ont été définis sur des critères physionomiques liés au substrat, à la profondeur de l’eau et au type de végétation (Fig. 2) :
- • les milieux tourbeux (marécages et pelouses), essentiellement caractérisés par un substrat organique partiellement décomposé, et alimentés par des sources ne s’asséchant généralement pas au cours du cycle annuel [34] ;
- • les lacs semi-permanents, correspondant à des plans d’eau ne s’asséchant pas totalement en période estivale ; l’assèchement total des deux lacs semi-permanents n’est observé que les années exceptionnellement sèches [25] ;
- • les cultures inondables, essentiellement localisées dans les grandes plaines cultivées de la région de Sejenane et caractérisées par un régime hydrologique saisonnier, contrôlé par l’irrigation [18,27] ;
- • les marais temporaires, correspondant à des plans d’eau peu profonds, entièrement couverts par une végétation hélophytique et caractérisés par une alternance de phases sèches et inondées au cours du cycle annuel ; la durée de la phase inondée est généralement supérieure à celle de la phase sèche [35] ;
- • les mares temporaires, qui correspondent à des zones humides peu profondes, couvertes par une végétation herbacée n’excédant pas 20–30 cm et caractérisées par des alternances de phases sèches et inondées au cours du cycle annuel ; la durée de la phase inondée est généralement inférieure à celle de la phase sèche [36,37] ;
- • les pelouses humides, développées sur substrat minéral, en bordure de mares et de marais temporaires ou en milieu forestier et caractérisées par une végétation à dominance d’espèces thérophytiques ; le régime hydrologique est éphémère et fortement lié aux précipitations [38,39] ;
- • les ruisseaux temporaires, développés sur des sols plus ou moins riches en matière organique et généralement alimentés par des sources naturelles ; la végétation y est clairsemée et le régime hydrologique très éphémère [38].

Exemples de milieux humides de la région des Mogods (photos 1, 5 : H. Ferchichi-Ben Jamaa ; photos 2, 3, 4, 6 : S.D. Muller). 1 : marécage tourbeux à Erica scoparia, Garâa Sejenane (GP6) ; 2 : lac semi-permanent à Myriophyllum alterniflorum, Majen Choucha (MCho) ; 3 : marais temporaire à Bolboschoenus glaucus, Garâa Guetma (GGT) ; 4 : culture inondable à Nicotiana tabacum, Garâa Sejenane (GG2) ; 5 : mare temporaire à Isoetes velata, Lythrum borysthenicum et Pilularia minuta, Maachar2 (Maa2) ; 6 : ruisseau temporaire, Msaddar (Msad). Masquer
Exemples de milieux humides de la région des Mogods (photos 1, 5 : H. Ferchichi-Ben Jamaa ; photos 2, 3, 4, 6 : S.D. Muller). 1 : marécage tourbeux à Erica scoparia, Garâa Sejenane (GP6) ; 2 : lac semi-permanent à Myriophyllum alterniflorum, Majen Choucha (MCho) ; ... Lire la suite
Examples of wetlands in Mogods region (photos 1, 5: H. Ferchichi Ben Jamaa; photos 2, 3, 4, 6: S.D. Muller). 1: peaty carr with Erica scoparia, Garâa Sejenane (GP6); 2: semi-permanent lake with Myriophyllum alterniflorum, Majen Choucha (MCho); 3: temporary marsh with Bolboschoenus glaucus, Garâa Guetma (GGT); 4: flooded field with Nicotiana tabacum, Garâa Sejenane (GG2); 5: temporary pond with Isoetes velata, Lythrum borysthenicum and Pilularia minuta, Maachar2 (Maa2); 6: temporary stream, Msaddar (Msad).
3.3 Végétation des milieux humides temporaires
L’analyse factorielle des correspondances (Fig. 3) a pour but de caractériser la végétation des différents milieux définis ci-dessus, et notamment de mettre en évidence la distribution des espèces en fonction de gradients environnementaux. Cette analyse permet en effet de comparer les milieux (Fig. 3A) avec la répartition des espèces qui s’y développent (Fig. 3B). Sur la Fig. 3A, le positionnement des sites sur le plan factoriel ½ montre une opposition le long de l’axe 1 (inertie : 8,16 %) de 5 sites (ABK, AK, GP6-E, GP6-I, Nwj) correspondant aux milieux tourbeux et des 40 sites correspondant aux autres milieux humides. Ces derniers se regroupent le long de l’axe 2 (inertie : 7,53 %), qui oppose les lacs semi-permanents aux mares et aux ruisseaux temporaires. La Fig. 3B présente quant à elle la répartition des espèces hydrophiles sur l’espace défini par ces 2 mêmes axes. On retrouve l’organisation décrite sur la Fig. 3A, avec un groupe distinct isolé sur l’axe 1 et un continuum d’espèces le long de l’axe 2 allant des espèces des milieux les plus profonds (Myriophyllum alterniflorum…) aux espèces des milieux exondés (Isoetes histrix, Isoetes duriei, Ophioglossum lusitanicum…). La Fig. 3C présente les facteurs environnementaux intégrés à l’AFC en tant que variables supplémentaires. Ces facteurs sont regroupés à l’intersection des 2 axes, à l’exception de la profondeur d’eau qui est positivement corrélée à l’axe 2.
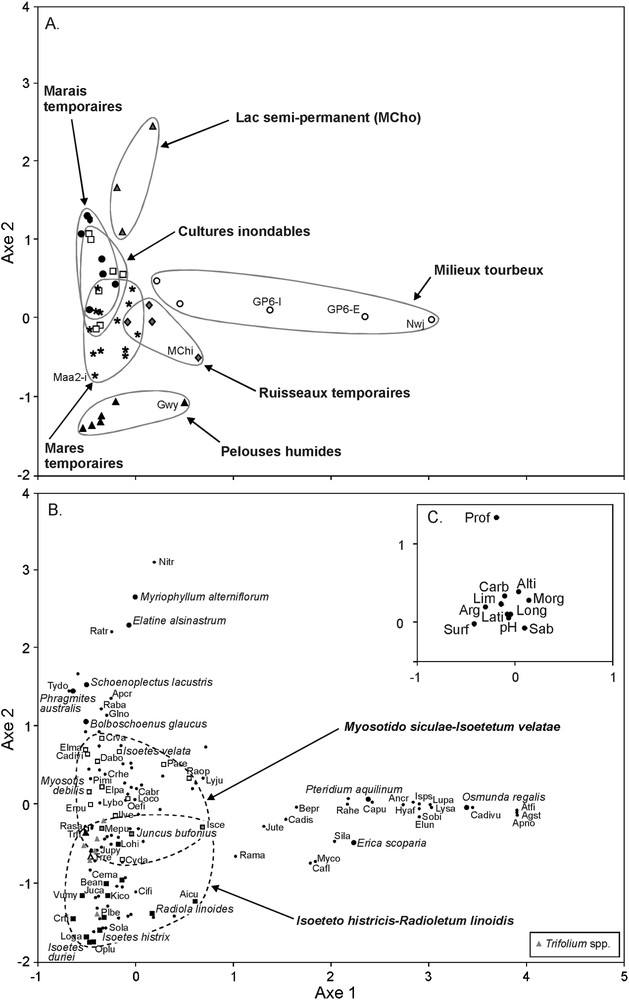
Répartition des sites (A), des espèces (B) et des facteurs environnementaux (C) selon les deux premiers axes de l’analyse factorielle des correspondances. L’analyse a été réalisée sur les indices de recouvrement des espèces. Les facteurs environnementaux ont été intégrés à l’analyse en tant que variables supplémentaires. Les axes 1 et 2 ont, respectivement, des pourcentages d’inertie de 8,16 et 7,53. La signification des abréviations des noms d’espèces et des facteurs environnementaux est donnée en Annexe S1 et dans le Tableau 1. Les lignes en tirets regroupent les espèces caractéristiques et compagnes du Myosotido siculae-Isoetetum velatae (respectivement, carrés et triangle blancs) et du Isoeteto histricis-Radioletum linoidis (respectivement, carrés et triangle noirs). Certaines espèces notées par des carrés gris sont des compagnes communes aux deux associations. Masquer
Répartition des sites (A), des espèces (B) et des facteurs environnementaux (C) selon les deux premiers axes de l’analyse factorielle des correspondances. L’analyse a été réalisée sur les indices de recouvrement des espèces. Les facteurs environnementaux ont été intégrés à ... Lire la suite
Scatterplot of the first two axes of correspondence analysis showing the distribution of study sites (A), species (B) and environmental factors (C) based on species abundances. Environmental factors were added to the dataset as supplementary variables. Inertia percentages of axes 1 and 2 are 8.16 and 7.53 respectively. The signification of abbreviated species names and environmental factors are given in Annexe S1 and Table 1. Dashed lines link characteristic and companion species of the Myosotido siculae-Isoetetum velatae (white squares and triangle) and of the Isoeteto histricis-Radioletum linoidis (black squares and triangle). Species occurring in both associations are indicated by grey squares. Masquer
Scatterplot of the first two axes of correspondence analysis showing the distribution of study sites (A), species (B) and environmental factors (C) based on species abundances. Environmental factors were added to the dataset as supplementary variables. Inertia percentages of axes ... Lire la suite
La classification hiérarchique ascendante (Fig. 4) a pour but de définir le degré d’individualisation des assemblages floristiques et de caractériser un certain nombre de communautés végétales reconnaissables sur le terrain. Elle permet de regrouper les espèces rencontrées dans les 36 zones humides étudiées en 5 communautés principales, plus ou moins bien différenciées :
- • la communauté tourbicole à Erica scoparia, Pteridium aquilinum et Osmunda regalis est dominée par des espèces ligneuses (A. glutinosa, E. scoparia, Salix pedicellata), associées à des Ptéridophytes de grande taille (Athyrium filix-femina, O. regalis, P. aquilinum), à de nombreuses Cyperaceae (Carex punctata, C. hispida, C. divulsa, E. uniglumis, E. multicaulis, I. pseudosetacea) et à diverses herbacées vivaces (Anagallis crassifolia, Bellis prostrata, Ludwigia palustris, Lythrum junceum, L. salicaria, Potamogeton polygonifolius, Solenopsis bicolor). Elle se développe sur un substrat très organique, constitué des débris végétaux partiellement décomposés et est généralement associée à des sources ou à des suintements quasi-permanents ;
- • la communauté hélophytique à Phragmites australis, Bolboschoenus glaucus et Schoenoplectus lacustris est caractéristique de grands marais où la profondeur d’eau peut atteindre 1 m. Elle se développe essentiellement dans les plaines alluviales non cultivées (Garâa Guetma et Garâa Sejenane), sur des sols argilolimoneux profonds et est caractérisée par une faible richesse spécifique, fortement dominée par de grandes herbacées rhizomateuses. Cette communauté comprend également souvent Typha domingensis, Apium crassipes, Ranunculus baudotii et Glyceria notata ;
- • la communauté hydrophytique à M. alterniflorum et Elatine alsinastrum a été observée uniquement dans la zone centrale et la ceinture intermédiaire du lac semi-permanent de Majen Choucha (Fig. 3B). Lorsque la profondeur d’eau atteint 1 m, elle est dominée par des populations flottantes et submergées à M. alterniflorum. Eleocharis palustris, E. alsinastrum et R. baudotii constituent à des profondeurs de l’ordre de 50 cm, une ceinture intermédiaire qui se transforme graduellement en une communauté amphibie dominée par Isoetes velata lorsque la profondeur de l’eau diminue encore, à la périphérie du lac ;
- • la communauté amphibie à I. velata et Myosotis sicula constitue des pelouses oligotrophes très riches en espèces thérophytiques, parmi lesquelles Eryngium pusillum, Illecebrum verticillatum, Juncus pygmaeus, Lythrum borysthenicum, L. tribracteatum, M. sicula, Oenanthe fistulosa, P. minuta, Pulicaria sicula, R. baudotii, R. sardous et R. ophioglossifolius ;
- • la communauté terrestre de pelouses humides à I. histrix et Radiola linoides constitue des pelouses mésohygrophiles se développant dans des microdépressions limonosableuses inondées de manière éphémère. Ces groupements, organisés en mosaïque, se trouvent au contact étroit des pelouses mésoxérophiles à thérophytes de niveau topographique supérieur. Outre I. histrix et R. linoides, ils comprennent généralement Centaurium pulchellum, Cicendia filiformis, Crassula tillaea, O. lusitanicum et Solenopsis laurentia.
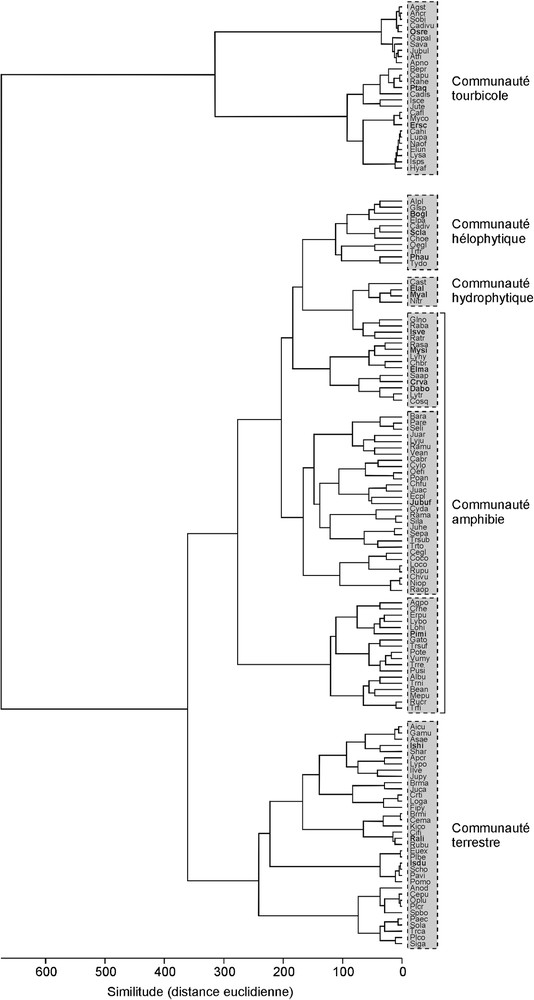
Dendrogramme obtenu par classification hiérarchique ascendante réalisée sur les relevés phytosociologiques des 36 zones humides étudiées.
La signification des abréviations des noms d’espèces est donnée en Annexe S1. Les espèces caractéristiques de chaque communauté sont notées en gras.
Dendrogram based on ascendant hierarchical classification using the phytosociological relevés of the 36 studied wetlands.
The signification of abbreviated species names is given in Annexe S1. Characteristic species of each community are noted in bold.
Une sixième communauté pourrait être considérée ici, bien qu’elle soit confondue avec le pôle le moins hydrophile de la communauté amphibie par la CHA (Fig. 4). La communauté thérophytique à Juncus bufonius, moins bien caractérisée que les communautés précédentes, apparaît intermédiaire entre la communauté amphibie des mares temporaires et la communauté terrestre de pelouses humides (Fig. 3B).
Enfin, les ruisseaux temporaires, qui présentent un régime hydrologique caractérisé par une très forte variabilité et sont souvent développés sur substrat organique, se localisent sur l’AFC en position intermédiaire entre les mares temporaires/pelouses humides et les milieux tourbeux (Fig. 3A). Leur cortège floristique, proche de celui des mares temporaires et des pelouses humides, en diffère essentiellement par l’abondance d’Isolepis cernua, Lythrum portula et Cotula coronopifolia.
4 Discussion
4.1 Communautés végétales des milieux humides temporaires des Mogods
La notion de communauté, définie par Tansley [40] comme une unité de végétation distincte, a été fortement débattue [41], notamment à propos du degré avec lequel les communautés constitueraient des entités intégrées et récurrentes, assimilables à des super-organismes [42,43] et classifiables d’un point de vue phytosociologique [33], ou seraient au contraire le résultat ‘individualistique’ d’événements stochastiques [44,45]. Dans une étude portant sur 42 zones humides du Minnesota et des Grandes Plaines, Hoagland et Collins [46] ont montré que les végétations zonées ne correspondent ni au modèle de l’unité de végétation ni à celui du continuum, mais s’organisent plutôt selon un modèle hiérarchisé (modes imbriqués). En dépit de ce débat conceptuel, la notion de communauté demeure extrêmement pratique pour décrire le couvert végétal et étudier les processus qui contrôlent sa structure, son fonctionnement et sa dynamique et aider à la mise en place de mesures de gestion conservatoire [41,47]. Les données phytosociologiques recueillies ici peuvent être utilisées pour discuter cette notion et définir le degré d’individualisation d’ensembles floristiques au sein des zones humides de la région des Mogods.
Dans notre travail, la caractérisation des communautés végétales est réalisée sur la base d’une classification hiérarchique ascendante (Fig. 4) et de la distinction préalablement faite des différents milieux. Bien que les communautés ainsi définies apparaissent comme des ensembles floristiques faiblement individualisés s’organisant le long d’un continuum lié au gradient hydrologique (Fig. 3), la Fig. 4 permet d’en discriminer cinq principales, décrites dans les résultats : tourbicole, hélophytique, hydrophytique, amphibie et terrestre. Leur signification écologique est discutée ici en relation avec les unités phytosociologiques déjà décrites pour le Maghreb :
- • la communauté tourbicole se distingue par une végétation très spécifique, organisée autour d’éléments médio-européens notamment ligneux (irradiations européennes sensu [48]) et présentant une endémique nord-africaine (B. prostrata). Cette communauté, beaucoup mieux développée en Kroumirie et en Numidie algérienne, paraît sur ces points être vicariante des groupements hygrophiles à Betula fontqueri, Salix atrocinerea et Frangula alnus du Rif marocain [49]. Le cortège floristique appauvri de cette communauté et l’abondance d’E. scoparia rend difficile son attribution à l’alliance de l’Alnion glutinosae Malcuit 1929 ou à celle de l’Osmundo regalis-Alnion glutinosae (Braun-Blanq., P. Silva & Rozeira 1956) Rivas-Mart. 1975 [50,51] ;
- • la communauté hélophytique dominée par P. australis, B. glaucus et S. lacustris peut être rattachée à la classe des Phragmiti-Magnocaricetea Klika 1941 et aux alliances du Phragmition australis Koch 1926 et du Scirpion maritimi compacti Dahl & Hadac 1941 [50]. Les cultures inondables présentent des cortèges floristiques relativement indistincts de cette communauté, bien qu’en général plus pauvres, ce qui confirme qu’elles ont été principalement développées au détriment des marais qui occupaient il y a 50 ans la majeure partie de la Garâa Sejenane [18]. Quelques espèces particulières, pour certaines plutôt liées au cortège floristique des mares temporaires, caractérisent toutefois ces milieux perturbés : des espèces très rares, récemment découvertes en Tunisie (C. vaillantii et C. braunii [8,26]), ainsi que Damasonium bourgaei et deux espèces introduites (Crassula helmsii et C. decumbens) ;
- • la communauté hydrophytique apparaît très proche de la communauté amphibie à I. velata (Fig. 4), probablement parce qu’elle ne comprend que très peu d’espèces et qu’elle n’occupe actuellement qu’un seul site (Majen Choucha). Le fait qu’elle ne soit encore présente que dans cette unique localité, protégée par un relief très accidenté qui rend difficile son accès, souligne sa grande vulnérabilité face aux perturbations d’origine anthropique. Cette communauté flottante et submergée à M. alterniflorum est clairement assimilable au Myriophylletum alterniflori Lemné 1937 em. Siss. 1943 [52], et sans doute également au Zannichellio-Myriophylletum alternifolii Gehu, Kaabeche et Gharzouli 1993 [50] ;
- • la communauté amphibie à I. velata et M. sicula a été décrite en tant qu’association (Myosotido siculae-Isoetetum velatae Pottier-Alapetite 1952 [53]), comprise dans l’alliance de l’Antinorio agrostideae-Isoetion velatae De Foucault 1988 [54]. Elatine macropoda, C. vaillantii et Damasonium bourgaei, observées ensemble dans les parties cultivées de la Garâa Sejenane (GG1, GG5 et GG8) et à la Rassauta en Algérie [55], pourraient caractériser une sous-association du Myosotido siculae-Isoetetum velatae [26,56]. L’AFC et la CHA (Fig. 3 et 4) suggèrent que cette communauté, caractérisée par une forte hétérogénéité floristique, est capable de se développer dans une large gamme de conditions hydrologiques, depuis les rives des lacs semi-permanents et des marais jusqu’aux mares temporaires et aux cultures inondables ;
- • la communauté terrestre de pelouses humides à I. histrix et R. linoides a été décrite en tant qu’association (Isoeteto histricis-Radioletum linoidis Chevassut & Quézel 1956 [53]) au sein de l’alliance de l’Ophioglosso lusitanici-Isoetion histricis De Foucault 1988 [54]. Elle apparaît subdivisée en 2 groupes, le premier correspondant à l’association typique et le second à la sous-association à I. duriei (Isoetetosum durieui Chevassut & Quézel 1956 [53]). Bien qu’I. duriei soit très rare au Maghreb, il est possible que le groupement qu’il caractérise soit un vicariant de l’alliance de l’Isoetion durieui décrite en France méditerranéenne [51].
Enfin, la communauté thérophytique à Juncus bufonius correspond vraisemblablement à l’alliance du Juncenion bufonii Philippi 1968 (= Radiolon linoidis Pietsch 1971) et à la classe des Juncetea bufonii de Foucault 1988 [54,57]. C’est une communauté d’extension souvent très limitée qui apparaît au cours de la phase d’assèchement, dans la ceinture intermédiaire des mares temporaires, et est essentiellement caractérisée par Juncus bufonius, Spergularia bocconi, associés à divers Trifolium annuels. Cette alternance de groupements de phase humide et de phase sèche au cours du cycle annuel [52], assimilable à une succession cyclique, est une caractéristique des milieux soumis à des inondations saisonnières [58].
4.2 Contrôles de la composition et de la distribution de la végétation
L’AFC (Fig. 3) sépare en premier lieu les milieux tourbeux des autres milieux, installés sur substrat minéral. La nature du substrat, qui contrôle entre autres la quantité et la disponibilité des nutriments pour les plantes, semble donc être le principal facteur responsable de la spécificité des communautés végétales des zones tourbeuses, naturellement riches en matière organique, par rapport à celles des autres milieux, beaucoup plus oligotrophes [9]. La rareté des zones tourbeuses dans les Mogods explique que les paramètres liés à la nature du substrat (pourcentages de matière organique et de sables ; Fig. 3C) ne soient pas clairement identifiés sur l’axe 1.
Le continuum mis en évidence sur l’axe 2 (Fig. 3B) révèle quant à lui le rôle de l’hydrologie (Fig. 3C) dans la composition et la structure des communautés végétales sur substrat minéral. L’importance majeure de l’hydrologie pour les communautés de plantes est bien connue, en particulier dans les milieux humides temporaires [9,13,59,60]. Le régime hydrologique contrôle les rythmes de germination, de développement, de floraison et de fructification des espèces végétales, mais il influence également d’autres facteurs parmi lesquels la disponibilité des nutriments et le potentiel d’oxydoréduction du sol [61]. Les autres paramètres mésologiques (pH, surface, altitude, latitude, longitude, granulométrie), qui se retrouvent groupés autour du point d’intersection des 2 axes (Fig. 3C), n’interviennent pas ou très peu dans la distribution de la végétation au sein des différents types de zones humides étudiées.
D’autres paramètres non intégrés dans l’analyse, comme les facteurs biotiques (compétition, stratégies biodémographiques), topographiques (superficie, pente) ou édaphiques (humidité du sol, nature du substratum) [13], pourraient jouer des rôles secondaires dans la répartition et la structuration de la végétation dans ces milieux. Les données recueillies permettent d’évaluer l’influence de certains de ces paramètres, comme le degré de spécialisation des espèces [62]. En dépit d’un biais de représentation (les milieux temporaires étant plus abondants que les milieux semi-permanents), l’indice de spécialisation des communautés (Community Specialization Index [62]) et la comparaison entre les proportions des espèces spécialistes et généralistes montrent que l’amplitude écologique des espèces est plus restreinte pour les habitats semi-permanents que pour les habitats temporaires (Fig. 5). Cette différence pourrait traduire une sélection des stratégies biodémographiques en fonction du degré de stabilité du milieu : espèces spécialistes dominantes dans les milieux les plus stables (lac, tourbières et pelouses humides) et espèces généralistes dominantes dans les milieux les moins prévisibles. Ces éléments soulignent une particularité de la succession hydrosérale [63,64], qui, contrairement aux successions écologiques classiques [42,43,47], voit le degré d’imprévisibilité du milieu augmenter avec le temps et par voie de conséquence, les stratèges r remplacer peu à peu les stratèges K [65]. Cette importante différence semble pouvoir être attribuée au fait que la succession hydrosérale est principalement contrôlée par la transformation progressive du milieu [66] et non par les processus biotiques [67].
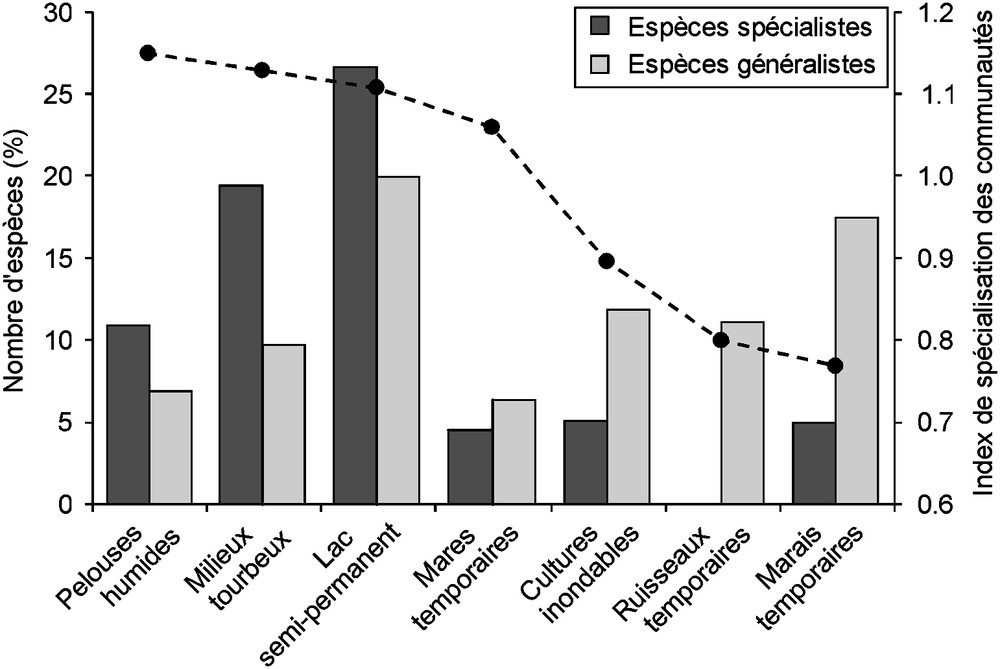
Indice de spécialisation des communautés (courbe) et pourcentages d’espèces spécialistes et généralistes (histogrammes) de chaque milieu. L’indice de spécialisation des communautés correspond à la moyenne des indices de spécialisation des espèces présentes dans le milieu [62]. Les histogrammes ne présentent que les proportions des espèces spécialistes strictes (présentes dans un seul milieu) et généralistes strictes (présentes dans les sept milieux). La ceinture externe du lac semi-permanent de Majen Choucha (MCho), qui constitue un habitat intermédiaire entre le milieu terrestre et le milieu aquatique, n’a pas été prise en compte ici. Masquer
Indice de spécialisation des communautés (courbe) et pourcentages d’espèces spécialistes et généralistes (histogrammes) de chaque milieu. L’indice de spécialisation des communautés correspond à la moyenne des indices de spécialisation des espèces présentes dans le milieu [62]. Les histogrammes ne ... Lire la suite
Community specialization index (curve) and percentages of specialist and generalist species (histogram) of each habitat. The community specialization index corresponds to the average of species specialization indexes of species present in the habitat. Histograms present only the proportions of strict specialist species (present in one habitat) and strict generalist species (present in the seven habitats). The external belt of the semi-permanent lake of Majen Choucha (MCho), representing an intermediate zone between the terrestrial and the aquatic habitats, was excluded from the dataset. Masquer
Community specialization index (curve) and percentages of specialist and generalist species (histogram) of each habitat. The community specialization index corresponds to the average of species specialization indexes of species present in the habitat. Histograms present only the proportions of strict ... Lire la suite
Deux autres paramètres peuvent être évalués de manière simple : la superficie et la distance entre zones humides. La théorie biogéographique des îles [68] prévoit que la richesse spécifique d’un milieu insulaire est fonction de sa superficie et de son éloignement des autres milieux similaires (ou du continent), qui y déterminent respectivement le taux d’extinction et le taux d’immigration des espèces. Les zones humides, en tant que milieux isolés au sein d’une matrice terrestre [59,69,70], constituent des modèles extrêmement intéressants pour tester cette théorie [71]. Nos données montrent que ni la superficie (r2 = 0,015), ni la distance (r2 = 0,000), ni l’interaction entre les deux (superficie/distance ; r2 = 0,016) n’influencent la richesse spécifique pour un ensemble hétérogène de milieux humides. Ce résultat confirme des données déjà obtenues au Maroc [13] et en Angleterre [72]. Nos résultats révèlent que les milieux les plus vastes (marais) sont également les plus pauvres, probablement en raison d’une faible diversité en microhabitats. En outre, les milieux les plus petits, bien que ne comprenant individuellement que peu d’espèces, contribuent significativement à la biodiversité régionale en offrant au contraire une large gamme de microhabitats et de milieux d’âges différents [64].
4.3 Implications pour la conservation
Les résultats présentés révèlent la richesse et la diversité des milieux humides de la région des Mogods, qui apparaît comme une des régions les plus diversifiées en zones humides temporaires à l’échelle de la Tunisie [8], et même de l’Afrique du Nord [8,13,50]. D’après nos prospections, les Mogods abritent en effet 128 hydrophytes (sensu [8,73,74]), comprenant de nombreuses espèces peu répandues, rares ou très rares (38 espèces ; Annexe S1), dont certaines ont été observées pour la première fois en Tunisie dans le cadre de cette étude (C. vaillantii, C. braunii, E. uniglumis, I. pseudosetacea, N. opaca, P. minuta [8,26]). Par contre, plusieurs espèces notées dans la Garâa Sejenane par Gauthier-Lièvre [24], Pottier-Alapetite [17,18,74] et Maire [73] n’y ont pas été retrouvées : Alternanthera sessilis, Butomus umbellatus, Persicaria amphibia, Rumex tunetanus, Utricularia gibba, U. vulgaris, Myriophyllum alterniflorum, Potamogeton lucens, Exaculum pusillum et Nymphaea alba. Parmi ces espèces, les 6 premières n’avaient été observées en Tunisie que dans la région de Sejenane et sont aujourd’hui probablement éteintes à l’échelle du pays.
Ces extinctions présumées peuvent être directement imputées aux activités humaines récentes, et plus précisément au drainage et à la mise en culture de la Garâa Sejenane [27,75], autrefois recouverte par un vaste marais à hélophytes entouré d’une large ceinture à I. velata [17,18,24]. En dépit des modifications subies par cette zone exceptionnelle, la plupart des espèces de milieux humides temporaires se sont maintenues dans de petits habitats isolés. Ces modifications semblent même avoir été favorables à la colonisation et/ou au développement de certaines espèces rares comme P. minuta et C. vaillantii. À l’échelle de la région des Mogods, les pratiques agropastorales ont entraîné un morcellement des milieux et la modification de certaines communautés (cultures inondables, sources, ruisseaux…) en favorisant notamment le développement d’espèces opportunistes comme C. coronopifolia et C. helmsii, ainsi que la destruction de nombreux sites (remembrement, construction de barrages, de retenues collinaires…). C. helmsii, déterminée pour la première fois en Tunisie lors de cette étude (2008), est une espèce envahissante originaire d’Australie, peut-être introduite dans les lots de semence de trèfle souterrain importés d’Australie dans les années 1970 [32,75] ou par le biais de l’aquariophilie (E. Le Floc’h, comm. pers.). Les pratiques traditionnelles, et en particulier le pâturage extensif qui contribue à maintenir les milieux ouverts [9,59,76,77], semblent toutefois compatibles avec le maintien d’une diversité élevée tant au niveau biocénotique que spécifique. Les menaces les plus importantes à moyen et long termes résident dans l’intensification et la modernisation des pratiques agropastorales. Ces menaces concernent non seulement les espèces rares, mais également et surtout les milieux rares comme les lacs semi-permanents et les zones tourbeuses. Les risques liés à leur destruction ou leur dégradation sont d’autant plus importants qu’elles peuvent engendrer la disparition complète du cortège floristique et des espèces rares qui leur sont spécifiques (A. crassifolia, E. alsinastrum, E. uniglumis, I. pseudosetacea, M. alterniflorum…).
Les plus fortes menaces actuelles concernant les milieux humides de la région des Mogods sont incontestablement localisées sur la Garâa Sejenane, qui bien que déjà fortement dégradée, abrite encore une très grande diversité de milieux et d’espèces [27] (Annexe S1). L’argile qui recouvre 70 % des sols de cette plaine constitue en outre la matière première d’une industrie de poteries traditionnelles [78]. La conservation des zones humides de la région de Sejenane apparaît donc également nécessaire pour le maintien à long terme de ce patrimoine culturel et populaire unique en Tunisie. L’importance des zones humides pour la poterie traditionnelle de la région des Mogods n’est toutefois qu’un aspect des services souvent mésestimés que ces milieux rendent aux populations rurales (points d’eau pour le bétail, régulation des flux hydrologiques, amélioration de la qualité des eaux, irrigation…).
Le lac de Majen Chitane est actuellement le seul site humide des Mogods à bénéficier de mesures de protection, sous la forme du statut de réserve naturelle depuis 1993 et de site Ramsar depuis 2007. En dépit de ces mesures, les communautés végétales du lac ont été considérablement modifiées et appauvries depuis 50 ans, vraisemblablement en raison de la mise en culture d’une tourbière située au-dessus du lac et constituant la source principale de son approvisionnement en eau [25,79,80]. Les modifications engendrées par les activités humaines sur les zones humides des Mogods tendent à y banaliser les cortèges floristiques, qui se retrouvent fortement dominés par des espèces tolérantes au stress (Apium nodiflorum, C. coronopifolia, C. helmsii, Cynodon dactylon) dans les zones les plus perturbées.
Les résultats obtenus montrent que près de 30 % des espèces hydrophytiques des Mogods sont peu répandues, rares ou très rares (Annexe S1), et se trouvent menacées par les activités anthropiques susceptibles de dégrader ou de détruire leur habitat. Ce chiffre correspond aux évaluations faites à l’échelle de la Tunisie (29 % [8]) et du Maroc (34 % [10]). La situation actuelle des zones humides de la Tunisie en général, et de la région des Mogods en particulier, nécessite une prise de conscience urgente et la mise en place de mesures de restauration et de conservation. Sans cela, la pression croissante exercée par les populations locales sur les fragiles écosystèmes hydrophytiques des Mogods entraînera inexorablement leur dégradation voire leur disparition à plus ou moins court terme. Bien que les autorités politiques locales et les administrations territoriales soient sensibilisées à ce problème, le manque de données scientifiques récentes et la complexité du contexte légal et sociétal (absence de cadres juridique et institutionnel spécifiques, statut foncier souvent mal défini, droit d’usage classiquement consenti aux populations locales…) constituent actuellement des barrières au développement de politiques de gestion conservatoire durable des zones humides.
5 Conclusion
Les résultats présentés dans le cadre de ce travail montrent l’existence, au sein des zones humides temporaires de la région des Mogods, de plusieurs communautés végétales, dont une est caractéristique des milieux tourbeux tandis que les autres se répartissent selon un gradient de profondeur d’eau (lié à la durée de submersion). Ils révèlent en outre les richesses spécifique et biocénotique très importantes de cette région, qui apparaît comme un « hot-spot » de biodiversité pour les zones humides, à l’échelle de la Méditerranée [8]. La situation actuelle de ces milieux très localisés apparaît extrêmement préoccupante. Un tiers des espèces hydrophytiques y est actuellement directement menacé par les activités humaines (surpâturage, drainage, agriculture, construction de barrages…).
La mise en protection et la restauration d’un certain nombre de zones humides sont nécessaires et urgentes pour assurer leur pérennité et la survie des communautés qu’elles abritent. Ces mesures de conservation doivent être basées sur plusieurs critères [9,59,81], parmi lesquels :
- • le maintien des populations d’espèces rares ;
- • celui des biocénoses rares ;
- • et le maintien du fonctionnement des métapopulations dans l’ensemble des zones humides de la région.
La Garâa Sejenane et les divers milieux humides des Mogods constituent en effet un réseau métapopulationel, impliquant une dépendance des différentes populations les unes par rapport aux autres, notamment via des échanges de semences [35]. En raison de leur dégradation et de leur destruction, les zones humides se retrouvent de plus en plus isolées et leurs communautés de plus en plus vulnérables. Cette tendance au morcellement d’origine anthropique des aires de répartition observée à l’échelle des Mogods, est également mise en évidence à l’échelle de l’Afrique du Nord [82] et de la Méditerranée [2,9].
Ce travail, qui révèle à la fois la richesse et le déclin des communautés hydrophytiques des Mogods, pose le cadre phytoécologique sur lequel pourront être développées des études fonctionnelles plus ciblées. L’étude des aspects fonctionnels impliquant par exemple la banque de semences et le régime d’inondation pour l’établissement des communautés végétales et l’étude de la variabilité interannuelle de la composition floristique des zones humides temporaires sont en effet majeures pour évaluer le risque d’extinction des espèces rares et définir les mesures de conservation appropriées. De tels travaux sont déjà menés dans d’autres régions à climat méditerranéen, comme la péninsule ibérique [83,84], le Maroc occidental [13], la France méridionale [3,76] et la Californie [85]. Il apparaît urgent d’en développer en Numidie algérotunisienne afin de préserver le patrimoine naturel exceptionnel des zones humides de cette région.
Remerciements
Nous remercions pour leur aide au laboratoire et/ou sur le terrain : L. Dezileau et son équipe (Géosciences Montpellier), F. Jamoussi et B. Moussi (Centre de Recherche des Technologies des Eaux CERTE, Technopôle Borj Cédria), M. Laaribi (UR Biogéographie, Climatologie Appliquée et Dynamique Érosive, Faculté des Lettres, des Arts et des Humanités de Manouba), A. Karem (Direction Générale des Forêts, ministère de l’Agriculture et des Ressources Hydrauliques, Tunisie), ainsi que la population locale de la plaine de Sejenane et plus spécialement celle du village de Maachar. Nous remercions également E. Le Floc’h et les lecteurs anonymes pour leurs commentaires qui ont permis d’améliorer le manuscrit. Le travail présenté a bénéficié d’un financement Egide-CMCU (PHC 07G0908) et CMPTM (08-TM 82), ainsi que d’une bourse d’alternance du ministère de l’Enseignement Supérieur, de la Recherche Scientifique et de la Technologie, Tunisie (H. Ferchichi-Ben Jamaa).
Cette publication est la contribution ISEM 2010-002.


