Abridged English version
In primates, a high level of C19 steroids, called adrenal androgens (DHEA, DHEA sulphate and androstenedione) is secreted by the adrenal cortex. These hormones characterised by a weak androgen activity are precursors of estrogens and androgens. In human and other primates, high amounts of androgens are produced by the reticularis zona according to the adrenarche process, which occurs before the gonadotrope axis maturity. In this study, the androstenedione is quantified both in plasma and adrenal gland of young, prepubertal and adult rabbits and the castration effects on adrenal cortex histology are noted too. The absolute weight (AW) of the left adrenal gland is slightly higher than the right (p > 0.05) for all animals and the gland absolute weight (AW) for the adult rabbit is superior to the young and prepubertal rabbits (p < 0.05). The castration effect in adult increases the adrenal weight (p < 0.001). A zonation of adrenal cortex for young rabbits is observed. The zona fasciculata is important for young and prepubertal rabbits whereas, the zona reticularis is thicker for the adult. Thickness of glomerulosa, fasciculata and reticularis zonas increased with 6.55% (p > 0.05), 15.9% (p < 0.01) and 79.21% (p < 0.001) for the castred adult rabbits and histological modifications were observed in the zona reticularis. The plasma androstenedione is negligible for the young (0.060 ± 0.01 ng/mL), weak for the prepubertal (0.152 ± 0.03 ng/mL) and reaches (0.263 ± 0.03 ng/mL) for adults. The androstenedione relative content (ng/100 mg of adrenal weight) is 2.90 ± 0.30; 4.54 ± 0.82 and 1.34 ± 0.36 for the young, prepubertal and adult rabbits. The adrenal androgen concentrations and their secretion profiles are different between species. It is known that these hormones increase during the prepubertal period, before the increase of testicular androgens (man, chimpanzee, hamster and rat). However, in rabbits, results show a growth of adrenal cortex from 37th day until the adult age (6 months). The androstenedione adrenal content is important for the prepubertal animals. Results complete those showed, in rabbits, a DHEA increase during sexual maturation and a development of the zona reticularis considered as the adrenal androgens zona producer. The adrenal cortex hypertrophy and the important thickness of the zona reticularis observed after 28 days of castration in rabbit are comparable to the laboratory and the sand rat (P. obesus), after one month of castration. The adrenal cortex histological modification, after castration, induced the increase of androstenedione production. We suggest that the evaluated plasma androstenedione for the adult rabbit has a testicular origin. These results corroborate those obtained after one week adult rabbit castration, whereas the DHEA and the androstenedione became undetectable. The adrenarche process clearly described for the man and as a similar process for the rat could be real for the rabbit. The prepubertal period could be an activation step of the 17-hydroxylase activity. In adults, testicular androgens would inhibit the production of androgens by the adrenal gland. In this work, an increase of the androstenedione adrenal content is observed for the prepubertal rabbits, which could intervene in the process of puberty. In the absence of testicular androgens, the zona reticularis would be stimulated to synthesize this hormone.
1 Introduction
Le cortex surrénalien des primates sécrète un taux élevé de stéroïdes en C19 : DHEA, DHEA sulfate et l’androstènedione. Ces hormones, appelées androgènes surrénaliens, ont une faible activité androgénique, mais sont considérés comme des précurseurs des estrogènes et des androgènes. Chez l’homme, peu avant la puberté, la DHEA et le SDHEA sont produites par la zone réticulée en quantité importante [1–6], ce processus représente l’adrénarche [4,7–9], il a été décrit chez l’homme et d’autres primates et se produit avant la maturité de l’axe gonadotrope.
Les androgènes surrénaliens ont été détectés dans le sang des animaux domestiques et de laboratoire à des taux faibles par rapport à ceux trouvés chez l’homme [10]. Chez le rat, la CYP17, responsable de la formation de la DHEA, est considérée comme absente dans le cortex surrénalien [11,12], cependant d’autres auteurs [13] ont observé, chez le rat prépubère, un pic d’androstènedione et un pic de mRNA codant pour la CYP17. Chez le lapin, le développement de la zone réticulée et l’augmentation de la DHEA et de l’androstènedione plasmatique ont été constatés pendant la période post-pubertaire. La castration du lapin adulte réduit la DHEA et l’androstènedione plasmatiques à des taux indétectables suggérant que ces hormones pourraient alors être d’origine testiculaire [14]. Dans ce travail, l’androstènedione est évaluée dans le plasma et la glande surrénale du lapin jeune, prépubère et adulte ainsi que les effets de la castration du lapin adulte sur l’histologie du cortex surrénalien sont rapportés.
2 Matériel et méthodes
2.1 Animaux
L’étude est réalisée sur 27 lapins mâles de populations locales provenant de l’Institut technologique des élevages (ITELV, Alger). Ils sont placés dans des salles avec des températures de 20–22 °C et sous une photopériode naturelle. Les animaux sont répartis selon leur âge en trois lots : les jeunes (lot 1, n = 7, âge : 37 jours), les prépubères (lot 2, n = 7, âge : deux mois) et les adultes (lot 3, n = 7, âge : six mois). Leur poids corporel moyen en kilogramme sont respectivement de 0,502 ± 0,152 ; 1,480 ± 0,212 et 2,436 ± 0,321.
Dans le quatrième lot de lapins adultes (n = 6, âge : six mois et de poids corporel 1,76 ± 0,085 kg), quatre lapins sont castrés par voie scrotale, sous anesthésie locale par du chlorhydrate de lidocaïne et deux lapins servent de témoins. Tous les animaux sont sacrifiés entre 9 h et 11 h du matin. Les castrés et leurs témoins sont sacrifiés 28 jours après castration.
Le sang recueilli dans des tubes à EDTA (2 %) est centrifugé, le plasma récupéré est congelé à −20 °C pour les dosages hormonaux. Les glandes surrénales droites sont prélevées rapidement et congelées, elles sont broyées dans du tampon phosphate pH = 7,4 avant les dosages hormonaux.
2.2 Dosages de l’androstènedione
La concentration plasmatique et le contenu surrénalien en androstènedione sont évalués par la méthode radio immunoassay (RIA) sur kit Immunotech.
2.3 Histologie
Les glandes surrénales gauches sont fixées dans le Bouin Hollande, les coupes de paraffine de 5 μm d’épaisseur sont colorées par le trichrome de Masson et observées au microscope photonique Zeiss dont un oculaire est gradué.
2.4 Analyse statistique
Les poids surrénaliens et l’androstènedione mesurée sont présentés sous forme de moyennes arithmétique ± ESM. La validité statistique des différences entre les moyennes est évaluée d’après le test (t) de Fisher-Student, la signification est considérée à p < 0,05.
3 Résultats
3.1 Poids absolu (PA) de la glande surrénale
Les PA des glandes surrénales gauches (Fig. 1) sont légèrement plus élevés que ceux des surrénales droites (p > 0,05) chez tous les lapins étudiés. Le PA de la glande du lapin adulte est supérieur à celui de la glande du lapin jeune et prépubère (p < 0,05). La castration chez l’adulte entraîne une augmentation significative (p < 0,001) du poids de la glande surrénale (Fig. 2).
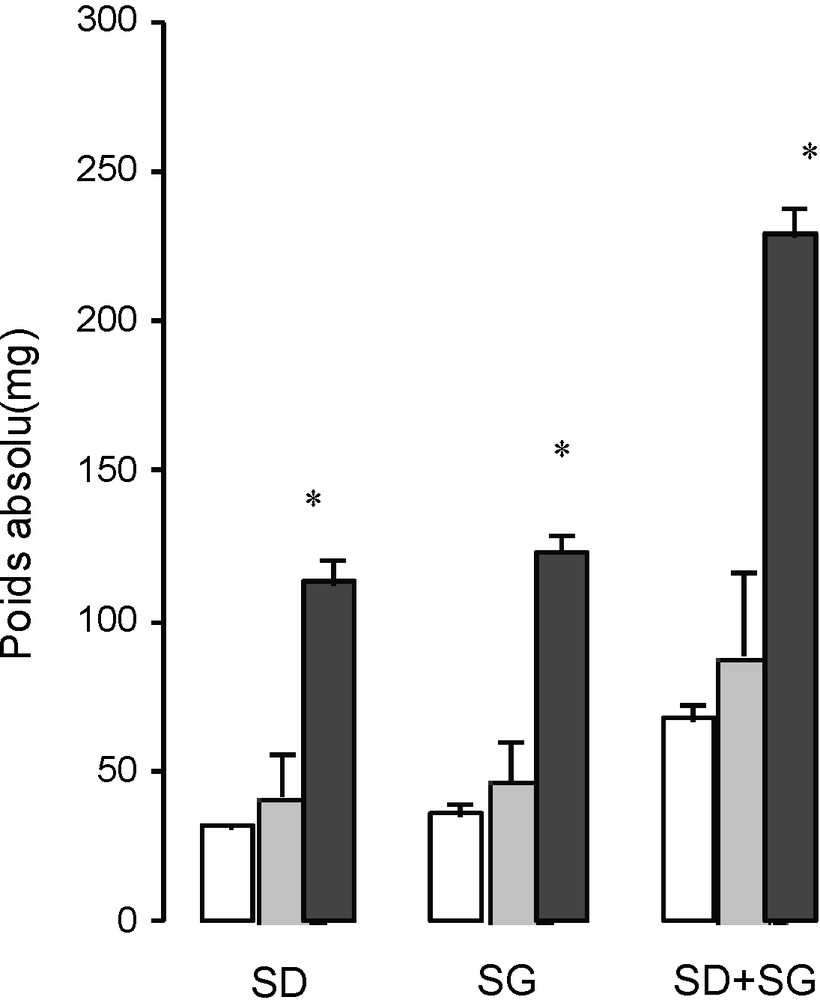
Poids absolu des surrénales droite (SD), gauche (SG) et droite + gauche (2S) chez les lapins mâles âgés de 37 jours (□), 60 jours () et six mois (), * P < 0,05.
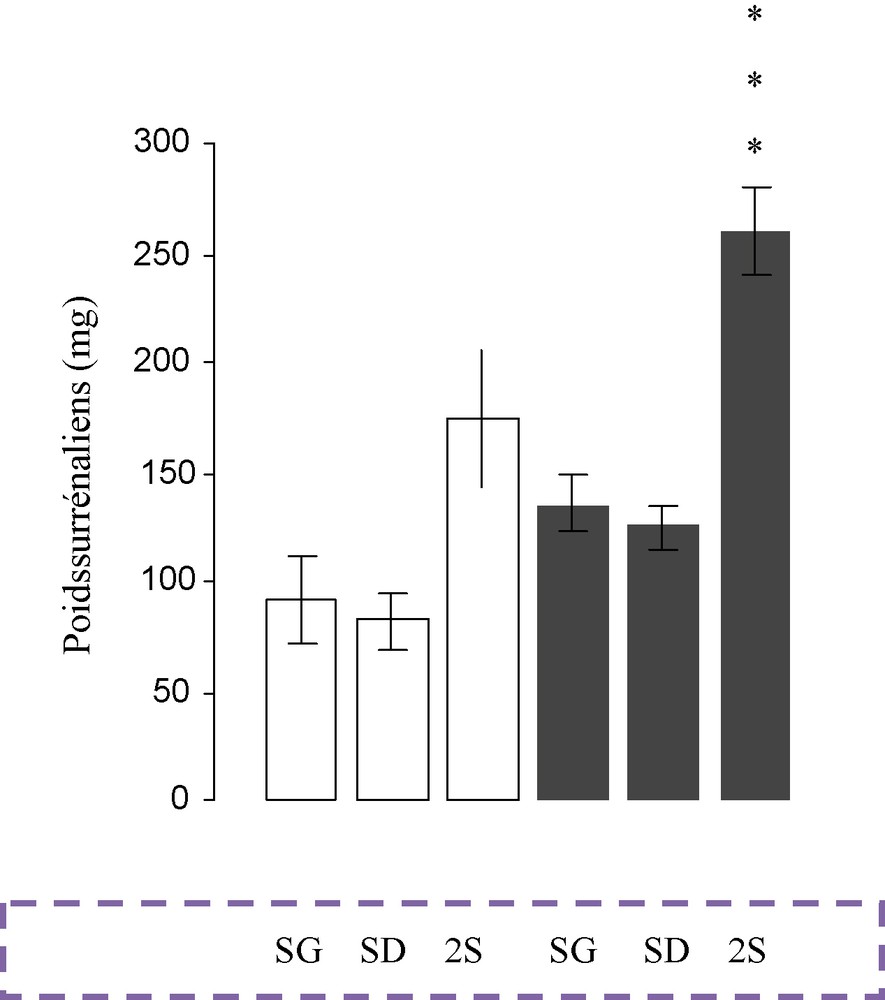
Poids absolu (mg) des surrénales gauches (SG), surrénales droites (SD) et des deux surrénales (SD + SG) chez les lapins mâles adultes témoins (□) et castrés (), *** P < 0,001.
3.2 Morphologie de la glande surrénale
Les hauteurs des zones du cortex surrénalien sont exprimées en pourcentage par rapport à la hauteur totale du cortex surrénalien (Fig. 3). Les résultats montrent que la zonation du cortex surrénalien est très nette chez les jeunes. La zone fasciculée est particulièrement développée chez le jeune et le prépubère alors que la zone réticulée est plus épaisse chez l’adulte.
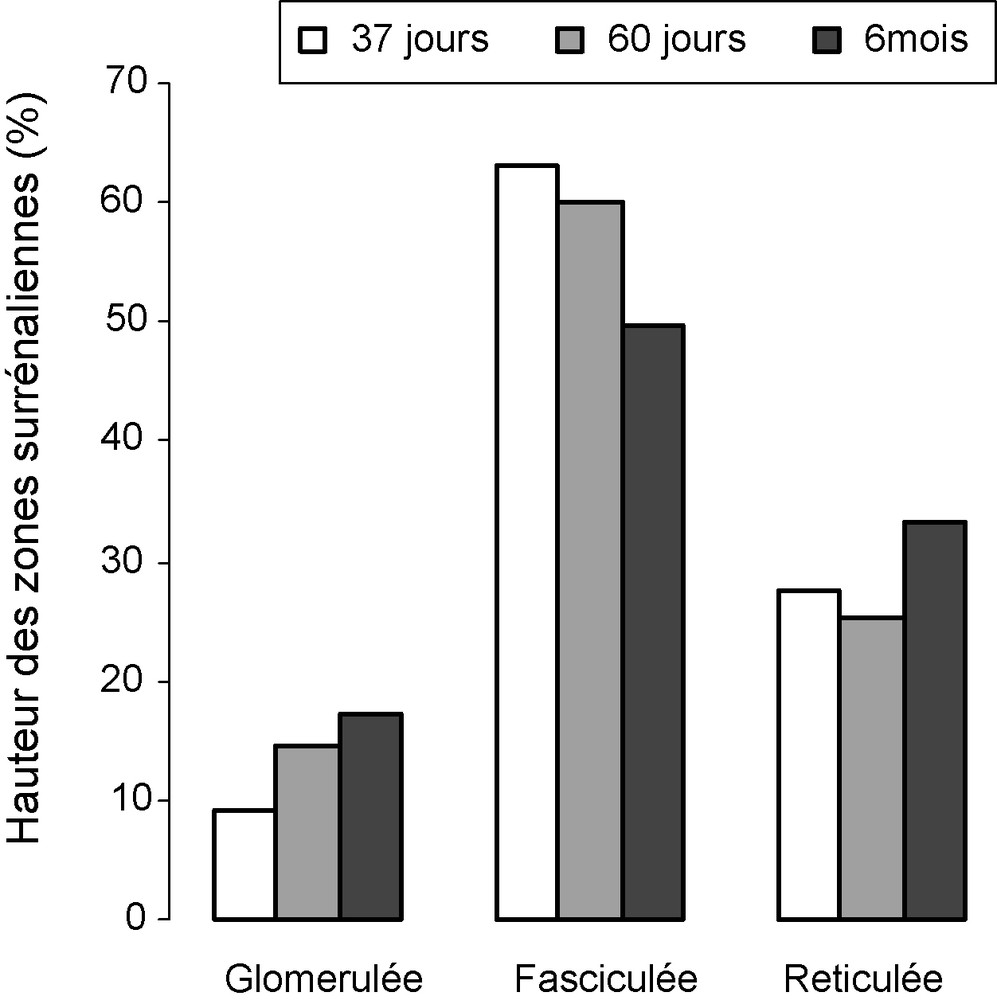
Hauteurs (%) des zones glomérulée, fasciculée et réticulée chez les lapins mâles de 37 jours, 60 jours et six mois.
Chez le lapin adulte castré, les hauteurs des zones glomérulée, fasciculée et réticulée augmentent respectivement de 6,55 % (p > 0,05), 15,9 % (p < 0,01) et 79,21 % (p < 0,001) (Fig. 4). La zone réticulée montre des modifications histologiques chez le lapin castré (Fig. 5) par rapport au témoin (Fig. 6). Le nombre de cellules dans cette zone est plus important, le cytoplasme est clair et les noyaux plus volumineux avec une chromatine claire.
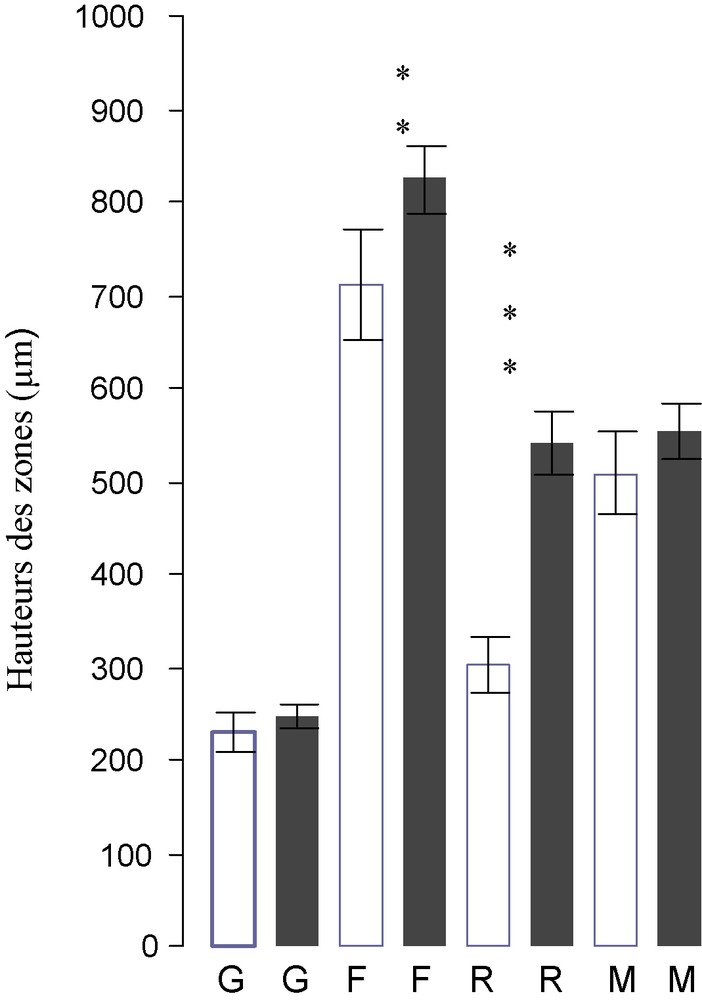
Hauteurs (μm) de la zone glomérulée (G), zone fasciculée (F) zone réticulée (R) et la médulla (M) des lapins mâles adultes témoins (□) castrés (), ** P < 0,01, *** P < 0,001.
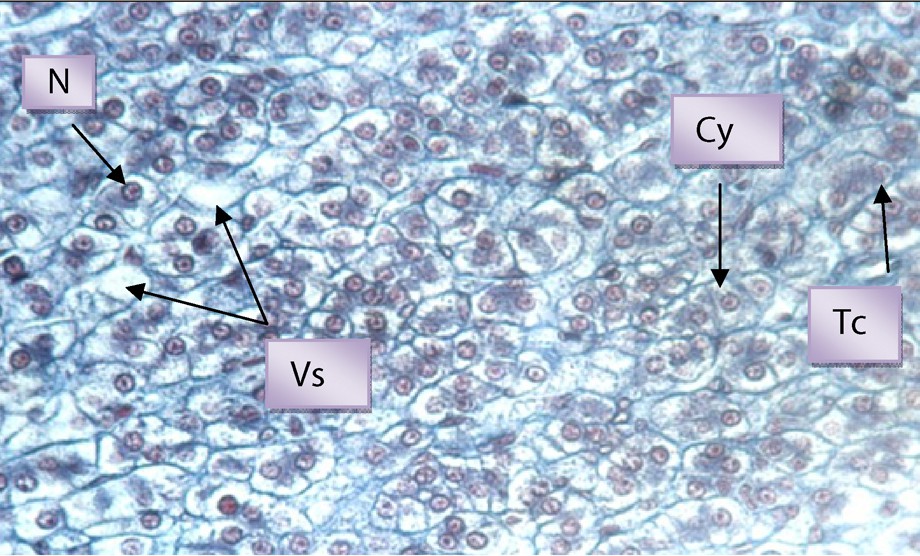
Zone réticulée de la glande surrénale du lapin mâle castré, N : noyau, Cy : cytoplasme, Tc : travée conjonctive, Vs : vaisseau sanguin, G × 400.

Zone réticulée de la glande surrénale du lapin mâle adulte témoin, N : noyau, Cy : cytoplasme, Tc : travée conjonctive, Vs : vaisseau sanguin, G × 400.
La teneur plasmatique en androstènedione (Fig. 7) est pratiquement négligeable (0,060 ± 0,01 ng/mL) chez le jeune, faible chez le prépubère (0,152 ± 0,03 ng/mL) et atteint (0,263 ± 0,03 ng/mL) chez l’adulte.

Androstènedionémie (ng/ml) chez les lapins mâles de 37 jours, 60 jours et six mois.
Le contenu moyen en androstènedione relatif à 100 mg de poids surrénalien (Fig. 8) est de 2,90 ± 0,30 ng ; 4,54 ± 0,82 ng et 1,34 ± 0,36 ng respectivement chez le lapin jeune, prépubère et adulte. Chez le prépubère, la valeur est respectivement de 1,5 et trois fois supérieure à celle du jeune et de l’adulte.
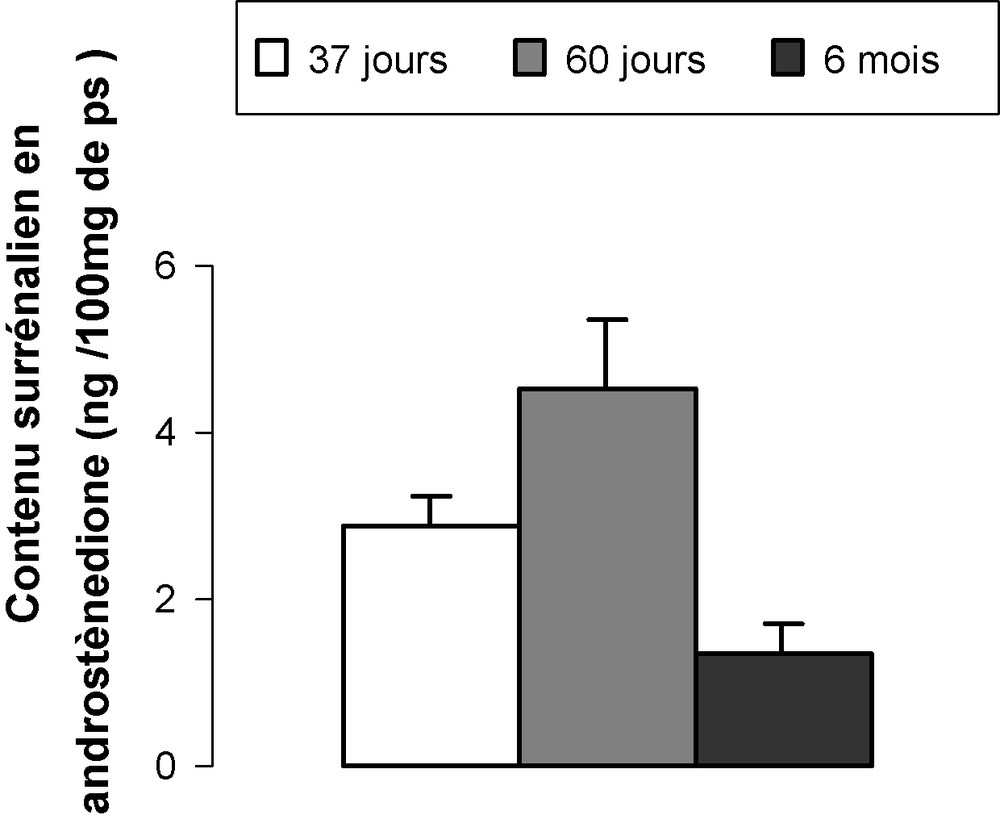
Contenu surrénalien en androstènedione (ng/100 mg de poids surrénalien) chez les lapins mâles de 37 jours, 60 jours et six mois.
4 Discussion
La concentration des androgènes surrénaliens et leurs profils de sécrétion sont différents d’une espèce à une autre. Chez l’homme, la DHEA et le SDHEA sont produites en grande quantité [15] comparativement aux animaux de laboratoire et domestique [10,13,16,17]. Ces hormones subissent une nette augmentation pendant la période prépubertaire, avant l’augmentation des androgènes testiculaires comme c’est le cas chez l’homme [15], le chimpanzé [10], le hamster [17] et le rat [13]. Chez le lapin, les résultats obtenus montrent une croissance du cortex surrénalien durant le passage de l’âge de 37 jours à l’âge adulte (six mois) avec un contenu surrénalien en androstènedione plus important chez l’animal prépubère que le jeune et l’adulte. Les résultats complètent ceux de [10] qui montrent une augmentation de la DHEA pendant la maturation sexuelle chez le lapin ainsi que le développement de la zone réticulée [14] considérée comme étant la zone productrice des androgènes surrénaliens. Ces hormones sont produites in vitro après stimulation des cellules surrénaliennes de lapin par l’ACTH [18]. L’hypertrophie du cortex surrénalien avec une augmentation de la hauteur de la zone réticulée observée chez le lapin castré depuis 28 jours est comparable à celle observée chez le rat de laboratoire [19], le rat des sables (P. obesus) [20,21] et chez les Mérions sahariens [22,23], après castration. L’aspect clair du cytoplasme des cellules de la zone réticulée des lapins castrés est expliqué par la présence de lipides dans le cytoplasme de ces cellules, qui sont mis en évidence par la coloration au noir Soudan B [20,21]. Ces lipides sont la source nécessaire à la synthèse des androgènes. L’augmentation de la production de l’androstènedione est en effet constaté après castration [19,20]. In vivo, la concentration plasmatique en androstènedione est significativement importante chez le lapin adulte par rapport au jeune et au prépubère. Il a été suggéré que chez l’adulte, l’androstènedione évaluée au niveau plasmatique est d’origine testiculaire. Ces résultats sont en accord à ceux obtenus après castration d’une semaine du lapin adulte alors que la DHEA et l’androstènedione deviennent indétectables [14]. Le processus d’adrénarche décrit clairement chez l’homme [5,8,9] et le phénomène semblable connu chez le rat [13] peut être aussi une réalité chez le lapin. En effet, la période prépubertaire pourrait être une période d’activation de l’activité de la 17-hydroxylase. Chez l’adulte, les androgènes testiculaires inhiberaient la production des androgènes au niveau de la glande surrénale.
En conclusion, cette étude montre que le contenu surrénalien en androstènedione augmente chez le lapin prépubère, cette hormone pourrait intervenir au cours de la puberté. En absence des androgènes testiculaires, la zone réticulée serait stimulée pour la synthèse de cette hormone.


