Abridged English version
The vascular wilt of the date palm (Phoenix dactylifera L.), locally known as Bayoud disease, is caused by a soil fungus: Fusarium oxysporum f. sp. albedinis (Killian and Maire) Gordon. This forma specialis has been reported to produce, in vitro, fusaric, succinic, 3-phenyl lactic acids and toxins of a peptidic nature. The analysis of these metabolites was carried out mainly using high performance liquid chromatography (HPLC) and thin layer chromatography (TLC). However, very few studies used gas chromatography coupled with mass spectrometry (GC-MS).
In the present work, we performed GC-MS isolation and identification of phenylacetic acid contained in the culture filtrates of two strains of F. oxysporum f. sp. albedinis. To our knowledge, phenylacetic acid has never been reported in this formae specialis.
Three formae speciales of F. oxysporum (F.o.albedinis, F.o.cubense, F.o.lycopersici) were cultivated in a liquid Czapek-Glucose medium. Stationary cultures were kept at 28 °C in the dark. After seven, ten and twenty two days, fungal cultures were passed through Whatman n°1 filter paper to remove the mycelium which is dried at 60 °C before weighing. Culture filtrates pH is noted. The extracellular secondary metabolites were extracted with 70 ml ethyl acetate. The organic phase was evaporated to dryness. The residue was dissolved in 200 μl of methanol, filtered through a 0.45 μm filter. A quantity of 5 μL of the solutions was injected.
The analysis of methanol extracts by GC-MS of the formae speciales of F. oxysporum was performed using a gas chromatograph Hewlett Packard 6890 coupled to a mass spectrometer electron impact HP5973 type. The identification of compounds was done by comparing the mass spectra we obtained with those of the NIST98 library (National Institute of Standards and Technology).
Chromatograms of methanol extracts of fungal strains showed several peaks, one of them corresponds to a phenolic compound, identified as Phenylacetic acid (PAA) or benzeneacetic acid. The retention time of PAA (C8H8O2), is 13.24 min. In our experimental conditions, we could note that this compound is only produced 22 days after inoculation of the medium by F.o.a. It is strictly absent in F.o.c. and F.o.l. extracts.
PAA is a secondary metabolite derived from the phenylalanine which is the precursor of indole acetic acid (IAA) and salicylic acid. We can assume that the phenylacetic acid produced by the fungus modifies the endogenous level of free IAA and/or salicylic acid in the diseased plant, which reduced its defence mechanisms. Phenylacetic acid is also known to be involved in defence mechanisms against competitive microorganisms.
1 Introduction
Le palmier dattier (Phoenix dactylifera L.) constitue l’élément essentiel des écosystèmes sahariens des pays phoenicicoles. Cependant, sa culture est menacée par plusieurs ravageurs et maladies telles que la fusariose vasculaire appelée localement Bayoud et incontestablement la plus destructrice et la plus menaçante pour les pays du Maghreb où elle sévit. Elle a détruit de nombreuses palmeraies marocaines, une partie des palmeraies du sud-ouest algérien [1] et a été signalée en Mauritanie [2].
La fusariose vasculaire du palmier dattier est causée par un champignon tellurique, Deutéromycète, Fusarium oxysporum f. sp. albedinis (F.o.a.). Il pénètre par les racines, atteint les vaisseaux, puis se propage dans toute la plante jusqu’au bourgeon terminal provoquant ainsi la mort des individus.
Au cours de leur développement dans les tissus de leurs hôtes respectifs, ou sur milieux de culture, les champignons produisent un très grand nombre de métabolites de nature et de structures variées, volatils ou non [3]. Les composés volatils et thermiquement stables produits par les champignons sont généralement analysés par chromatographie en phase gazeuse (CG) couplée à la spectrométrie de masse (SM) [4] ; ils sont utilisés aussi bien pour la chimiotaxonomie des champignons [5] que pour la détection de toxines [6].
F.o.a. sécrète, en milieu de culture, des enzymes hydrolytiques, cellulases et pectinases, [7] et plusieurs toxines telles que l’acide fusarique (dont le rôle dans la pathogenèse a été précisé [8]), les acides succinique, 3-phényle lactique et leurs dérivés [9] et des toxines de nature peptidique [10] ; ces résultats ont été obtenus par chromatographie liquide à haute performance (CLHP), par électrophorèse et par chromatographie sur couche mince (CCM). Cependant, très peu d’études ont fait appel à la CG couplée à la spectrométrie de masse (CG-SM).
Dans le présent travail, nous avons réalisé l’analyse par CG-SM d’extraits de filtrat de cultures de souches de plusieurs formae speciales de F. oxysporum. Nous avons pu mettre en évidence la présence d’acide phénylacétique (APA) dans les filtrats de culture du F.o.a, agent du Bayoud.
2 Matériel et méthodes
2.1 Les souches fongiques
Nous avons travaillé sur 4 souches de F. oxysporum : deux sont des souches de F. oxysporum f. sp. albedinis (Gh1 et NRRL 38298) et les deux autres sont : une souche de F. oxysporum f. sp. cubense (NRRL 26022) et une souche de F. oxysporum f. sp. lycopersici (NRRL 38554) (Tableau 1).
Origine des souches fongiques utilisées.
| Souches | NRRL | Taxonomie | Hôte/substrat | Origine géographique |
| F.o.a Gh1 | – | F. o. f. sp. albedinis | Phoenix dactylifera L. | Ghardaia -Algérie |
| F.o.a ref | 38298 | F. o. f. sp. albedinis | Phoenix dactylifera L. | Algérie |
| F.o.c. | 26022 | F. o. cubense | Bananier Musa ABB ‘Pisang awak‘ |
Thaïlande |
| F.o.l. | 38554 | F. o. f. sp. lycopersici | Solanum esculentum | Israël |
Les souches NRRL nous ont été fournies par le « Northern Region Research Laboratory » de l’United States Department of Agriculture (USDA), la souche Gh1 a été isolée d’un palmier mâle bayoudé et mise à notre disposition par la station régionale (Ghardaïa) de l’Institut National de la Protection des Végétaux (INPV) (Algérie).
2.2 Culture du champignon
Les souches sont ensemencées sur milieu gélosé PDA (Potato Dextrose Agar : 250 g de pomme de terre, 20 g de glucose et 20 g d’Agar) en boites de Petri et incubées pendant 5 jours à 28 °C.
2.3 Production de métabolites secondaires
La production de métabolites secondaires est réalisée sur milieu liquide Czapek-Glucose (CZ-Glu), constitué du Czapek-Dox (Tom et Raper, 1945), de glucose (D (+)-glucose anhydre, rectapur, Prolabo, France) et d’extrait de levure (Cultimed, Panreac, CEE, professional use). Ce milieu favorise la production de métabolites fongiques [11] ; il contient (g/l) : 3 g de NaNO3 ; 1 g de K2 HPO4 ; 0,5 g de MgSO4, 7 H2O ; 0,01 g de FeSO4, 7 H2O ; 2 g d’extrait de levure, 30 g de saccharose comme première source de carbone et 8 g de glucose comme deuxième source de carbone. L’inoculation est réalisée en introduisant dans des flacons de 250 ml contenant chacun 20 ml du milieu CZ-Glu liquide, un disque de PDA de 15 mm de diamètre portant une culture de chacune des souches âgée de 5 jours. L’incubation se fait à l’obscurité à 28 °C pendant 7, 10 et 22 jours. Une filtration, à l’aide d’un papier Whatman no 1, est réalisée pour récupérer le surnageant qui constitue le filtrat de culture dont le pH est noté. Le mycélium est récupéré, séché à 60 °C, puis pesé (poids sec).
Pour chacune des souches, trois flacons sont utilisés et trois répétitions sont réalisées.
2.4 Extraction des métabolites secondaires
Elle se fait par mélange du filtrat de culture avec 70 ml d’acétate d’éthyle. La phase organique est récupérée et évaporée sous vide. L’extrait sec est suspendu à nouveau dans 200 μl de méthanol, après filtration à l’aide d’une seringue munie d’un filtre Poly-Tri-Fluoro-Éthylène (PTFE) de 3 mm de diamètre et 0,45 μm de porosité.
2.5 Analyse par CG-SM
L’analyse par CG-SM est effectuée sur un chromatographe HEWLETT PACKARD 6890, couplé à un spectromètre de masse à impact électronique de type HP 5973. Le chromatographe est équipé d’une colonne capillaire HP5MS (30 m × 0,25 mm × 0,25 μm). Le gaz vecteur est l’hélium de débit 1 ml/min. Les températures de l’injecteur et du détecteur sont respectivement de 250 et 270 °C. La colonne est programmée aux températures suivantes : 60 °C pendant 2 min, à raison de 6 °C/min jusqu’à 270 °C, pendant 5 min. Le volume de la solution injectée est de 5 μl en mode split (1/50). La température de l’interface est de 280 °C et celle de la source est de 230 °C. Les spectres de masse sont enregistrés par un détecteur de type quadripôle (150 °C) ; l’ionisation est réalisée sur un potentiel de 70 eV.
Les composés sont détectés selon leur ordre d’élution, ils sont identifiés grâce à leur spectre de masse et leur temps de rétention. Ceci est réalisée grâce à l’ensemble chromatographe en phase gazeuse-spectromètre de masse, couplé à un système informatique gérant une bibliothèque de spectres de masse : NIST98 (National Institute of Standards and Technology).
Le traitement des données est réalisé à l’aide du logiciel origin 6.0 (Data Analysis and Technical Graphics).
3 Résultats et discussions
Les chromatogrammes des extraits secs dans le méthanol des filtrats de culture des différentes souches de F. oxysporum âgées de 22j, montrent plusieurs pics (Fig. 1) correspondant chacun à un métabolite volatil. Au total, nous avons pu identifier 16 sur 28 composés détectés pour Gh1, 16 sur 29 pour NRRL 38298,7 sur 14 pour F.o.c et 26 sur 50 métabolites pour F.o.l, dont certains sont communs à toutes les souches. Le poids sec du mycélium des différentes souches étudiées augment en fonction du temps, ils varient de 0,11à 0,2 g alors que le pH du filtrat de culture varie entre 5 et 6.
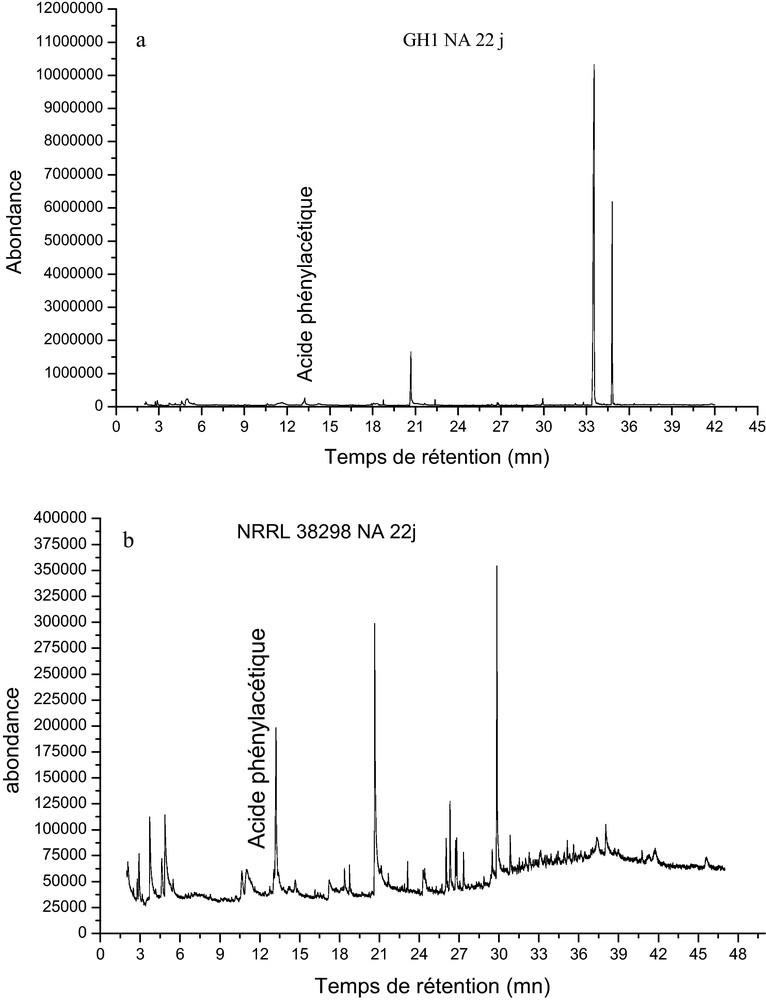

Chromatogrammes des extraits méthanolique des formae specialis de Fusarium oxysporum cultivé sur milieu liquide Czapek-Glucose. (a) et (b) Fusarium oxysporum f. sp. albedinis, (c) Fusarium oxysporum f. sp. cubense, (d) Fusarium oxysporum f. sp. lycopersici NA : milieu Non Agité.
L’étude des spectres de masse des composés mis en évidence montre que l’extrait de culture de F.o.a. renferme un métabolite phénolique en C6-C2 ; la comparaison de son spectre de masse à celui de la bibliothèque Nist 98 (Fig. 2), a permis de l’identifier comme étant l’APA ou acide benzène acétique. L’analyse des spectres indique un rapport masse/charge (m/z) de 91 (100 %), 136 (40 %), 28 (15 %) et 65 (10 %). Le temps de rétention de l’APA est de 13,24 min, sa formule chimique est C8H8O2.
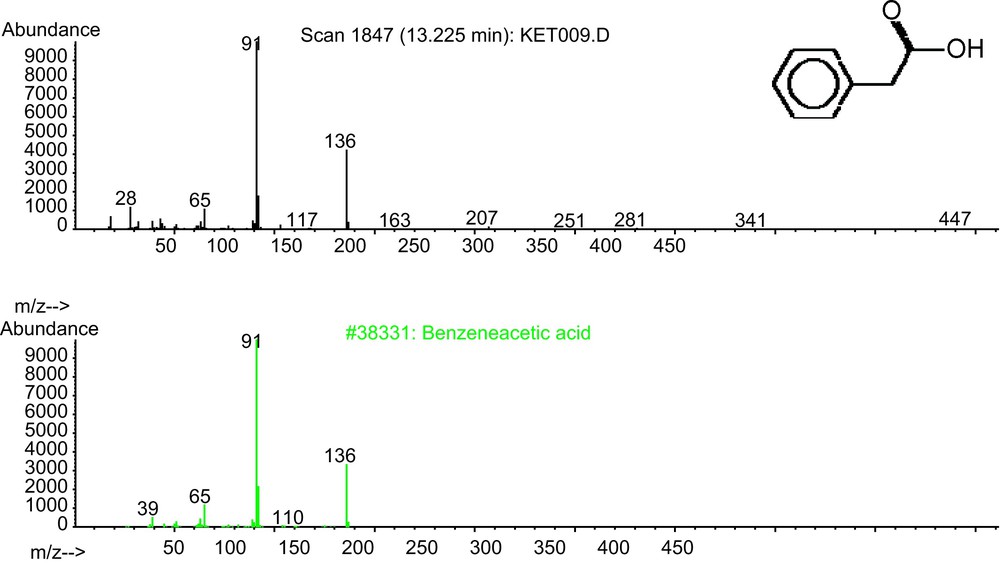
Spectres de masse de l’acide phénylacétique sécrété par Fusarium oxysporum f. sp. albedinis sur milieu Czapek-Glucose (extraction par l’acétate d’éthyle).
Ainsi, dans nos conditions expérimentales, nous constatons que ce composé est absent dans toutes les cultures, aux 7e et 10e jours. Il n’est produit que par les souches de F.o.a, 22 jours après l’inoculation du milieu ; il est strictement absent des extraits de F.o.c. et F.o.l. (Tableau 2).
Temps de rétention et pourcentage de présence de l’acide phénylacétique.
| Tr (min) | Nomenclature IUPAC |
Nom commun | Formule | F.o.a Gh1 | F.o.a. NRRL 38298 | F.o.c. | F.o.l. |
| 13,24 | Acide phénylacétique | Acide benzène acétique | C8H8O2 | 1,38 % | 9,70 % | – | – |
D’après ce tableau, nous constatons que le pourcentage d’abondance du composé identifié est plus important chez la souche de référence de F.o.a que chez la souche isolée d’un palmier bayoudé, sachant que le nombre de métabolites détectés est sensiblement le même. Cette différence serait du probablement à la capacité de chaque souche dans la biosynthèse des métabolites secondaires.
L’APA est produit aussi bien par les plantes que par les microorganismes. Chez ces derniers, il a été isolé à partir du mycélium et des filtrats de culture de F. oxysporum Schlecht. Emend. Snyd. et Hans. [12], Rhizoctonia solani [13], d’Azospirillum brasilense [14] et de quelques espèces de Bacillus [15]. Récemment, il a également été isolé des sclérotes de R. solani [16].
Ce composé, très largement décrit dans la littérature, est connu comme un facteur de virulence pour la pomme de terre [17], un antimicrobien contre Azospirillum tumefaciens, contre des bactéries Gram négatif et un antifongique de F. oxysporum f. sp. matthiola [14], de Phytophthora et Pythium spp. [18]. Il possède en outre une activité hormonale semblable à celle de l’acide indole acétique (AIA) [19].
Plusieurs auteurs ont montré que l’APA est largement impliqué dans la pathogénie de R. solani [20,21]. Aliferis et Jabaji [16] ont montré qu’il n’y a pas de relation directe entre le développement de ce pathogène et le contenu en APA des sclérotes, et dans ce cas, ce composé ne joue pas un rôle majeur dans les processus physiologiques.
L’APA est un métabolite secondaire, dérivé de la phénylalanine. Somers et al. [14] ont suggéré que sa synthèse se fait par l’indole-3-pyruvate carboxylase. La phénylpyruvate libérée après désamination de la phénylalanine peut être décarboxylée par l’indole pyruvate décarboxylase (Ipdc) en phénylacétaldéhyde puis oxydée en APA. Cette voie est analogue à celle de la biosynthèse de l’AIA chez Azospirillum brasilense [22]. En parallèle, chez la plante, la phénylalanine est le précurseur de l’APA et de l’acide salicylique [23] ; ce dernier est responsable de l’induction de la résistance systémique acquise (RAS) contre des microorganismes [24]. Nous pouvons donc supposer que l’APA produit par le champignon modifie le niveau endogène de l’AIA libre et/ou de l’acide salicylique, dans la plante malade, ce qui amoindrit ses capacités de défense. La variation de la balance hormonale peut jouer un rôle majeur dans l’interaction plante-microorganismes. De nombreux auteurs ont en effet montré que certains champignons interfèrent avec la physiologie de la plante-hôte en produisant des hormones végétales [25,26] ou des molécules signales intervenant dans le processus de reconnaissance de l’agent pathogène [27,28].
4 Conclusion
L’analyse chromatographique par CG-SM des extraits méthanoliques de trois formes spéciales de F. oxysporum, (Foa, Foc et Fol) nous a permis de constater leur capacité à sécréter, en culture pure, un grand nombre de composés volatiles dont certains sont connus pour posséder des propriétés antibiotiques, antifongiques et phytotoxiques. Seuls les extraits des deux souches de F. oxysporum f. sp. albedinis, (Foa et NRRL), contiennent l’APA que nous avons isolé et identifié. Ce métabolite, également connu sous l’appellation d’acide benzène acétique, est impliqué dans la pathogenèse.
Dans nos conditions de culture, ce composé a pu être mis en évidence chez F.o.a., ce qui, à notre connaissance, n’a pas été signalé auparavant.
Ainsi que de nombreux métabolites secondaires connus, l’APA est impliqué dans les mécanismes de défense de la souche qui le produit contre les microorganismes compétitifs, ou de jouer des rôles aussi divers qu’importants dans les interactions plante–microorganismes.
Des tests de phytotoxicité de ce composé (naturel ou de synthèse) sont en cours dans notre laboratoire, ce qui devrait nous permettre de mieux comprendre et préciser le pouvoir pathogène de F.o.a. vis-à-vis du palmier dattier.
Conflit d’intérêt
L’auteur Tassadit Ait kettout du Laboratoire de Recherche sur les Zones Arides, Faculté des Sciences Biologiques, Université des Sciences et de la Technologie Houari Boumediene sis au BP 32, El Alia, Bab Ezzouar, Alger, Algérie, déclare sur l’honneur n’avoir aucun conflit d’intérêt.
Remerciements
Nous remercions Dr. Kerry O’Donnell de l’United States Department of Agriculture d’avoir bien voulu mettre à notre disposition les souches de références.


