Abridged English version
Antagonistic rhizobacteria have been repeatedly shown to be promising microorganisms for biological control of plant diseases. Studies on a number of plant-microbe interactions have shown that such antagonistic rhizobacteria could function directly by competition and antibiosis but also indirectly by inducing systemic resistance in the plant towards soil-borne pathogens.
Antibiosis has been described as a powerful mode of action in disease suppression by which development and (or) activity of the pathogen is thought to be directly inhibited. Cell-free culture filtrates have been used to demonstrate the possible role of antibiosis in biocontrol. Antibiosis is mediated by microbial metabolites, for example by toxic substances, enzymes or volatile compounds.
Rhizobacteria-mediated induced resistance has been demonstrated against fungi, bacteria and viruses in Arabidopsis, bean, cucumber and radish, under conditions in which the inducing bacteria and the challenging pathogen remained spatially separated. However, bacterial compounds that induce plant defense mechanisms are highly variable depending on bacterial strain and pathosystems. Salicylic acid (SA) production has been observed for several bacterial strains, and exogenously applied SA can induce resistance in many plant species. In beans, enhanced defense by Pseudomonas aeruginosa strain 7NSK2 towards the pathogenic fungus Botrytis cinerea was initiated by bacterial salicylic acid. In tomato and radish, lipopolysaccharides (LPS) of non-pathogenic pseudomonads induced resistance against challenge inoculations by pathogenic bacteria. In potato induced systemic resistance to infection by the cyst nematode Globodera pallida was triggered by heat-killed cells and purified LPS of Rhizobium etli G12.
Our previous work in vitro has demonstrated that Rhizobium leguminosarum acted towards Fusarium oxysporum MR 84 by antibiosis and inhibited mycelia growth and conidia germination. The objective of this investigation was to determine the protection mechanism of the lentil plant by this antagonistic rhizobacterium against the pathogen Fusarium oxysporum MR 84. The protective effect of culture filtrates, living bacterial cells and heat-killed cells of Rhizobium leguminosarum have been studied when they were applied in the same compartment infection or in a different compartment. All experiments were carried out twice. Plants were examined, during 60 days at 15-day intervals, for the occurrence of plant mortality. Based on the percentage of dead plants, AUDPC (area under disease progress curve) was calculated according to the equation of Shaner and Finney. AUDPC reflects disease progress over the curse of the rating period. Moreover, final disease severity of fusarium wilt was assessed at the end of the experiments (60 days after inoculation) by the final dry weight per plant.
Our results demonstrated that the first application of living bacterial cells, heat-killed cells of Rhizobium leguminosarum and inoculation of the pathogen MR 84 in the same compartment resulted in a total protection of the lentil plant: AUDPC=0, the same dry weight as on the healthy plant control, about 0.7 g. The application of culture filtrate of Rhizobium resulted in significant reduction of AUDPC and severity of fusarium wilt: AUDPC was lower (AUDPC=8) than in the disease control (AUDPC=25) and final dry weight per plant was higher (0.58 g) than in the disease control (0.3 g).
To understand if this antagonistic rhizobacterium induced resistance of plant to the pathogen, bacterial strain and the pathogen were spatially separated. Application of the pathogen on inferior half of the root and application of living or dead bacterial cells or culture filtrate of Rhizobium on the superior half resulted in different reactions of plants. Thus, inoculation of living cells did not cause any induced resistance of plants against pathogen in this test: AUDPC (25) and disease severity (0.23 g) were statistically similar to the disease control (AUDPC=24, final dry weight per plant=0.11 g).
Application of culture filtrate separately of the pathogen gave the same results as those of the plants submitted to the pathogen and culture filtrate in the same compartment: significant decrease of AUDPC (8) and severity of the fusarium wilt (0.42 g). It appears that the culture filtrate protects the plants by acting indirectly: it contains signals able to induce plant resistance.
The protective effect of heat-killed bacterial cells of Rhizobium decreased but had not disappeared once inoculated separately of the pathogen: AUDPC=12, final dry weight per plant=0.34 g. This residual protection was the result of induced resistance against Fusarium infection. Surface structures of cell wall may be the inducing factors. It is possible that the elicitor activity of the cell wall has been or not affected by heat treatment depending on structure stability. The heat treatment can influence changes in size and geometric shape of cell wall structure. Indeed, the elicitor activity depends on fragment size and geometric structure. Studies show that N-acetylchitooligosaccharides larger than hexaose have very high elicitor activity but those smaller than tetraose have only negligible activity. Moreover, only one steric form among 300 isomeric forms of hepta-β-glucoside of Phytophtora megasperma is active but all the other forms do not induce any resistance of the soybean plants.
Our results suggest that stimuli existing in the culture filtrate and in the cell wall were suppressed by substances excreted by living bacterial cells once Rhizobium was in contact with plant: living bacterial cells did not induce any resistance in lentil plants. This hypothesis is in agreement with the results of some authors who have demonstrated that mutants of Rhizobium meliloti, unable to synthesize the nodulating factor EPS I, become able to induce an increase of phenolic compounds, activity of peroxidase and phenylalanine ammonia-lyase into the pseudonodule cell wall of alfalfa host plant when compared with wild type nodule. Those authors proposed that EPS I acts as a suppressor of the plant defense system, enabling Rhizobium meliloti to infect plants.
It seems that the protection of lentil plants by Rhizobium leguminosarum is due to others mechanisms more effective than induction of resistance, probably secretion of antibiotics. The role of these antibiotics in the biocontrol of fusarium wilt will be studied, among other possibilities, using mutants not producing antibiotics. A variety of antibiotics have been described and are involved in the suppression of different pathogens. This antagonist rhizobacterium is a very interesting microorganism. It can be used as a potential agent of biocontrol against the fusarium wilt of lentil plants as well as a nitrogen-fixing symbiotic agent. Additional studies are needed to evaluate the protection against fusarium wilt in the field under environmental conditions where natural infection occurs.
1 Introduction
Les rhizobactéries sont présentes en grand nombre à la surface des racines où existent les nutriments provenant des exsudats racinaires [1,2]. Certaines d'entre elles sont capables de stimuler la croissance des plantes (PGPR : plant growth-promoting rhizobacteria) [3,4] et de réduire leur maladie en supprimant les pathogènes du sol [5]. Ces rhizobactéries constituent des agents prometteurs de lutte biologique contre les champignons, les bactéries, les virus et les nématodes. Des études sur les interactions plante–microorganisme ont montré que les rhizobactéries antagonistes interviennent directement contre les pathogènes par compétition et antibiose [6] mais également indirectement par induction du système de résistance des plantes [7–9]. Le rôle de l'antibiose dans l'antagonisme peut être démontré par l'utilisation du filtrat de culture cellulaire [10,11]. Les substances bactériennes ayant des effets inhibiteurs peuvent être des antibiotiques [12–14], des enzymes [15,16] ou des substances volatiles [17,18].
Par ailleurs, la résistance conférée aux plantes par les rhizobactéries a été démontrée chez l'Arabidopsis [19], la fève [20], le concombre [21] et le radis [22] dans des conditions où la bactérie inductrice et le pathogène restent spatialement séparés : split root system [23]. Cependant, les déterminants bactériens qui induisent les mécanismes de défense des plantes dans différents systèmes sont très variables. La souche Pseudomonas aeruginosa 7NSK2 synthétise l'acide salicylique qui induit une augmentation de la défense des plantes envers Botrytis cinerea [20]. Les lipopolysaccharides de Pseudomonas fluorescens peuvent induire la résistance aux fusarioses des plantes de tomate [24] et de radis [25]. L'implication des structures de la paroi dans l'induction de la résistance peut être démontrée par l'utilisation des cellules tuées de l'antagoniste. Ainsi, des cellules tuées par la chaleur de Bacillus sphaericus [26] et d'Agrobacterium radibacter (actuellement renommé Rhizobium etli) [26,27] sont capables de stimuler la résistance des plants de pomme de terre contre l'infection par Globodera pallida.
Dans un travail préliminaire in vitro, nous avons montré une activité antagoniste de Rhizobium leguminosarum à l'encontre de Fusarium oxysporum f. sp. lentis MR 84. Cette activité se manifeste par la sécrétion de substances inhibitrices de la croissance mycélienne et de la germination des conidies [28]. Dans ce travail, nous avons trouvé intéressant de chercher les mécanismes par lesquels cette activité antagoniste protège les plantes de lentille contre Fusarium oxysporum f. sp. lentis MR 84. S'agit-il d'un effet direct sur le pathogène lui-même et/ou d'une induction de la résistance des plantes au pathogène. Dans ce but, nous avons étudié les effets du filtrat de culture, des cellules vivantes et des cellules tuées de Rhizobium sur la protection des plantes lorsqu'ils sont inoculés avec le pathogène au même endroit de la racine et lorsqu'ils sont inoculés séparément à un endroit différent de la racine.
2 Matériel et méthodes
2.1 Préparation du filtrat de culture et de l'inoculum bactérien de l'antagoniste
Rhizobium leguminosarum est isolé d'une nodosité racinaire prélevée à partir d'un plant de lentille qui a été cultivée dans un sol résistant (Boukhalef). Il présente in vitro un antagonisme élevé à l'encontre de la souche pathogène F. oxysporum f. sp. lentis MR 84 [28].
La culture de R. leguminosarum est mise en incubation pendant 3 jours à 30 °C sous agitation, après ensemencement d'un millilitre d'une préculture fraı̂che à 500 ml de milieu YEM liquide (K2HPO4, 0,5 g ; MgSO4·7 H2O, 0,2 g ; NaCl, 0,1 g ; mannitol, 10 g ; extrait de levure, 1 g ; agar, 20 g pour un litre d'eau distillée). La suspension bactérienne est ensuite centrifugée pendant 20 min à . Le surnageant recueilli après passage à travers le filtre millipore (0,22 μm) représente le filtrat de culture de Rhizobium. Le culot est suspendu dans de l'eau stérile. La densité optique de la suspension bactérienne lue à 600 nm est ajustée à 2, ce qui correspond à une concentration de . L'inoculum bactérien ainsi préparé est utilisé tel qu'il est (cellules vivantes) ou après traitement thermique à l'autoclave à 120 °C pendant 20 min (cellules tuées).
2.2 Préparation de l'inoculum du pathogène
La souche pathogène Fusarium oxysporum f. sp. lentis MR 84 est cultivée en étalant une suspension concentrée de conidies, provenant d'une culture mère, à la surface du milieu potato–dextrose–agar (PDA, Difco). La suspension de conidies est recueillie après quatre jours par lavage de la culture avec de l'eau distillée stérile puis sa densité est ajustée à par estimation de la densité initiale à l'aide d'une cellule de Thomas, puis dilution.
2.3 Essais des inoculations
La variété de lentille L 24 fournie par l'Inra est sensible à l'agent pathogène Fusarium oxysporum MR 84. Les graines sont stérilisées par l'hypochlorite de calcium à 5 % pendant 15 min. Elles sont ensuite mises à germer pendant une semaine dans des boites de Pétri contenant deux disques de papier filtre imbibés d'eau stérile. Les plantules ayant des tailles identiques sont choisies pour les expériences.
2.3.1 Inoculation du pathogène et de l'antagoniste dans le même compartiment
Les plantules âgées d'une semaine sont transférées dans des pots contenant chacun 500 g de sable préalablement stérilisé pendant 24 h à 180 °C. Les cellules vivantes, les cellules tuées ou le filtrat de culture de Rhizobium sont inoculés 14 jours avant l'inoculation du pathogène Fusarium MR 84. Les inoculations consistent à injecter l'inoculum dans le sable situé à proximité de la racine (Fig. 1a). Les cellules vivantes, les cellules tuées et le filtrat de culture sont appliqués chacun avec un volume de 10 ml soit une concentration de 2×107 bactéries g−1 de sable pour les cellules vivantes et les cellules tuées. Le pathogène est aussi appliqué avec un volume de 10 ml mais à une densité de de sable. Certains pots témoins sont inoculés avec le pathogène seul, d'autres pots témoins, non inoculés avec le pathogène, reçoivent soit de l'eau stérile soit le filtrat de culture ou encore le milieu YEM ou les cellules vivantes ou les cellules tuées de Rhizobium. Chacun des traitements est appliqué avec un volume de 10 ml.
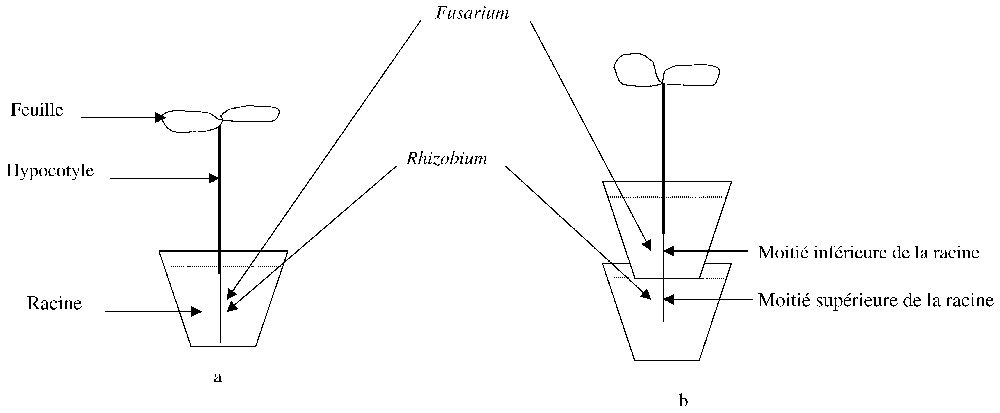
Inoculation de Fusarium et de Rhizobium. (a) Inoculation dans le même pot par injection dans le sable qui se trouve au voisinage de la racine. (b) Inoculation dans deux pots emboı̂tés en injectant délicatement Rhizobium dans le sable qui se trouve au voisinage de la moitié supérieure de la racine et Fusarium dans le sable qui se trouve à proximité de la moitié inférieure de la racine. Ce dispositif expérimental permet d'examiner l'induction de la résistance des plantes par Rhizobium.
2.3.2 Inoculation du pathogène et de l'antagoniste dans des compartiments différents
La culture des plantules âgées d'une semaine est réalisée dans un système formé de deux pots placés l'un sur l'autre et emboı̂tés (Fig. 1b). La plantule avec la moitié de sa racine est mise dans le pot supérieur, l'autre moitié de la racine est introduite à travers un petit trou et passe dans le pot inférieur. Le pot inférieur est inoculé avec 10 ml du filtrat de culture de Rhizobium ou avec 10 ml de l'inoculum bactérien contenant soit les cellules vivantes ou les cellules tuées de Rhizobium à 2×107 bactéries g−1 de sable. L'inoculation se fait en injectant délicatement le filtrat ou l'inoculum dans le sable situé au voisinage de la moitié supérieure de la racine. Des pots témoins reçoivent 10 ml d'eau stérile. Après 14 jours de culture le pot supérieur est inoculé avec 10 ml d'une suspension de l'agent pathogène à de sable. La suspension est injectée délicatement dans le sable qui se trouve au voisinage de la moitié inférieure de la racine. Les pots témoins reçoivent 10 ml de l'agent pathogène seul ou 10 ml d'eau stérile.
Pour tous les traitements, les plantes sont cultivées dans du sable arrosé tous les deux jours par la solution nutritive de Hoagland et Arnon [29]. Les conditions de culture sont : 25 °C le jour et 18 °C la nuit, la photopériode est de 16 h sous un flux énergétique de , fourni par des tubes fluorescents émettant une lumière blanche (type TAB 40).
2.4 Évaluation de la fusariose
L'incidence de la fusariose des plantes est estimée chaque période de 15 j par le pourcentage des plantes mortes, l'aire comprise entre la courbe de progression de l'incidence et l'axe du temps (AUDPC) est ensuite calculée. L'AUDPC originellement définie par Shaner et Finney [30] est utilisée pour résumer la progression de la maladie.
L'AUDPC standardisée est calculée suivant la formule suivante :
Au terme de l'expérience (60 j), les plantes sont délicatement retirées des pots, une à une, les racines sont lavées pour les débarrasser du reste de sable ; le poids sec de chaque plante est ensuite déterminé après un séchage à 60 °C pendant 48 h. Le poids sec final par plante est calculé, dans chaque condition expérimentale, à partir de 60 plantes, pour estimer la gravité de la maladie.
2.5 Recherche de l'agent pathogène MR 84 dans le sable
Pour vérifier l'absence d'une interaction entre le filtrat de culture de Rhizobium et l'agent pathogène MR 84 ou entre le pathogène et les cellules vivantes ou les cellules tuées, le pathogène est recherché tous les 15 jours dans le pot où il n'a pas été inoculé (pot inférieur) en prélevant le sable au voisinage de la racine. Une série de dilution au 1/10 est réalisée à partir d'une suspension de solution mère contenant 1 g de sable dans 9 ml d'eau stérile. Un millilitre de la suspension diluée est étalé à la surface de milieu Komada [31]. La lecture des résultats est effectuée après une semaine d'incubation à 25 °C et à l'obscurité.
2.6 Analyses statistiques
Chaque expérience est répétée deux fois avec 30 plantes pour chaque traitement ; les pots sont arrangés au hasard en trois blocs de 10 plantes par bloc. Les résultats de la première et de la deuxième expérience sont regroupés puisque l'expérience répétée a donné le même niveau de maladie et des variances homogènes. Les analyses statistiques sont effectuées à l'aide du logiciel Statistica [32]. Les résultats expérimentaux sont comparés par analyse de variance, suivie du test de Newman–Keul, après transformation angulaire pour le pourcentage des plantes mortes.
3 Résultats
3.1 Effets des inoculations dans le même compartiment
L'inoculation de l'agent pathogène MR 84 seul provoque un flétrissement des plantes puis leur mort. La Fig. 2 montre que la mortalité des plantes augmente avec le temps de culture, toutes les plantes sont mortes au 60e jour après inoculation du pathogène. Toutefois, après inoculation des cellules vivantes ou des cellules tuées de Rhizobium au même site d'infection que le pathogène, toutes les plantes restent saines durant les deux mois qui suivent l'inoculation du pathogène. Après application du filtrat de culture les plantes restent saines durant les 30 jours qui suivent l'inoculation ; après ce temps la mortalité des plantes commence à apparaı̂tre et une mortalité similaire à celle observée dans le cas des plantes inoculées avec le pathogène seul est notée au 60e jour après inoculation. Le filtrat de culture retarde cependant la mort des plantes mais ne l'empêche pas. L'absence ou le retard de la mortalité des plantes se répercute sur les AUDPC (Tableau 1) et la gravité de la maladie (Fig. 3). En effet, la valeur de l'AUDPC est égale à zéro en présence des cellules vivantes ou des cellules tuées et le pathogène n'a aucun effet sur le poids sec final par plante. Toutefois, l'AUDPC est réduite en présence du filtrat de culture par rapport à celle enregistrée quand les plantes sont soumises à l'action du pathogène seul et le poids sec final par plante est légèrement affecté.

Évolution du pourcentage de plantes mortes après pré-inoculation du filtrat de culture, des cellules vivantes ou des cellules tuées de Rhizobium, dans le même compartiment que l'agent pathogène MR 84. Les plantes témoins n'ont reçu que de l'eau stérile ou l'agent pathogène seul. Les moyennes suivies d'une même lettre ne sont pas significativement différentes au seuil de 5% d'après le test de Newman–Keul.
AUDPC (aire délimitée par la courbe de progression de la maladie) calculée pour chaque traitement, dans le cas des inoculations dans le même compartiment et dans le cas des inoculations dans des compartiments différents
| Traitements | |||||
| Cas | Témoin | Fusarium | Rhizobium vivant | Rhizobium tué | Filtrat de Rhizobium |
| MR 84 | + MR 84 | + MR 84 | + MR 84 | ||
| Inoculations dans le même | |||||
| pot | 0 a | 25±5 b | 0 a | 0 a | 8±3 c |
| Inoculations séparées dans | |||||
| deux pots | 0 a | 24±6 b | 25±9 b | 12±3 c | 8±2 c |
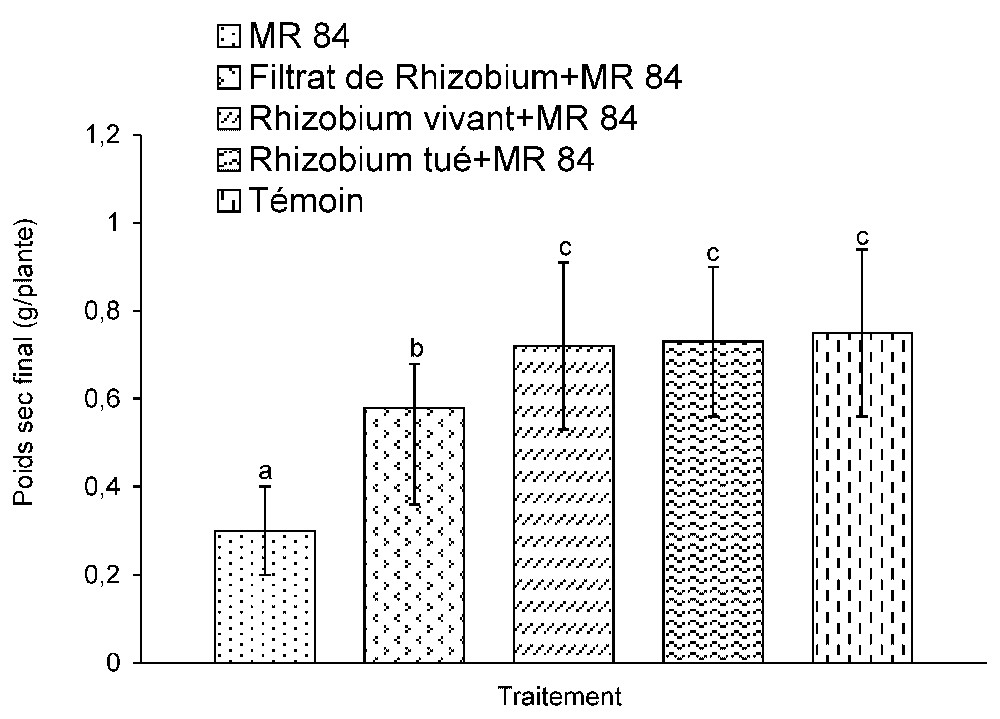
Gravité de la fusariose estimée par le poids sec final par plante au 60e jour après inoculation du pathogène. Le filtrat de culture, les cellules vivantes ou les cellules tuées de Rhizobium sont pré-inoculés avant l'agent pathogène MR 84, dans le même pot. Les moyennes suivies d'une même lettre ne sont pas significativement différentes au seuil de 5% d'après le test de Newman–Keul.
Quand le milieu YEM est fourni aux plantes avec le pathogène, aucun effet protecteur n'est enregistré et la même cinétique de mortalité des plantes que celle observée après inoculation du pathogène seul est obtenue. Au 60e jour après inoculation, toutes les plantes sont mortes. La valeur de l'AUDPC et le poids sec final par plante sont similaires à ceux des plantes mises au contact du pathogène seul (résultat non présenté). Toutefois, le filtrat de culture, les cellules vivantes ou les cellules tuées de Rhizobium ne produisent aucun effet apparent sur les plantes quand ils sont inoculés en absence du pathogène (résultats non présentés).
3.2 Effets des inoculations dans des compartiments différents
Quand les cellules vivantes de Rhizobium sont appliquées séparément du pathogène, les plantes ne sont plus saines et leur mortalité commence a apparaı̂tre en même temps que celle des plantes inoculées avec le pathogène (quelques jours après inoculation) pour atteindre 100 % au 60e jour après inoculation (Fig. 4). Cependant, après application des cellules tuées ou du filtrat de culture, la mortalité des plantes ne commence à apparaı̂tre qu'a partir du 15e jour pour les cellules tuées et à partir du 30e jour pour le filtrat de culture. Les cellules tuées et le filtrat de culture retardent la mort des plantes, mais ne l'empêchent pas, car toutes les plantes sont mortes au 60e jour après inoculation. Le calcul des AUDPC (Tableau 1) et du poids sec final par plante (Fig. 5) montrent qu'en présence des cellules vivantes la valeur de l'AUDPC est élevée, proche de celle obtenue avec Fusarium et la gravité de maladie est aussi importante que celle enregistrée en présence du Fusarium seul. Toutefois, en présence des cellules tuées ou du filtrat de culture, la valeur de l'AUDPC est faible et la gravité de la maladie est réduite.

Évolution du pourcentage de plantes mortes après inoculation du filtrat de culture, des cellules vivantes ou des cellules tuées de Rhizobium séparément de l'agent pathogène MR 84. Les plantes témoins n'ont reçu que de l'eau stérile ou l'agent pathogène seul. Les moyennes suivies d'une même lettre ne sont pas significativement différentes au seuil de 5% d'après le test de Newman–Keul.

Gravité de la fusariose estimée par le poids sec final par plante au 60e jour après inoculation du pathogène. Le filtrat de culture, les cellules vivantes ou les cellules tuées de Rhizobium sont pré-inoculés séparément de l'agent pathogène MR 84. Les moyennes suivies d'une même lettre ne sont pas significativement différentes au seuil de 5% d'après le test de Newman–Keul.
La comparaison des résultats des AUDPC et du poids sec final par plante dans les deux situations étudiées permet de conclure que les cellules vivantes ne protègent plus les plantes si elles sont inoculées séparément du pathogène. Les cellules tuées protègent les plantes même si elles sont inoculées séparément du pathogène ; une diminution de leur effet protecteur est cependant notée. Le filtrat de culture protège les plantes de la même manière qu'il soit inoculé avec le pathogène ou séparément.
3.3 Recherche de la souche MR 84 dans le sable
Nous avons vérifié tout le long de l'expérience l'absence d'interactions entre la souche pathogène et Rhizobium ou entre celle ci et les cellules tuées de Rhizobium ou le filtrat de culture. Les résultats des recherches de la souche pathogène MR 84 dans le sable prélevé à côté de la racine ont montré que pour tous les traitements effectués, le pathogène est absent dans les pots ou il n'a pas été inoculé.
Par ailleurs, dans le cas particulier des inoculations effectuées avec les cellules vivantes de Rhizobium, la présence de petites nodosités dans les racines qui se trouvent dans le pot inférieur et leur absence dans les racines du pot supérieur témoigne que Rhizobium n'a pas colonisé les parties inférieures des racines.
4 Discussion et conclusion
Cette étude montre une protection totale des plantes de lentille contre le pathogène Fusarium oxysporum MR 84 à la suite de leur pré-inoculation avec Rhizobium leguminosarum. Dans le but de comprendre les mécanismes par lesquels Rhizobium protège les plantes de lentille, il était intéressant d'étudier l'importance des constituants de la paroi ou des substances secrétées par Rhizobium dans cette protection. Ainsi, il apparaı̂t que l'inoculation des plantes avec les cellules tuées de Rhizobium protège les plantes d'une manière totale comme les cellules vivantes. Cependant, le filtrat de culture retarde la cinétique de mortalité des plantes et réduit intensément la sévérité de la maladie. Le milieu YEM, milieu de culture de Rhizobium, n'a pas montré d'effet protecteur sur les plantes suggérant que la protection des plantes par le filtrat est due à des substances secrétées par Rhizobium et non à des substances se trouvant dans le milieu de culture.
Afin de chercher si la protection des plantes par Rhizobium est le résultat d'une action directe sur la pathogène ou d'une induction de la résistance des plantes, le filtrat de culture, les cellules tuées ou les cellules vivantes de cet antagoniste sont inoculés dans un compartiment séparé de l'agent pathogène tout en contrôlant, au cours de l'expérience, l'absence d'une interaction directe entre les deux protagonistes. Le résultat obtenu avec le filtrat de culture reste inchangé et laisse supposer que les substances secrétées dans le filtrat n'ont pas un effet direct sur le pathogène mais un effet indirect par induction de la résistance des plantes. L'induction de la résistance des plantes par des métabolites microbiens a été notée dans la littérature comme, par exemple, l'induction de la résistance des plantes de tabac contre le virus de la mosaı̈que de tabac par des sidérophores secrétées par Pseudomonas fluorescens CHAO [33] ou l'induction de la résistance des plants de pomme de terre contre les nématodes par le filtrat de culture de Bacillus sphaericus [26].
Quand les cellules tuées de Rhizobium sont inoculées séparément du pathogène, les plantes ne restent plus saines mais leur cinétique de mortalité est ralentie et la sévérité de la maladie est réduite comparées à celles des plantes soumises à l'action du pathogène seul. La protection des plantes par les cellules tuées, après leur inoculation séparée du pathogène, n'est donc pas supprimée totalement, mais seulement atténuée. Ces résultats semblent indiquer qu'une partie de la protection est due à une action directe sur le pathogène et qu'une autre partie serait le résultat d'une action indirecte. L'action directe des cellules tuées pourrait être due à une toxicité générée après autoclavage des cellules de Rhizobium et leur action indirecte à une induction de la résistance des plantes par des structures situées au niveau de la paroi des cellules. Ces structures pourraient être thermostables ou non. Si les structures de la paroi des cellules de Rhizobium sont thermostables, la protection conférée aux plantes par les cellules tuées serait le résultat d'une induction de la résistance, non affectée par l'autoclavage des cellules. Si ces structures ne sont pas thermostables, l'induction de la résistance pourrait ne pas être la vraie induction mais une induction affaiblie après autoclavage des cellules de Rhizobium. Ce traitement à la chaleur pourrait affecter la taille et la forme géométrique des structures élicitrices de la paroi des cellules de Rhizobium. En effet, l'activité élicitrice dépend de la taille du fragment inducteur et de sa forme géométrique. Ainsi, chez des cultures cellulaires de riz, les fragments N-acétylchitooligosaccharides, ayant une taille supérieure à celles des hexoses montrent une activité élicitrice plus grande que ceux qui ont une taille inférieure à celle des tétraoses [34]. De plus chez le couple Phytophtora megasperma/Soja, une seule forme stérique, parmi plus de 300 isomères d'hepta-β-glucosides, s'est révélée active alors que les autres isomères sont dépourvus de pouvoir inducteur de la résistance des plantes [35]. Pour confirmer la présence d'éliciteurs et leur nature, aussi bien dans le filtrat que dans la paroi, il convient de poursuivre cette étude par la purification des molécules inductrices de la résistance et par l'évaluation de leur capacité élicitrice. Chez la souche G12 de Rhizobium etli, ce sont les lipopolysaccharides qui sont responsables de l'induction de la résistance des plants de pomme de terre à l'infection par Globodera pallida [36].
Par ailleurs, quand les cellules vivantes de Rhizobium sont inoculées séparément de l'agent pathogène elles deviennent incapables de protéger les plantes, même faiblement. Il apparaı̂t que les cellules vivantes de Rhizobium n'induisent pas la résistance des plantes mais agissent en secrétant probablement des antibiotiques ayant une action directe sur la pathogène. L'étude de l'antagonisme in vitro a montré que Rhizobium inhibe la croissance mycélienne et la germination de Fusarium MR 84 en secrétant des substances de nature protéique [28]. Certaines souches de Rhizobium secrètent des substances à activité antifongique [37,38] et antibactérienne [39–42]. Des résultats non publiés ont montré que plus le décalage dans le temps entre l'inoculation de Rhizobium et Fusarium MR 84 est grand, plus la protection conférée aux plantes est importante. Ceci conforte l'hypothèse selon laquelle cet antagoniste secrète des antibiotiques. Il serait utile, dans l'avenir, de purifier ces substances ou d'isoler des mutants non producteurs de ces antibiotiques et d'étudier leur action sur le développement de la fusariose. Plusieurs auteurs ont montré l'importance de l'activité antibiotique des bactéries dans la limitation de la gravité des maladies d'origine telluriques [43–45]. Ce qui est surprenant c'est que les cellules vivantes de Rhizobium n'induisent pas la résistance des plantes alors que le filtrat de culture et les cellules tuées le font. Il paraı̂t vraisemblable qu'une fois en présence de la plante Rhizobium secrète des substances qui répriment les signaux susceptibles de le faire reconnaı̂tre comme étranger. Cette hypothèse s'accorde avec la déduction de Niehaus et al. [46] qui ont observé que les mutants de Rhizobium meliloti, incapables de synthétiser les facteurs de nodulation EPSI, deviennent capables de stimuler la synthèse des composés phénoliques, des activités peroxidases et phénylalanine ammonia-lyases au niveau des pseudonodules des plantes d'alfalfa. Ces auteurs ont par la suite conclu que les facteurs de nodulation sont également des répresseurs du système de défense des plantes, laissant ainsi la bactérie symbiotique les infecter. L'induction de la résistance des plantes par le filtrat et les cellules tuées retarde la mortalité des plantes mais ne l'empêchent pas ce qui laisse suggérer que ce mécanisme permet de retarder la progression du pathogène à l'intérieur de la plante sans la bloquer contrairement à l'action directe de Rhizobium sur le pathogène qui confère une protection totale des plantes.
Rhizobium leguminosarum est un agent symbiotique fixateur d'azote, son utilisation en tant qu'agent de lutte biologique contre la fusariose de la lentille est une approche très prometteuse à condition de poursuivre cette étude par des travaux ultérieurs permettant de tester l'efficacité de Rhizobium dans les conditions d'infection naturelle et en présence d'autres microorganismes du sol. Certaines espèces de Rhizobium se sont montrées capables de protéger les plantes contre certaines maladies comme la verticilliose de la luzerne [38], la pourriture racinaire [47,48] et le charbon [49] du Soja. De même la combinaison de Rhizobium leguminosarum et de Trichoderma harzianum permettent de réduire la gravité de la fonte des semis et la pourriture racinaire chez la lentille [50].


