Abridged English version
The Algerian Numidia, located at the junction of Euro-Siberian, Mediterranean and Subtropical biogeographical influences, is characterised by a very high biodiversity, notably within coastal wetland complexes. Among the most original wetland communities of the region, are Alnus glutinosa forests developed along rivers (riparian alder forests) and in peat-forming habitats close to lakes or in interdunal ridges (alder carrs). These exceptional habitats are partly comprised within the El Kala National Park, and sometimes benefit from indirect conservation measures, based on waterfowl richness (alder forests of Tonga, Guerbès-Senhadja and Ain Khiar, elected Ramsar sites in 1983, 2001 and 2002, respectively). However, these measures prove to be insufficient, since most of the regional alder forests suffer from cutting, burning, draining and/or dumping. The impact of these disturbances has still never been evaluated. The present work aims at (1) characterising the present-day state of the alder forests of Numidia, (2) assessing the extent and nature of threats, and (3) proposing adapted conservation measures.
The study is based on 255 phytosociological relevés, realised between 1996 and 2010, in 35 alder forests distributed throughout the wetland complexes of Annaba-El Kala and Guerbès-Senhadja: 10 alder carrs installed in coastal interdunal ridges, 15 riparian alder forests developed along wadies, and 10 alder carrs developed on lake margins. These forests are dominated by A. glutinosa, alone or associated to Fraxinus angustifolia, Populus alba, Quercus canariensis, Salix alba, S. atrocinerea, S. pedicellata and Ulmus minor. Their understoreys comprise some shrubs (e.g., Frangula alnus, Laurus nobilis, Rubus ulmifolius), as well as herbaceous plants (e.g., Athyrium filix-femina, Carex remota, Osmunda regalis).
The alder forests of Numidia harbour more than 400 species, among which 236 present at least 5 occurrences. A first correspondence analysis (CA), realised on the entire dataset, reveals a gradient between close and open habitats (competition), and a high community heterogeneity related to the hydrological gradient. Three main herbaceous communities are distinguished: (1) the hydrophytic community, dominated by large helophytic species; (2) the amphibious community, comprising geophytous Pteridophytes (Isoetes) and a number of annual species; and (3) the meso-xerophilous community, organised along a gradient from open scrublands to grazed dwarf meadows. A second CA, realised on the relevés harbouring more than 25 % of alder, allows distinguishing the riparian alder forests, more diversified, from the peat-forming ones. All the investigated forests however harbour a common characteristic plant cortege, comprising trees, shrubs, creepers, hydrophilous herbs, and Pteridophytes. This plant assemblage is often associated to a diversity of transgressive species, originating from surrounding marshes, forests, scrublands, lakes, and meadows.
While generally poorer than the vicariant formations of western Europe, the alder forests of Numidia present a similar stratification, composed of a 20–25 m-high arboreal layer, a shrubby layer with a laurifoliate tendency, a creepy layer, and a herbaceous sciaphilous layer. Their richness and their complex structure attest their old age, and imply their long-term regeneration, probably favoured by natural and/or anthopogenic clearings. Salix atrocinerea, often found at the margins of alder forests, plays a significant role in this secondary succession.
The studied forests belong to two different ecological and phytosociological entities. First, the riparian forests, close to the alder forests of south-western Europe, are developed on well-drained soils and are subjected to marked hydrological alternations. They correspond to the suballiance Campanulo alatae-Alnenion glutinosae Bensettiti & Lacoste 1999, alliance Osmundo-Alnion Drske. & Riv.-Mart. 1975, order Populetalia albae Br.-Bl. 1931, and class Querco-Fagetea Br.-Bl. & Vlieg. 1937. This syntaxon is well differentiated by the presence of Allium triquetrum, Helosciadium nodiflorum, Salix pedicellata, Vitis vinifera subsp. sylvestris, and more particularly the North African endemic Campanula alata. It, moreover, harbours a number of species of the Populetalia albae, and some species transgressive from the Quercetea ilicis. Second, the alder carrs are developed on peaty, hydromorphic soils; such conditions explain the absence in these formations of most species of the Populetalia albae. They correspond to the association Rusco hypophylli-Alnetum glutinosae Géhu, Kaabeche & Gharzouli 1994, alliance Alnion glutinosae Malcuit 1929, order Alnetalia glutinosae R.Tx 1937, and class Alnetea glutinosae Br.-Bl. & R.Tx 1943. This association differs from the vicariant syntaxa of western Europe (the mid-European Carici elongatae-Alnetum glutinosae, the Atlantic Carici laevigatae-Alnetum glutinosae, the Basquo-Cantabric Osmundo-Alnetum glutinosae, and the Italian Hydrocotylo-Alnetum glutinosae) essentially by the presence of Ruscus hypophyllum. The hydroseral succession of these carrs seems to comprise two stages described from Kroumiria (Tunisia): the Cariceto-Sphagnetum plumulosi Labbe & Nègre 1952, characterised by Carex punctata and Sphagnum auriculatum, and the Osmundo-Ericetum scopariae Nègre 1952, characterised by Erica scoparia and Osmunda regalis.
The obtained results highlight the rapid decline of the Numidian alder forests, which is exemplified by the ongoing degradation of the largest alder forest of North Africa (Righia, 400 ha) and the destruction of the forests of Ain Bergougaia and Lac Bleu. This decline, induced by generalised anthopogenic disturbances (draining, cutting, overgrazing, burning, dumping, gathering), results in: (1) retreat of forest margins, (2) soil drying, salinisation and modification of the hydrological regime, (3) degradation of water quality, (4) degradation of plant coverage and dumping-induced pollution, (5) regression of gathered species, such as Frangula alnus and Laurus nobilis, and (6) modification of local conditions and competitive equilibriums, related to the introduction of exogenous species such as Acacia spp., Eucalyptus spp. and Taxodium distichum. These changes are accompanied by the rarefaction, sometimes the disappearance, of several species, among which some are restricted to the Numidian alder forests: the most impacted species are Thelypteris palustris, T. interrupta (= Dryopteris gongylodes subsp. propinqua), Sphagnum auriculatum, Campanula alata and Borago longifolia. On the opposite, the environmental changes responsible for these declines seem to favour some species indicator of pollution and eutrophication (Cotula coronopifolia, Lemna minor, Potamogeton trichoides, Wolffia arrhiza). Several naturalised (Oxalis floribunda, Paspalum distichum, Phytolacca americana, Ricinus communis) and indigenous species (Juncus heterophyllus) appear, moreover, to be favoured by allogenic disturbances.
The alder forests of Numidia represent the regional term of the hydroseral succession of freshwater wetlands, and harbour a rich Euro-Siberian plant cortege. This cortege, here in situation of peripheral isolation, confers on them a particular importance in terms of genetic-diversity conservation. The worrying situation and the rapid decline of north-eastern Algerian wetlands, including alder forests, should urgently induce the implementation of adapted protection measures and the rational management of human activities. The existence of the El Kala National Park and of some local conservation status (e.g., Ramsar sites) is clearly insufficient. The main threats concerning the Numidian alder forests are related to human activities, which impact is today extremely alarming: uncontrolled urbanisation, increasing agricultural practices, illegal cutting, pollution by domestic and industrial dumping, overgrazing, criminal burning, sand extraction, uncontrolled development of roads, and unregulated gathering of declining species. The fragmentation of alder forests makes them more vulnerable to disturbance and climate change. It is now urgent to identify accurately the causes of the degradation of this exceptional natural patrimony, and to assess their extent and their structural and functional consequences, before to envisage conservation or restoration actions. This work should be undertaken by management organisms (national parks, reserves…), with the help of scientists and the financial support of the International community.
The conservation of Numidian wetlands, including alder forests, implies to best understand both the relationships between local populations and natural ecosystems, and the functioning of these ecosystems. The first topic, which should integrate the socioeconomic study of behaviours, needs and motivations leading people to overexploit sometimes up to destruction their natural resources, should allow one to propose alternative functioning modes compatible with the sustainable management of wildness. One avenue to explore could be the development of ecotourism, on the basis of the exceptional natural landscapes of the region. The second topic, which concerns ecosystem study, should provide a better understanding of their functioning and of their responses to disturbances. It is necessary for that to pursue hydrological and ecological studies, and to implement monitoring of ecosystem dynamics. This dataset will constitute the indispensable basis for elaborating management policies in the optic of sustainable development of Algerian Numidia. Before the realisation of these different studies, it is nevertheless necessary to immediately create zones of integral reserve, in order to manage the present-day problems and to stop the ongoing decline of the regional wetlands.
1 Introduction
La Numidie fait partie d’un point-chaud de biodiversité, récemment reconnu au sein de l’ensemble méditerranéen [1]. Elle constitue en effet un carrefour biogéographique majeur, réunissant des éléments floristiques eurosibériens, méditerranéens et subtropicaux [2–6]. Cette richesse spécifique a depuis longtemps été remarquée dans les complexes humides des plaines littorales de la région d’Annaba [5–9], qui abritent très probablement les communautés hydrophiles les plus riches d’Afrique du Nord. L’intérêt biologique majeur de cette région a suscité la création du Parc National d’El Kala, qui englobe environ un quart du complexe humide d’Annaba-El Kala, et l’élection de plusieurs sites Ramsar. Toutefois, en dépit de ces mesures de protection, le déclin des zones humides se poursuit à l’intérieur même des limites du Parc [10–11].
Parmi la grande diversité des zones humides de Numidie, dans le nord-est algérien, les aulnaies à Alnus glutinosa représentent un écosystème d’affinité septentrionale extrêmement original à l’échelle de l’Afrique du Nord [12–14]. Ces formations, bien que présentes dans le nord du Maroc [15,16] et le nord-ouest de la Tunisie [17,18], ne sont nulle part aussi étendues en Afrique du Nord que dans les complexes humides d’Annaba-El Kala et de Guerbès-Senhadja. Leur abondance régionale est conditionnée par des conditions géomorphologiques et climatiques particulières [19], et notamment par des substrats argilo-sableux favorables à la formation de sols hydromorphes [20] et un climat de type méditerranéen humide chaud [13]. En dépit de leur importance conservatoire, écologique et biogéographique, les aulnaies numidiennes n’ont été à ce jour que très peu étudiées [14,21] et ne font l’objet que de très rares mesures de protection, essentiellement liées à la présence d’oiseaux d’eau (aulnaies du Tonga, de Guerbès-Senhadja et d’Ain Khiar, élues sites Ramsar, respectivement en 1983, 2001 et 2002) et à la localisation de certaines d’entre elles dans les limites du Parc National d’El Kala. Nombre d’entre elles subissent des défrichements illégaux, des incendies volontaires, des pollutions d’origines diverses et des assèchements consécutifs aux pompages excessifs réalisés dans les nappes phréatiques, et les cultures développées à leurs marges ne cessent de les rogner peu à peu. L’ampleur de ces dégradations et leur influence sur la structure, la composition et la pérennité de ces formations exceptionnelles n’a encore fait l’objet d’aucune évaluation.
Le travail présenté vise à combler en partie cette lacune, et s’attache à : (1) caractériser l’état actuel de ces formations hydrophiles emblématiques de la Numidie, (2) évaluer l’ampleur et la nature des menaces les concernant, et (3) proposer sur ces bases des mesures de conservation et de protection. Pour cela, des relevés phytosociologiques ont été réalisés entre 1996 et 2010 dans 35 aulnaies réparties dans les complexes humides d’Annaba-El Kala et de Guerbès-Senhadja. Ces données doivent notamment permettre d’inventorier les espèces végétales caractérisant les formations étudiées (aulnaies et pelouses/prairies marécageuses résultant de leur dégradation) et d’identifier les stations les plus vulnérables.
2 Matériel et méthodes
2.1 Région d’étude
La Numidie se situe à l’extrême Nord-Est de l’Algérie, entre les longitudes 07°08′ et 08°37′Est et les latitudes 36°43′ et 37°07′Nord. Elle est centrée sur des plaines littorales qui s’étendent de part et d’autre du Massif de l’Edough et entre Annaba et El Kala (Fig. 1), et est limitée au nord par la Méditerranée, à l’est par le Jbel Addada sur la frontière algéro-tunisienne, au sud par le Jbel Ghorrah, les Monts de la Cheffia et le Tell Nord-Guelmois, et à l’ouest par les Jbels Safia et Fedj el Foul. Le substratum géologique est dominé par des grès d’âge oligo-miocène, qui, associés à des argiles, constituent le flysch numidien [6,22]. Les plaines littorales s’organisent en plusieurs ensembles distincts. La partie ouest, qui comprend la plaine de Guerbès-Senhadja, le lac Fetzara et la plaine d’Annaba, est constituée par une grande unité étalée en arc de cercle autour du massif de l’Edough. La partie est, entre Annaba et El Kala, se décompose en revanche en une série de dépressions, de massifs dunaires, de terrasses et de petites collines, généralement couverts par une végétation dense. Ainsi, d’ouest en est, se succède une série de petites plaines (Bouteldja, El Tarf, Ain el Assel, Oum Teboul) et de cuvettes lacustres (lacs Mellah, Oubeira et Tonga) [23].

Localisation des aulnaies étudiées dans le nord-est algérien. Les symboles identifient les différents systèmes : dunaire (triangles blancs), fluviatile (carrés noirs) et lacustre (losanges gris). Les noms complets des sites sont donnés (Tableau 1).
Le réseau hydrographique est partagé en trois grands ensembles : un système fluviatile se déversant dans la mer par l’intermédiaire de quatre grands cours d’eau (d’ouest en est : Oued El Kebir ouest, Oued Seybouse, Oued Bounamoussa et Oued El Kebir est), un système lacustre comprenant les quatre grands lacs de la région (d’ouest en est : Fetzara, Mellah, Oubeira et Tonga), et un système dunaire, qui par sa capacité de rétention des eaux, génère un ensemble de zones humides à fonctionnement hydrique quasiment autonome. Ces zones dunaires abritent des formations forestières marécageuses (aulnaies, frênaies, ormaies et saulaies pures ou en mélange) dans les dépressions interdunaires et des ripisylves le long des cours d’eau (châabas, rivières).
Caractérisée par des précipitations comprises entre 760 et 1200 mm/an, la Numidie est une des régions les plus arrosées d’Algérie. Le régime pluviométrique reste toutefois fortement marqué par le climat méditerranéen, avec 50 % des précipitations tombant en hiver contre seulement 3 % en été. Malgré le déficit hydrique estival, l’humidité de l’air demeure généralement supérieure à 70 %, avec des moyennes annuelles de 72–74 % au Cap de Garde, à Annaba et à El Kala. Cette particularité est imputable à la proximité du littoral, à l’importance de la surface forestière et à la présence de très nombreuses zones humides, parmi lesquelles les aulnaies exercent une influence prédominante. L’humidité de l’air élevée en période estivale se traduit en effet très fréquemment par la présence de brumes, qui constituent « une véritable compensation occulte pour les végétaux ne bénéficiant d’aucune précipitation durant l’été » [21]. Sur le plan bioclimatique, la Numidie se situe dans les variantes chaude à tempérée des ambiances subhumide et humide. Les températures élevées et l’humidité estivales se conjuguent toutefois pour créer localement de véritables ambiances subtropicales, favorables au développement et au maintien de nombreuses espèces d’affinité tropicale [8].
2.2 Sites étudiés
L’étude a porté sur 35 aulnaies réparties le long du littoral méditerranéen depuis les reliefs de l’extrême est de l’Algérie jusqu’à la plaine de Guerbès-Senhadja (Fig. 1, Tableau 1). Ce sont toutes des aulnaies de plaine, à l’exception des aulnaies de Ain Bergougaia et de Seraidi, respectivement situées à 303–309 et 517–556 m d’altitude. Afin d’obtenir une vision générale de la diversité des aulnaies de la région étudiée, nous avons échantillonné des aulnaies appartenant aux trois grands systèmes hydrologiques régionaux :
- – 10 aulnaies sont installées dans des dépressions interdunaires, sans aucun lien avec le réseau hydrographique régional (système dunaire). Ces aulnaies marécageuses sont localisées sur des substrats sablonneux ou sur les zones de contact entre sables et alluvions. Elles sont toutes caractérisées par des dépôts organiques dont l’épaisseur varie entre 1 et 6 m [20]. Ces aulnaies, parfois qualifiées d’aulnaies de source [24], sont parcourues par de petits ruisseaux de proximité ou alimentées par la nappe phréatique dunaire, et leur substrat est généralement asséché l’été ;
- – 15 aulnaies, généralement en situation de ripisylve, appartiennent au système fluviatile ; ce sont des formations souvent linéaires, installées sur les rives des cours d’eau dont la majorité est exondée en été ou fragmentée en chapelets de mares (par exemple, Oued El Kébir Est près d’El Tarf) ;
- – 10 aulnaies, enfin, sont développées en contact direct avec le système lacustre, dans des zones saisonnièrement inondées par les eaux des lacs (Tonga, Oubeira, Mellah, Lac Bleu). Cette proximité entre l’écosystème lacustre et l’écosystème marécageux favorise l’existence d’une faune diversifiée comprenant souvent des espèces très rares [25].
Caractéristiques générales des sites d’étude. Les codes des sites respectent les grands compartiments hydrologiques régionaux : fluviatile (Flu-), lacustre (Lac-) et dunaire (Dun-). Les espèces de la canopée sont notées par ordre d’importance dans la station, comme suit : Alnus glutinosa (A), Fraxinus angustifolia (F), Populus alba (P), Quercus canariensis (Q), Salix spp. (S) et Ulmus minor (U). Les différents régimes hydrologiques sont : inondation permanente (IP), inondation saisonnière (IS) et inondation intermittente (II).
| Code | Site | Bassin versant | Latitude | Longitude | Altitude (m) | Canopée | Surface (ha) | Régime hydrologique |
| Flu-1 | Oum Lâagareb | Oued El Kebir est | 36°49′34′′N | 08°12′58′′E | 17 | A | 200 | IS |
| Flu-2 | Righia | Oued El Kebir est | 36°50′27′′N | 08°10′39′′E | 16–30 | A-S | 400 | IS |
| Flu-3 | Bou Mohacène | Oued El Kebir est | 36°50′28′′N | 08°03′58′′E | 6 | A-S | 50 | II |
| Flu-4 | Ain Khiar | Oued El Kebir est | 36°48′17′′N | 08°19′17′′E | 30 | A-U-F-Q | 50 | IS |
| Flu-5 | Bourdim | Oued El Kebir est | 36°48′53′′N | 08°15′58′′E | 32 | A-U-F-Q | 85 | IS |
| Flu-6 | Bouglès | Oued El Kebir est | 36°49′39′′N | 08°13′01′′E | 15–25 | A | 20 | IS |
| Flu-7 | Mechta Dridra | Oued Laouledj | 36°53′00′′N | 08°34′00′′E | 59 | A | 1 | II |
| Flu-8 | Laouledj-1 | Oued Laouledj | 36°53′04′′N | 08°34′62′′E | 18–59 | A-F-U-S | 2 | IS |
| Flu-9 | Laouledj-2 | Oued Laouledj | 36°53′63′′N | 08°32′38′′E | 29 | A | 2 | IS |
| Flu-10 | Oued El Arg | Oued Melloul | 36°53′63′′N | 08°34′62′′E | 18 | A-F | 1 | II |
| Flu-11 | Kef Oum Chetoub | Oued Melloul | 36°53′37′′N | 08°33′02′′E | 178 | A | 5 | IS |
| Flu-12 | Ain Bergougaia | Aulnaie d′altitude | 36°50′58′′N | 08°35′25′′E | 303–309 | A-Q | 2 | IS |
| Flu-13 | Seraidi | Oued El Hrour | 36°54′44′′N | 07°39′20′′E | 517–558 | A-Q | 1 | IS |
| Flu-14 | Nechâa Khellalba | Oued El Kebir ouest | 36°55′25′′N | 07°16′44′′E | 17 | A | 75 | IS |
| Flu-15 | Oued El Aneb | Oued El Kebir ouest | 36°52′77′′N | 07°27′40′′E | 52 | U-A-F | 1 | IS |
| Lac-1 | Nechâa Tonga | Lac Tonga | 36°52′80′′N | 08°31′00′′E | 2 | A | 37 | IS |
| Lac-2 | Demnet Errihane | Lac Oubeira | 36°52′02′′N | 08°23′19′′E | 30 | A-S | 20 | IS |
| Lac-3 | Bou Merchène | Lac Oubeira | 36°52′40′′N | 08°25′05′′E | 53 | A-U | 30 | IS |
| Lac-4 | Gantra El Hamra | Lac Mellah | 36°51′44′′N | 08°20′06′′E | 12 | A-F | 4 | IS |
| Lac-5 | Bou Malek | Lac Mellah | 36°53′22′′N | 08°20′30′′E | 12 | A | 2 | IS |
| Lac-6 | Souk Erreguibet | Lac Mellah | 36°54′03′′N | 08°17′25′′E | 12 | A | 4 | IS |
| Lac-7 | Dhekhil El N’Meur | Lac Mellah | 36°54′24′′N | 08°17′54′′E | 12 | A-F-P | 50 | IS |
| Lac-8 | Oued Mellah | Lac Mellah | 36°53′23′′N | 08°20′33′′E | 4 | A | 2 | IP |
| Lac-9 | Brabtia | Lac Mellah | 36°51′14′′N | 08°19′55′′E | 10 | A-U-S | 3 | IS |
| Lac-10 | Lac Bleu | Lac Bleu | 36°54′54′′N | 08°20′38′′E | 7 | A-S | 2 | IS |
| Dun-1 | Berrihane-1 | – | 36°50′09′′N | 08°06′19′′E | 12 | A-S | 10 | IP |
| Dun-2 | Berrihane-2 | – | 36°50′07′′N | 08°06′18′′E | 16 | A | 2 | IP |
| Dun-3 | Berrihane-3 | – | 36°50′08′′N | 08°07′14′′E | 13 | A | 5 | IS |
| Dun-4 | Berrihane-4 | – | 36°50′37′′N | 08°08′39′′E | 12 | A | 2 | IP |
| Dun-5 | Sebâa-1 | – | 36°50′24′′N | 08°05′30′′E | 2 | A | 1 | IS |
| Dun-6 | Sebâa-2 | – | 36°50′25′′N | 08°05′30′′E | 5 | A | 2 | II |
| Dun-7 | Demnet Ataoua | – | 36°56′23′′N | 07°14′25′′E | 5 | A | 280 | IS |
| Dun-8 | Sidi Makhlouf | – | 36°53′09′′N | 07°18′25′′E | 14 | A | 50 | IS |
| Dun-9 | Sidi Freitis | – | 36°54′48′′N | 07°17′08′′E | 15 | A | 4 | IS |
| Dun-10 | Garâat Ouas | – | 36°57′18′′N | 07°15′51′′E | 10 | A | 2 | IP |
Les canopées de ces formations sont dominées par A. glutinosa, seul ou en mélange avec F. angustifolia, Populus alba, Quercus canariensis, Salix alba, Salix atrocinerea, Salix pedicellata et Ulmus minor (Tableau 1). Les strates inférieures comprennent un grand nombre d’espèces inféodées à cet écosystème, parmi lesquelles des espèces ligneuses comme Frangula alnus, Laurus nobilis et Rubus ulmifolius, et des herbacées comme Athyrium filix-femina, Carex remota et Osmunda regalis.
2.3 Terrain
Des relevés phytosociologiques (méthode de Braun-Blanquet [26]) ont été réalisés dans 35 aulnaies en 1996–1999, et les différents sites ont été revisités entre 2000 et 2010. Pour l’ensemble de l’étude, l’effort d’investigation représente 255 relevés. Les aulnaies les plus accessibles ont été échantillonnées de manière systématique en multipliant les relevés dans l’espace quand les stations n’étaient pas inondées. Les relevés floristiques ont été effectués durant la période de végétation, au printemps et durant l’été. Les aires minimales ont varié entre 16 m2 pour les milieux ouverts (pelouses ou prairies marécageuses) et 400 m2 pour les zones forestières les plus pauvres en espèces [27]. Chaque relevé floristique comprend les caractéristiques pédologiques des stations (analyses réalisées dans les laboratoires de pédologie de l’Université de Annaba et de l’INA d’El Harrach, et complétées par une étude antérieure [28]), la structure de la végétation, les indices d’abondance-dominance pour toutes les espèces présentes et, pour les populations accessibles, les caractéristiques dendrométriques des aulnes (hauteur et circonférence à 1,30 m sur des placettes de 10 individus).
2.4 Analyse des données
Les relevés phytosociologiques ont été soumis à des analyses factorielles des correspondances (AFC) à l’aide des logiciels Statos [29] et ADE4 [30]. Une première AFC a été réalisée sur la totalité des relevés et sur les 236 espèces présentes dans au moins 5 relevés, car les espèces peu représentées influencent généralement de manière disproportionnée le résultat des analyses. Dans un second temps, pour caractériser la végétation des zones forestières, une seconde AFC a été réalisée sur les relevés comprenant plus de 25 % d’aulne et sur les mêmes espèces (à l’exception de Filago pygmaea et Fuirena pubescens, qui n’apparaissent pas dans ces relevés). La nomenclature botanique respecte le récent catalogue de la flore de Tunisie [31].
3 Résultats
Les données pédologiques, écologiques et dendrométriques prélevées sur les différentes stations d’A. glutinosa et l’évaluation de la nature et de l’intensité des perturbations d’origine anthropique sont respectivement présentées Tableaux 2 et 3. Les aulnaies étudiées comprennent plus de 400 espèces, dont 236 sont présentes dans au moins 5 des 255 relevés réalisés (Annexe 1). L’AFC réalisée sur l’ensemble des relevés (Fig. 2) met en évidence l’existence d’un gradient entre milieux fermés et milieux ouverts (compétition), ainsi qu’une forte hétérogénéité coenotique liée à un gradient hydrologique. Trois principales communautés à dominante herbacée peuvent ainsi être distinguées :
- • La communauté hydrophytique est dominée par de grandes herbacées hélophytes (Carex elata, C. paniculata, C. pendula, Cladium mariscus, Cyperus longus, Phragmites australis, Schoenoplectus lacustris, Sparganium erectum, Typha domingensis) et comprend des espèces aquatiques (Baldellia ranunculoides, Helosciadium crassipes, Nymphaea alba, Ranunculus baudotii, R. flammula), ainsi que plusieurs Poaceae ubiquistes (Cynosurus polybracteatus, Leersia hexandra, Holcus lanatus, Paspalum distichum, Polypogon monspeliensis) ;
- • La communauté amphibie est organisée autour de Ptéridophytes géophytes (Isoetes histrix, I. velata) et comprend diverses espèces annuelles (Bellis annua, Briza minor, Juncus bufonius, J. capitatus, Lythrum hyssopifolia, Trifolium resupinatum) ;
- • La communauté méso-xérophile, enfin, est organisée selon un gradient depuis des fruticées ouvertes dominées par des phanérophytes arbustifs (Chamaerops humilis, Daphne gnidium, Genista ferox, Halimium halimifolium, Quercus coccifera subsp. pseudococcifera) et de grandes monocotylédones bulbeuses (Asphodelus aestivus, Drimia numidica) jusqu’à des formations herbacées naines comprenant Erodium cicutarium, Euphorbia biumbellata, E. peplis, Filago pygmaea, Geranium molle, Paronychia argentea, Plantago lagopus, Polycarpon tetraphyllum, Spergula arvensis…
Données pédologiques, écologiques et dendrométriques sur Alnus glutinosa. Pour certains sites présentant une diversité importante d’habitats, plusieurs placettes ont été analysées. Le substrat est caractérisé en fonction de la dominance des fractions minéralogiques : argiles (Arg), limons (Lim), sables (Sab) et grès (Gre).
| Code | Substrat | pH | Richesse spécifique | Circonférence (cm) | Hauteur (m) |
| Flu-1 | Sab, Lim | 6,6 | 110 | 60,7 | 6,5 |
| Flu-2 | Sab, Lim | 6,2 | 132 | – | – |
| Flu-3 | Sab, Lim | 6,6 | 81 | 76,7 | 9,5 |
| Flu-4 | Sab, Lim | 5,6 | 116 | 58,6 | 11,2 |
| Flu-5 | Sab | 6,8 | 138 | 96 | 12,6 |
| Flu-6 | Sab, Arg, Lim | 6,6 | 118 | – | – |
| Flu-7 | Sab, Lim | 6,2 | 26 | 65,5 | 9,1 |
| Flu-8 | Sab | 6,7 | 79 | 95 | 11,2 |
| Flu-9 | Sab | 6,6 | 19 | 92,5 | 10 |
| Flu-10 | Sab | 6,4 | 52 | 98,9 | 11,1 |
| Flu-11 | Sab | 6,6 | 81 | 72,2 | 10,1 |
| Flu-12 | Sab, Lim | 6,8 | 79 | 82,3 | 11 |
| Flu-13 | Sab, Lim | 6,7 | 93 | 102 | 10,5 |
| Flu-14 | Sab, Lim | 6,7 | 101 | 119,1 | 17 |
| Flu-15 | Sab, Lim | 7,2 | 77 | 79,1 | 13,2 |
| Lac-1 | Sab, Lim | 5,6 | 142 | 48,3 | 10,1 |
| Lac-2 | Sab | 7,2 | 98 | 88,3 | 12,3 |
| Lac-3 | Sab, Arg | 7,0 | 76 | 105,3 | 14 |
| Lac-4 | Lim | 5,8 | 115 | 106,9 | 16,5 |
| Lac-5 | Sab | 7,3 | 130 | 75,9 | 12,2 |
| Lac-6 | Sab, Arg | 6,8 | 91 | 109,7 | 12,9 |
| Lac-7 | Sab, Arg | 6,4 | 97 | 54,5 | 11,6 |
| Lac-8 | Sab, Arg | 6,7 | 60 | 92,4 | 12,8 |
| Lac-9 | Arg, Gre | 6,7 | 99 | 158,5 | 12,9 |
| Lac-10 | Sab, Lim | 7,5 | 97 | 74 | 11,2 |
| Dun-1 | Sab, Lim | 6,6 | 56 | 107,7 | 17,6 |
| Dun-2 | Sab | 6,3 | 82 | 79,2 | 12,8 |
| Dun-3 | Sab | 5,8 | 77 | 67,2 | 14,7 |
| Dun-4 | Sab | 6,4 | 80 | 8,2 | 4,8 |
| Dun-5 | Sab | 5,9 | 74 | 66,1 | 10,5 |
| Dun-6 | Sab | 6,5 | 58 | 101 | 13,3 |
| Dun-7 | Sab, Lim | 6,4 | 68 | 92,8 | 13,9 |
| Dun-8 | Sab, Lim | 6,1 | 128 | 84,8 | 15,1 |
| Dun-9 | Sab | 6,9 | 89 | 58 | 11,7 |
| Dun-10 | Sab, Lim | 6,1 | 111 | 90 | 8,3 |
Perturbations d’origine anthropique. L’intensité des perturbations a été évaluée sur une échelle de 4 niveaux : absence (), faible (+), moyenne (++) et forte (+++). Le pâturage a été évalué par la présence et l’abondance des troupeaux de bovins, ovins et caprins, sans distinction. Les défrichements sont, à l’exception des cas spécifiés, liés à l’agriculture et se traduisent par le déracinement des aulnes sur des surfaces faibles (+) à importantes (+++). La pollution est essentiellement due aux nitrates (N), aux détergents et huiles de moteur (H) et à des décharges sauvages (DS). Les collectes illégales concernent Frangula alnus (Fa) et Laurus nobilis (Ln). Les espèces introduites envahissantes sont : Acacia spp. (A), Ailanthus altissima (Aa), Eucalyptus spp. (E), Phytolacca americana (Pa), Populus spp. (P), Ricinus communis (Rc) et Taxodium distichum (Td).
| Code | Pâturage | Défrichement et pompage | Pollution | Carrière de sable | Coupe | Collecte illégale | Espèces envahissantes |
| Flu-1 | + | + | + N | + Ln | |||
| Flu-2 | + | + | + N | +++ | + Ln | ||
| Flu-3 | + | + | + N | E | |||
| Flu-4 | + | + | + N | + | + | + Ln | |
| Flu-5 | + | + | + N | E, A | |||
| Flu-6 | + | + | + N | + | A | ||
| Flu-7 | + | + | + N | ||||
| Flu-8 | + | + N | + | ||||
| Flu-9 | + | + N | |||||
| Flu-10 | + | +++ (pont) | ++ N, DS | ||||
| Flu-11 | + | +++ | + N | + | + | ||
| Flu-12 | + | +++ | ++ N, DS | +++ Fa | |||
| Flu-13 | + | +++ (charbonnière) | ++ N, DS | + Ln | Aa | ||
| Flu-14 | + | +++ | + N | ||||
| Flu-15 | + | +++ | + N | ||||
| Lac-1 | + | +++ (tourisme, été) | ++ N, DS | +++ | A, P, Td, Pa | ||
| Lac-2 | + | + | + N | Pa | |||
| Lac-3 | + | +++ | + N | + | |||
| Lac-4 | + | + | + N | ||||
| Lac-5 | + | + | + N | + Fa, Ln | |||
| Lac-6 | + | + | + N | ||||
| Lac-7 | + | + | + N | + | |||
| Lac-8 | + | + | + N | + | |||
| Lac-9 | + | +++ (zoo) | + N | ||||
| Lac-10 | +++ | +++ | + N, H | + Fa | Rc | ||
| Dun-1 | + | +++ | + N | ||||
| Dun-2 | + | +++ | + N | ||||
| Dun-3 | + | +++ | + N | ||||
| Dun-4 | + | +++ | + N | ||||
| Dun-5 | + | +++ | + N | ||||
| Dun-6 | + | +++ | + N | ||||
| Dun-7 | + | +++ | + N | ||||
| Dun-8 | + | +++ | + N | ||||
| Dun-9 | + | +++ | + N | ||||
| Dun-10 | + | +++ | + N |
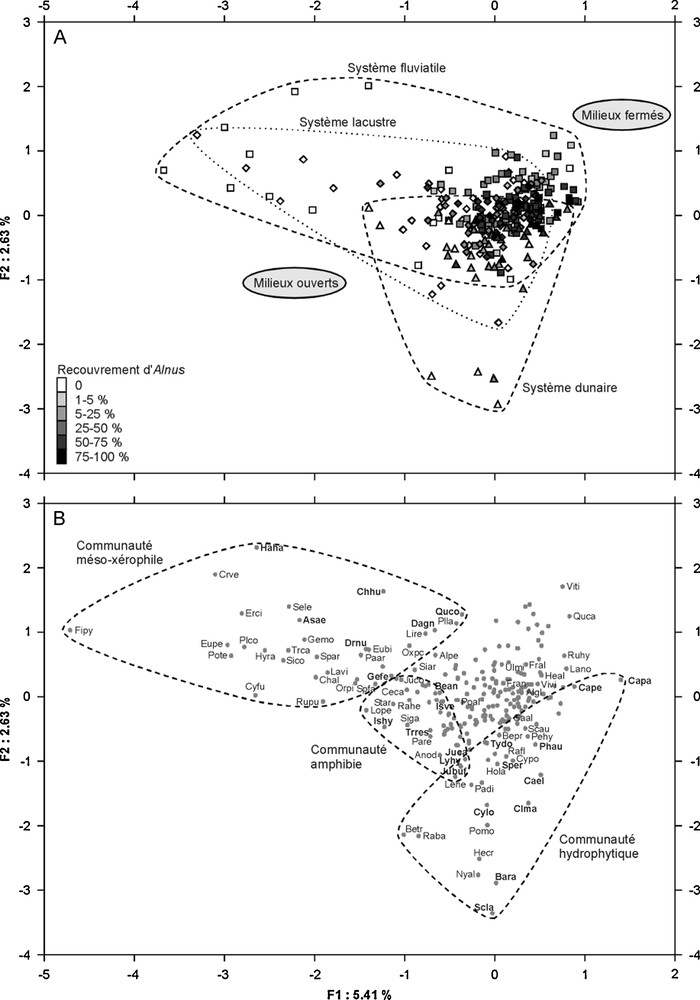
Plan 1/2 de l’analyse factorielle des correspondances (AFC) réalisée sur l’ensemble des 255 relevés (A) et sur 236 espèces (B). Les espèces notées en gras correspondent aux espèces dominantes des communautés distinguées (voir texte pour les détails). Les symboles identifient les différents systèmes : dunaire (triangles), fluviatile (carrés) et lacustre (losanges). La signification des codes des espèces est donnée (Annexe 1).
La Fig. 2 ne permettant pas de mettre en évidence les éventuelles différences floristiques entre les aulnaies des différents systèmes, une seconde AFC a été réalisée sur les relevés comprenant plus de 25 % d’aulne. Les résultats, présentés Fig. 3, révèlent l’existence d’un cortège spécifique aux aulnaies du système fluviatile, qui apparaissent plus diversifiées que les aulnaies des deux autres systèmes. L’ensemble des aulnaies partage toutefois un fond floristique commun, avec :
- • des ligneux arborescents ou arbustifs (Calicotome villosa, Ficus carica, Frangula alnus, Hypericum afrum, Laurus nobilis, Rubus ulmifolius, Salix alba, S. atrocinerea, S. pedicellata) ;
- • des lianes (Calystegia sepium, Hedera algeriensis, Rubia peregrina, Smilax aspera, Tamus communis, Vitis vinifera subsp. sylvestris) ;
- • des herbacées hydrophiles (Bellis prostrata, Carex remota, Helosciadium nodiflorum, Juncus bulbosus, J. effusus, Ludwigia palustris, Lythrum junceum, L. salicaria) ;
- • des Ptéridophytes (Asplenium scolopendrium, Athyrium filix-femina, Equisetum telmateia, Osmunda regalis, Polystichum setiferum, Pteridium aquilinum, Thelypteris interrupta, T. palustris).

Plan 1/2 de l’analyse factorielle des correspondances (AFC) réalisée sur les 150 relevés contenant plus de 25 % d’aulne (A) et sur 234 espèces (B). Le pH, les perturbations et les caractéristiques dendrométriques ont été intégrés à l’AFC en tant que variables supplémentaires (C). Les espèces notées en gras correspondent aux phanérophytes. Les symboles identifient les différents systèmes : dunaire (triangles), fluviatile (carrés) et lacustre (losanges). La signification des codes des espèces est donnée (Annexe 1).
Ce cortège est, selon les systèmes, mêlé d’espèces transgressives de différents milieux plus ou moins ouverts et plus ou moins hydrophiles :
- • des espèces hélophytiques, comme Carex elata, C. paniculata, C. pendula, Cladium mariscus, Cyperus longus, Phragmites australis, Schoenoplectus lacustris, Sparganium erectum et Typha domingensis ;
- • des espèces forestières, comme Acanthus mollis, Asplenium adiantum-nigrum, Cyclamen africanum, Prunus avium, Quercus canariensis, Q. suber et Viburnum tinus, surtout représentées dans le système fluviatile ;
- • des espèces de matorral, comme Asphodelus aestivus, Crataegus monogyna, Cytisus villosus, Erica arborea, E. scoparia, Halimium halimifolium, Olea europaea, Pistacia lentiscus, Quercus coccifera subsp. pseudococcifera et Rosa sempervirens, surtout représentées dans le système fluviatile ;
- • des espèces hydrophytiques, comme Juncus acutus, Nymphaea alba, Ranunculus baudotii et Utricularia vulgaris, généralement très peu abondantes, mais qui présentent d’importants recouvrements dans un site du système dunaire dominé par Populus alba (Dun-7, Demnet Ataoua ; Fig. 1, Tableau 1) ;
- • des espèces de pelouses, qui comprennent à la fois les espèces amphibies de mare temporaire (Eleocharis palustris, Isoetes velata, Juncus heterophyllus, Ranunculus sardous) et des espèces de pelouses thérophytiques (Coleostephus myconis, Isoetes histrix, Juncus bufonius, J. capitatus, Silene gallica).
4 Discussion
4.1 Composition et structure des aulnaies de Numidie
Les relevés floristiques réalisés révèlent, avec 404 espèces recensées (Annexe 1), la très grande richesse spécifique des aulnaies de la région d’Annaba. Ces espèces regroupent un cortège floristique caractéristique des aulnaies, relativement pauvre en comparaison du cortège des aulnaies européennes [14,21], ainsi qu’un grand nombre d’espèces liées aux milieux ouverts (fruticées, pelouses et marais). La structure des aulnaies, caractérisée par le recouvrement de l’espèce dominante (A. glutinosa), influence fortement la composition floristique. Plusieurs communautés de dégradation peuvent ainsi être définies, en fonction de l’hydromorphie du substrat et du milieu environnant : (1) une communauté hydrophytique, dominée par des hélophytes et des espèces aquatiques, se développant sur des sols inondés toute l’année, surtout en bordure des lacs, (2) une communauté amphibie, comprenant les espèces caractéristiques des pelouses temporaires à isoètes, développée sur les substrats soumis à des inondations saisonnières, et (3) une communauté méso-xérophile transgressive des milieux environnants, qui remplace l’aulnaie sur substrat sec.
La structure verticale des aulnaies de Numidie est complexe et organisée en strates bien différenciées, similaires à celles qui ont été décrites pour les formations comparables d’Europe occidentale [32–33]. Elle comprend généralement une strate arborescente qui peut atteindre 20 à 25 m de hauteur (A. glutinosa, Fraxinus angustifolia, Populus alba, Quercus canariensis, Salix alba), une strate arbustive souvent à tendance laurifoliée (Ficus carica, Hypericum afrum, Frangula alnus, Laurus nobilis, Rubus ulmifolius, Salix pedicellata, Ulmus minor), une strate lianescente (Calystegia sepium, Hedera algeriensis, Rubia peregrina, Smilax aspera, Tamus communis, Vitis vinifera subsp. sylvestris) et une strate herbacée, composée d’espèces sciaphiles et hydrophiles (Athyrium filix-femina, Carex remota, Ludwigia palustris, Osmunda regalis, Thelypteris interrupta). Cette structure complexe témoigne de l’âge de ces formations [34,35], qui, bien que peu de régénérations soient observées à l’intérieur des aulnaies fermées, semblent se régénérer à la faveur de chablis naturels et se maintenir ainsi sur le long terme. La dynamique de régénération est d’ailleurs extrêmement rapide et vigoureuse dans les zones récemment défrichées, à la fois à partir de graines et de rejets de souche.
La composition des aulnaies apparaît relativement constante sur l’ensemble de la Numidie algérienne, avec un cortège commun bien individualisé (Fig. 2 et 3). Seules les aulnaies du système fluviatile se distinguent sensiblement des aulnaies des deux autres systèmes par la plus grande diversité des canopées, où A. glutinosa est souvent associé sinon co-dominant avec Fraxinus angustifolia, Populus alba, Quercus canariensis, Salix alba, S. atrocinerea, S. pedicellata et/ou Ulmus minor. S. atrocinerea apparaît particulièrement lié aux aulnaies, dont il constitue un stade pionnier (saulaie rousse) et dont il structure souvent les manteaux de lisière [14].
4.2 Phytosociologie des aulnaies de Numidie
Sur le plan phytosociologique, les aulnaies de Numidie appartiennent à deux ensembles différents. D’une part, les aulnaies riveraines, développées sur des sols bien oxygénés et soumises à des alternances saisonnières d’inondation et d’assèchements, relèvent de la classe des Querco-Fagetea Br.-Bl. & Vlieg. 1937 et de l’ordre des Populetalia albae Br.-Bl. 1931 [13] ; d’autre part, les aulnaies marécageuses, développées sur des sols en permanence engorgés et anoxiques, tourbeux ou paratourbeux (de type anmoor) sont assimilées à la classe des Alnetea glutinosae Br.-Bl. & R.Tx 1943 et à l’ordre des Alnetalia glutinosae R.Tx 1937 [14].
Les aulnaies riveraines, affines des aulnaies d’Europe sud-occidentale, sont rattachées à l’alliance de l’Osmundo-Alnion Drske. & Riv.-Mart. 1975, au sein de laquelle elles déterminent une sous-alliance de répartition nord-africaine, le Campanulo alatae-Alnenion glutinosae Bensettiti & Lacoste 1999. Ces formations ont été attribuées à une association restreinte à la région Numidie-Kroumirie, le Rubo caesii-Alnetum glutinosae Bensettiti & Lacoste 1999 [21,24,36], considérée comme vicariante régionale de l’Osmundo-Alnetum glutinosae Van den Berghen 1971 européen. Cette dénomination nous paraît douteuse en regard de la grande rareté de Rubus caesius en Algérie, où il est limité aux Aurès [37], et de son absence en Tunisie [18,31]. Cette espèce pourrait avoir été confondue dans l’étude de Bensettiti & Lacoste [21] avec R. ulmifolius, très abondante dans les aulnaies de Numidie-Kroumirie. Outre les caractéristiques d’alliance (Athyrium filix-femina, Circaea lutetiana, Iris pseudacorus et Osmunda regalis), ce syntaxon est nettement différencié par la présence d’Allium triquetrum, Helosciadium nodiflorum, Salix pedicellata, Vitis vinifera subsp. sylvestris, et surtout de Campanula alata, une endémique nord-africaine qui trouve son optimum dans les forêts d’A. glutinosa [21,34]. Ces aulnaies riveraines sont en outre caractérisées par un contingent d’espèces des Populetalia albae (Arum italicum, Fraxinus angustifolia, Populus alba, Tamus communis, Ulmus minor), auxquelles peuvent être ajoutées quelques transgressives des Quercetea ilicis qui y sont particulièrement abondantes (Asparagus acutifolius, Ficus carica, Laurus nobilis, Rubia peregrina, Smilax aspera) [21].
Les aulnaies marécageuses, surtout développées dans les systèmes dunaires et lacustres, se distinguent essentiellement des aulnaies riveraines par l’absence de la plupart des espèces des Populetalia, à l’exception notable de Carex remota et de quelques autres espèces beaucoup plus rares. Les conditions hydromorphes en permanence des sols et leur caractère tourbeux [20] paraissent notamment responsables de la disparition de Fraxinus angustifolia, Populus alba et Ulmus minor, qui trouvent leur optimum dans les vallées alluviales, sur sol minéral, oxygéné et inondé par intermittence. Les aulnaies marécageuses de la Numidie sont rattachées à l’alliance de l’Alnion glutinosae Malcuit 1929, dont elles constituent une forme méridionale, floristiquement appauvrie, en situation d’isolat périphérique, et à une association d’aire numidienne, le Rusco hypophylli-Alnetum glutinosae Géhu, Kaabeche & Gharzouli 1994 [14]. Cette association se distingue principalement des syntaxons vicariants d’Europe occidentale (le Carici elongatae-Alnetum glutinosae médio-européen, le Carici laevigatae-Alnetum glutinosae atlantique, l’Osmundo-Alnetum glutinosae basquo-cantabrique, et l’Hydrocotylo-Alnetum glutinosae italien) par la présence de Ruscus hypophyllum. Ces aulnaies marécageuses sont en outre caractérisées par quelques rares espèces transgressives des Populetalia albae (Athyrium filix-femina, Iris pseudacorus, Osmunda regalis) et des Quercetea ilicis (Ficus carica, Laurus nobilis, Rubia peregrina, Smilax aspera), ici associées à Carex pendula, Salix atrocinerea, Thelypteris interrupta et T. palustris. La succession hydrosérale de ces aulnaies marécageuses semblent faire intervenir deux stades décrits en Kroumirie (Tunisie) : le Cariceto-Sphagnetum plumulosi Labbe & Nègre 1952, caractérisé par Carex punctata et Sphagnum auriculatum, et l’Osmundo-Ericetum scopariae Nègre 1952, caractérisé par Erica scoparia et Osmunda regalis [17]. Ces communautés pourraient jouer un rôle majeur dans le maintien à long terme des aulnaies marécageuses, dans le cadre d’une succession cyclique similaire à celle mise en évidence pour une aulnaie de plaine alluviale en République Tchèque [38].
4.3 Évolution récente, usages actuels et menaces
Les résultats obtenus mettent en évidence le déclin rapide des aulnaies de la Numidie algérienne. La comparaison de nos relevés de végétation avec ceux réalisés précédemment [23,24,39] dans l’aulnaie de Righia (Flu-2), qui constitue, avec ses 400 ha, la plus grande aulnaie d’Afrique du Nord, révèle la dégradation rapide de cette forêt humide exceptionnelle. Ce n’est malheureusement pas un cas isolé, car la plupart des aulnaies du nord-est algérien ont subi de semblables dégradations au cours des deux dernières décennies. C’est en particulier le cas des aulnaies d’Ain Bergougaia et du Lac Bleu (Flu-12, Lac-10), qui sont aujourd’hui en grande partie détruites. Ces dégradations, sous l’influence des perturbations anthropiques généralisées (pompages excessifs et incontrôlés, défrichements à finalité agricole, surpâturage, incendies volontaires, coupes illicites, décharges sauvages, prélèvements non réglementés), se traduisent par : (1) le recul rapide des marges des aulnaies, principalement marécageuses, sous l’influence des défrichements pour l’agriculture (cultures maraîchères, arachides et pastèques) ; (2) l’assèchement du sol, la modification du régime hydrologique et la salinisation des eaux souterraines, sous l’influence des pompages réalisés directement dans les aulnaies ou dans les nappes souterraines, qui affectent en particulier les aulnaies de Sidi Freitis, de Righia et du Lac Bleu (respectivement, Dun-9, Flu-2, Lac-10) ; (3) la dégradation de la qualité de l’eau, sous l’influence des rejets d’eaux usées, des effluents industriels et du ruissellement des intrants d’origine agricole, entraînant des problèmes d’eutrophisation par exemple dans les bassins du Lac Oubeira et du Lac Bleu (respectivement, Lac-2, Lac-3, Lac-10) ; (4) la dégradation du couvert végétal et la pollution liée à l’installation de décharges sauvages dans certains sites, comme Berrihane, Ain Bergougaia et Demnet Errihane (respectivement, Dun-1/4, Flu-12, Lac-2) ; (5) la régression des espèces présentant un intérêt économique pour les populations locales, comme la bourdaine (Frangula alnus) et le laurier sauce (Laurus nobilis) ; (6) enfin, la modification des conditions locales et des équilibres compétitifs, liée à l’introduction d’espèces exogènes, telles que les acacias (Acacia spp.), les eucalyptus (Eucalyptus spp.) ou le cyprès chauve (Taxodium distichum).
Ces changements s’accompagnent de la raréfaction, voire de la disparition de certaines espèces caractéristiques, souvent restreintes à la Numidie. C’est notamment le cas de Thelypteris palustris, qui n’était connu que de l’aulnaie de Demnet Ataoua, dans la plaine de Guerbès-Senhadja [37], et qui n’y a pas été revu récemment, ainsi que de Thelypteris interrupta (= Dryopteris gongylodes subsp. propinqua), qui était signalé dans la région d’El Kala [37], où il n’a été retrouvé qu’à Oum Lâagareb, Righia, Bouglès, Kef Oum Chetoub et au Lac Bleu (respectivement, Flu-1, Flu-2, Flu-6, Flu-11, Lac-10). C’est également le cas de Sphagnum auriculatum, autrefois connue dans la plaine de Guerbès-Senhadja, au marais de Demet près d’El Kala, et à Demnet Errihane (Lac-2 [8]) et qui n’a plus été observée qu’à Aïn Bergougaia (Flu-12), près de la frontière algéro-tunisienne, où sa survie est menacée par les diverses perturbations qui affectent ce site. Nous pouvons enfin citer Campanula alata, qui était considérée comme assez commune en Numidie algérienne [37] et qui n’a été retrouvée qu’à Sidi Makhlouf (Dun-8), et Borago longifolia, endémique des zones humides du nord de l’Algérie, considérée comme assez rare [37] et qui n’a été retrouvée qu’à Oum Lâagareb (Flu-1).
Les modifications des conditions environnementales responsables de ces régressions paraissent avoir, en revanche, favorisé un certain nombre d’espèces indicatrices de pollution et d’eutrophisation, comme les Lemnaceae (Lemna minor, Wolffia arrhiza), Cotula coronopifolia ou Potamogeton trichoides, apparus au Lac Bleu en 1997 [40]. Plusieurs espèces naturalisées (Oxalis floribunda, Paspalum distichum, Phytolacca americana, Ricinus communis) et indigènes (Juncus heterophyllus) s’intègrent probablement au cortège des aulnaies à la faveur de perturbations exogènes modifiant les conditions locales (ouverture de la canopée, assèchement du substrat). L’absence de corrélation claire entre l’abondance de ces différentes espèces et les dégradations observées dans le cadre de cette étude suggèrent une influence complexe des perturbations en fonction du système hydrologique, de la taille des aulnaies et de leur proximité avec les zones urbanisées. En outre, la rapidité du processus rend souvent difficile la perception et l’évaluation des différents types de perturbations.
5 Conclusions et implications pour la conservation
Les aulnaies marécageuses de la région d’Annaba-El Kala sont considérées comme le terme régional de la succession hydrosérale des dépressions humides d’eau douce [17]. Leur grande richesse floristique (plus de 400 espèces si l’on considère les faciès de dégradation) est en partie liée à leur localisation géographique, au carrefour entre des influences biogéographiques d’origine tropicale, atlantique, méditerranéenne et euro-sibérienne. Cette particularité régionale a récemment motivé la définition de la région Kabylies-Numidie-Kroumirie en tant que point-chaud de biodiversité, au sein de l’ensemble méditerranéen [1]. Les aulnaies de Numidie abritent en particulier une riche flore d’origine euro-sibérienne, ici en situation d’isolement périphérique, ce qui leur confère une importance particulière en terme de conservation de la diversité génétique des espèces considérées [41,42]. Au vu de l’importance majeure et de la vulnérabilité de leurs communautés biologiques, la situation préoccupante et le déclin rapide des milieux humides du nord-est algérien [4,10,11,14,43], qui, comme le révèle la présente étude, affecte fortement les aulnaies, devrait se traduire de toute urgence par la mise en place de mesures de protection adaptées et d’une gestion raisonnée des activités humaines. L’implémentation de telles mesures conservatoires aurait dû être facilitée depuis plus de 20 ans par l’élection de nombreux habitats au statut de sites Ramsar ou par leur inclusion dans le périmètre du Parc National d’El Kala.
Les plus grandes menaces qui pèsent actuellement sur les aulnaies de la Numidie algérienne (ainsi que plus généralement sur les aulnaies du Maghreb) sont incontestablement liées aux activités humaines, dont l’impact croissant atteint des proportions alarmantes : urbanisation incontrôlée, intensification des pratiques agricoles, défrichements illicites, pollution par rejets domestiques et industriels, surpâturage, incendies criminels, sablières, développement anarchique du réseau routier et prélèvement non réglementé d’espèces en déclin comme le laurier noble (Laurus nobilis) et la bourdaine (Frangula alnus). Le morcellement et la perte d’intégrité des aulnaies les rendent d’autant plus vulnérables aux perturbations et à l’assèchement du climat prévu pour les décennies à venir [44]. Il devient urgent d’identifier avec précision les causes ultimes de la dégradation de ce patrimoine naturel exceptionnel, et d’en évaluer l’ampleur et les conséquences structurelles et fonctionnelles avant d’envisager toute action de préservation ou de restauration. La responsabilité de ce travail revient aux organismes gestionnaires (parc national, réserves…), avec le concours de scientifiques spécialistes des disciplines nécessaires et l’aide financière de la communauté internationale.
La conservation des zones humides de Numidie algérienne en général, et des aulnaies en particulier, implique donc de mieux comprendre à la fois les relations entre les populations locales et les écosystèmes naturels, et le fonctionnement de ces écosystèmes. Le premier volet, qui devrait intégrer l’étude socioéconomique des comportements, des besoins et des motivations qui amènent les habitants des zones concernées à surexploiter parfois jusqu’à leur destruction complète les ressources naturelles [45], devrait permettre de proposer des modes de fonctionnement alternatifs compatibles avec une gestion durable des milieux naturels. Une des pistes à explorer pourrait être le développement de l’écotourisme, sur la base des paysages et du patrimoine naturel exceptionnels de la région. Le second volet, concernant l’étude des milieux naturels, devrait apporter une meilleure compréhension de leur fonctionnement et de leur réponse aux perturbations. Pour cela, il apparaît nécessaire de poursuivre les études hydrologiques (variations saisonnières des niveaux d’eau, qualité des eaux…) et écologiques (flore, faune, plancton…) [40,42], et de mettre en place des programmes de suivi dans le temps de l’évolution des écosystèmes [46]. L’ensemble de ces données constituera la base indispensable à l’élaboration de plans de gestion dans une optique de développement durable de la Numidie algérienne. Dans l’attente de la réalisation de ces différentes études, il est toutefois nécessaire, afin de gérer les problèmes immédiats et d’enrayer à court terme la régression des zones humides de la région, de mettre en place immédiatement des zones de réserve intégrale, totalement interdites d’accès.
Conflit d’intérêt
Aucun des co-auteurs de ce manuscrit n’a de conflits d’intérêt.
Remerciements
L’étude a bénéficié de financements dans le cadre du Projet National de Recherche (PNR2 63/08/98), en collaboration entre l’Institut National de Recherches Forestières (INRF) et le Centre de Recherches Scientifiques et Techniques des Régions Arides (CRSTRA), dans le cadre du programme Egide-CMEP Tassili (PHC 09mdu786) et dans le cadre d’un programme algéro-tunisien (Projet Conjoint de Recherche Tunisie/Algérie). Nous remercions Abbas Belghit et Ahmed Houili Bachir (Conservation des forêts d’El Tarf) pour leur aide sur le terrain, et Amina Daoud-Bouattour et deux reviewers anonymes pour leurs commentaires qui ont permis d’améliorer le manuscrit. Cette publication est la contribution ISEM-2010-143.


