Abridged English version
Wetlands deserve a number of functions, comprising inundation control, groundwater recharge, chemical trapping and nutrient recycling, and harbour remarkable habitats and adapted floras and faunas. In Mediterranean regions, and more particularly in North Africa, wetlands contain a very rich, but declining biodiversity. In Algeria, wetlands are mainly concentrated on the northeastern coast and are very rarely protected from anthropogenic disturbances, even if they are recognised as conservation priorities, for instance through the ‘Ramsar site’ status. Previous investigations underline the exceptional richness of the wetlands of Kabylia, Numidia and Kroumiria. However, very few studies dealt with them, and most of them focused on the great wetland complexes of Annaba-El Kala and Guerbès-Senhadja. No scientific study has ever been published on other wetlands of northeastern-Algeria, which, like Beni-Belaid Wetland (36°52′36″N ; 06°06′16″E ; 0–3 m), are completely unknown by the international community. A preliminary report revealed in 2000 the major interest of this wetland, which notably houses Lutra lutra, Mauremys leprosa, Emys orbicularis, Porphyrio porphyrio, Ixobrychus minutus, Alcedo atthis, Aythya nyroca, Acrocephalus scirpaceus, as well as the endemic fish Pseudophoxinus callensis. Despite its recognition as a Ramsar site in 2003, neither study nor management has been still implemented, with the exception of a discontinuous enclosure installed in 2008 on the southern shore of the lake. The wetland is presently highly threatened on its sea side by the inward displacement of the coastal dune, and on its inland side by human activities, including agriculture, pumping, grazing, hunting and fishing. This worrying situation motivated the present study, which aims at: (1) evaluating the species and community richness of the Beni-Belaid Wetland, and specifying the ecological controls of its hydrophytic vegetation; (2) assessing its conservation status just after its election as Ramsar site; and (3) proposing avenues for its long-term conservation management. The work is based on phytoecological data recovered at each season during three consecutive years (2003–2005).
The inventory of the flora of Beni-Belaid Wetland reveals the local occurrence of 201 species, representing five biogeographical elements: eurasiatic/circumboreal (37.3%), circum-Mediterranean (30.3%), cosmopolitan/subcosmopolitan (12.9%), western Mediterranean (10.0%) and tropical/subtropical (7.5%). The local flora moreover contains two endemics (Battandiera amoena, Biscutella raphanifolia), and at least three introduced species (Cotula coronopifolia, Cyperus eragrostis, Ludwigia peploides). Four communities are discriminated by a correspondence analysis: (1) the psammophilous community (class Ammophiletea); (2) the hydrophytic community (class Potamogetonetea pectinati, order Potamogetonetalia pectinati, alliance Nymphaeion albae); (3) the helophytic community (class Phragmiti-Magnocaricetea, orders Phragmitetalia australis and Scirpetalia compacti); and (4) the forest community (class Querco-Fagetea, order Populetalia albae, alliance Populion albae). This richness mainly reflects the diversity of microhabitats and ecological conditions, but the diversified biogeographical affinities of the species also reveal the importance of past migrations during pluvial-interglacial periods for tropical/subtropical and Atlantic species, and during interpluvial-glacial periods for eurasiatic/circumboreal species. However, the rarity of endemics in North African wetlands suggests the long-term persistence of genetic fluxes, maybe due to migratory waterbirds.
The plant mosaic of Beni-Belaid is mainly controlled by hydrology and human-induced disturbances, which appear as the major controls of North African wetlands. The hydrological gradient, from permanent open waters to rarely inundated soils, is clearly related to the deltaic origin of the wetland. The hydrology is also characterised by an intra-annual cyclicity, mainly due to the summer development of hydrophytic and helophytic plants. The complex influence of hydrology allowed the local development of five rare plants, classed vulnerable (Nymphaea alba, Persicaria amphibia, Rumex palustris) or near threatened (Baldellia ranunculoides, Helosciadium crassipes) on the red list of wetland plants of North Africa. The influence of anthropogenic disturbances is revealed by aerial photographs and multivariate analyses, which show the spread of nitrophilous and adventice species (translating the proximity of fields), and of stress-tolerant ones (translating the influence of overgrazing). The livestock pressure for several decades is moreover responsible for the erosion of the coastal dune, which progressively overruns the lake. Like other Mediterranean ecosystems, Mediterranean wetlands are however adapted since the Neolithic to an extensive grazing. Grazing suppression, likely to lead to habitat closing and to favour competitive monospecific communities, should be avoided. In return, a moderate disturbance regime could be used in order to generate and manage an optimal biodiversity by increasing the spatial heterogeneity. The conservation of Beni-Belaid Wetland implies first its protection from agricultural impacts and invasive species introductions, by restoring the riparian forest. For this, grazing should be at least temporarily excluded from large parts of the lake rive and from the surrounding dune complexes. Intensive pumping, associated to dam constructions are likely to modify on the short term the hydrology of the alluvial plain, to affect the transport and deposition of sediments by rivers and to lead to soil salinisation. The summer water-table lowering observed for 10 years at Beni-Belaid has already triggered vegetation changes: several species regressed (H. crassipes, N. alba), while some others spread (Ceratophyllum demersum, Myriophyllum spicatum, Lemna minor, Phyla nodiflora). These changes could have favoured invasive species such as Cotula coronopifolia, Cyperus eragrostis, Ludwigia repens and P. nodiflora, and indigenous opportunistic species such as Juncus acutus and Bolboschoenus glaucus. Finally, hunting and fishing are practiced without management or restriction, and are likely to affect waterbird, fish and mammal communities.
The present-day situation of Beni-Belaid Wetland is similar to most other exceptional wetlands of northeastern Algeria. This questions the efficiency and consistency of the ‘Ramsar site’ status (http://www.ramsar.org), which does not result in sufficient conservation managements. Methods and knowledge allowing control of the increasing anthropogenic pressure however exist and are already applied in diverse Mediterranean regions. Locally, maintaining the hydrological functioning of Beni-Belaid Wetland appears as the main conservation goal. The first measure should be protecting integrally the wetland from grazing, cutting and other human-induced disturbances, and to restore a protecting forested belt. It is also urgent to implement the monitoring of biological communities, in order to adapt conservatory measures. These first measures would, however, be insufficient for preserving Beni-Belaid Wetland on long term. The integral protection, while allowing conservation on the short term, will create problems such as the reproductive isolation of populations or the decrease in energy and matter fluxes with adjacent ecosystems. It is thus important to plan the implementation of migratory ways for animal and plant species between Beni-Belaid and the closest wetlands. This set of conservatory measures should moreover be accompanied by an information program about the interests of wetland conservation, in order to involve local populations in the wetland management. Compensations for loosed cultivated lands could be provided by the improvement of agro-pastoral practices, by financial supports in non-protected zones, by the creation of works in the conservation field, and by the development of an ‘eco-tourism’ like in European and North American natural areas. The long-term preservation of the Ramsar site of Beni-Belaid and of all other threatened wetlands of North Africa will not be effective without the actual awareness of public authorities, and without the will of reaching sustainable compromises between agricultural interests and the conservation of such a unique natural heritage.
1 Introduction
Les zones humides jouent des rôles écologiques et paysagers majeurs, parmi lesquels le contrôle des inondations, la recharge des aquifères, le piégeage des éléments chimiques toxiques et le recyclage des nutriments [1,2]. Elles constituent en outre des habitats remarquables pour des flores et des faunes adaptées, contribuant fortement aux biodiversités régionales [3–5]. Les régions caractérisées par un climat de type méditerranéen abritent des milieux humides particulièrement riches et diversifiés, et très généralement en fort déclin [6]. C’est en particulier le cas des mares temporaires méditerranéennes, qui, en dépit des faibles superficies qu’elles représentent, sont aujourd’hui reconnues comme des milieux d’importance prioritaire en termes de biodiversité [7–9]. En Algérie, bien que les régions arides présentent de vastes dépressions salées continentales (chotts, sebkhas et oasis), les zones humides sont surtout concentrées dans le nord-est du pays, à proximité du littoral méditerranéen. En dépit de leur richesse biologique exceptionnelle pourtant reconnue depuis longtemps [10,11], ces milieux sont à ce jour presque totalement ignorés et ne font l’objet que de très peu de mesures de conservation. Ils accusent en conséquence un déclin extrêmement inquiétant, sous l’influence de pressions anthropiques diverses (pompage, drainage, pâturage, pollution, mise en culture… [12–14]).
Les premières prospections de la flore phanérogamique des milieux humides de l’Afrique du Nord ont été réalisées par Labbe et Desfontaines entre 1885 et 1887. Elles ont essentiellement porté sur le littoral nord-oriental de l’Algérie, entre El Kala (ex-La Calle) et Annaba (ex-Bône). D’autres botanistes ont exploré l’ensemble du littoral algérien : Durieu de Maisonneuve de 1840 à 1842, Le Franc de 1859 à 1861, Letourneux et Kralick en 1861, Cosson en 1879, Battandier et Trabut en 1902, Gauthier-Lièvre de 1923 à 1929 et Maire en 1930 [11]. Les recherches plus récentes [14–20] se sont attachées à décrire et à comprendre l’organisation, la structure et la diversité des communautés végétales des zones humides de ces régions. Elles ont souligné la richesse floristique exceptionnelle de ces milieux, qui jouent le rôle de zones refuges pour de nombreuses espèces relictuelles animales et végétales. Leur flore phanérogamique est en effet constituée par un mélange d’espèces d’origines biogéographiques diverses, principalement en raison de la situation géographique de l’Algérie septentrionale, véritable carrefour migratoire à l’interface entre les domaines européen, atlantique, méditerranéen et tropical [21]. La grande richesse de cette région a récemment suscité la proposition de classer la zone phytogéographique comprenant la Kabylie, la Numidie algérienne et la Kroumirie (Tunisie) en tant que point chaud de biodiversité [22]. Cette zone répond en effet à la définition des hotspots [23], qui porte à la fois sur la richesse spécifique, le taux d’endémisme [24] et les menaces anthropiques croissantes [25].
Les études écologiques les plus récentes se sont focalisées sur les complexes humides de Senhadja-Guerbès et Annaba-El Kala, en Numidie [12–14,18,19,26]. Les rares zones humides situées sur le littoral de la Kabylie, à l’ouest de la Numidie, n’ont en revanche quasiment pas été étudiées. Les seuls travaux existants [21,27] ont été réalisés sur les zones humides d’eau douce de Beni-Belaid et d’El-Kennar, dans la willaya de Jijel (Kabylie). L’étude [21], qui a porté sur l’inventaire préliminaire des ressources biologiques, a mis en évidence l’intérêt écologique international de ces sites comme habitats pour la loutre (Lutra lutra) et les oiseaux d’eau. Le site de Beni-Belaid abrite notamment des populations sédentaires de talève poule-sultane (Porphyrio porphyrio), de blongios nain (Ixobrychus minutus) et de martin-pêcheur (Alcedo atthis), ainsi que des populations migratrices potentiellement nicheuses de fuligule nyroca (Aythya nyroca) et de rousserole effarvatte (Acrocephalus scirpaceus). Il abrite également le Cyprinidé endémique algéro-tunisien Pseudophoxinus callensis, et deux espèces de tortues aquatiques, l’émyde lépreuse (Mauremys leprosa) et la cistude d’Europe (Emys orbicularis). Sur cette base, la zone humide de Beni-Belaid, située à l’arrière d’un cordon dunaire, à l’embouchure de l’Oued El Kébir, a été classée comme site Ramsar en 2003. En dépit de ce statut, ce milieu n’a jamais été étudié en détail et ne fait encore aujourd’hui l’objet d’aucune mesure de gestion ou de protection, à l’exception d’une clôture grillagée installée depuis 2008 sur la rive sud du lac. Le plan d’eau est pourtant menacé, d’un côté par l’ensablement lié à l’action des courants marins et des vents qui entraînent un déplacement du cordon dunaire vers l’intérieur des terres, et d’un autre côté par l’empiètement des activités humaines (agriculture, pompage, pâturage, chasse, pêche) sur les habitats humides. Plusieurs parties du lac ont d’ailleurs disparu depuis 2003, parmi lesquelles des zones peu profondes localisées à l’extrémité est du site.
Cette situation inquiétante a motivé la présente étude, avec pour objectifs : (1) d’évaluer les richesses spécifique et phytocénotique du site et de préciser les déterminismes écologiques de la composition et de la structure de la végétation hydrophytique, (2) d’établir un état des lieux de la gestion et de la conservation de site juste après son classement Ramsar, et (3) de proposer sur ces bases, des éléments pour une gestion conservatoire appropriée. Ce travail est basé sur des données phytoécologiques recueillies toutes les saisons durant trois années successives (2003–2005). Afin d’analyser la structure et le fonctionnement de l’écosystème, la variation des communautés végétales a été prise en compte à la fois dans le temps (dynamique temporelle) et dans l’espace (structure spatiale).
2 Matériel et méthodes
2.1 Contexte géographique, géomorphologique et climatique
La région de Beni-Belaid est située dans l’une des séries géologiques complexes des zones côtières du secteur des massifs anciens de la petite Kabylie, dans le Nord-Est de l’Algérie (Fig. 1). Elle est délimitée par des chaînes montagneuses essentiellement formées de terrains métamorphiques, recouvertes de lambeaux argilo-gréseux d’âge oligo-miocène et traversées par des roches éruptives d’âge miocène [28]. Ces montagnes sont très accidentées et entaillées par de profondes vallées à évolution morphologique très rapide. La plaine elle-même se caractérise par des nappes de charriage, d’alluvions argileuses, de limons et de sables du Quaternaire. Sous l’influence directe de la Méditerranée, cette région est caractérisée par un bioclimat méditerranéen humide. Elle recueille plus de 1000 mm/an avec de larges fluctuations interannuelles (de 633 à 1202 mm/an sur la période 1995–2006), la période humide s’étendant sur huit mois (octobre à mai). Les températures moyennes mensuelles oscillent entre 15 °C durant l’hiver et 25 °C durant l’été [21,29].

Orographie et réseau hydrographique de la région de la zone humide de Beni-Belaid.
L’Oued El Kébir, qui alimente la zone d’étude, prend sa source dans les chaînons montagneux de la Numidie occidentale, où il porte le nom d’Oued Rhumel. Il traverse la plaine de Belghimouze, avant de gagner la mer en franchissant un cordon littoral de faible largeur (au plus 300 m). En dépit de son étroitesse, le cordon littoral constitue un obstacle à l’écoulement des eaux en période de basses eaux, entraînant ainsi la création de méandres. L’oued est actuellement dévié vers l’ouest, et éventre périodiquement le lido (Fig. 2). La zone humide étudiée, située sur la rive ouest de l’embouchure de l’Oued El Kébir, se trouve sur la commune d’Oued Adjoul, daira d’El Ancer, à environ 32 km du chef-lieu de wilaya Jijel. Elle constitue le prolongement de la plaine alluviale de Belghimouze, d’une superficie de 1800 ha, alimentée par un réseau hydrographique très dense qui trouve son origine dans la chaîne montagneuse du Djebel Aourar (Fig. 1) [28]. Ce réseau hydrographique, caractérisé par de nombreuses confluences, est marqué par des crues annuelles puissantes qui entraînent le dépôt de limons organiques dans la plaine.

Photographies aériennes de la zone humide de Beni-Belaid (1973, 2004 ; source : Institut national de cartographie et de télédétection d’Alger) et localisation des relevés floristiques réalisés autour du lac. La carte a été dessinée à partir de la photographie aérienne Google Earth du 24.06.2009.
2.2 Site étudié
La zone humide de Beni-Belaid (36°52′36″N ; 06°06′16″E ; 0–3 m d’altitude ; Fig. 2) appartient aux domaines de l’état et est gérée par la Conservation des Forêts de Jijel. Elle occupe une dépression parallèle au littoral méditerranéen, limitée au nord par la Méditerranée et au sud par des terrains agricoles. Elle est alimentée par les eaux de pluie, par les résurgences de la nappe phréatique et, par intermittence, par l’Oued Adjoul qui sillonne diagonalement la plaine dans sa partie nord. Lors des crues de faible récurrence, peu dévastatrices, il se produit des débordements et des inondations qui constituent des marécages temporaires. Ce phénomène empêche l’exploitation agricole de décembre jusqu’en mars–avril. Le site a une grande importance sur le plan hydrologique : en période de faible pluviosité, il assure l’alimentation de l’aquifère de Belghimouze et en période de forte pluviosité, il participe à tamponner les crues, notamment par la rétention des eaux excédentaires de l’Oued Adjoul.
La zone humide est située entre deux cordons dunaires littoraux (Fig. 2). Le substrat, dominé par les sables (> 95 %) sur les rives au contact des dunes, devient argilo-limoneux au centre des plans d’eau. L’eau, d’un pH de 7,8, présente une conductivité moyenne de 600 μs/cm. La proximité d’un tel écosystème dulçaquicole avec le littoral, tout en étant exceptionnelle, n’est pas un cas isolé dans le Maghreb, puisque de tels milieux sont connus au Maroc Atlantique Nord (lac de Sidi Bou Rhaba [30]) et dans le complexe humide d’Annaba-El Kala [14,18]. La zone humide de Beni-Belaid représente en outre l’extrémité occidentale d’un ensemble de zones humides qui occupe les plaines littorales entre les Mogods (Tunisie) et la petite Kabylie (Algérie). Elle est constituée d’un plan d’eau permanent (prof. 2,5 m) à l’ouest et d’une zone temporaire à l’est (prof. 0,2–0,6 m) pour une superficie d’environ 10 ha. Les plans d’eau sont entourés par une ceinture de végétation palustre, essentiellement composée de Bolboschoenus glaucus, Phragmites australis, Tamarix africana, T. gallica, Typha domingensis et Vitex agnus-castus. Les hydrophytes sont représentés par des espèces libres comme Ceratophyllum demersum et Lemna minor, et des espèces radicantes comme Nymphaea alba, Myriophyllum spicatum, Persicaria amphibia, Potamogeton lucens, P. pectinatus et Zannichellia palustris. À l’extrémité ouest du lac, s’étend une peupleraie âgée à Populus alba, dont le sous-bois comprend Nerium oleander, Rosa sempervirens, Rubus ulmifolius et Smilax aspera. Un cordon dunaire sépare le lac de la Méditerranée. Depuis la ligne de rivage, on rencontre successivement des plages colonisées par Cakile maritima et Salsola kali, des dunes vives dominées par un couvert herbacé plus dense, caractérisé au printemps par Calystegia soldanella, et enfin, des dunes plus ou moins stabilisées, dominées par Eryngium maritimum, Euphorbia peplis, Medicago marina, Otanthus maritimus, Pancratium maritimum, Phyla nodiflora, et deux espèces très rares en Algérie, Echinophora spinosa et Matthiola incana [31]. Au bord du lac, sur la dune, se développe une ceinture ligneuse composée de R. sempervirens, R. ulmifolius, Retama raetam subsp. bovei, Tamarix africana, T. gallica et V. agnus-castus. Enfin, des populations hélophytiques (B. glaucus, Iris pseudacorus, P. australis, Schoenoplectus litoralis, T. domingensis) sont développées en plusieurs points du lac, sur des substrats vaseux en permanence inondés. Une ceinture discontinue de Scirpoides holoschoenus et Juncus acutus marque la limite des eaux. Du côté sud, à l’opposé de la dune littorale, le lac est bordé par une zone temporaire, entièrement asséchée en été et transformée alors en espace agricole pour les cultures saisonnières, et par un cordon dunaire consolidé couvert d’une végétation à base de R. raetam subsp. bovei. Cette structuration complexe de la végétation témoigne de la grande diversité des conditions écologiques locales.
2.3 Échantillonnage et étude diachronique
Le site a fait l’objet d’un échantillonnage systématique durant trois années consécutives (2003 à 2005), à raison de quatre relevés par an (printemps, été, automne et hiver) sur 23 stations. Le recouvrement de chacune des 180 espèces floristiques observées lors des relevés a été estimé selon l’échelle (1–5) de Braun-Blanquet [32]. Le plan d’échantillonnage comportait des transects permanents distants les uns des autres de 50 à 150 m, orientés de l’extérieur vers l’intérieur du site et parallèles aux gradients hydrologiques (Fig. 2). Les relevés ont ainsi été effectués de manière à assurer une couverture exhaustive de tous les types d’habitats susceptibles d’être mis en relation avec une modification écologique dans le site. Chaque transect comprenait plusieurs quadrats, dont la superficie (aire minimale) a varié entre 15 et 25 m2. Des échantillons d’herbier ont été constitués, et les espèces récoltées ont été identifiées à l’aide des flores régionales [31,33,34]. La nomenclature botanique respecte [35].
L’étude actuelle, réalisée sur la base des relevés floristiques, a été complétée par l’étude de photographies aériennes datant de 1973 et 2004 (Fig. 2).
2.4 Analyses numériques
Les données floristiques ont été soumises à une analyse factorielle des correspondances (AFC) afin de déterminer la structure spatiale de la végétation, puis à une analyse discriminante (AD) dans le but de caractériser la dynamique temporelle. Cette dernière analyse a été basée sur la matrice de covariance issue d’une analyse en composantes principales (ACP). Les analyses multivariées ont été réalisées à l’aide des logiciels STATOS [36] et ADE-4 [37].
3 Résultats
3.1 Composition de la végétation
L’inventaire de la flore de la zone humide de Beni-Belaid, établi par [21] et dans le présent travail, révèle la présence locale de 201 espèces (Tableau 1), appartenant majoritairement aux Asteraceae (22 espèces), aux Poaceae (20 espèces), aux Cyperaceae (16 espèces) et aux Fabaceae (14 espèces). Trente et une espèces sont rares, assez rares ou très rares [31,33], et certaines d’entre elles (C. soldanella, E. spinosa, N. alba et P. amphibia) sont abondantes localement. Les espèces recensées appartiennent essentiellement à cinq éléments d’origines biogéographiques différentes : l’élément eurasiatique/circumboréal, dominant avec 75 espèces (37,3 %), l’élément méditerranéen (61 esp. ; 30,3 %), l’élément cosmopolite/subcosmopolite (26 esp. ; 12,9 %), l’élément méditerranéen atlantique (20 esp. ; 10,0 %) et l’élément tropical/subtropical (15 esp. ; 7,5 %). L’élément endémique, quant à lui, n’est représenté que par deux espèces méso-xérophiles (Battandiera amoena, Biscutella raphanifolia), et au moins trois espèces sont introduites (Cotula coronopifolia, Cyperus eragrostis, Ludwigia peploides). À ces dernières espèces, se rajoutent peut-être Paspalum distichum et P. nodiflora, dont le statut d’espèce indigène/introduite en Afrique du Nord n’est pas clairement établi.
Espèces recensées dans la zone humide de Beni-Belaid.
| Code | Espèce | Synonyme(s) | Famille | Origine biogéographique |
| Alpl | Alisma lanceolatum With. | A. plantago | Alismataceae | Circumboréale |
| Algl | Alnus glutinosa (L.) Gaertn. | Betulaceae | Paléotempérée | |
| Albu | Alopecurus bulbosus Gouan. | Poaceae | Méditerranéenne atlantique | |
| Alse | Alternanthera sessilis (L.) R. Br. | A. repens | Amaranthaceae | Tropicale/subtropicale |
| Anar | Anagallis arvensis L. | Primulaceae | Cosmopolite/subcosmopolite | |
| Anmo | Anagallis monelli L. | Primulaceae | Méditerranéenne | |
| Anit | Anchusa italica Retz. | A. azurea | Boraginaceae | Eurasiatique |
| Anma | Anthemis maritima L. | Asteraceae | Méditerranéenne | |
| Ashi | Asperula hirsuta Desf. | Rubiaceae | Méditerranéenne | |
| Asae | Asphodelus aestivus Brot. | A. microcarpus, A. ramosus | Asphodelaceae | Méditerranéenne atlantique |
| Atriplex littoralis L. | Chenopodiaceae | Eurasiatique | ||
| Atpr | Atriplex prostrata Boucher | A. hastata | Chenopodiaceae | Circumboréale |
| Bara | Baldellia ranunculoides (L.) Parl. | Echinodorus ranunculoides | Alismataceae | Méditerranéenne atlantique |
| Baam | Battandiera amoena (Batt.) Maire | Ornithogalum amaenum | Hyacinthaceae | Endémique Maroc–Algérie |
| Bean | Bellis annua L. | Asteraceae | Méditerranéenne | |
| Besy | Bellis sylvestris L. | Asteraceae | Méditerranéenne | |
| Bira | Biscutella raphanifolia Poiret | B. radicata | Brassicaceae | Endémique Af. N |
| Blpe | Blackstonia perfoliata (L.) Huds. subsp. perfoliata | B. perfoliata. subsp. eu-perfoliata | Gentianaceae | Méditerranéenne |
| Bogl | Bolboschoenus glaucus (Lam.) S.G. Smith | Scirpus maritimus | Cyperaceae | Cosmopolite/subcosmopolite |
| Boof | Borago officinalis L. | Boraginaceae | Méditerranéenne | |
| Brsy | Brachypodium sylvaticum (Huds.) P. Beauv. | Poaceae | Méditerranéenne | |
| Brse | Bromus secalinus L. | Poaceae | Circumboréale | |
| Brsq | Bromus squarrosus L. | Poaceae | Paléotempérée | |
| Cama | Cakile maritima Scop. | C. aegyptiaca | Brassicaceae | Eurasiatique |
| Casp | Calicotome spinosa (L.) Link. | Calycotome spinosa | Fabaceae | Méditerranéenne |
| Callitriche obtusangula Le Gall | C. palustris subsp. obtusangula | Callitrichaceae | Eurasiatique | |
| Callitriche truncata Guss. | C. hermaphroditica subsp. truncata | Callitrichaceae | Méditerranéenne atlantique | |
| Case | Calystegia sepium (L.) R. Br. | Convolvulus sepium | Convolvulaceae | Paléotempérée |
| Caso | Calystegia soldanella (L.) R. Br. | Convolvulus soldanella | Convolvulaceae | Cosmopolite/subcosmopolite |
| Canu | Carduus nutans L. | Asteraceae | Eurasiatique | |
| Cadis | Carex distans L. | Cyperaceae | Paléotempérée | |
| Cadiv | Carex divisa Huds. | Cyperaceae | Méditerranéenne atlantique | |
| Carex divulsa Stockes subsp. divulsa | Cyperaceae | Eurasiatique | ||
| Cafl | Carex flacca Schreb. subsp. serrulata (Biv.) Greuter | Cyperaceae | Cosmopolite/subcosmopolite | |
| Casy | Carex sylvatica Huds. | Cyperaceae | Eurasiatique | |
| Cavu | Carex vulpina L. | Cyperaceae | Paléotempérée | |
| Caco | Carlina corymbosa L. subsp. corymbosa | C. involucrata subsp. corymbosa | Asteraceae | Eurasiatique |
| Cari | Catapodium rigidum (L.) C.E. Hubb. subsp. rigidum | Scleropoa rigida | Poaceae | Eurasiatique |
| Cena | Centaurea napifolia L. | Asteraceae | Méditerranéenne | |
| Cesp | Centaurea sphaerocephala L. | Asteraceae | Méditerranéenne | |
| Ceca | Centaurium candelabrum Lindb.f. | C. pulchellum subsp. grandiflorum | Gentianaceae | Paléotempérée |
| Cegl | Cerastium glomeratum Thuill. | Caryophyllaceae | Cosmopolite/subcosmopolite | |
| Cede | Ceratophyllum demersum L. | Ceratophyllaceae | Cosmopolite/subcosmopolite | |
| Chmi | Chamaemelum mixtum (L.) All. | Anthemis mixta, Ormenis mixta | Asteraceae | Méditerranéenne |
| Chara globularis Thuillier | Characeae | |||
| Chara vulgaris (L.) Wall. | Characeae | |||
| Chma | Charybdis maritima (L.) Speta | Urginea maritima | Hyacinthaceae | Méditerranéenne atlantique |
| Chondrilla juncea L. | Asteraceae | Eurasiatique | ||
| Cien | Cichorium endivia L. subsp. divaricatum (Schousb.) P.D. Sell | C. intybus L. | Asteraceae | Eurasiatique |
| Cisc | Cirsium scabrum (Poir.) Bonnet & Baratte | Asteraceae | Méditerranéenne | |
| Clci | Clematis cirrhosa L. | Ranunculaceae | Méditerranéenne | |
| Coju | Coronilla juncea L. | Fabaceae | Méditerranéenne | |
| Coco | Cotula coronopifolia L. | Asteraceae | Introduite (Afrique australe) | |
| Crla | Crataegus laevigata (Poir.) DC. | Crataegus oxyacantha L. | Rosaceae | Eurasiatique |
| Cral | Crypsis alopecuroides (Piller & Mitterp.) Schrad. | Poaceae | Paléotempérée | |
| Cuep | Cuscuta epithymum L. | Cuscutaceae | Cosmopolite/subcosmopolite | |
| Cuma | Cutandia maritima (L.) Barbey | Scleropoa maritima | Poaceae | Méditerranéenne |
| Cyac | Cynanchum acutum L. | Asclepiadaceae | Eurasiatique | |
| Cyda | Cynodon dactylon (L.) Pers. | Poaceae | Cosmopolite/subcosmopolite | |
| Cycl | Cynoglossum clandestinum Desf. | Boraginaceae | Méditerranéenne | |
| Cyca | Cyperus capitatus Vand. | C. kalli | Cyperaceae | Méditerranéenne atlantique |
| Cyer | Cyperus eragrostis Lam. | Cyperaceae | Introduite (Amérique) | |
| Cyfu | Cyperus fuscus L. | Cyperaceae | Paléotempérée | |
| Cyla | Cyperus laevigatus L. var. distachyos (All.) Coss. & Durand | Cyperaceae | Tropicale/subtropicale | |
| Cylo | Cyperus longus L. subsp. badius (Desf.) Bonnier & Layens | Cyperaceae | Tropicale/subtropicale | |
| Dagn | Daphne gnidium L. | Thymelaeaceae | Méditerranéenne | |
| Daucus carota L. | Apiaceae | Méditerranéenne | ||
| Depe | Delphinium peregrinum L. | Ranunculaceae | Méditerranéenne | |
| Difu | Dipsacus fullonum L. | D. sylvestris | Dipsacaceae | Eurasiatique |
| Divi | Dittrichia viscosa (L.) Greuter | Inula viscosa | Asteraceae | Méditerranéenne |
| Ecspi | Echinophora spinosa L. | Apiaceae | Eurasiatique | |
| Ecspb | Echinops spinosus L. subsp. bovei (Boiss.) Murb. | E. bovei | Asteraceae | Tropicale/subtropicale |
| Elpa | Eleocharis palustris (L.) Roem. & Schult. | Heleocharis palustris | Cyperaceae | Cosmopolite/subcosmopolite |
| Elfa | Elymus farctus (Viv.) Runemark subsp. farctus | Agropyrum junceum, Elytrigia juncea | Poaceae | Méditerranéenne atlantique |
| Elre | Elymus repens (L.) Gould | Agropyron repens | Poaceae | Circumboréale |
| Eqra | Equisetum ramosissimum Desf. | Equisetaceae | Circumboréale | |
| Erma | Eryngium maritimum L. | Apiaceae | Eurasiatique | |
| Erpu | Eryngium pusillum L. | E. barrelieri | Apiaceae | Méditerranéenne |
| Ertr | Eryngium tricuspidatum L. | Apiaceae | Méditerranéenne | |
| Euhi | Euphorbia hirsuta L. | E. pubescens | Euphorbiaceae | Méditerranéenne |
| Eupa | Euphorbia paralias L. | Euphorbiaceae | Méditerranéenne atlantique | |
| Eupe | Euphorbia peplis L. | Chamaesyce peplis | Euphorbiaceae | Méditerranéenne atlantique |
| Fear | Festuca arundinacea Schreb. subsp. arundinacea | F. elatior | Poaceae | Circumboréale |
| Fica | Ficus carica L. | Moraceae | Méditerranéenne | |
| Fipy | Filago pygmaea L. | Evax pygmaea | Asteraceae | Méditerranéenne |
| Fran | Fraxinus angustifolia Vahl. | F. oxyphylla | Oleaceae | Eurasiatique |
| Gato | Galactites tomentosa Moench | G. elegans | Asteraceae | Méditerranéenne |
| Gapa | Galium palustre L. subsp. elongatum (C.Presl) Lange | G. elongatum | Rubiaceae | Eurasiatique |
| Gemo | Genista monspessulana (L.) L.A.S. Johnson | Cytisus monspessulanus | Fabaceae | Méditerranéenne |
| Gedi | Geranium dissectum L. | Geraniaceae | Eurasiatique | |
| Glfl | Glaucium flavum Crantz. | Papaveraceae | Méditerranéenne | |
| Glse | Glebionis segetum (L.) Fourr. | Chrysanthemum segetum | Asteraceae | Cosmopolite/subcosmopolite |
| Hehe | Hedera helix L. | Araliaceae | Eurasiatique | |
| Heco | Hedysarum coronarium L. | Fabaceae | Méditerranéenne | |
| Hecr | Helosciadium crassipes W.D.J. Koch ex Rchb. | Apium crassipes | Apiaceae | Méditerranéenne |
| Hyhi | Hyparrhenia hirta (L.) Stapf. | Andropogon hirtus | Poaceae | Tropicale/subtropicale |
| Hyto | Hypericum tomentosum L. | Hypericaceae | Méditerranéenne | |
| Irfo | Iris foetidissima L. | Iridaceae | Méditerranéenne atlantique | |
| Irps | Iris pseudacorus L. | Iridaceae | Eurasiatique | |
| Isolepis cernua (Vahl) Roem. & Schult. | Scirpus cernuus, S. savii | Cyperaceae | Cosmopolite/subcosmopolite | |
| Juac | Juncus acutus L. | Juncaceae | Cosmopolite/subcosmopolite | |
| Juar | Juncus articulatus L. subsp. articulatus | J. lamprocarpus | Juncaceae | Circumboréale |
| Jubu | Juncus bufonius L. | Juncaceae | Cosmopolite/subcosmopolite | |
| Juef | Juncus effusus L. | Juncaceae | Eurasiatique | |
| Juin | Juncus inflexus L. | Juncaceae | Tropicale/subtropicale | |
| Juox | Juniperus oxycedrus L. | Cupressaceae | Méditerranéenne atlantique | |
| Laov | Lagurus ovatus L. | Poaceae | Méditerranéenne atlantique | |
| Lemi | Lemna minor L. | Lemnaceae | Cosmopolite/subcosmopolite | |
| Loma | Lobularia maritima (L.) Desv. | Alyssum maritimum | Brassicaceae | Méditerranéenne |
| Lomu | Lolium multiflorum Lam. | Poaceae | Méditerranéenne | |
| Lona | Loncomelos narbonensis (L.) Raf. | Ornithogalum pyramidale | Hyacinthaceae | Méditerranéenne |
| Loco | Lotus corniculatus L. subsp. preslii (Ten.) P. Fourn. | L. corniculatus subsp. decumbens | Fabaceae | Eurasiatique |
| Lohi | Lotus hispidus Desf. | L. subbiflorus | Fabaceae | Méditerranéenne atlantique |
| Loor | Lotus ornithopodioides L. | Fabaceae | Méditerranéenne | |
| Lupe | Ludwigia peploides (Kunth) P.H. Raven | Jussieua repens | Oenotheraceae | Introduite (Amérique) |
| Lyeu | Lycopus europeus L. | Lamiaceae | Circumboréale | |
| Lyhy | Lythrum hyssopifolia L. | Lythraceae | Cosmopolite/subcosmopolite | |
| Lyju | Lythrum junceum Banks & Sol. | L. graefferi | Lythraceae | Méditerranéenne |
| Lysa | Lythrum salicaria L. | Lythraceae | Cosmopolite/subcosmopolite | |
| Main | Matthiola incana (L.) R. Br. | Brassicaceae | Eurasiatique | |
| Mema | Medicago marina L. | Fabaceae | Méditerranéenne | |
| Meaq | Mentha aquatica L. | Lamiaceae | Paléotempérée | |
| Mepu | Mentha pulegium L. | Lamiaceae | Eurasiatique | |
| Mesu | Mentha suaveolens Ehrh. | M. rotundifolia | Lamiaceae | Méditerranéenne atlantique |
| Mysp | Myriophyllum spicatum L. | Haloragidaceae | Circumboréale | |
| Nata | Narcissus tazetta L. | Amaryllidaceae | Eurasiatique | |
| Neol | Nerium oleander L. | Apocynaceae | Méditerranéenne | |
| Nyal | Nymphaea alba L. | Nymphaeaceae | Eurasiatique | |
| Oefi | Oenanthe fistulosa L. | Apiaceae | Eurasiatique | |
| Onpe | Oncostema peruviana (L.) Speta | Scilla peruviana | Hyacinthaceae | Méditerranéenne atlantique |
| Onva | Ononis variegata L. | Fabaceae | Méditerranéenne | |
| Otma | Otanthus maritimus (L.) Hoffmanns & Link | Diotis maritima | Asteraceae | Méditerranéenne atlantique |
| Pama | Pancratium maritimum L. | Amaryllidaceae | Méditerranéenne | |
| Pare | Panicum repens L. | Poaceae | Tropicale/subtropicale | |
| Pavi | Parentucellia viscosa L. | Scrophulariaceae | Eurasiatique | |
| Paar | Paronychia argentea Lam. | P. mauritanica | Caryophyllaceae | Méditerranéenne |
| Padi | Paspalum distichum L. | P. paspalodes | Poaceae | Tropicale/subtropicale |
| Peam | Persicaria amphibia (L.) Gray | Polygonum amphibium | Polygonaceae | Eurasiatique |
| Persicaria salicifolia (Willd.) Assenov | Polygonum salicifolium | Polygonaceae | Tropicale/subtropicale | |
| Phmi | Phalaris minor Retz. | Poaceae | Tropicale/subtropicale | |
| Phau | Phragmites australis (Cav.) Trin | P. communis | Poaceae | Cosmopolite/subcosmopolite |
| Phno | Phyla nodiflora (L.) Greene | Lippia nodiflora | Verbenaceae | Introduite (Amérique) |
| Pile | Pistacia lentiscus L. | Anacardiaceae | Méditerranéenne | |
| Pllag | Plantago lagopus L. | Plantaginaceae | Méditerranéenne | |
| Pllan | Plantago lanceolata L. | Plantaginaceae | Méditerranéenne | |
| Plma | Plantago major L. | Plantaginaceae | Eurasiatique | |
| Plse | Plantago serraria L | Plantaginaceae | Méditerranéenne | |
| Poma | Polygonum maritimum L. | Polygonaceae | Cosmopolite/subcosmopolite | |
| Polypogon maritimus Willd | Poaceae | Eurasiatique | ||
| Poal | Populus alba L. | Salicaceae | Paléotempérée | |
| Potamogeton lucens L. | Potamogetonaceae | Cicumboréale | ||
| Pope | Potamogeton pectinatus L. | Potamogetonaceae | Cosmopolite/subcosmopolite | |
| Prvu | Prunella vulgaris L. | Lamiaceae | Eurasiatique | |
| Ptaq | Pteridium aquilinum (L.) Kuhn | Pteris aquilina | Dennstaedtiaceae | Cosmopolite/subcosmopolite |
| Pudy | Pulicaria dysenterica (L.) Bernh | Asteraceae | Eurasiatique | |
| Raba | Ranunculus baudotii Godr. | R. aquatilis subsp. baudotii | Ranunculaceae | Cosmopolite/subcosmopolite |
| Rabu | Ranunculus bulbosus L. | Ranunculaceae | Eurasiatique | |
| Ranunculus ophioglossifolius Vill | Ranunculaceae | Méditerranéenne | ||
| Rasc | Ranunculus sceleratus L. | Ranunculaceae | Paléotempérée | |
| Ranunculus trichophyllus Chaix | Ranunculaceae | Eurasiatique | ||
| Real | Reseda alba L. subsp. alba | Resedaceae | Eurasiatique | |
| Rera | Retama raetam (Forssk.) Webb subsp. bovei (Spach) Talavera & Gibbs | R. monosperma subsp. bovei | Fabaceae | Méditerranéenne atlantique |
| Rose | Rosa sempervirens L. | Rosaceae | Méditerranéenne | |
| Rubia peregrina L. | Rubiaceae | Méditerranéenne atlantique | ||
| Ruul | Rubus ulmifolius Schott | Rosaceae | Eurasiatique | |
| Ruco | Rumex conglomeratus Murray | Polygonaceae | Cosmopolite/subcosmopolite | |
| Rupa | Rumex palustris Sm. | Polygonaceae | Eurasiatique | |
| Saka | Salsola kali L. | Chenopodiaceae | Paléotempérée | |
| Sava | Samolus valerandi L. | Primulaceae | Cosmopolite/subcosmopolite | |
| Sami | Sanguisorba minor Scop | Rosaceae | Eurasiatique | |
| Scabiosa atropurpurea L. subsp. maritima (L.) Arcang | S. maritima | Dipsacaceae | Méditerranéenne | |
| Scli | Schoenoplectus litoralis (Schrad.) Palla | Scirpus littoralis | Cyperaceae | Tropicale/subtropicale |
| Scho | Scirpoides holoschoenus (L.) Soj | Scirpus holoschoenus | Cyperaceae | Paléotempérée |
| Schi | Scolymus hispanicus L. | Asteraceae | Méditerranéenne | |
| Seer | Senecio erraticus Bertol. | S. jacobaea, Jacobaea vulgaris | Asteraceae | Eurasiatique |
| Shar | Sherardia arvensis L. | Rubiaceae | Eurasiatique | |
| Sico | Silene coelirosa (L.) Godr | S. coeli-rosa | Caryophyllaceae | Méditerranéenne |
| Sini | Silene nicaensis All | S. arenicola | Caryophyllaceae | Méditerranéenne |
| Siar | Sinapis arvensis L. | Brassicaceae | Paléotempérée | |
| Smas | Smilax aspera L. | Smilaceae | Méditerranéenne atlantique | |
| Tamarix africana Poir | Tamaricaceae | Méditerranéenne | ||
| Taga | Tamarix gallica L. | Tamaricaceae | Tropicale/subtropicale | |
| Tesc | Teucrium scordium L. subsp. scordioides (Schreb.) Arcang | T. scordioides | Lamiaceae | Méditerranéenne |
| Toar | Torilis arvensis (Huds.) Link | Apiaceae | Paléotempérée | |
| Trcae | Trachelium caeruleum L. | Campanulaceae | Méditerranéenne | |
| Trcam | Trifolium campestre Schreb | Fabaceae | Paléotempérée | |
| Trifolium fragiferum L. | Fabaceae | Eurasiatique | ||
| Trrep | Trifolium repens L. | Fabaceae | Circumboréale | |
| Trres | Trifolium resupinatum L. | Fabaceae | Méditerranéenne | |
| Tydo | Typha domingensis (Pers.) Poir ex Steud | T. angustifolia | Typhaceae | Circumboréale |
| Ulmi | Ulmus minor Mill. subsp. minor | U. campestris | Ulmaceae | Eurasiatique |
| Urfu | Urginea fugax (Moris) Steinh | Hyacinthaceae | Méditerranéenne | |
| Utricularia vulgaris L. | Lentibulariaceae | Circumboréale | ||
| Vesi | Verbascum sinuatum L. | Scrophulariaceae | Méditerranéenne | |
| Veof | Verbena officinalis L. | Verbenaceae | Paléotempérée | |
| Veronica anagalloides Guss | V. anagallis-aquatica subsp. anagalloides |
Plantaginaceae | Circumboréale | |
| Viag | Vitex agnus-castus L. | Verbenaceae | Méditerranéenne | |
| Vivi | Vitis vinifera L. subsp. sylvestris (C.C. Gmel.) Berger & Hegi | Vitaceae | Méditerranéenne | |
| Vuli | Vulpia ligustica (All.) Link | Poaceae | Méditerranéenne | |
| Xast | Xanthium strumarium L. | Asteraceae | Cosmopolite/subcosmopolite | |
| Zannichellia palustris L. subsp. pedicellata Wahlenb. & Rosén | Z. pedicellata | Zannichelliaceae | Cosmopolite/subcosmopolite |
3.2 Structure spatiale de la végétation
L’analyse factorielle des correspondances (AFC ; Fig. 3) met en évidence la coexistence de quatre communautés végétales distinctes, organisées selon deux gradients environnementaux :
- • la communauté glyco-psammophile (relevés 15–19), développée sur sol sableux, sous l’influence de la mer, comprend C. maritima, C. soldanella, E. spinosa, Elymus farctus, E. maritimum, E. peplis, Glaucium flavum, O. maritimus et P. maritimum ;
- • la communauté hélo-hydrophytique (relevés 01, 14, 20), développée dans les zones d’eau douce, à proximité du cordon dunaire, comprend des hydrophytes (C. demersum, L. peploides, M. spicatum, N. alba, P. amphibia et Potamogeton pectinatus) et des hélophytes (B. glaucus, P. australis, S. litoralis, S. holoschoenus et T. domingensis) ;
- • la communauté anthropique (relevés 02–09), développée dans les zones cultivées inondables, comprend des espèces opportunistes ou tolérantes aux perturbations (Carex flacca subsp. serrulata, C. coronopifolia, Juncus spp., L. minor, Lythrum spp., Phalaris minor, Plantago spp., Ranunculus bulbosus et Trifolium spp.), ainsi que quelques espèces de ripisylve (Alnus glutinosa, Carex divulsa subsp. divulsa, N. oleander et V. agnus-castus) ;
- • la communauté forestière (relevés 10–13 et 21–23), développée dans les zones boisées, comprend Crataegus laevigata, Fraxinus angustifolia, Hedera helix, Iris foetidissima, I. pseudacorus, Lolium muricatum, Lycopus europaeus, P. alba, R. sempervirens, R. ulmifolius, S. aspera, Ulmus minor et Vitis vinifera subsp. sylvestris.
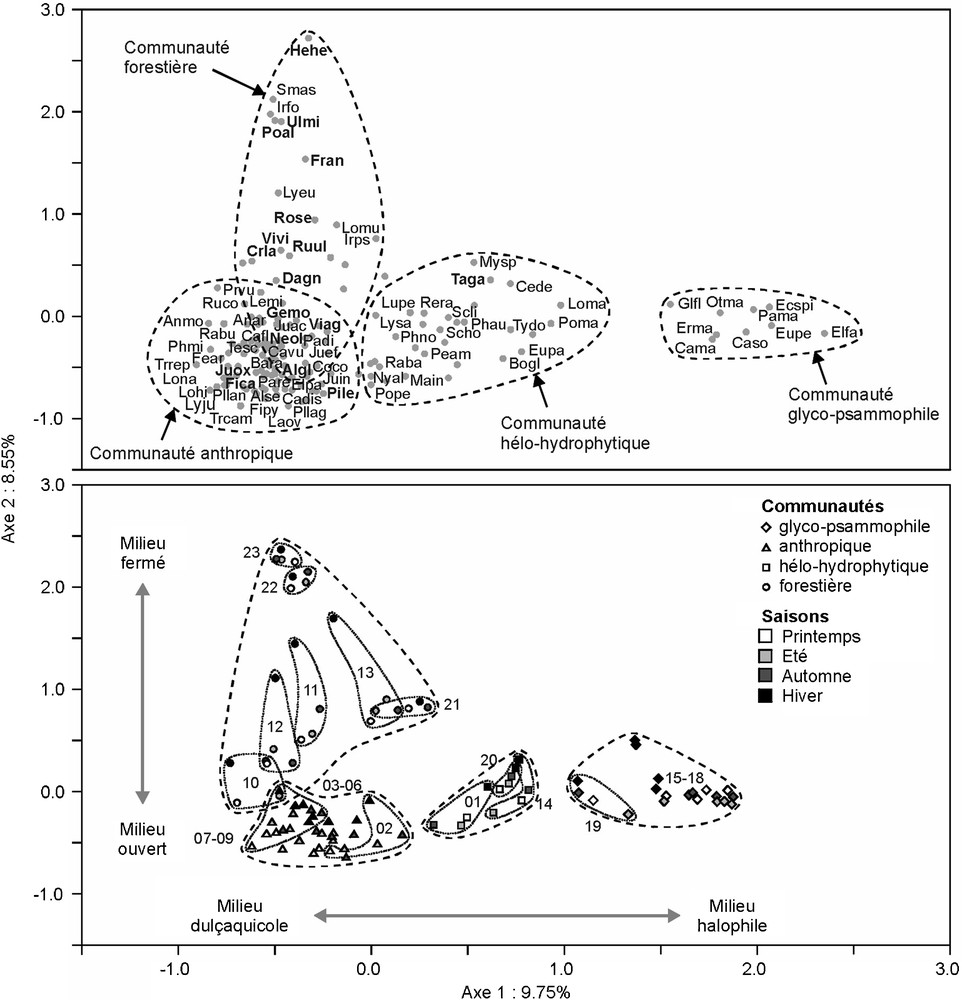
Plan factoriel 1/2 de l’analyse factorielle des correspondances (AFC). Haut : espèces regroupées en communautés ; la signification des codes est donnée dans le Tableau 1 ; les espèces ligneuses sont notées en gras. Bas : stations, représentées chacune par quatre relevés (printemps, été, automne, hiver) ; les numéros sont ceux des stations.
Ces deux gradients, qui expliquent 18,3 % de la variance totale, révèlent l’influence des perturbations, d’une part d’origine anthropique et d’autre part d’origine marine. Le premier axe révèle que la communauté glyco-psammophile, développées sur des sables non consolidés, remplace la communauté hélo-hydrophytique suite à l’envahissement du lac par les dunes de sables. Le second axe révèle que la communauté anthropique se développe quant à elle à la place des communautés hélo-hydrophytique et forestière dans les zones soumises aux pratiques agropastorales.
3.3 Structure temporelle de la végétation
Une première AD, effectuée entre les trois années de suivi, n’a pas donné de résultat significatif. En revanche, l’analyse effectuée entre les quatre dates de relevés a révélé une co-structure significative entre les saisons et les espèces. Cette co-structure est décrite par les deux premiers axes, qui expliquent 98 % de la variance totale (Fig. 4). L’axe 1, qui explique à lui seul la presque totalité de l’information (94 %), oppose l’hiver aux autres saisons. L’hiver apparaît ainsi caractérisé par Clematis cirrhosa, Filago pygmaea et R. raetam subsp. bovei ; le printemps par Galactites tomentosa, N. alba, S. aspera ; l’été par C. demersum, E. peplis, P. australis, T. domingensis et Xanthium strumarium ; et l’automne par L. minor, Lobularia maritima, Lythrum salicaria et V. agnus-castus.
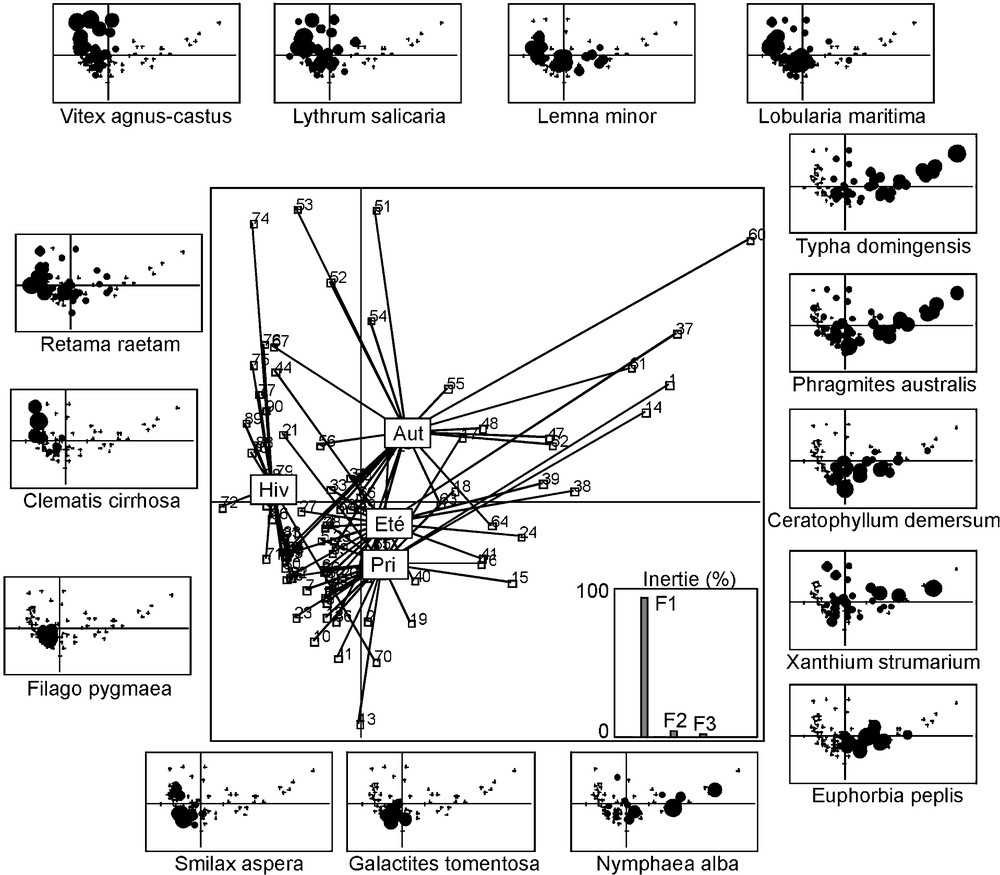
Structure temporelle de la végétation des 23 stations. Plan factoriel 1/2 de l’analyse discriminante interclasses (3 années × 188 espèces végétales × 4 saisons). Les valeurs propres des trois premiers axes sont données sous forme d’histogrammes. Les barycentres correspondent aux saisons : Pri : printemps ; Eté : été ; Aut : automne ; Hiv : hiver. La succession des espèces est présentée en format réduit du plan factoriel principal. La distribution de chaque espèce est figurée par des cercles noirs, dont le diamètre est proportionnel à l’abondance. Les croix matérialisent l’absence de l’espèce.
4 Discussion
4.1 Origine et diversité du cortège floristique
La zone humide de Beni-Belaid présente une grande richesse floristique, qui reflète la diversité des microhabitats et des conditions écologiques (zones d’eau libre permanentes et temporaires, substrat sableux à limoneux, milieu ouvert à fermé… ; Fig. 2 et 3). Les quatre communautés mises en évidence par l’AFC (Fig. 3) représentent différents groupements phytosociologiques :
- • classe Ammophiletea Br.-Bl. & Tüxen ex Westhoff, Dijk & Passchier 1946 (communauté glyco-psammophile) ;
- • classe Potamogetonetea pectinati Tüxen & Preising 1942 corr. Oberd. 1979, ordre Potamogetonetalia pectinati W. Koch 1926 corr. Oberd. 1979, alliance Nymphaeion albae Oberd. 1957 (communauté hydrophytique) ;
- • classe Phragmiti-Magnocaricetea Klika 1941 (communauté hélophytique), ordres Phragmitetalia australis Koch 1926 em. Pign. 1953 et Scirpetalia compacti Hejny in Holub et al. 1967 ;
- • classe Querco-Fagetea Br.-Bl. & Vlieg. 1937, ordre Populetalia albae Br.-Bl. ex Tchou 1948, alliance Populion albae Br.-Bl. ex Tchou 1948 (communauté forestière).
Bien que développée sur une surface restreinte et hors des grandes plaines littorales de Numidie, la zone humide de Beni-Belaid apparaît aussi riche que les grandes zones humides du Parc National d’El Kala [18]. Comme ces dernières, elle abrite un cortège floristique très riche sur le plan biogéographique, réunissant notamment à l’élément méditerranéen différencié in situ, un élément septentrional (eurasiatique/circumboréal), un élément occidental (méditerranéen atlantique) et un élément méridional (tropical/subtropical). Ce dernier est associé à une communauté d’insectes d’affinité afrotropicale, qui comprend notamment Acisoma panorpoides subsp. ascalaphoides, Anisops sardea, Diplacodes lefebvrii, Hydrocyrius columbiae, Mesovelia vittigera et Trithemis annulata [21]. En Afrique du Nord, ce cortège floristique est inféodé aux ambiances bioclimatiques subhumides et humides de l’étage thermoméditerranéen [38,39], ce qui traduit un déterminisme climatique fortement lié aux précipitations. Son origine est en partie la conséquence d’anciennes voies de migration des espèces végétales en provenance du nord, du sud et de l’ouest [40–42], qui peuvent être rapportées aux périodes pluviales du Quaternaire pour les flores tropicales/subtropicales et atlantiques, et aux périodes glaciaires pour les flores eurasiatiques/circumboréales [39,43]. Toutefois, la rareté des hydrophytes endémiques à l’échelle de l’Afrique du Nord suggère la persistance de flux génétiques continus, attribuables au moins en partie à l’avifaune migratrice [44,45]. La dispersion ornithochore des semences sur de longues distances est un phénomène encore mal connu, mais qui pourrait jouer un rôle plus important qu’on ne le pensait jusqu’à présent [46,47].
4.2 Mosaïque et dynamique temporelle de la végétation
La mosaïque végétale de la zone humide de Beni-Belaid apparaît structurée par deux gradients environnementaux dominants : l’hydrologie et les perturbations d’origine anthropique (Fig. 3). Ce résultat confirme l’influence prépondérante de ces deux facteurs dans la structuration des communautés hydrophiles à l’échelle de l’Afrique du Nord [14,48,49]. À Beni-Belaid, l’influence de l’hydrologie se traduit d’une part par un gradient topographique (successionnel), depuis les zones inondées de manière permanente (Nymphaeion albae), en passant par les zones inondées de manière temporaire (Phragmitetalia et Scirpetalia) jusqu’aux zones exondées la majeure partie de l’année (Populion albae), et d’autre part par un gradient de salinité, depuis les zones argilo-limoneuses dulçaquicoles jusqu’aux zones sableuses, sous l’influence des embruns salés. Ces gradients spatiaux sont clairement liés à l’origine fluviatile de la zone humide, qui correspond à l’ensemble des bras morts anastomosés d’un ancien delta de l’Oued El Kébir, aujourd’hui coincé entre deux cordons dunaires (Fig. 2). Le gradient hydrologique présente également une composante temporelle, caractérisée par une cyclicité intra-annuelle liée au développement estival des communautés hydrophytique et hélophytique (Fig. 4). Un bras mort, encore actif en 1973 (Fig. 2), a été depuis complètement abandonné par le fleuve, ce qui a vraisemblablement augmenté le régime temporaire de l’extrémité est du plan d’eau. Cette influence complexe de l’hydrologie, à la fois temporelle et spatiale, explique en grande partie la richesse spécifique et coenologique du site (Tableau 1), et traduit un équilibre précaire entre les influences marines et fluviales, sous le contrôle du climat méditerranéen. Cette situation a en outre permis le développement local de plusieurs plantes rares [18,21,31], dont 5 sont classées vulnérables (N. alba, P. amphibia, Rumex palustris) ou quasi-menacées (Baldellia ranunculoides, Helosciadium crassipes) dans la liste rouge des espèces de zone humide d’Afrique du Nord [50].
Comme le montrent les photographies aériennes (Fig. 2), les perturbations anthropiques ont, depuis plus de 30 ans, fortement affecté la rive sud du lac. La présence résiduelle d’espèces de ripisylve (par exemple, A. glutinosa, C. divulsa subsp. divulsa, N. oleander et V. agnus-castus) au sein des zones anthropisées (Fig. 3) indique que cette dégradation s’est essentiellement faite au détriment de la communauté forestière riveraine (P. albae). Ce constat se rajoute aux résultats déjà obtenus dans les complexes humides de Guerbès-Senhadja et d’El Kala [12,13,51–53] et dans d’autres régions du Maghreb [49,54,55], qui révèlent le déclin alarmant des formations hydrophytiques dulçaquicoles (mares temporaires, aulnaies, marais, tourbières…) de la rive sud de la Méditerranée.
La communauté anthropique se développe dans la zone de balancement des eaux, à l’interface entre le plan d’eau et les terres cultivées. Sa composition floristique comprend de nombreuses espèces opportunistes, parmi lesquelles des espèces nitrophiles (Cichorium endivia subsp. divaricatum, C. coronopifolia, Glaucium flavum, L. minor, L. peploides), des espèces adventices (Delphinium peregrinum, Glebionis segetum, Hedysarum coronarium, Sinapis arvensis) et des espèces stress-tolérantes (Carduus nutans, Carlina corymbosa, Charybdis maritima, Dittrichia viscosa, G. tomentosa, J. acutus, Plantago spp., Pulicaria dysenterica, Scolymus hispanicus, X. strumarium). L’augmentation de la pression de pâturage et de la fréquentation du site par les troupeaux de bovins et d’ovins au cours des dernières décennies est probablement responsable de l’érosion du cordon dunaire littoral, qui apparaît plus étroit en 2004 qu’en 1973 (Fig. 2). La remobilisation du sable piégé sur les dunes de front de mer suite à la disparition de leur couverture végétale menace directement les plans d’eau douce installés dans la dépression interdunaire. L’envahissement de la zone humide par le sable a déjà entraîné le colmatage de l’extrémité orientale du site. À l’impact du pâturage et de l’agriculture, se rajoute l’influence des pompages réalisés dans la nappe phréatique afin d’approvisionner en eau les cultures maraîchères développées sous serre et en plein champs, de part et d’autre de la dune consolidée au sud de la zone humide.
4.3 Menaces à court et moyen termes et implications pour la conservation
Le surpâturage est un des problèmes majeurs au Maghreb, où son impact a d’abord été mis en évidence sur les écosystèmes forestiers [39,56], avant que des travaux récents n’en révèlent les effets sur les zones humides [54,57]. Il s’y traduit essentiellement par le remplacement des communautés hydrophiles oligotrophes par des communautés résistantes au stress, dominées par des thérophytes opportunistes dans les milieux temporaires [57] et par de grands hélophytes dans les milieux permanents [9]. Les zones humides méditerranéennes (de même que la grande majorité des écosystèmes méditerranéens) apparaissent toutefois adaptées à un pâturage extensif, sous l’influence duquel elles ont évolué depuis le Néolithique : l’abandon récent du pastoralisme sur la rive nord de la Méditerranée entraîne généralement la fermeture des milieux [58,59] et une baisse de la biodiversité [60]. Différentes études théoriques et empiriques [61–64] soulignent l’importance des perturbations d’intensité et de fréquence moyennes pour promouvoir et maintenir la diversité dans les communautés. Certains auteurs [65,66] préconisent même un usage raisonné pour générer une biodiversité supérieure à une situation de non-usage. À Beni-Belaid, le surpâturage se traduit, d’une part par le développement local d’un abondant cortège d’espèces stress-tolérantes, et d’autre part, par l’envahissement de la zone humide par les dunes, suite à l’érosion de leur couvert végétal. La suppression totale du pâturage sur le long terme, susceptible d’entraîner la fermeture du milieu et le développement de communautés monospécifiques compétitives [67], n’est toutefois pas souhaitable. En revanche, un contrôle strict de la pression de pâturage, ainsi que la protection totale des zones les plus sensibles comme le cordon dunaire, apparaissent nécessaires et urgents.
Le développement agricole très important des dernières décennies s’est traduit dans l’ensemble du Maghreb par le défrichement d’immenses superficies dans les plaines et les régions collinéennes, au détriment des écosystèmes forestiers (notamment l’Oleo-Lentiscetum) et des zones humides [63,68]. Outre leur destruction systématique, les zones humides d’Afrique du Nord souffrent également de l’accumulation des pesticides et fertilisants, qui se traduisent par une pollution et une eutrophisation croissante des eaux douces [69]. La protection de la zone humide de Beni-Belaid implique, dans un premier temps, de la préserver de l’influence directe des cultures par la restauration d’une ceinture boisée [70,71]. Cette ceinture pourrait également servir de barrière à la pénétration des espèces exotiques potentiellement envahissantes [72] et favoriser le maintien de la macrofaune (loutre, oiseaux) inféodée aux habitats riverains. Cette restauration ne peut toutefois se faire sans l’exclusion au moins temporaire du pâturage, et donc la mise en défens d’importantes portions du pourtour de la zone humide, comprenant les complexes dunaires environnants.
Les pompages intensifs, associés à la construction de barrages en amont de l’Oued El Kébir (Béni Haroun en 2005 et Boussiaba en 2009), sont susceptibles de modifier à court terme l’hydrologie de la plaine alluviale et de la zone humide, d’affecter le transport et le dépôt des alluvions par les cours d’eau, et d’entraîner une salinisation des sols [73]. De tels changements ont été mis en évidence au lac Ichkeul, en Tunisie [74,75], où les modifications des conditions environnementales ont entraîné des modifications de la salinité, et par voie de conséquence des cortèges floristiques [76] et faunistiques [77]. La baisse estivale du niveau d’eau, observée depuis 10 ans à Beni-Belaid, a déjà entraîné des modifications de la flore : plusieurs espèces ont régressé (H. crassipes, N. alba, P. amphibia), tandis que d’autres se sont au contraire étendues (C. demersum, L. minor, Ludwigia repens, M. spicatum, P. nodiflora). Cette dégradation des habitats naturels affecte en outre les équilibres compétitifs, et peut favoriser le développement d’espèces exotiques, potentiellement envahissantes [78]. C’est le cas à Beni-Belaid pour C. coronopifolia, C. eragrostis, L. repens, et peut-être également pour P. distichum et P. nodiflora, connues pour poser d’importants problèmes dans diverses régions du pourtour méditerranéen [79,80]. Un autre exemple est fourni par le marais d’El-Kennar, située à une quinzaine de kilomètres du site étudié. Cette mare est affectée par les activités agricoles limitrophes, qui ont entraîné la prolifération de N. alba et L. peploides, qui ont totalement envahi le milieu au détriment des autres espèces [27].
La pression agropastorale favorise également les espèces indigènes opportunistes compétitives, comme J. acutus ou B. glaucus [48,67]. Enfin, la pêche, la chasse, le braconnage et le pillage des nids d’oiseaux sont pratiqués sans aucune gestion ni restriction sur la zone humide. Ces pratiques, bien que n’impactant pas directement la flore, sont susceptibles d’affecter les populations animales, déjà réduites et isolées et de modifier les équilibres écologiques.
5 Conclusions et perspectives pour la conservation
La présente étude met en évidence la très grande richesse biologique et écologique de la zone humide de Beni-Belaid, qui se situe au cœur du point chaud de biodiversité Kabylie-Numidie-Kroumirie [22]. Cette richesse apparaît clairement liée : (1) à la situation biogéographique du site, au carrefour de plusieurs influences bioclimatiques ; et (2) à son origine deltaïque, qui se traduit par une mosaïque d’habitats, induite par la superposition de gradients de durée de submersion, de profondeur d’eau, de salinité, de substrat et de perturbation. L’approche phytodynamique souligne le rôle des conditions environnementales, topographiques et hydrologiques, dans la structuration et la zonation des groupements végétaux riverains.
Les résultats obtenus révèlent également de très importantes menaces à court et moyen termes, qui apparaissent essentiellement liées aux pratiques agropastorales intensives et à la modification de l’hydrologie locale par des pompages excessifs et la construction de barrages en amont. Ces menaces sont d’autant plus inquiétantes qu’il n’existe actuellement aucun suivi régulier des communautés animales et végétales, ni aucune gestion des pratiques humaines (agropastoralisme, chasse, pêche, pompage…), dans ou aux alentours de la zone humide. Ces constatations confirment des observations réalisées dans d’autres sites Ramsar de la région, comme le lac noir et le lac des oiseaux, détruits il y a une vingtaine d’années [12,13] ou la zone humide de Sidi Freitis (complexe humide de Guerbès-Senhadja [19]), où toute la végétation riveraine a été défrichée et remplacée par des cultures irriguées directement par l’eau du lac. Cette situation soulève la question de la pertinence et de l’efficacité du statut de site Ramsar (http://www.ramsar.org), qui n’entraîne dans la région étudiée aucune action de gestion conservatoire des sites considérés. Les méthodes et les connaissances permettant de juguler la pression croissante des activités anthropiques existent pourtant, et sont déjà appliquées avec succès dans diverses régions du bassin méditerranéens [9].
Le maintien du fonctionnement hydrologique du site et des équilibres écologiques apparaît sans aucun doute comme le principal enjeu de conservation. Pour cela, il semble incontournable de mettre très rapidement en défens la totalité de la zone humide et des complexes dunaires environnants, afin d’en préserver la biodiversité encore existante et de restaurer une ceinture forestière protectrice. Il apparaît également urgent de mettre en place un programme de suivi régulier des communautés végétales et animales, afin de pouvoir adapter les mesures conservatoires. Ce programme pourrait par exemple comprendre un suivi saisonnier des espèces rares et des principales espèces indicatrices de l’état du site, complété par des études approfondies tous les 5–10 ans.
Ces premières mesures ne seraient toutefois pas suffisantes pour assurer la pérennité des communautés biologiques de la zone humide de Beni-Belaid. La mise en défens (réserve intégrale) du site par installation d’une clôture grillagée protectrice, bien que préservant à court terme les communautés végétales et animales des perturbations anthropiques, ne manquerait pas de poser des problèmes, notamment en termes d’isolement reproductif et de transfert d’énergie et de matière avec les écosystèmes adjacents. Cette fragmentation paysagère serait préjudiciable aux espèces, qui comme la loutre (L. lutra), exploitent à la fois la zone humide et les berges de l’Oued El Kébir. Il apparaît ainsi indispensable de réfléchir, dans le cadre théorique des métapopulations [81], à la mise en place à moyen terme de corridors migratoires pour les diverses espèces animales et végétales entre Beni-Belaid et les zones humides proches.
L’ensemble de ces mesures conservatoires devrait en outre impérativement être accompagné d’une campagne de sensibilisation des populations locales sur l’intérêt de la conservation des milieux naturels, en vue de leur implication dans la gestion des sites [57]. Les compensations à la perte de terres cultivables peuvent être recherchées dans l’amélioration et le subventionnement des pratiques agropastorales dans les zones non protégées, dans la création d’emplois liés à la conservation, et dans le développement d’un écotourisme semblable à celui que connaissent actuellement les Parcs Naturels d’Europe et d’Amérique du Nord. L’implication des populations locales dans la gestion conservatoire permettrait d’implémenter des plans de gestion intégrant un pâturage extensif durant certaines périodes de l’année dans certaines zones afin d’y maintenir un régime intermédiaire de perturbations [61]. La préservation du site Ramsar de Beni-Belaid et de l’ensemble des zones humides du Maghreb, qui nécessite des mesures à la fois sur le court et le moyen terme, ne pourra être réalisée sans une réelle prise de conscience des pouvoirs publics et sans une volonté de trouver des compromis durables entre les intérêts agricoles et la conservation d’un patrimoine naturel unique.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Ce travail a bénéficié du soutien financier de la faculté des sciences exactes et des sciences de la nature et de la vie de l’université de Jijel (Algérie), du projet CNEPRU (F : 1801/01/2003) et du programme EGIDE-CMEP Tassili (PHC 09mdu786). Nous remercions A. Chefrour et M. Saheb pour leur aide et leurs encouragements, ainsi qu’un relecteur anonyme, dont les commentaires ont été très appréciés. Cet article est la contribution ISEM 2011-090.


