Abridged English version
Introduction
ATP is a nucleotide essential for the maintenance of cellular homeostasis. Besides its classical intracellular functions, ATP, along with other nucleotides such as ADP, UTP and UDP, as well as its breakdown product, adenosine, is also acting as an extracellular signalling molecule. Upon cellular release, nucleoside tri- and diphosphates specifically activate P2 receptors, while adenosine acts selectively via P1 receptors. Liver cells ubiquitously express multiple P1 and P2 receptors that, upon activation, modulate important cellular functions such as glucose metabolism and ion secretion. In addition, liver cells also express various ectoenzymes at their surface that metabolise extracellular nucleosides and nucleotides, namely the P1 and P2 receptor ligands, respectively. The presence of several key components of the signalling pathways that are dependent on extracellular nucleosides and nucleotides underlines the functional relevance of these mediators to liver physiology. The current review presents a number of mechanisms and functions under the control of extracellular nucleosides and nucleotides in hepatic cells.
Signalling pathways dependent on extracellular nucleosides and nucleotides
Extracellular nucleosides and nucleotides are essential mediators of liver homeostasis, as they modulate a wide array of key physiological mechanisms and/or processes, such as glucose metabolism, urea metabolism, vascular tone, cell volume regulation and inflammatory response as well as basic cellular functions such as cell cycle progression, protein synthesis, and ion secretion. To exert their biological effects, extracellular nucleosides and nucleotides activate nucleoside-specific P1 and nucleotide-specific P2 receptors that are expressed by most hepatic cells.
Nucleotide receptors–P2 receptors
By definition, P2 receptors are transmembrane receptors that are selectively activated by extracellular nucleoside tri- and/or diphosphates such as ATP and ADP. P2 receptors are divided into two subtypes: ionotropic P2X receptors and metabotropic P2Y receptors.
P2X receptors
P2X receptors are ATP-gated, non-selective ion channels whose structure consists of three subunits assembled in a homo- or heteromeric manner. Each of the seven cloned P2X receptor (P2X1 to P2X7) subunits has a protein structure characterised by intracytoplasmic N- and C-termini with two transmembrane-spanning domains connected by a large extracellular loop containing an ATP-binding domain. The ATP-activated P2X receptor undergoes conformational changes generating extracellular ion fluxes (e.g. Ca2+, Na+, K+or Cl−) across the plasma membrane and subsequently triggers intracellular signalling pathways that are still poorly understood. P2X receptors are pharmacologically characterised by their affinity to their natural ligand ATP and its analogues such as α,β-MeATP, as well as their sensitivity toward synthetic antagonists such as suramin and Coomassie Blue.
All P2X receptors are expressed in the liver. In functional terms, P2X receptors are involved in the regulation of ion secretion (P2X4), glucose metabolism (P2X4) and the inflammatory response (P2X6, P2X7).
P2Y receptors
P2Y receptors are serpentine receptors that respond to adenine and uracil nucleoside tri- and diphosphates. Eight P2Y receptors, namely P2Y1, 2, 4, 6, 11-14, have been identified in mammals. P2Y receptors are pharmacologically characterised by their specificity and affinity to their natural ligand(s), namely purine and pyrimidine nucleotides. Quite notably, P2Y14 is selective for nucleotide sugars like UDP– glucose and UDP –galactose. In addition to P2Y receptors, cysteinyl leukotriene receptor-1 and -2 (CysLT1 and CysLT2), and GRP17 can also be activated by low UDP concentrations. Upon ligand binding, the activation of P2Y receptors can trigger either Ca2+- or cAMP-dependent intracellular signalling pathways. Based on molecular pharmacology studies, several synthetic P2Y receptor agonists such as ATPγS and antagonists such as MRS 2179 have been developed.
Furthermore, all P2Y receptors, and both CysLT1 and GRP17 receptors, are expressed in the liver. P2Y receptors have been shown to modulate glucose metabolism (P2Y1), bile formation (P2Y2), cytokine (P2Y11) and hormone (P2Y12) secretion, chemosensory function (P2Y12) and cholesterol endocytosis (P2Y13).
Nucleoside/adenosine receptors–P1 receptors
P1 receptors are serpentine receptors that respond to extracellular adenosine. Four P1 receptors named A1, A2a, A2b and A3 have been identified and characterised. With the exception of some cellular types, the activation of the A2a and A2b receptors generally leads to an increase in intracellular cAMP levels while the activation of A1 and A3 causes a decrease of the latter parameter. The A1, A2a and A3 receptors are low-capacity, high-affinity receptors that respond to adenosine concentrations in the order of 0.01 to 1 μM, while the A2b receptor is a high-capacity, low-affinity receptor that responds to ∼10 μM adenosine. The P1 receptor pharmacology has been extensively studied using natural compounds such as caffeine, as well as synthetic agonists such as ATL146e and antagonists such as 1,3-dipropyl-8-cyclopentylxanthine.
In the liver, all four P1 receptors are expressed and their activation is involved in the modulation of various hepatic functions, including glucose metabolism (A2b and A3), urea metabolism (A1) and inflammation (A1, A2a, A2b and A3).
Extracellular nucleoside and nucleotide release
Given their central roles in cellular metabolism, nucleotides such as ATP and their derivatives such as adenosine are ubiquitous. In most cells, the nucleotide levels measured within the cytoplasm are in the millimolar range. For instance, the intracellular ATP concentration in hepatocytes varies between 3 and 5 mM; hence, every cell represents a potential source of extracellular nucleotides as well as nucleosides. In liver, the adenine nucleotide concentrations measured in the bile are ∼5 μM. Numerous mechanisms of cellular nucleotide release have thus far been described. First, necrotic and apoptotic cells, as well as damaged cells whose plasma membrane has been disrupted, can release large amounts of nucleotides. Second, exocytosis of secretory vesicles by excitable cells such as neurons (nerve terminals) and platelets are well-established mechanisms of nucleotide release. Third, several cell types release nucleotides constitutively, i.e. in the absence of stimulation. Fourth, most cells express transmembrane nucleoside transporters that can regulate the extracellular levels of these molecules, especially adenosine. Fifth, spontaneous nucleotide release is also observed when cells are subjected to various physiological stimuli such as mechanical pressure or osmotic gradient, as well as to pathological conditions such as hypoxia and ischæmia. Spontaneous nucleotide release is however poorly understood and several candidate proteins, including the volume-sensitive osmolyte and anion channel (VSOAC), the cystic fibrosis transmembrane conductance regulator (CFTR), and the hemichannel proteins, connexins Cx43, Cx32, Cx26 and pannexin-1, have been proposed as candidates for mediating nucleotide efflux. Finally, numerous cell types, including endothelial cells, release nucleotides into the medium upon stimulation by physiological ligands such as hormones. Although the specific mechanisms involved in the stimulus-induced release of extracellular nucleotides are not yet clearly defined, mobilisation of intracellular Ca2+ appears to be a key step in this signalling pathway.
Extracellular nucleoside and nucleotide metabolic pathways
Signal transduction mechanisms initiated by nucleotides are directly dependent on the extracellular levels of these messengers which, in turn, are modulated by the biochemical activity of ectonucleotidases belonging to several families. Ectonucleotidases are divided into two categories: the nucleotide-degrading ectophosphohydrolases/esterases and the nucleotide-generating ectokinases/phosphotransferases.
Hydrolysis/catabolism
Nucleoside triphosphate diphosphohydrolases (NTPDases)
The E-NTPDase family regroups 8 members (NTPDase1 to -8) sharing significant amino acid sequence homology. All NTPDases specifically hydrolyse the - and -phosphate residues of tri- and diphosphonucleosides, respectively, albeit with different affinities. NTPDases are transmembrane glycoproteins with two membrane-spanning domains (with both intracellular N- and C-termini) which delimit a large extracellular loop featuring five conserved apyrase regions and a catalytic domain. Remarkably, NTPDase5 and -6 are type II transmembrane proteins that possess a single membrane-spanning domain (with an intracellular N-terminus) and that can be secreted upon proteolytic cleavage. While NTPDase4 to -7 are mainly associated with intracellular organelles, NTPDase1, -2, -3 and -8 are responsible for the major nucleotide hydrolysis activity detected at the cell surface at neutral pH. In the liver, the expression of NTPDase1, -2, and -8 has been demonstrated at both the mRNA and protein levels, and for NTPDase3 to -7, at the transcriptional level only. While the localisation of NTPDase1 and -2 is mainly vascular, NTPDase8 expression is restricted to the canalicular membrane domain of hepatocytes.
Due to their recent identification, the liver NTPDases are not well functionally characterised. The control of hemostasis is the first general function attributed to vascular NTPDase1 and -2, via their distinct ability to hydrolyse platelet-derived ADP, which is a major physiological aggregating agent. While the endothelial NTPDase1 favours the complete elimination of ADP from blood flow, the adventitial NTPDase2 favours rather its accumulation. Recently, NTPDase1 and -2 have also been reported to control the proliferation of endothelial cells, hepatocytes and cholangiocytes. Moreover, the genetic deletion of NTPDase1 in both bone marrow-derived and endothelial cells from Entpd1−/− mice renders these mice less permissive to hepatic metastatic tumor growth. In Entpd1−/− mice, the absence of NTPDase1 has also been associated with a decreased secretion of inflammatory interferon-γ by activated hepatic natural killer cells and by a limited ischæmia/reperfusion liver injury. In addition, the increase in NTPDase1 expression driven by the transcription factor Sp1 contributes to the protective effect of ischæmic preconditioning in a mouse model of liver ischæmia and reperfusion injury. Finally, the Entpd5−/− mice phenotype is characterised by the development of hepatocellular carcinomas and adenomas, suggesting an additional role for this enzyme in cell proliferation.
Nucleotide pyrophosphatases/phosphodiesterases (NPPs)
The E-NPP family comprises 7 ectoenzymes (NPP1 to -7) that possess the ability to hydrolyse a broad range of substrates present in the extracellular medium, including nucleoside tri- and diphosphates and their derivatives, and/or lysophospholipids. NPP1 to -3 are the only members that can hydrolyse nucleotides such as ATP and ADP. NPP1 to -3 protein sequences feature a highly conserved endonuclease-like catalytic domain typical of all NPPs, and two cysteine-rich somatomedin B-like domains that are exclusive to these three members. While NPP1 and -3 are type II transmembrane glycoproteins featuring an intracellular N-terminus, a single membrane-spanning domain and an extracellular loop corresponding to the somatomedin B and catalytic domains, the functionally active NPP2 is secreted upon maturation by proteolytic cleavage. In the liver, hepatocytes express NPP1 and NPP3 basolaterally and apically, respectively, and secrete NPP2. NPP3 is also expressed apically by cholangiocytes.
In the liver NPP1 has been associated with insulin resistance, most likely via the inhibition of insulin receptor autophosphorylation. Interestingly, Enpp1−/− mice are phenotypically characterised by elevated blood glucose and insulin levels. NPP1 also appears to be involved in the control of liver cell growth, since its expression is decreased during the proliferative phase observed following partial (70%) hepatectomy. Although increases in NPP2 and NPP3 mRNA levels were observed during the pathogenesis of hepatitis C and cholangiocarcinoma, respectively, no physiological function has yet been clearly established for these ectonucleotidases.
Acid (ACPs) and alkaline (ALPs) phosphatases
The acid and alkaline phosphatase superfamilies consist of several ectoenzymes that are able to dephosphorylate various substrate types, including nucleotides, phosphorylated proteins, polysaccharides and alkaloids. The acid phosphatase family comprises five members named after their cell or tissue of origin: EAP (erythrocytes), LAP (lysosomes), PAP (prostate), MAP (macrophages) and OcAP/TrAP (osteoclasts, tartrate-resistant form). Acid phosphatases are glycoproteins whose basic structure typically includes one single-spanning membrane domain, with the exception of the secreted forms. The alkaline phosphatase family includes four members also named after their cell or tissue of origin: PLALP (placenta), GCALP (germ cells), IALP (intestine) and TNAP/ALPL (non-specific tissues; liver, bone and kidneys). Alkaline phosphatases are glycosylphosphatidylinositol (GPI)-anchored glycoproteins and can be secreted following proteolytic cleavage. All acid phosphatases, as well as TNAP, are expressed in the liver; however, the functional importance of these ectoenzymes in liver homeostasis remains unknown.
Ecto-5′-nucleotidase/CD73
The 5′-nucleotidase family counts seven members including five cytosolic isoenzymes, namely, cNIa, cNIb, cNII, cNIII, and cdN, one mitochondrial isoenzyme, namely mdN, and one cell-surface GPI-anchored isoenzyme, ecto-5′-nucleotidase/CD73. All 5′-nucleotidases specifically catalyse the conversion of monophosphonucleosides to nucleosides and inorganic phosphate. In contrast with cytosolic 5′-nucleotidases, ecto-5′-nucleotidase has a broad range of specificity toward nucleoside monophosphates. At physiological pH, the activity of ecto-5′-nucleotidase represents the main source of extracellular adenosine, the natural ligand of the P1 receptor class. In the liver, ecto-5′-nucleotidase is expressed by hepatocytes and mesenchymal cells. A well-established function for ecto-5′-nucleotidase in the liver is in tissue protection against ischæmia-reperfusion. Indeed, cd73−/− mice are more susceptible to liver injury following ischæmia-reperfusion when compared to their wild-type counterparts.
Ecto-adenosine deaminase (ecto-ADA)
Ecto-ADA catalyses the deamination reaction of adenosine to inosine in the extracellular medium. Three isoforms of adenosine deaminase have been identified: ADA1 and ADA2, which are both cytosolic, and one membrane-bound ecto-ADA found at the cell surface. Interestingly, analysis of the amino acid sequence of ecto-ADA shows no membrane-spanning domain nor membrane localisation signal, suggesting that ecto-ADA is likely to be anchored to unidentified membrane proteins. In the liver, ecto-ADA is expressed by hepatocytes in the bile canaliculi; however, no physiological function has been shown for this liver ectoenzyme.
Regeneration/anabolism
Ecto-adenylate kinase (ecto-AK)
Ecto-AK catalyses the transfer of a phosphate group from triphosphonucleosides to nucleoside monophosphates, thus yielding two diphosphonucleosides in a reversible manner. The adenylate kinase family includes eight isoforms: six intracellular isoforms, namely AK1α and AK2 to -6, AK7, whose localisation is unknown, and ecto-AK (also known as AK1β), which is bound to the cell membrane surface. Ecto-AK modulates the ATP- and ADP-dependent signalling pathways via the P2X and P2Y receptors. In the liver, ecto-AK is expressed by hepatocytes. A role in the regulation of cholesterol transport by hepatocytes has been attributed to ecto-AK, likely via the enzymatic reduction in ADP availability, and the resulting decrease in activation of the P2Y13 receptor, which has a major function in the stimulation of endocytosis-mediated transport of LDL-cholesterol.
Ecto-nucleoside diphosphokinases (ecto-NDP kinases)
The NDP kinase family is a group of ten proteins (NM23-H1 to -10) encoded by the NM23 tumor metastasis suppressor gene family. NM23-H1 to -H4 and NM23-H6 are the only members endowed with transphosphorylase activity, i.e. the transfer of phosphate groups from ATP to nucleoside diphosphates, thus generating ADP and triphosphonucleosides. NM23-H1 and -H2 are the only membrane-bound members of the NM23 family, and therefore could be responsible for the NDP kinase activity detected at the surface of various cell types, including hepatocytes. To date, the functional relevance of ecto-NDP kinases in liver physiology remains to be determined.
Reabsorption
As mentioned above, once in the extracellular medium, nucleosides and nucleotides can act as effector ligands and exert various biological functions via the activation of specific receptors. Alternatively, they can act as substrates for an array of cell-surface nucleotidases and undergo several biotransformation steps. To support nucleotide-dependent signalling pathways, most cells need to recycle the required building blocks (i.e. nucleobases or nucleosides) in a constant fashion since the highly charged nucleotides cannot cross the plasma membrane. These reabsorption mechanisms, or salvage pathways, are mediated by two classes of membrane proteins, known as equilibrative nucleoside transporters (ENTs) and concentrative nucleoside transporters (CNTs).
Equilibrative (ENTs) and concentrative (CNTs) transporters
The four members (ENT1 to -4) of the ENT/SLC29 family are passive low-affinity facilitative transporters which allow nucleosides and, to a lesser extent, nucleobases to diffuse across the plasma membrane according to their concentration gradient. In contrast, the three members (CNT1 to -3) of the CNT/SLC28 permease family are high-affinity cation-dependent unidirectional symporters that use the potential energy built in the transmembrane Na+ gradient to transfer extracellular nucleosides into the cytoplasm. All ENTs and CNTs are expressed in the liver. Hepatocytes express ENT1, ENT2 and CNT1 at the sinusoidal face, whereas CNT2 is found at the apical face. The expression of several nucleoside transporters that all dampen the loss of these metabolically expensive molecules in the liver is in agreement with the fact that hepatocytes represent the main source of exogenous nucleosides and nucleotides for tissues that are deficient in de novo purine and pyrimidine biosynthesis, such as brain, bone marrow, erythrocytes, and intestinal mucosa.
Conclusion
Extracellular nucleosides and nucleotides are now recognised as essential regulators of liver homeostasis. By activating the ubiquitous P1 and P2 receptors, these physiological mediators modulate several liver functions such as glucose metabolism, urea metabolism, cholesterol metabolism, hemostasis, ion transport, cell proliferation, inflammation and immunity. In addition, hepatic cells express different cell surface enzymes and membrane transporters which regulate the metabolism and abundance of extracellular nucleosides and nucleotides as well as cognate signalling pathways. With the constant progress in the development of innovative molecular and pharmacological tools, the elucidation of extracellular nucleotide and nucleoside signalling pathways is expected to lead to a better understanding of liver (patho)physiology.
Conflict of interest statement
The authors have declared no conflict of interest.
Acknowledgements
M.F. was a recipient of a scholarship from the Government of Gabon, and J.S. of a New Investigator Award from the Canadian Institutes of Health Research (CIHR) and more recently, of a Scholarship from the “Fonds de la Recherche en Santé du Québec” (FRSQ). The authors also thank Dr Richard Poulin (Scientific Proofreading and Writing Service, CHUQ Research Center) for the edition of this article.
1 Introduction
L’ATP est une molécule multifonctionnelle et indispensable à l’homéostasie cellulaire. Ce nucléotide participe à plusieurs fonctions intracellulaires essentielles, dont la biosynthèse des acides nucléiques, la respiration et la signalisation cellulaire modulée par les kinases et les phosphatases cytoplasmiques. On sait maintenant que l’ATP et plusieurs autres nucléotides comme l’UTP, l’ADP et l’UDP, ainsi que l’adénosine, un nucléoside issu de l’hydrolyse de l’ATP, participent également à la signalisation extracellulaire. L’identification de plusieurs récepteurs membranaires de nucléotides et de nucléosides à la surface des cellules hépatiques, ainsi que de plusieurs ectoenzymes capables de métaboliser ces molécules, suggère l’existence d’une signalisation hépatique via les nucléosides et nucléotides extracellulaires. La notion selon laquelle les nucléotides et nucléosides extracellulaires contribuent au maintien de l’homéostasie cellulaire hépatique est maintenant reconnue et appuyée par une quantité sans cesse croissante d’information, laquelle fait l’objet de cette revue. Nous présentons d’abord les différents mécanismes de transduction de signal activés par les nucléosides et nucléotides extracellulaires, ainsi que leur importance physiologique dans diverses fonctions hépatiques. Ensuite, après avoir décrit les différentes sources des nucléosides et nucléotides extracellulaires, nous verrons que leur concentration extracellulaire est contrôlée de manière dynamique par l’activité hydrolytique de diverses ectoenzymes, et que ce niveau de régulation constitue un paramètre-clé de la signalisation induite par ces médiateurs. Finalement, nous décrirons le processus de recapture qui est très important pour l’homéostasie hépatique des nucléosides et nucléotides extracellulaires.
2 La signalisation par les nucléotides et nucléosides extracellulaires
Plusieurs éléments supportent l’implication des nucléosides et nucléotides extracellulaires dans l’homéostasie hépatique [1]. Ces molécules modulent plusieurs processus physiologiques comme le métabolisme du glucose, le métabolisme de l’urée, le tonus vasculaire, la régulation du volume cellulaire, la réponse inflammatoire, ainsi que plusieurs fonctions cellulaires de base telles la synthèse protéique, la sécrétion ionique et le cycle cellulaire [1–4]. Les nucléosides et nucléotides extracellulaires exercent leurs effets biologiques via l’activation de différents récepteurs spécifiques de nucléosides (essentiellement l’adénosine) et de nucléotides (à l’exception des nucléosides monophosphates) appelés P1 et P2, respectivement, et situés dans la membrane plasmique des cellules hépatiques [1]. Dans les deux prochaines sections, nous traiterons de ces récepteurs ainsi que des mécanismes de transduction de signal qu’ils déclenchent lorsqu’activés par leurs ligands spécifiques.
2.1 Les récepteurs de nucléotides
Par définition, les récepteurs P2 sont des récepteurs membranaires ayant pour ligands naturels les nucléosides triphosphates et diphosphates tels l’ATP et l’ADP, respectivement [5]. Les récepteurs P2 sont répartis en deux groupes distincts, soit les récepteurs ionotropes P2X et les récepteurs métabotropes P2Y [6].
Les récepteurs P2X ionotropes forment des canaux ioniques (ex : à Ca2+, Na+, K+ ou Cl−) dont l’ouverture est spécifiquement sous le contrôle de l’ATP (Tableau 1) [7]. La famille des récepteurs P2X compte 7 membres, désignés P2X1 à P2X7 (produits respectifs des gènes P2RX1 à −7 selon la nomenclature officielle HUGO approuvée). La structure de base de chaque sous-unité est caractérisée par la présence de deux domaines transmembranaires reliés par une boucle extracellulaire qui englobe le domaine de liaison à l’ATP, ce qui confère une localisation cytoplasmique aux portions amino- et carboxy-terminales du récepteur [8]. Les sous-unités des récepteurs sont assemblées à l’état natif sous la forme d’homo- ou hétérotrimères formant un canal fonctionnel [7,9]. Suite à la liaison de trois molécules d’ATP, l’ouverture du canal permet l’entrée sélective de cations dans la cellule. L’influx ionique provoque simultanément des changements dans le potentiel membranaire et dans la concentration cytosolique d’ions (ex : Ca2+), conduisant à l’activation de voies de signalisation intracellulaires dont la nature exacte est encore mal définie [7]. Les récepteurs P2X diffèrent entre eux pharmacologiquement par leur affinité pour l’ATP, qui est leur agoniste naturel, et pour ses dérivés tels l’α,β-MeATP, ainsi que par leur sensibilité aux antagonistes de synthèse comme la suramine et le bleu de Coomassie (Tableau 1) [7,10]. L’activation des récepteurs P2X est notamment modulée par la présence de métaux de transition divalents (e.g. Zn2+, Cu2+, Hg2+, Ni2+ ou Cd2+), par le pH extracellulaire ainsi que par les interactions physiques avec les récepteurs ionotropes de la famille « boucle de cystéines » (« Cys-loop ») (soit les récepteurs spécifiques à la nicotine, à l’acétylcholine, à l’acide γ-aminobutyrique, à la glycine et à la sérotonine) [7,11].
Récepteurs de nucléotides et nucléosides hépatiques.
| Récepteura | Agonisteb | Antagonisteb | Signalisationb | Expression hépatique | Fonction |
| Récepteurs P2X ionotropes | |||||
| P2X1 | ATP, α,β-MeATP | IP5I, NF023, NF449, TNP-ATP | Canal ionique (Ca2+ et Na+) | Lymphocytes | n/d |
| P2X2 | ATP, ATPγS | isoPPADS, NF279, NF770, RB2, suramine | Canal ionique (surtout Ca2+) | Épithélium biliaire, lymphocytes | n/d |
| P2X3 | ATP, 2-MeSATP | A317491, IP5I, NF110, PPADS, TNP-ATP, RO-85 | Canal ionique intrinsèque | Épithélium biliaire | n/d |
| P2X4 | ATP, α,β-MeATP | Bleu de Coomassie, TNP-ATP | Canal ionique (surtout Ca2+) | Hépatocytes (membrane apicale), endothélium vasculaire, muscle lisse, épithélium biliaire, cellules dendritiques, cellules de Küpffer, lymphocytes | Métabolisme du glucose [12], transport ionique (bile) [12,13] |
| P2X5 | ATP, α,β-MeATP | Bleu de Coomassie, PPADS, suramine | Canal ionique intrinsèque (Cl−) | Tissu artériel mésentérique | n/d |
| P2X6 | Hétéromère obligatoire | – | Canal ionique intrinsèque | Épithélium biliaire, cellules de Küpffer | n/d |
| P2X7 | ATP, BzATP | KN62, KN04, MRS2427, oATP | Canal ionique intrinsèque et pore | Hépatocytes, endothélium vasculaire, muscle lisse, épithélium biliaire, cellules dendritiques, cellules de Küpffer, lymphocytes | Apoptose [127], inflammation [15] |
| Récepteurs P2Y métabotropes | |||||
| P2Y1 | ADP, 2-MeSADP, ATP, ATPγS | 2-ClATP, 2-MeSATP, MRS2179, MRS2279 | Gq/G11 ; activation de PLC-β | Hépatocytes, endothélium vasculaire, muscle lisse, épithélium biliaire, cellules de Küpffer, lymphocytes | Métabolisme du glucose [26] |
| P2Y2 | ATP, Ap4A, UTP, UTPγS | ARC126313, RB2, suramine | Gq/G11 ; activation de PLC-β | Hépatocytes, endothélium vasculaire, muscle lisse, épithélium biliaire, cellules de Küpffer, cellules étoilées hépatiques, lymphocytes, neutrophiles | Transport ionique (bile) [27] |
| P2Y4 | ATP, Up4U, Up4dC, UTP | PPADS, RB2, suramine | Gq/G11 ; activation de PLC-β | Hépatocytes, épithélium biliaire, cellules de Küpffer, cellules étoilées hépatiques, lymphocytes | n/d |
| P2Y6 | MRS2693, UDP, UDPβS, Up3U | MRS2567, MRS2575, MRS2578, RB2 | Gq/G11 ; activation de PLC-β | Hépatocytes, endothélium vasculaire, muscle lisse, épithélium biliaire, cellules de Küpffer, cellules étoilées hépatiques, lymphocytes, neutrophiles | n/d |
| P2Y11 | ARC67085, ATP, ATPγS, BzATP, dATP | 5′AMPS, NF157, NF340, RB2, suramine | Gq/G11 ; activation de PLC-β et Gs ; activation de AC | Épithélium biliaire, lymphocytes | Régulation transcriptionnelle de l’interleukine-6 [28] |
| P2Y12 | ADP, ADPβS, 2-MeSADP, 2-MeSATP | AZD6140, BX667, Cangrelor, Clopidogrel, INS50589 | Gi/o ; inhibition de AC | Épithélium biliaire, lymphocytes | Fonctions chimiosensibles [29] |
| P2Y13 | ADP, 2-MeSADP, 2-MeSATP | Ap4A, Cangrelor, 2-MeSAMP, MRS2211, MRS2603, RB2 | Gi/o ; inhibition de AC et G16 ; activation de PLC-β | Hépatocytes | Métabolisme du cholestérol [31,128] |
| P2Y14 | UDP, UDP-galactose, UDP-glucuronate, UDP-glucose | UDP | Gi/o ; inhibition de AC | Lymphocytes | n/d |
| Autres récepteurs de nucléotides | |||||
| CysLT1 | UDP | MK571 | n/d | ARNm (tissu total) | n/d |
| GPR17 | UDP, UDP-glucose | Cangrelor, MRS2179 | Gi/o ; inhibition de AC et Gq/G11 ; activation de PLC-β | ARNm (tissu total) | n/d |
| Récepteurs P1 métabotropes | |||||
| A1 | Adénosine, CCPA, R-PIA, NECA | DPCPX, CGS15943, CPT, FR194921, WRC-0571, XAC | Gi/o ; inhibition de AC | Hépatocytes | Inflammation [41], métabolisme de l’urée [40] |
| A2a | Adénosine, ATL146e, CGS21680, CV-1808, IAB-MECA, NECA | CGS15943, MRS1093, SCH58261, ZM241385 | Gs ; activation de AC | Hépatocytes, cellules étoilées hépatiques, cellules de Küpffer | Inflammation [43,44,129,130], métabolisme de l’urée [40], chimiotaxie [45,46] |
| A2b | Adénosine, NECA | AS99, AS101, MRE2029F20, MRS1754, OSIP339391, XAC | Gs ; activation de AC | Hépatocytes | Métabolisme du glucose [39], métabolisme de l’urée [40] |
| A3 | Adénosine, I-ABA, IAB-MECA, IB-MECA, NECA | MRS1177, MRS1220, MRE3010F20, VUF8504 | Gi/o ; inhibition de AC | Hépatocytes | Apoptose [47–49], métabolisme du glucose [38], inflammation [42], métabolisme de l’urée [40] |
a Nomenclature formelle selon Alexander et al. [131].
b Informations provenant de la base de données IUPHAR (www.iuphar-db.org) [10,19,36,132,133] et selon Mellor et al. [134], Pugliese et al. [135], Brotherton-Pleiss et al. [136].
On peut démontrer l’expression de tous les récepteurs P2X dans le foie, où leur distribution tissulaire est décrite au Tableau 1. On remarque que les récepteurs P2X4 et P2X7 sont exprimés chez la plupart des cellules hépatiques et que tous les récepteurs P2X, sauf P2X1 et P2X5, sont présents dans l’épithélium biliaire. On accorde un rôle au récepteur P2X4 dans la sécrétion des ions Na+ et Ca2+ par les hépatocytes [12], et au transport du Cl− dans l’épithélium des canaux biliaires [13]. De plus, des observations indirectes suggèrent que le récepteur P2X4 est impliqué dans la régulation du métabolisme du glucose, car l’expression de son ARN messager (ARNm) est augmentée dans les hépatocytes riches en glycogène dans le cas de souris chez lesquelles le gène encodant la protéine ChREBP, un facteur de transcription activé par les hydrates de carbone, a été éliminé par invalidation (souris knock-out), [12]. L’expression du récepteur P2X6 est fortement augmentée chez les macrophages résidents du foie (i.e. les cellules de Küpffer), durant le développement postnatal ou suite à l’exposition à l’endotoxine lipopolysaccharidique, ce qui suggère que le récepteur P2X6 jouerait un rôle dans la fonction immune hépatique [14]. Le récepteur P2X7 est, quant à lui, impliqué dans la protection tissulaire hépatique lors de conditions inflammatoires. En effet, dans un modèle d’hépatite induite par injection de concanavaline A, une lectine, il y a réduction des dommages tissulaires et des niveaux d’interleukine-4 et d’interféron-γ, deux cytokines inflammatoires, chez les souris P2rx7−/− (dont le gène encodant le récepteur P2X7 a été invalidé) présentent comparativement aux souris de type sauvage [15].
Les récepteurs P2Y sont des récepteurs serpentins métabotropes liant spécifiquement les nucléosides tri- et diphosphates adényliques et/ou uridyliques [16]. Jusqu’à présent, huit récepteurs P2Y ont été identifiés chez les mammifères, soit P2Y1, 2, 4, 6, 11-14 (produits respectifs des gènes P2RY1, P2RY2, P2RY4, P2RY6, P2RY11 à -14 selon la nomenclature HUGO approuvée) [17]. Les récepteurs P2Y sont caractérisés pharmacologiquement par la spécificité et l’affinité pour leur agoniste naturel (Tableau 1) [16,17]. Fait inusité, le récepteur P2Y14 se lie spécifiquement aux monosaccharides nucléotidiques tels l’UDP-glucose et l’UDP-galactose. Hormis les récepteurs P2Y, les récepteurs CysLT1, CysLT2 et GPR17, dont les ligands principaux sont les cystéinyl-leucotriènes, peuvent également répondre à des concentrations d’UDP de l’ordre de 10−9 M [17]. Les récepteurs P2Y sont classés selon leur mécanisme d’action métabotropique principal, soit la mobilisation de Ca2+ ou la régulation du niveau d’AMPc intracellulaire [16,17]. Les propriétés pharmacologiques distinctes des récepteurs P2Y ont permis le développement de plusieurs agonistes synthétiques comme l’ATPγS, ou d’antagonistes tel le MRS 2179 (Tableau 1) [16–19].
On retrouve tous les récepteurs P2Y dans le foie, ainsi que les récepteurs CysLT1 et GPR17 [1,20–25]. Les récepteurs P2Y1 2, 4, 6 ont la distribution la plus étendue (Tableau 1), tandis que l’épithélium biliaire exprime tous les récepteurs P2Y, sauf P2Y13 et P2Y14.
Le récepteur P2Y1 participe à la modulation du métabolisme du glucose, puisque son agoniste spécifique, la 2-méthyl-thio-ADP, induit une augmentation de l’activité de la glycogène phosphorylase chez les hépatocytes du rat [26]. Le récepteur P2Y2 est impliqué dans le contrôle de la sécrétion biliaire en modulant l’activité de l’échangeur Na+/H+ chez les cholangiocytes de l’homme et du rat [27]. De plus, l’activité transcriptionnelle du gène de l’interleukine-6 est modulée suite à la stimulation des cholangiocytes par l’ATP extracellulaire chez le rat, ce qui suggère l’existence chez cette espèce d’un récepteur de nucléotides apparenté au récepteur P2Y11 humain [28]. La signalisation via le récepteur P2Y12 contribue aux fonctions chimiosensibles des cils vibratiles chez les cholangiocytes [29]. L’activation du récepteur P2Y12 semble quant à elle impliquée dans le contrôle de la sécrétion de la sérotonine plaquettaire, qui est essentielle au processus de régénération cellulaire faisant suite à une hépatectomie partielle [30]. Enfin, le récepteur P2Y13 contrôle l’endocytose des lipoprotéines de haute densité (high density lipoproteins [HDL]), qui constitue une étape essentielle dans le métabolisme du cholestérol chez les hépatocytes du rat [31].
2.2 Les récepteurs de nucléosides
Les récepteurs P1 sont des récepteurs serpentins métabotropes ayant pour ligand naturel l’adénosine. Il en existe quatre sous-types, dénommés A1, A2a, A2b et A3 (produits respectifs des gènes ADORA1, -2A, -2B et -3 selon la nomenclature HUGO approuvée) [32,33]. À l’exception de quelques types cellulaires, l’activation des récepteurs A2a et A2b aboutit à une augmentation de la production d’AMPc intracellulaire, alors que l’activation des récepteurs A1 et A3 en entraîne plutôt la diminution (Tableau 1) [34]. Les récepteurs A1, A2a et A3 sont dits de forte affinité parce que leur activation nécessite de faibles concentrations d’adénosine (de 0,01 à 1 μM) [34]. Par contre, le récepteur A2b est dit de faible affinité parce qu’il est activé par des niveaux d’adénosine > 10 μM. Les récepteur A2a et A3 sont également sensibles à un autre nucléoside, l’inosine [32,35]. Les récepteurs P1 ont été largement caractérisés à l’aide d’analogues synthétiques de l’adénosine (e.g. ATL146e), de composés naturels comme les méthylxanthines (e.g. caféine) ainsi que d’antagonistes spécifiques comme la 1,3-dipropyl-8-cyclopentylxanthine (DPCPX) (Tableau 1) [32,36,37].
Tous les récepteurs P1 sont exprimés dans le foie [23]. Les hépatocytes expriment les quatre récepteurs de l’adénosine. Par contre, les cellules hépatiques étoilées et les cellules de Küpffer n’expriment que le récepteur A2a, tandis que les cellules épithéliales biliaires en sont totalement dépourvues. L’adénosine est impliquée dans la régulation du métabolisme hépatique du glucose par l’activation des récepteurs A2b et A3, tant pour la glycogénolyse que dans le cas de la gluconéogenèse [38,39]. L’adénosine, via l’activation des quatre récepteurs P1, peut également stimuler le métabolisme de l’urée [40]. De plus, les récepteurs A1, A2a et A3 jouent des rôles immunomodulateurs essentiels à la protection du foie en conditions pathologiques comme lors de l’ischémie, du choc septique et de la fibrose [4,34]. Par exemple, dans un modèle de septicémie, tant les souris Adora1−/− (chez lesquelles le récepteur A1 a été invalidé) que les souris de type sauvage exposées au DPCPX (un antagoniste sélectif du récepteur A1), présentent une exacerbation de la réponse inflammatoire et un taux de mortalité supérieur à celui des souris de type sauvage témoins [41]. On a fait des observations similaires en comparant les souris Adora3−/− (chez lesquelles le récepteur A3 a été invalidé) et les souris de type sauvage traitées au MRS 1191 (un antagoniste sélectif du récepteur A3) à leurs congénères témoins de type sauvage [42]. Il a été également démontré en outre chez trois modèles de fibrose hépatique que les souris Adora2a−/− (chez lesquelles le récepteur A2a a été invalidé) sécrètent des quantités plus élevées de cytokines inflammatoires telles le TNF-α et l’IFN-γ, et sont plus susceptibles aux dommages tissulaires concomitants que les souris de type sauvage [43,44]. De plus, l’activation du récepteur A2a bloque la chimiotaxie chez les cellules hépatiques étoilées et les cellules-souches mésenchymateuses de la moelle osseuse, deux types cellulaires essentiels à la réparation tissulaire hépatique [45,46]. Enfin, plusieurs études tant in vitro qu’in vivo ont également mis en évidence un rôle pour le récepteur A3 dans l’induction de l’apoptose hépatique [47–49].
Comme nous venons de le voir ci-dessus, il y a une vingtaine de récepteurs connus qui répondent à divers nucléo(s/t)ides d’origine variée. La section qui suit traite donc des diverses sources extracellulaires de ces médiateurs.
3 Relargage des nucléosides et nucléotides extracellulaires
En accord avec leur rôle central dans le métabolisme intracellulaire, les nucléo(s/t)ides comme l’adénosine et l’ATP sont ubiquitaires. Les niveaux de nucléotides mesurés dans le cytoplasme chez la plupart des cellules sont de l’ordre de 10−3 M [50,51]. Par exemple, la concentration d’ATP intracellulaire varie entre 3 et 5 mM chez les hépatocytes [52]. Chaque cellule constitue donc une source potentielle de nucléo(s/t)ides extracellulaires. Les niveaux de nucléotides mesurés à l’équilibre in vitro dans les fluides extracellulaires chez plusieurs types de cellules primaires ou immortalisées sont de l’ordre de 10−9 M [53–55]. Dans le foie, la concentration de nucléotides adényliques dans la bile est estimée à environ 5 μM [55]. Plusieurs modes de relargage des nucléo(s/t)ides à la surface des cellules ont été décrits [56–58]. Premièrement, les cellules nécrotiques ou apoptotiques ainsi que les cellules dont la membrane plasmique est endommagée relâchent des nucléo(s/t)ides de manière incontrôlée dans le milieu. Deuxièmement, l’exocytose de vésicules de sécrétion chez des cellules excitables comme les cellules β pancréatiques [57] ou chez d’autres types cellulaires telles les plaquettes [59] constituent un mécanisme bien établi de relargage de nucléo(s/t)ides. Troisièmement, plusieurs types cellulaires libèrent constitutivement des nucléotides dans le milieu, i.e. de façon spontanée et en absence de stimulation [3,55,60,61]. Quatrièmement, chez la plupart des cellules, on retrouve dans la membrane plasmique des transporteurs passifs (ou facilitateurs) de nucléosides qui régulent les niveaux extracellulaires de ces molécules, notamment celui de l’adénosine [62]. Cinquièmement, on observe également un relargage spontané de nucléotides lorsque les cellules sont soumises à divers stress, tant physiologiques − comme la pression mécanique et le stress osmotique − que non-physiologiques − comme l’hypoxie et l’ischémie [56,60,63]. Par exemple, les cholangiocytes stimulés mécaniquement par le flux biliaire relarguent spontanément de l’ATP [64], de même que les érythrocytes soumis aux forces de cisaillement dans la circulation sanguine [56]. Finalement, plusieurs types cellulaires exportent des nucléotides vers le milieu suite à une stimulation par un ligand spécifique [56]. Ainsi, les hépatocytes exposés aux acides biliaires tels l’ursodésoxycholate et le tauroursodésoxycholate relarguent physiologiquement de l’ATP dans la bile [65].
Toutefois, les modes de relargage spontané et/ou induit par un stimulus demeurent mal compris. Dans le cas du relargage spontané, aucune étude n’est parvenue jusqu’à présent à clairement déterminer l’identité du canal ou pore responsable de l’efflux de l’ATP. En revanche, en utilisant différentes approches tant pharmacologiques que moléculaires, on a pu identifier plusieurs protéines comme régulateurs potentiels de l’efflux de nucléo(s/t)ides. Parmi ces protéines, on retrouve le canal anionique sensible au volume (ou volume-sensitive osmolyte and anion channel [VSOAC]), le canal transmembranaire régulateur de la fibrose kystique (cystic fibrosis transmembrane conductance regulator [CFTR]), une isoforme du canal mitochondrial anionique dépendant du voltage (voltage-dependent anion channel [VDAC]) qui est présente dans la membrane plasmique, et plus récemment des protéines de jonctions communicantes telles les connexines Cx43, Cx32 et Cx26 ainsi que la pannexine-1 [56]. Une étape importante dans la voie de signalisation activée lors de l’efflux induit par un stimulus semble être la mobilisation du Ca2+ intracellulaire, tel qu’observé chez la lignée de cholangiocytes Mz-Cha-1 [16]. Néanmoins, la nature véritable des mécanismes impliqués dans le relargage de nucléotides, à l’exception de celui qui résulte de la lyse cellulaire ou de l’exocytose de granules de sécrétion, reste à clarifier.
Les fonctions associées aux nucléo(s/t)ides extracellulaires dépendent directement de leurs concentrations extracellulaires. Ce paramètre biologique est en partie contrôlé par les différents mécanismes de relargage ainsi que par l’activité biochimique de plusieurs familles d’enzymes de surface [66], sujet que nous allons maintenant aborder dans la section suivante.
4 Le métabolisme des nucléotides extracellulaires
En catalysant diverses réactions biochimiques importantes, plusieurs familles d’ectoenzymes sont responsables de la modulation des voies de signalisation dépendantes des nucléo(s/t)ides extracellulaires [67]. Ces ectoenzymes sont séparées en deux classes principales : les ectophosphohydrolases/estérases, soit les enzymes catalysant la dégradation des nucléo(s/t)ides extracellulaires, et les ectokinases/phosphotransférases, soit les enzymes catalysant les réactions de transphosphorylation des nucléotides [68].
4.1 Hydrolyse des nucléotides et nucléosides extracellulaires
4.1.1 Les nucléosides triphosphates diphosphohydrolases (NTPDases)
En 1944, Kalckar décrit pour la première fois l’existence de l’apyrase, une enzyme extraite de Solanum tuberosum (pomme de terre) capable d’hydrolyser l’ATP, l’ADP et l’ITP en leurs dérivés monophosphates respectifs, tout en libérant des molécules de phosphate inorganique (Pi) [69]. En 1980, l’étude de Lebel et al. a rapporté la purification et la caractérisation d’une enzyme pancréatique porcine aux propriétés biochimiques semblables à celles de l’apyrase de la pomme de terre [70]. Au milieu des années 1990, l’homologue mammalienne de l’apyrase de la pomme de terre, qui correspond à la protéine CD39, a été clonée et identifiée chez plusieurs espèces, dont l’homme [66,71–73]. L’identification du gène CD39 a mené à la découverte de sept autres ectonucléotidases possédant une homologie de séquence et des caractéristiques biochimiques similaires, regroupées au sein d’une nouvelle famille d’enzymes appelées NTPDases [EC 3.6.1.5] (NTPDase1 à −8 ; produits respectifs des gènes ENTPD1 à −8 selon la nomenclature HUGO approuvée) [74]. Ces enzymes sont responsables de la majeure partie de l’activité d’hydrolyse des nucléotides à la surface des cellules à pH physiologique (Tableau 2) [66,68]. Les NTPDase1-4, 7 et 8 sont des protéines membranaires intégrales de type I, avec de courtes portions amino- et carboxy-terminales intracytoplasmiques ainsi que deux domaines transmembranaires hydrophobes délimitant une large boucle extracellulaire contenant le site catalytique. Ces enzymes existent sous forme monomérique ou homo-oligomérique (Fig. 1). Les NTPDase5 et −6, quant à elles, sont des protéines membranaires intégrales de type II possédant un domaine transmembranaire unique avec une portion C-terminale extracellulaire, et pouvant être sécrétées après clivage protéolytique [75]. Alors que les NTPDase1 à −3 et la NTPDase8 sont ancrées à la membrane plasmique et que leur site actif est exposé au milieu extracellulaire, les NTPDase4 à −7 sont généralement ancrées à la membrane d’organites (lysosomes, appareil de Golgi et réticulum endoplasmique), et leur site actif fait face à la lumière de l’organite. Les NTPDase4 à −7 sont parfois appelées endo-NTPDases en référence à leur compartimentation intracellulaire principale [75]. L’organisation particulière des domaines des NTPDases fait en sorte que ces enzymes n’hydrolysent pas les nucléotides cytosoliques. Les NTPDases se distinguent principalement par leur spécificité et par leur capacité d’hydrolyser les nucléosides tri- et diphosphates de type puriniques et pyrimidiniques [66,74]. Par exemple, la NTPDase1 hydrolyse aussi bien l’ATP que l’ADP, tandis que la NTPDase2 favorise spécifiquement la dégradation de l’ATP. Les NTPDase3 et −8 sont des intermédiaires fonctionnels entre les NTPDase1 et −2. L’activité biochimique des NTPDases requiert la présence de métaux de transition divalents comme le Ca2+, le Mg2+, le Mn2+et le Zn2+, et est optimale pour une large gamme de pH (∼5–10) [76]. De plus, ces ectoenzymes sont sujettes à des modifications post-traductionnelles comme la glycosylation et l’acylation (e.g. la palmitoylation) qui peuvent affecter divers aspects de leur physiologie, tels leur activité biochimique, leur ciblage à la membrane plasmique et leur trafic intracellulaire [66].
Ectonucléotidases hépatiques.
| Ectonucléotidase | Réaction catalyséeb | Substratb | Expression hépatique | Fonction |
| Ecto-nucléotide pyrophosphatases/phosphodiestérases (NPPs) [EC 3.6.1.9]/[EC 3.1.4.1] a | ||||
| NPP1, NPPase, PC-1 | NTP → NMP + PPi NDP → NMP + Pi NpnN → NMP + Npn-1 3′5’-NMPc → NMP |
ATP, NpnN, pNP-TMP, NAD+ | Hépatocytes (membrane basolatérale) | Prolifération cellulaire [93], résistance hépatique à l’insuline [92] |
| NPP2, autotaxine, PD-1α | ATP, NpnN, pNP-TMP, LPC, SPC | Hépatocytes | n/d | |
| NPP3, PD-1β, gp130RB13−6, B10 | ATP, NpnN, pNP-TMP | Hépatocytes (membrane apicale), épithélium biliaire (membrane apicale) | n/d | |
| Ecto-nucléoside triphosphate diphosphohydrolases (NTPDases) [EC 3.6.1.5] a | ||||
| NTPDase1, CD39, apyrase | NTP → NDP + Pi NDP → NMP + Pi |
NTP, NDP | Endothélium vasculaire, endothélium sinusoïdal, cellules de Küpffer, lymphocytes | Hémostase [79], prolifération cellulaire [80] |
| NTPDase2, CD39L1, ecto-ATPase | NTP | Adventice vasculaire, fibroblastes portaux, cellules étoilées hépatiques activées | Hémostase [79], prolifération cellulaire [74] | |
| NTPDase3, CD39L3 | NTP, NDP | ARNm (tissu total) | n/d | |
| NTPDase4, UDPase, LALP70 | GDP, IDP, UDP, CDP | ARNm (tissu total) | n/d | |
| NTPDase5, CD39L4, PCPH | UDP, GDP, CDP, ADP | ARNm (tissu total) | Développement du cancer [85] | |
| NTPDase6, CD39L2 | UTP, TTP, UDP | ARNm (tissu total) | n/d | |
| NTPDase7, LALP1 | UTP, GTP, CTP | ARNm (tissu total) | n/d | |
| NTPDase8, hATPDase | NTP, NDP | Hépatocytes (membrane apicale) | n/d | |
| Phosphatases acides (ACPs) [EC 3.1.3.2] * | ||||
| PAP (forme membranaire) | NTP → NDP + Pi NDP → NMP + Pi NMP → Nucléoside + Pi |
NTP, NDP, NMP, pNPP, molécules phosphorylées (alcaloïdes, lipides, protéines, sucres) | ARNm (tissu total) | n/d |
| TrAP | NTP → NDP + Pi NDP → NMP + Pi NMP → Nucléoside + Pi |
NTP, NDP, NMP, pNPP, molécules phosphorylées (alcaloïdes, lipides, protéines, sucres) | Cellules de Küpffer | n/d |
| Phosphatases alcalines (APs) [EC 3.1.3.1] * | ||||
| TNAP, ALPL | NTP → NDP + Pi NDP → NMP + Pi NMP → Nucléoside + Pi |
NTP, NDP, NMP, pNPP, molécules phosphorylées (alcaloïdes, lipides, protéines, sucres) | Hépatocytes | n/d |
| 5′-nucléotidases (5′-NTs) [EC 3.1.3.5] * | ||||
| Ecto-5′-nucléotidase, CD73 | NMP → Nucléoside + Pi | NMP | Hépatocytes | Inflammation [106] |
a Nomenclature formelle selon Zimmermann et al. [138] et *selon la base de données IUBMB (www.chem.qmul.ac.uk/iubmb/enzyme) [139]. Les autres appellations d’enzymes sont en italique.
b Informations provenant de la base de données IUBMB et selon Zimmermann et al. [74], Stefan et al. [86], Robson et al. [66] et Shirley et al. [140].
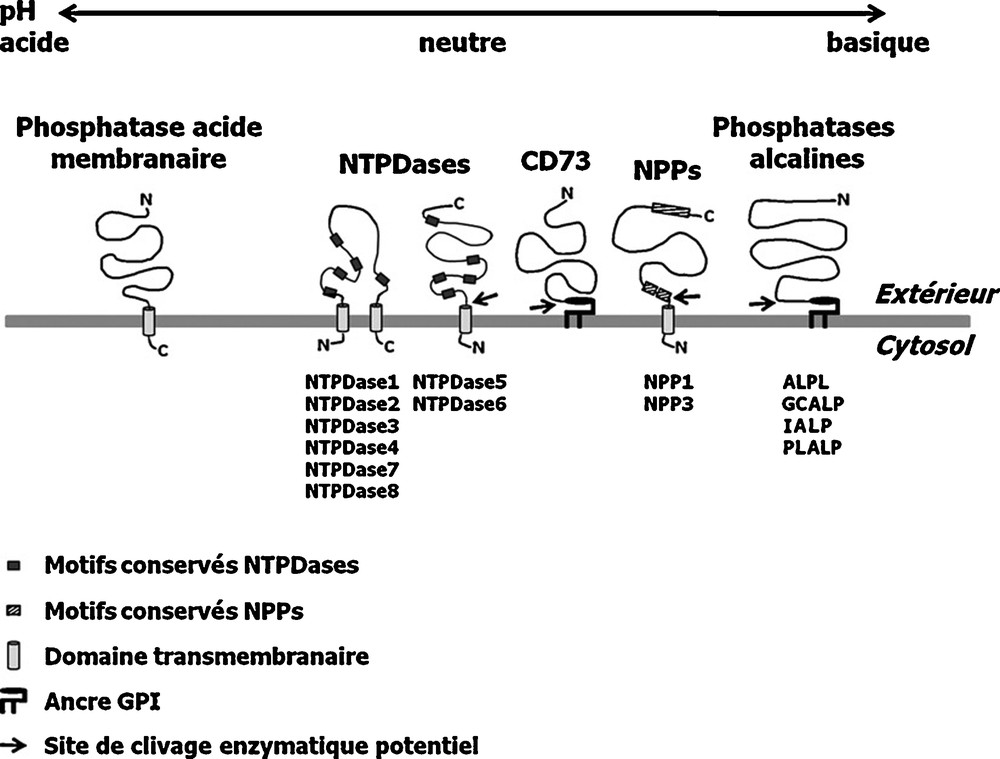
Représentation schématique des ectonucléotidases.
Les NTPDase1 à −8 sont exprimées dans le foie et leur distribution est assez large (Tableau 2). Il est à noter cependant, que l’expression hépatique des NTPDase3 à −7 a été détectée seulement au niveau transcriptionnel ([77] et F. Bigonnesse, E.G. Lavoie et J. Sévigny, données non publiées). Dû à leur identification récente, on ne rapporte que peu d’études fonctionnelles sur les NTPDases. Le premier rôle physiologique qui a été identifié pour les NTPDase1 et −2 est le contrôle de l’hémostase, qui est directement associé aux capacités distinctes de ces enzymes d’hydrolyser l’ADP sécrété par les plaquettes activées [78,79]. L’activité de la NTPDase1 qui est exprimée dans l’endothélium favorise l’élimination de l’ATP, un médiateur physiologique bien connu de l’agrégation plaquettaire, alors que celle de la NTPDase2, présente dans l’adventice de la vasculature, favorise l’accumulation de l’ADP [79]. Récemment, une étude a démontré que l’induction de l’expression de la NTPDase1 dans l’endothélium sinusoïdal hépatique est primordiale pour le processus de régénération cellulaire post-hépatectomie [80]. Chez les souris Entpd1−/−, l’absence de la NTPDase1 perturbe la voie d’activation du récepteur du facteur de croissance de l’endothélium vasculaire (vascular endothelial growth factor receptor [VEGFR]) de type 2 et du relargage subséquent du facteur de croissance hépatique (hepatocyte growth factor [HGF]), étape essentielle à la prolifération des hépatocytes. La NTPDase1 est également impliquée dans la modulation de la réponse inflammatoire hépatique. Chez les souris Entpd1−/−, la carence en NTPDase1 est associée à une diminution de la sécrétion de l’interféron-γ par les cellules NK (« natural killer ») activées et à une atténuation des dommages tissulaires liés à l’ischémie-reperfusion au niveau hépatique [81]. La déficience de NTPDase1 entraîne également une réduction dans la progression de métastases hépatiques chez les souris Entpd1−/− comparativement aux souris de type sauvage [82]. Ce phénomène découle, d’une part, de la baisse de l’effet immunosuppresseur des lymphocytes T régulateurs sur l’activité anti-tumorale des cellules NK effectrices et, d’autre part, de la vascularisation réduite des métastases, dans le foie des souris génétiquement modifiées. Plus récemment, chez un modèle d’ischémie-réperfusion hépatique chez la souris, on a montré que l’effet protecteur contre les dommages tissulaires conféré par le conditionnement pré-ischémique était attribuable à l’induction de l’expression de la NTPDase1 par le facteur de transcription SP1 [83]. Une autre étude a démontré que la NTPDase2 exprimée chez les fibroblastes portaux agissait comme un répresseur constitutif de la prolifération cellulaire des cholangiocytes [84]. En effet, la co-culture de cellules épithéliales biliaires Mz-ChA-1 avec des fibroblastes portaux de rat surexprimant la NTPDase2 entraîne une diminution significative de leur prolifération. De plus, l’effet antiprolifératif attribué à la NTPDase2 peut être reproduit in vitro en ajoutant de l’apyrase soluble ou de la suramine, un inhibiteur à large spectre des récepteurs P2. D’autre part, le phénotype des souris Entpd5−/− est caractérisé par le développement d’une hépatite progressive et de lésions néoplasiques [85]. La NTPDase5 étant l’homologue du proto-oncogène humain PCPH, ces observations suggèrent que la NTPDase5 pourrait être impliquée dans le développement de certains types de cancers.
4.1.2 Les nucléotides pyrophosphatases/phosphodiestérases (NPPs)
La famille des ecto-nucléotides pyrophosphatases [EC 3.6.1.9]/phosphodiestérases [EC 3.1.4.1] regroupe sept membres (NPP1 à −7 ; produits respectifs des gènes ENPP1 à −7 selon la nomenclature HUGO approuvée), dont certains hydrolysent un groupement pyrophosphate (PPi) ou phosphate (Pi) d’une grande variété de substrats naturels, incluant les nucléosides tri- et diphosphates et leurs dérivés naturels ou de synthèse (e.g. la paranitrophénolphosphate -thymidine 5′-mono-phosphate ou pNP-TMP), tandis que d’autres hydrolysent les lysophospholipides (Tableau 2) [68,86]. Les ectoenzymes NPP1/NPPase/PC-1, NPP2/autotaxine/PD-1α et NPP3/gp130RB13−6/B10/PD-1β sont les seuls membres de cette famille capables d’hydrolyser l’ATP et l’ADP [87]. La structure des NPP1 à −3 inclut un site de type endonucléase hautement conservé chez toutes les NPPs, ainsi qu’un domaine catalytique exclusif à ces trois membres et caractérisé par deux motifs de type somatomédine B riches en résidus cystéinyles. Les NPP1 et −3 sont des glycoprotéines membranaires de type II avec une portion N-terminale intracellulaire, un domaine transmembranaire unique, et une large boucle extracellulaire contenant les deux domaines somatomédine B et un domaine de type endonucléase (Fig. 1). Dans la portion N-terminale intracellulaire de NPP1, on trouve un motif dileucine de compartimentation cellulaire qui détermine la localisation basolatérale de l’enzyme chez les cellules polarisées. En comparaison, la NPP3, qui ne possède pas de tel motif, a une position apicale chez les cellules polarisées. Comme la forme active de la NPP2 est sécrétée après un clivage protéolytique par des endoprotéases de type furine, cette enzyme est donc synthétisée sous la forme d’un zymogène. Il est intéressant de noter que des formes solubles biochimiquement actives des NPP1 et −3 ont été identifiées, sans toutefois que le mécanisme aboutissant à la génération de ces isoenzymes ait été élucidé [86]. Sous leur forme fonctionnelle, les NPP1 et −3 sont homodimériques, contrairement à la NPP2 qui, elle, est monomérique [86]. La NPP2 hydrolyse préférentiellement les lysophospholipides tels la lysophosphatidylcholine (LPC) et la sphingophosphorylcholine (SPC), et avec une efficacité moindre, les nucléotides. Par contre, les NPP1 et −3 hydrolysent exclusivement les nucléotides, et ce, plus efficacement que la NPP2. L’activité enzymatique des NPPs est inhibée par les glycosaminoglycanes ainsi que par des agents réducteurs ou chélatants [88]. De plus, l’activité hydrolytique des NPPs est optimale à un pH alcalin, et dépend de la présence de métaux de transition divalents [74,88].
Dans le foie, les hépatocytes expriment la NPP1 à la face basolatérale et la NPP3 à la face apicale de la membrane plasmique, et sécrètent en plus la NPP2 [89–91]. Les cholangiocytes expriment également la NPP3 en position apicale [90]. La NPP1 est l’enzyme la mieux caractérisée, et son expression est associée à la résistance hépatique à l’insuline via l’inhibition de l’autophosphorylation du récepteur de l’insuline, laquelle est essentielle à l’activité de ce dernier [86,92]. De plus, les souris qui surexpriment spécifiquement la NPP1 humaine ciblée au foie présentent une glycémie et une insulinémie élevées [92]. La NPP1 semble également impliquée dans le contrôle de la prolifération cellulaire, puisque son expression est diminuée durant la phase proliférative qui s’ensuit après une hépatectomie partielle (∼70 %) [93]. Quant aux NPP2 et −3, plusieurs études ont rapporté une augmentation des niveaux respectifs de leur ARN messager lors de pathologies hépatiques comme l’hépatite C et le cholangiocarcinome [94–96]. Toutefois, la contribution des NPPs dans la modulation de la signalisation hépatique par les nucléo(s/t)ides extracellulaires reste à déterminer, puisque leur capacité d’hydrolyser les nucléotides est relativement faible à pH physiologique, en comparaison avec les NTPDases [97].
4.1.3 Les phosphatases acides (ACPs) et alcalines (ALPs)
Les familles des phosphatases acides [EC 3.1.3.2] et alcalines [EC 3.1.3.1] regroupent plusieurs ectoenzymes (et isoformes) capables de déphosphoryler de façon non spécifique plusieurs types de substrats comme les nucléotides, les phosphoprotéines, les polysaccharides, les alcaloïdes ainsi que le paranitrophénolphosphate (pNPP) (Tableau 2) [74,98–100]. La famille des phosphatases acides compte cinq isoenzymes nommées d’après leur origine : EAP (érythrocytes ; produit du gène ACP1 selon la nomenclature HUGO approuvée), LAP (lysosomes ; ACP2), PAP (prostate ; ACPP), MAP (macrophages ; ACPT) et OcAP/TrAP (ostéoclastes/forme résistante à l’inhibition par le tartrate ; ACP5) [98]. Les phosphatases acides sont des glycoprotéines de type I dont la structure peut comporter un segment transmembranaire (e.g. la forme membranaire de PAP) ou non (e.g. la forme sécrétée de PAP) (Fig. 1) [100]. Leur activité est optimale à un pH acide (3–5) et dépend de la présence d’ions Fe2+. La famille des phosphatases alcalines comporte quatre isoenzymes, soit PLALP (placenta ; produit du gène ALPP selon la nomenclature HUGO approuvée), GCALP (cellules germinales ; ALPPL2), IALP (intestin ; ALPI) et TNAP/ALPL (non spécifique à un tissu particulier : foie, os, rein ; ALPL) [74,99]. Les phosphatases alcalines sont des glycoprotéines ancrées dans la membrane plasmique via un groupement covalent glycosylphosphatidylinositol (GPI) (Fig. 1) [74]. De ce fait, chaque enzyme peut être relâchée dans le liquide interstitiel après clivage par des phospholipases endogènes [74]. Leur activité est optimale à un pH voisin de 8, thermosensible et dépend de la présence de métaux de transition divalents comme le Zn2+ et le Mg2+ [74].
En plus des tissus ou cellules où elles ont été originalement découvertes, les phosphatases se retrouvent dans d’autres tissus comme le cerveau, les poumons, les reins et le foie [98,99]. Toutes les phosphatases acides ainsi que la phosphatase alcaline TNAP sont exprimées dans le foie. Cependant, les rôles de ces enzymes dans la physiologie du foie demeurent inconnus. Il faut toutefois noter qu’en vertu de leurs propriétés biochimiques, les phosphatases acides et alcalines jouent implicitement le rôle de senseurs du pH extracellulaire. En effet, l’activité enzymatique de ces protéines est très réduite à un pH = 7, donc au voisinage du pH physiologique pour la plupart des tissus. Par conséquent, toute variation soudaine de leur activité enzymatique pourrait permettre de déduire que des changements physiologiques importants se produisent dans le milieu extracellulaire.
4.1.4 L’ecto-5′-nucléotidase/CD73
La famille des 5′-nucléotidases [EC 3.1.3.5] regroupe sept protéines, dont cinq isoenzymes cytosoliques [cNIa (produit du gène NT5C1A selon la nomenclature HUGO approuvée), cNIb (NT5C1B), cNII (NT5C2), cNIII (NT5C3), et cdN (NT5C)], une isoenzyme mitochondriale, soit mdN (NT5 M) et une isoenzyme membranaire, l’ecto-5′-nucléotidase (NT5E). Ces enzymes hydrolysent spécifiquement les nucléosides monophosphates comme l’AMP en nucléosides et Pi (Tableau 2) [101]. L’ecto-5′-nucléotidase est aussi connue sous le nom de lymphocyte vascular adhesion protein 2 (LVAP-2), un marqueur de la maturation des lymphocytes B et T [102]. C’est une glycoprotéine homodimérique de surface qui est liée à la membrane plasmique par un ancrage GPI et qui peut donc être sécrétée après clivage par des phospholipases endogènes (Fig. 1) [103]. L’activité biochimique de cette ectoenzyme est optimale à pH neutre et dépend de la présence de métaux de transition divalents comme le Mg2+, le Ca2+, le Zn2+, le Mn2+ et le Co2+ [74]. Contrairement aux 5′-nucléotidases cytosoliques, l’ecto-5′-nucléotidase possède une large spécificité de substrat pour les différents nucléosides 5′-monophosphates [101]. Une caractéristique physiologique importante de cette enzyme est que son activité est inhibée par l’ATP et l’ADP relâchées par les cellules, ce qui inhibe donc la production d’adénosine extracellulaire et par le fait même, l’activation subséquente des récepteurs P1. L’étude de l’ecto-5′-nucléotidase est facilitée par la disponibilité d’inhibiteurs spécifiques, dont l’α,β-méthylène-ADP (α,β-MeADP) et la concanavaline A [101,104]. L’ecto-5′-nucléotidase est exprimée dans la plupart des tissus, y compris le foie [105]. Comme la contribution des autres types d’enzymes capables de générer de l’adénosine, telles les phosphatases et les NPPs, est plutôt minimale au pH physiologique, l’ecto-5′-nucléotidase peut être alors considérée comme la source majeure de l’adénosine extracellulaire, un puissant médiateur anti-inflammatoire [105]. La fonction la mieux caractérisée de l’ecto-5′-nucléotidase est son rôle protecteur lors de l’ischémie-reperfusion observée suite à une embolie, à une baisse de pression artérielle ou à une transplantation [105]. Il a été démontré en effet que les effets bénéfiques du préconditionnement ischémique, qui réduit considérablement les dommages tissulaires au foie associés à l’ischémie-reperfusion, sont reliés à l’induction de l’expression hépatique de l’ecto-5′-nucléotidase [106]. Lorsque soumises à un protocole de préconditionnement ischémique avant une période d’ischémie-reperfusion, les souris cd73−/− (chez qui le gène de l’ecto-5′-nucléotidase a été invalidé) ont un niveau inférieur d’adénosine extracellulaire et démontrent une augmentation des enzymes hépatiques circulantes (e.g. myéloperoxidase, alanine aminotransférase et aspartate aminotransférase) par rapport aux souris de type sauvage. De plus, un phénotype normal (i.e. de type sauvage) et la protection conférée par le préconditionnement ischémique peuvent être rétablis chez les souris cd73−/− par injection intrahépatique d’ecto-5′-nucléotidase soluble [106].
4.1.5 L’ecto-adénosine désaminase (ecto-ADA)
L’ecto-ADA [EC 3.5.4.4] catalyse la réaction de désamination de l’adénosine en inosine et de la 2-désoxyadénosine en 2-désoxyinosine dans le milieu extracellulaire [107]. Il existe trois isoenzymes d’adénosine désaminase (produits du gène ADA selon la nomenclature HUGO approuvée) : une forme cytosolique avec deux polymorphismes génétiques ADA1 (le plus abondant) et ADA2, et une forme présente à la membrane plasmique, l’ecto-ADA. Curieusement, l’analyse des séquences protéiques des isoformes de l’ADA ne révèle aucun domaine transmembranaire ni de signal de localisation membranaire [107]. La topologie membranaire exacte de l’ecto-ADA reste inconnue, bien que plusieurs études suggèrent que l’ecto-ADA membranaire correspond en fait à un dimère de l’isoenzyme ADA1 en complexe avec des protéines membranaires comme la glycoprotéine CD26/DPPIV, les récepteurs de l’adénosine A1 et A2b, ou encore avec d’autres protéines non identifiées [107,108]. L’activité de l’ecto-ADA est inhibée par les analogues de purines tels la 2′-désoxycoformicine et l’érythro-9-(2-hydroxy-3-nonyl)adénine [107,109]. La vélocité d’hydrolyse de l’adénosine par l’ecto-ADA est optimale sur une large gamme de pH (∼6–9) et peut être modifiée par la présence de métaux de transition divalents, selon l’espèce considérée [110]. Dans le foie, l’ecto-ADA est exprimée au niveau des canalicules biliaires [111,112]. Jusqu’à présent, aucune fonction hépatique n’a été clairement démontrée pour cette enzyme.
4.2 Régénération des nucléotides extracellulaires
4.2.1 L’ecto-adénylate kinase (ecto-AK)
L’ecto-AK [EC 2.7.4.3] catalyse de manière réversible le transfert d’un groupement phosphate d’un nucléoside triphosphate à un nucléoside monophosphate pour ainsi produire deux nucléoside diphosphates [68,113]. La famille de l’adénylate kinase comprend huit formes exprimées dans divers compartiments cellulaires : une isoenzyme cytosolique, l’AK1α (produit du gène AK1 selon la nomenclature HUGO) ; quatre formes mitochondriales, AK2 à −5 (idem avec la nomenclature HUGO) ; une isoenzyme nucléaire, AK6 (TAF9) ; une forme de localisation non déterminée, AK7 (id.) ; et enfin, une isoenzyme membranaire, l’ecto-AK ou AK1β [113]. L’ecto-AK est une isoforme de l’enzyme AK1 cytosolique, possédant une séquence conservée de myristoylation N-terminale servant de signal de localisation membranaire. Par le biais de son activité biochimique, l’ecto-AK module le niveau de ligand apte à déclencher la signalisation dépendante de l’ATP via les récepteurs P2X et P2Y [68]. L’activité phosphotransférase de l’ecto-AK est spécifique aux nucléotides puriniques et requiert la présence d’ions Mg2+. L’activité de cette ectoenzyme est inhibée sélectivement par la diadénosine pentaphosphate [114].
Dans le foie, l’ecto-AK est exprimée par les hépatocytes [31,68], chez lesquels un rôle pour cette enzyme a été mis en évidence dans la régulation du transport du cholestérol [31]. En vertu de son activité biochimique et de l’équilibre des espèces nucléotidiques en présence, l’ecto-AK a la capacité de diminuer la concentration d’ADP extracellulaire, inhibant ainsi l’activation du récepteur P2Y13 qui est essentielle au transport du cholestérol-HDL. Toutefois, une étude plus approfondie de l’ecto-AK sera requise pour établir plus solidement sa contribution à la physiologie hépatique.
4.2.2 Les ecto-nucléosides diphosphokinases (ecto-NDP kinases)
Les NDP kinases [EC 2.7.4.6] font partie d’une famille de protéines regroupant dix membres (NM23-H1 à −H10 ; dans la nomenclature HUGO approuvée, NME1 à −10) qui sont les produits des gènes suppresseurs de tumeurs NM23 (« non-metastatic 23 »)-H1 à −H10 [115]. Les protéines NM23-H1 à −H4 (aussi appelées NDPKA à −D) et NM23-H6 sont les seuls membres de la famille possédant une activité de type nucléoside transphosphorylase, i.e. la catalyse du transfert d’un groupement phosphate d’une molécule d’ATP à un nucléoside diphosphate pour former de l’ADP et un nucléoside triphosphate [115]. Les protéines NM23 se présentent sous la forme d’homo- ou d’hétéro-hexamères fonctionnels et se retrouvent dans plusieurs compartiments intracellulaires, dont le noyau (isoformes H1 et H2), le cytoplasme (isoformes H1, H2, H3 et H6), les mitochondries (isoformes H3, H4 et H6), le cytosquelette (isoformes H5 et H9) et la membrane plasmique (isoformes H1 et H2) [68,115,116]. La localisation exacte des isoformes H7 et H8 demeure à ce jour inconnue. Une étude récente a démontré que les protéines NM23-H1/NDPKA et NM23-H2/NDPKB sont exprimées dans la membrane apicale des cellules de l’épithélium respiratoire humain [117]. Ces données suggèrent que les isoenzymes membranaires NDPKA et NDPKB pourraient être responsables de l’activité de type NDP kinase détectée à la surface de plusieurs types d’épithélia, dont l’épithélium respiratoire. L’activité ecto-NDP kinase utilise comme accepteurs les nucléosides diphosphates autant puriniques que pyrimidiniques, requiert la présence de métaux de transition divalents comme le Mg2+, et est optimale à un pH neutre [68,115].
Plusieurs types cellulaires, incluant les hépatocytes, expriment à leur surface l’ecto-NDP kinase [31,68]. En vertu de son activité, l’ecto-NDP kinase contribue au maintien des niveaux relatifs de nucléotides adényliques et uridyliques extracellulaires capables d’activer différentes voies de signalisation. Néanmoins, l’importance physiologique de l’ecto-NDP kinase dans le foie reste à démontrer.
5 Processus de recapture
Comme nous l’avons vu, une fois dans le milieu extracellulaire, les nucléo(s/t)ides exercent de nombreuses fonctions biologiques via l’activation de récepteurs spécifiques présents dans la membrane plasmique des cellules, et subissent aussi plusieurs étapes de biotransformation sous l’action d’une panoplie d’ectoenzymes. Afin de maintenir la signalisation par les nucléotides et nucléosides extracellulaires, les cellules recyclent continuellement les nucléosides et nucléobases correspondantes. Il faut noter que les nucléotides, qui sont fortement chargés, ne peuvent traverser directement la membrane plasmique et réintégrer la cellule. La réabsorption des nucléosides et nucléobases relâchés par les tissus se fait via l’action spécifique de deux classes de protéines membranaires ubiquitaires : les transporteurs de nucléosides équilibrateurs (equilibrative nucleoside transporter [ENT]) et les transporteurs de nucléosides concentrateurs (concentrative nucleoside transporter [CNT]) [118–120].
5.1 Les transporteurs équilibrateurs (ENT) et concentrateurs (CNT)
La première classe de transporteurs est composée de quatre membres (ENT1 à 4 ; produits respectifs des gènes SLC29A1 à −4 selon la nomenclature HUGO) qui forment un système de diffusion facilitée spécifique aux nucléosides, c’est-à-dire qu’ils catalysent le mouvement passif de ces molécules de part et d’autre de la membrane plasmique selon leur gradient de concentration [62]. Alors que les transporteurs ENT1 à −3 se distinguent par leur perméabilité non-sélective pour les nucléobases et les divers nucléosides puriniques et pyrimidiniques, le transporteur ENT4 est spécifique à l’adénosine. Les ENT sont caractérisés pharmacologiquement par leur sensibilité variable à la nitrobenzylthioinosine et au dipyridamole [2,62]. La deuxième classe de transporteurs comporte trois membres (CNT1 à 3 ; produits respectifs des gènes SLC28A1 à −3 selon la nomenclature HUGO approuvée) qui constituent un système de symport unidirectionnel dépendant des cations [121]. Ces transporteurs transfèrent les nucléosides du milieu extérieur vers le cytoplasme par un mécanisme de transport actif secondaire, i.e. en utilisant l’énergie potentielle contenue dans un gradient cationique (Na+, Li+ et/ou H+, bien qu’en conditions physiologiques, seul le gradient de Na+ soit utilisé) dirigé vers l’intérieur de la cellule afin de transporter des nucléosides même à l’inverse de leur gradient de concentration. Les transporteurs CNT se caractérisent par des différences dans leur perméabilité sélective aux nucléosides. Alors que le transporteur CNT1 est spécifique à l’adénosine et aux nucléosides pyrimidiniques, le transporteur CNT2 transporte préférentiellement l’uridine et les nucléosides puriniques. Le transporteur CNT3 est non-spécifique, puisqu’il est perméable aux nucléosides tant puriniques que pyrimidiniques. Les transporteurs CNT se caractérisent pharmacologiquement par leur capacité de transporter les analogues de nucléosides synthétiques utilisés dans les traitements antiviraux et antitumoraux tels la zidovudine et la formycine B [2,121].
Tous les transporteurs de nucléosides ENT et CNT sont exprimés dans le foie. Les hépatocytes expriment spécifiquement les transporteurs ENT1, ENT2 et CNT1 sur la face sinusoïdale de la membrane plasmique, tandis que le transporteur CNT2 est concentré à la face apicale canaliculaire [120]. L’expression hépatique d’un éventail complexe de transporteurs de nucléosides va de pair avec l’importance du métabolisme extra- et intracellulaire des nucléo(s/t)ides dans le maintien de l’homéostasie cellulaire générale. En effet, les hépatocytes sont responsables de la biosynthèse de novo des purines et des pyrimidines, et représentent la source principale de nucléosides pour les tissus qui sont dépourvus de l’arsenal enzymatique nécessaire pour synthétiser ces nucléobases, comme c’est le cas pour les cellules du cerveau, de la moelle osseuse, de la muqueuse intestinale et des érythrocytes [2,122–124].
6 Conclusion
Il est maintenant établi que les nucléo(s/t)ides extracellulaires sont essentiels au maintien de l’homéostasie cellulaire dans le foie. Par l’activation des récepteurs P1 et P2 qui sont ubiquitaires, ces médiateurs physiologiques modulent plusieurs fonctions hépatiques comme le métabolisme du glucose et celui du cholestérol, l’hémostase, le transport des ions, la prolifération cellulaire, l’immunité et l’inflammation. La majorité des cellules hépatiques expriment plusieurs ectoenzymes et transporteurs membranaires qui régulent ensemble le métabolisme des nucléo(s/t)ides extracellulaires et, par conséquent, les voies de signalisation que ces derniers agents induisent. Avec le développement de nouveaux outils moléculaires [125] et pharmacologiques [126] spécifiques, une étude plus approfondie des voies de signalisation ainsi que des mécanismes cellulaires dépendants des nucléo(s/t)ides extracellulaires permettra certainement une compréhension meilleure et plus globale de la (patho)physiologie hépatique.
Conflit d’intérêt
Les auteurs ne déclarent aucun conflit d’intérêt.
Remerciements
M.F. était détenteur d’une bourse doctorale du Gouvernement du Gabon, et J.S., d’une bourse de Nouveau Chercheur des Instituts de Recherche en Santé du Canada (IRSC) et plus récemment d’une bourse du Fonds de la Recherche en Santé du Québec (FRSQ). Les auteurs remercient également le Dr Richard Poulin (Service de révision et de rédaction scientifique, Centre de Recherche du CHUQ) pour sa contribution à la révision et l’édition du présent manuscrit.


