Abridged English version
P. macropus (Claparède 1870), is an Annelida polychaeta with a large geographic distribution in the Mediterranean Sea. This species is present in the Gulf of Gabes, but its biology is poorly documented. In the aim to obtain information about its reproduction, 30 specimens were monthly collected in the wadi Ferd from August 2004 to July 2005. In the laboratory, each specimen was kept in a small bottle with a little seawater. The sex was determined after examination of coelomic punctures. For females, 30 oocytes were measured using a calibrated eye piece reticle. Males were recognized by the presence of sperm plates in the coelomic fluid and mature ones by the presence of sperm aggregates. The specimens without sexual products were considered to be young and sexually undifferentiated. The female coelomic puncture has a heterogeneous aspect, and shows different oocyte diameters. For this reason, a biometric study of oocytes growth was essential to determine the reproduction period as well as the spawning season. The oocyte average diameter fluctuates between in September and in April. Otherwise, the application of statistic tests of variance analysis shows that the sexual cycle is divided into three stages. The period from June to November refers to the first one, where the oocyte average diameter is low ( to ). The second stage gathers the months from December to March ( to ), when the females are in vitellogenesis. The last one refers to April, with an average diameter of , when the females are mature and preparing to evacuate the gametes. These results allow us to describe the female cycle, which is divided into three stages. Otherwise, we suggest that P. macropus has an asynchronous oogenesis, and present a reproductive period stretching from March to June. However, spawning occurs in May when the seawater temperature starts rising.
1 Introduction
Les Polychètes sont des Annélides gonochoriques qui ne présentent pas d'organes génitaux bien différenciés. Cependant, ils possèdent des masses de cellules gamétiques, qui apparaissent comme des renflements du péritonium dans certains segments du corps [1].
Certains auteurs considèrent ces structures, chez les femelles de la majorité des Polychètes, comme des ovaires [2,3]. À maturité, les produits génitaux sont libérés, tombent dans le cœlome, puis sont évacués par les néphridies [4]. Dans le cas de l'épitoquie, les gamètes sont évacués par simple rupture du tégument [5]. L'ovogenèse peut être conventionnellement divisée en deux phases : une phase de prolifération, durant laquelle les ovogonies se divisent mitotiquement, donnant naissance à des ovocytes, et une phase de développement, durant laquelle les ovocytes accumulent le vitellus.
Par ailleurs, on peut rencontrer deux types fondamentaux d'ovogenèse : ovogenèse extraovarienne et ovogenèse intraovarienne. Dans le premier cas, les cellules germinales quittent l'ovaire précocement, au cours de la prévitellogenèse, et subissent l'ovogenèse dans le cœlome. Dans le cas de l'ovogenèse intraovarienne, les ovocytes restent dans l'ovaire, où se déroule la plus grande partie de la vitellogenèse. Ces derniers, une fois évacués dans le liquide cœlomique, vont subir un accroissement et la différenciation [6]. Enfin, l'ovogenèse peut être synchrone, comme le cas de la plupart des Polychètes, telles que Nereis diversicolor et Perinereis cultrifera. Dans ce cas, chez le même individu, les ovocytes se trouvent au même stade de vitellogenèse. En revanche, chez d'autres espèces, telles que Hesiocaea methanicola [7], l'ovogenèse présente une évolution asynchrone, où on rencontre chez le même individu des ovocytes de tailles différentes et appartenant à des stades différents de vitellogenèse. Afin d'obtenir des informations supplémentaires quant à la biologie de reproduction des Nereidae, nous envisageons, dans ce travail, d'étudier l'ovogenèse de Perinereis macropus dans le golfe de Gabès. C'est une espèce abondante durant toute l'année, qui présente une prédisposition à l'élevage au laboratoire. En outre, cette espèce n'a fait l'objet d'aucune étude biologique.
2 Matériels et méthodes
2.1 Protocole expérimental
Les spécimens de P. macropus ont été récoltés sur les bordures de l'oued El Ferd du golfe du Gabès (Fig. 1). Les prélèvements ont été effectués à marée basse. Le sexe, le stade de développement de chaque individu ainsi que l'étape de la gamétogenèse ont été déterminés par l'examen microscopique de la ponction du liquide cœlomique. Pour les femelles, le diamètre d'une trentaine d'ovocytes est mesuré à l'aide d'un microscope photonique muni d'un micromètre étalonné.
Situation géographique des stations prospectées.
2.2 Analyses statistiques
Les résultats relatifs au diamètre ovocytaire moyen ont été comparés par l'utilisation du test statistique ANOVA [8] appliqué pour l'analyse des variances.
3 Résultats
3.1 Étude biométrique de la croissance ovocytaire
L'examen d'une ponction cœlomique d'un individu femelle montre un aspect hétérogène : on observe des cellules sphériques sombres de diamètres différents, les ovocytes (Fig. 2).

Structure d'une ponction cœlomique chez un individu femelle au cours du mois de février. Ovm : ovocyte en cours de maturation ; Ovi : ovocyte immature. Échelle : barre = 100 μm.
Afin de déterminer la période de reproduction ainsi que la saison de ponte, il est indispensable d'évaluer le diamètre ovocytaire moyen. L'étude des histogrammes de fréquence du diamètre ovocytaire (Fig. 3), établis en portant en abscisses les diamètres répartis en 18 classes de 20 μm d'intervalle et en ordonnées les fréquences correspondantes, montre que la distribution des histogrammes ainsi que son étalement ne sont pas unimodaux. Ceci est dû à la présence de femelles de différentes tailles dans toutes les récoltes, surtout en mars, avril et mai, où apparaissent les diamètres les plus élevés. L'analyse statistique des résultats (Tableau 1) a mis en évidence une différence significative (ANOVA ; ; ). Cette analyse permet de diviser le cycle de reproduction en trois groupes (A, B, C) (Tableau 1). Ce test montre que les différences sont statistiquement significatives entre les trois groupes A, B et C. En revanche, les différences entre les diamètres moyens des ovocytes dans le même groupe sont statistiquement non significatives.
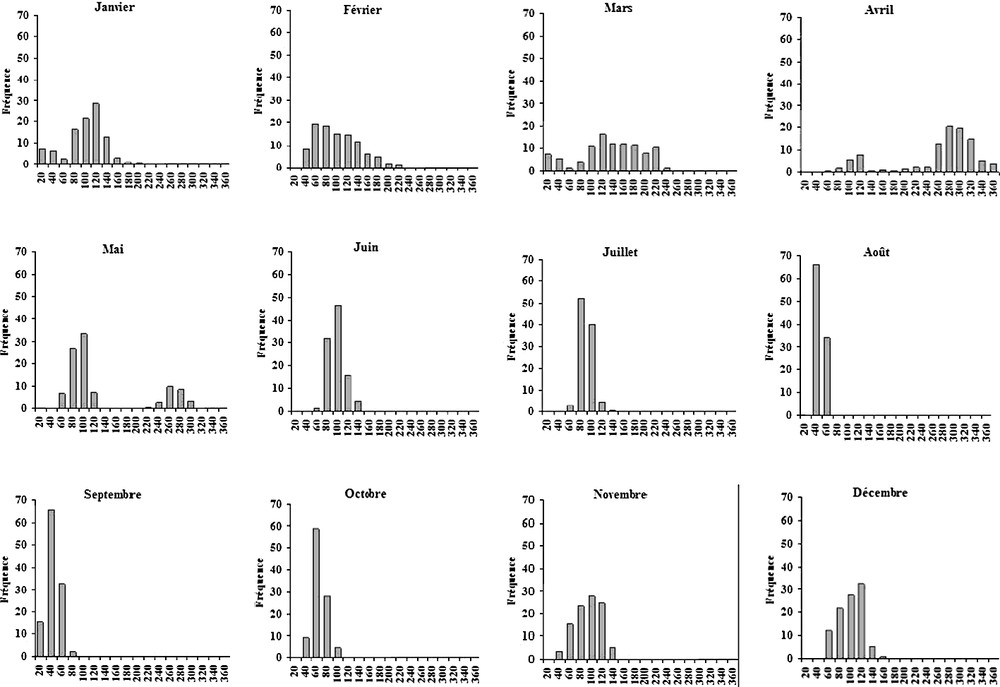
Histogrammes des fréquences des diamètres ovocytaires.
Résultats du test ANOVA appliqué pour l'analyse des variances des diamètres ovocytaires moyens mensuels (F=25,49 ; P=0,0001)
| Groupe | Diamètre moyen | Intervalle de confiance | Mois |
| A | 250 | 32,67 | avril |
| B | 121,7 | 57,05 | mai |
| B | 122,7 | 25,19 | mars |
| B | 88,57 | 18,14 | février |
| B | 86,02 | 16,60 | janvier |
| B | 85,32 | 11,66 | décembre |
| C | 74,98 | 7,18 | novembre |
| C | 63,35 | 10,01 | juin |
| C | 55,85 | 3,83 | juillet |
| C | 34,43 | 5,45 | août |
| C | 29,74 | 4,65 | septembre |
| C | 52,37 | 3,59 | octobre |
Le suivi de la croissance ovocytaire montre une évolution remarquable suivant le mois et la saison et nous a permis de préciser le cycle sexuel femelle durant une période d'un an d'août 2004 à juillet 2005 (Fig. 4). Pendant les mois de septembre à février, les ovocytes ont un diamètre restreint, compris entre 10 et 100 μm. Ils sont donc en phase de prévitellogenèse. À partir du mois de février, le diamètre moyen commence à augmenter pour atteindre 140 μm au mois de mars. Ceci indique que les femelles sont au stade de la vitellogenèse. Le diamètre moyen subit une croissance très rapide entre mars et avril, pour atteindre un diamètre dépassant les 200 μm. Cette augmentation brutale du diamètre moyen observée en avril (250 μm) est significative et peut être interprétée par le fait que ces derniers sont sur le point d'achever leur vitellogenèse pour devenir matures. Elles pourraient évacuer leurs gamètes pendant le mois suivant. Le pic observé en avril est suivi d'une chute rapide au cours du mois suivant. Cette réduction du diamètre est statistiquement significative. Ce résultat permet de supposer une première ponte au mois de mai. Toutefois, l'examen de la ponction ovocytaire en mai révèle encore des ovocytes matures, mais avec une faible fréquence. D'après ces observations, on suppose une deuxième ponte en juin. La différence du diamètre entre mai et juin est statistiquement significative. On pourrait suggérer qu'il existe une seule ponte continue, étalée entre avril et juin. En juillet et août, le diamètre ovocytaire moyen est respectivement de et . Cette différence, non significative, peut s'expliquer par l'apparition de nouvelles cellules en première phase de l'ovogenèse.

Cycle sexuel femelle proposé pour Perinereis macropus au cours de l'année d'étude août 2004–juillet 2005.
3.2 Déroulement de l'ovogenèse
En nous basant sur les données bibliographiques [5,9–13], ainsi que sur les résultats de l'analyse statistique, nous avons classé, en fonction de la taille et de l'aspect morphologique, les différentes catégories d'ovocytes en trois groupes.
3.2.1 La prévitellogenèse
Elle correspond à la formation des réserves lipidiques et des globules vitellins [9]. À ce stade, l'ovocyte a une petite taille. Chez P. macropus, le diamètre est compris entre 10 et 100 μm. Le cytoplasme est homogène, avec un noyau central. Ces ovocytes sont observés dans les ponctions cœlomiques, quelle que soit la saison. Dans le liquide cœlomique, on note la présence des éléocytes (Fig. 5). Ce sont des cellules somatiques qui jouent un rôle drastique dans le transfert des nutriments et des molécules du soma vers les gamètes [14]. En plus, ils synthétisent la vitellogénine, qui sera accumulée dans les ovocytes sous forme de vitellus [15].

Ponction cœlomique montrant des ovocytes en prévitellogenèse. el : éléocytes ; ov.p : ovocyte en prévitellogenèse ; ov.v : ovocyte en vitellogenèse ; L.c : liquide cœlomique. Échelle : barre = 60 μm.
3.2.2 Le grand accroissement ou vitellogenèse
Les cellules en vitellogenèse se distinguent de celles en prévitellogenèse par une taille nettement plus importante. Chez notre espèce, nous l'avons estimé entre 100 et 180 μm. Cette catégorie d'ovocytes commence à apparaître à partir du mois de décembre. Par ailleurs, le cytoplasme devient hétérogène. Cette hétérogénéité pourrait mettre en évidence la biosynthèse et l'accumulation du vitellus (Fig. 6).
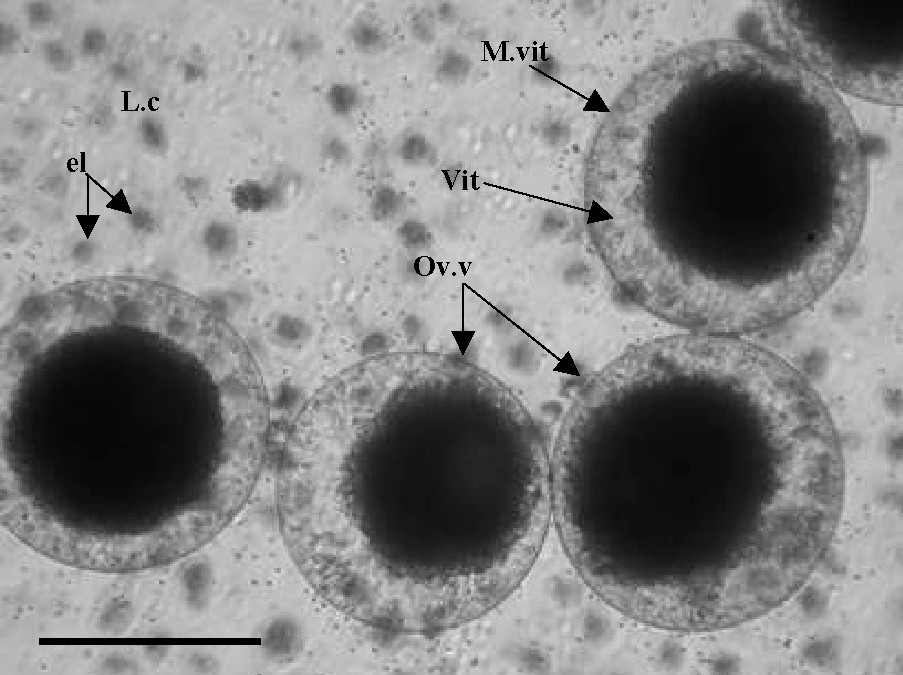
Ponction cœlomique montrant des ovocytes en vitellogenèse. L.c : liquide cœlomique ; el : éléocytes vit : vitellus ; M.vit : membrane vitelline ov.v : ovocyte en vitellogenèse. Échelle : barre = 150 μm.
3.2.3 La maturité
Durant ce stade, les gamètes atteignent leur diamètre maximal. Chez P. macropus, le diamètre des ovocytes submatures et matures oscille entre 200 et 350 μm (diamètre moyen = 250 μm). Ils sont observés aux mois d'avril et de mai. La cellule présente dans son cytoplasme des inclusions régulièrement disséminées (Fig. 7). Les constituants de l'ovocyte se séparent, marquant un nouvel agencement des inclusions cytoplasmiques. Les gouttelettes lipidiques se concentrent près du noyau. Cette structure est observée aussi chez Nereis virens [15].
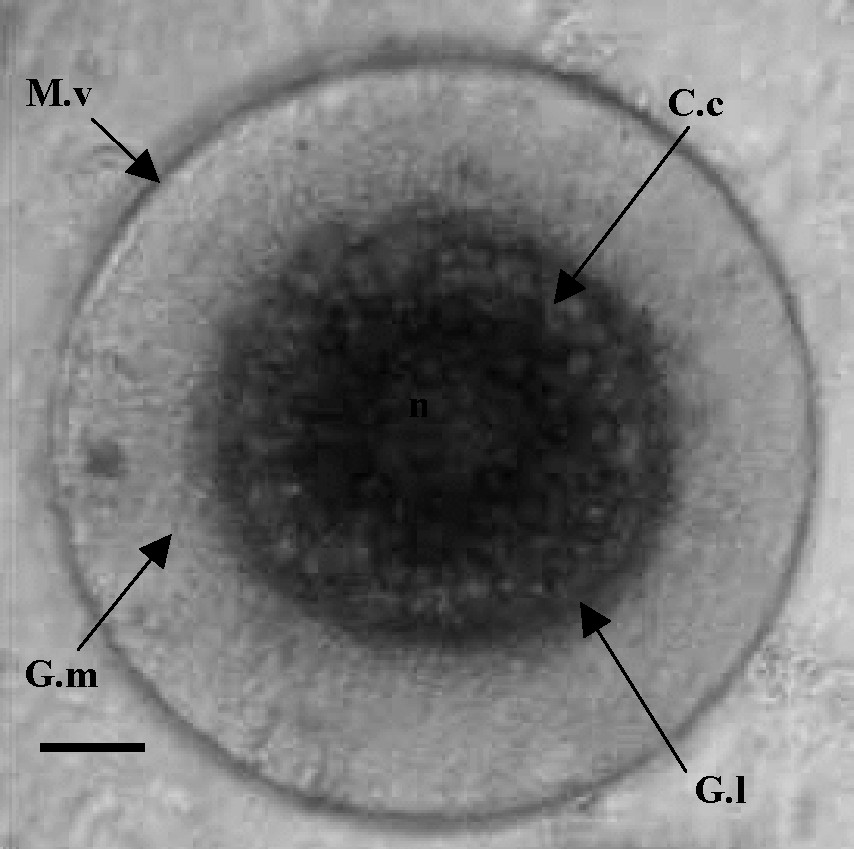
Aspect morphologique d'un ovocyte mature chez Perinereis macropus. M.v : membrane vitelline ; Gm : gangue mucopolysaccharidique ; n : noyau ; CC : cytoplasme clair ; GL : zone des gouttelettes lipidiques. Échelle : barre = 35 μm.
4 Discussion
L'étude biométrique de l'ovogenèse de la population de P. macropus permet de dégager des données précieuses sur le cycle biologique de cette espèce. En effet, si les produits génitaux libres dans le cœlome sont présents pendant toute l'année, des fluctuations de diamètre et de nombre sont observées en hiver et au printemps. Ceci suggère que la période de reproduction est concentrée pendant ces deux saisons de l'année. D'autre part, cette étude montre que la croissance ovocytaire est asynchrone, puisque nous avons rencontré chez le même individu des ovocytes présentant des diamètres différents. Par ailleurs, chez les espèces voisines de Néréidés tels que Perinereis cultrifera [16] et Platynereis dumerilii [17] la croissance ovocytaire est synchrone.
Cette étude nous a permis également de confirmer que l'ovogenèse se déroule de la même façon que chez la plupart de Polychètes [5,9–13,18]. Cette dernière est divisée en trois stades : la prévitellogenèse, la vitellogenèse – ou croissance rapide – et la maturité. Au cours du premier stade, les ovocytes de P. macropus présentent un diamètre ovocytaire compris entre 10 et 100 μm. Cependant, chez Nereis succinea [13], le diamètre peut atteindre 120 μm. Pendant le grand accroissement, le diamètre ovocytaire s'accroît et atteint 180 μm.
Ce résultat est observé aussi chez P. cultrifera [16]. À maturité, les ovocytes atteignent leur diamètre maximal, qui oscille chez notre espèce entre 200 et 350 μm avec une moyenne de 250 μm ; parmi ces derniers, certains peuvent atteindre 360 μm. Chez P. cultrifera [16], il a été démontré que le diamètre des ovocytes matures oscille entre 220 et 300 μm, avec une moyenne de 250 μm. Cependant, chez Platynereis dumerilii [17], lorsque les ovocytes achèvent leur croissance, ils présentent un diamètre de 165 μm.
Finalement, cette étude nous a permis de conclure que la période de reproduction de P. macropus est étalée pendant les mois de janvier à juin. La maturité commence au mois de mars et s'achève en avril. Durant ce dernier mois, on note la présence du plus grand diamètre moyen des ovocytes, qui est estimé à 250 μm. La ponte se déroulerait à la fin d'avril et s'étalerait sur le mois de mai.
Nous envisageons donc, chez P. macropus, de comparer le cycle de reproduction ainsi que le déroulement de l'ovogenèse de la population étudiée à l'oued Ferd dans le golfe de Gabès et les autres populations Tunisiennes.
Remerciements
Nous remercions très sincèrement M. Salaheddine Selmi, maître de conférences à la faculté des sciences de Gabès, qui a mis à notre disposition son laboratoire, où nous avons effectué la plus grande partie de ce travail.


