Abridged English version
Phytoplankton form the base of the marine food chain. Therefore, any variation of this compartment entails modifications in all levels of the trophic network.
The Moroccan Atlantic coast features one of the four major coastal upwelling systems in the world. The fluctuations of the upwelling activity in time and in space affect the spatial distribution and temporal development of the phytoplankton biomass.
This work describes the spatiotemporal distribution of phytoplankton during winter and summer in four transects, retained for their resurgence activity. Two cruises were held during January and July 2002, onboard of the Moroccan research vessel “Al Amir Moulay Abdellah”. The phytoplankton sampling was carried out at 15 stations, distributed among four transects (perpendicular to the coast): 32°30′N, 29°N, 24°30′N and 24°N. Water samples were collected at four depths (surface, 10 m, 30 m and 50 m), using Niskin bottles connected to a conductivity-temperature-depth (CTD).
A total of 142 phytoplankton species were identified during this study. These species are distributed in six groups: Diatoms, Dinoflagellats, Coccolithophorids, Euglenophyts, Silicoflagellats and Raphidophyts. Diatoms and Dinoflagellates are the most represented groups with respectively 76 and 56 taxa. Diatom dominance of phytoplankton communities in coastal upwelling areas especially in the southern Moroccan Atlantic ecosystem has been described in references [2,4].
The maximal specific richness, both in summer and in winter, was registered around Dakhla. The global spatiotemporal variability of species richness and specific diversity showed that the most structured and species-rich populations are situated in the coastal areas. The exception is made in summer at 24°N, where the population, at all levels of depth, was more structured than in the open-sea area. In the coastal stations of this transect, a low diversity was recorded because of a strong proliferation of Melosira and Chaetoceros species. The spatial variation of the two parameters (species richness and specific diversity) showed significant differences between stations. Indeed, the high values are observed at the south stations (24°30′N and 24°N) in both seasons. The vertical variation in each transect has, on the contrary, revealed homogeneity between bathymetric levels.
The analysis of phytoplanktonic densities showed high values during the warm season and particularly in the coastal areas, except at 24°N, where the highest density was observed during winter in the offshore stations. The strong coastal productivity registered in summer is explained by the intense activity of upwelling during the warm season [22,23]. This is confirmed by the homogeneous vertical distribution of phytoplanktonic densities, indicating an important vertical mixing of water column (high turbulence).
Generally, phytoplankton densities were greatest in the southern transects (24°30′N and 24°N), although the variation between stations was not significant. Indeed, the southern area (26°N–24°N) is characterized by more intense upwelling than in the north (32°30′N–28°N), contributing to higher primary production [23–25]. It should also be noted that the northern area (29°N–28°N) is supported by an intense remineralization process, which constitutes an important source of nutrients in summer.
Factorial analysis allowed us to reveal different associations of phytoplankton species according to their spatiotemporal affinities. Some of these associations testified to the presence of resurgence of cold water in the studied areas. Moreover, the results of the factorial analysis confirm the descriptive analysis of phytoplankton distribution. Therefore, the upwelling activity and the presence of filaments determine largely the qualitative and quantitative variability of phytoplankton in the studied areas. Moreover, this analysis revealed that the species Melosira, Thalassionema nitzschioides, Asterionellopis glacialis, Chaetoceros and Leptocylindrus minimus could be considered as good indicators of upwelling in the studied areas.
1 Introduction
Le phytoplancton occupe, dans l’écosystème marin, une position trophique primordiale et constitue, de ce fait, un élément capital de son fonctionnement. Toute variation de ce compartiment de base entraîne des variations de l’ensemble du réseau trophique. Les fluctuations importantes de la distribution, la composition et l’abondance des populations algales sont régies par des facteurs physiques, chimiques et biologiques caractérisant le milieu [1–3].
Le présent travail vient compléter l’étude réalisée sur le phytoplancton de la zone comprise entre Cap Blanc (21°N) et Cap Boujdor (26°30′N) [4] et contribuera à l’amélioration de nos connaissances sur les interactions environnement–ressource au sein de cet écosystème. Il s’agit pour nous de faire une comparaison entre quatre radiales, retenues pour leur activité de résurgence ayant un impact sur la variabilité spatio-temporelle des populations micro-algales.
2 Matériel et méthodes
L’échantillonnage a été réalisé lors de deux campagnes océanographiques pendant l’hiver (janvier du 18/01 au 29/01/2002) et l’été (juillet du 02/07 au 04/07/2002) à bord du navire Alamir Moulay Abdelah. Les échantillons d’eau destinés à l’analyse du phytoplancton sont réalisés à l’aide de bouteilles en rosette reliées à la Conductivity-Temperature-Depth (CTD). Ces dernières s’ouvrent à quatre niveaux de profondeur (surface, 10 m, 30 m et 50 m). Au total, 15 stations ont été échantillonnées. Elles sont réparties sur quatre radiales qui sont du nord au sud : 32°30′N (I), 29°N (II), 24°30′N (III) et 24°N (IV) (Fig. 1). Le choix de ces radiales est en relation avec l’hydrologie de la côte atlantique marocaine [5]. En effet les deux radiales nord correspondent à un upwelling saisonnier ; alors que celles du sud sont dans une zone d’upwelling permanent.
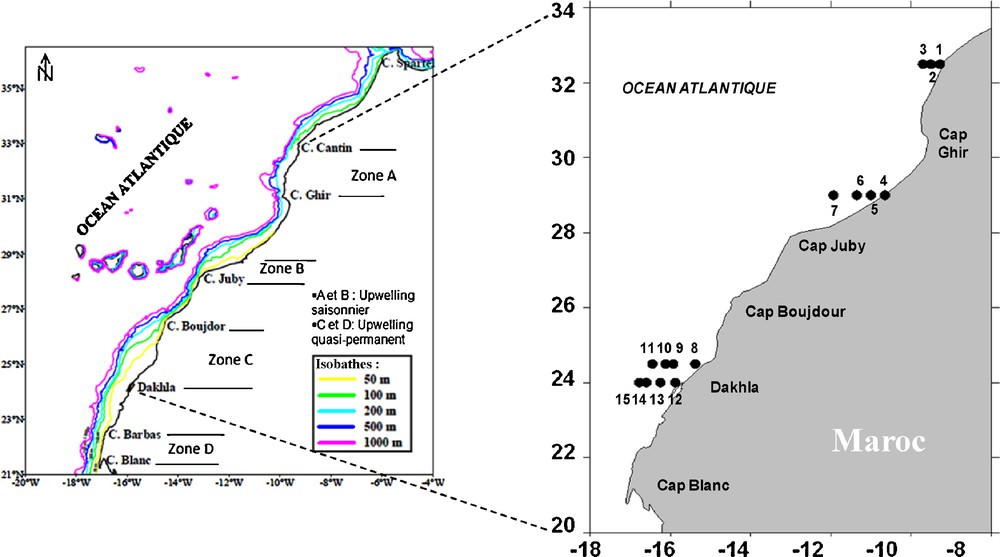
Localisation des stations de prélèvement.
Le dénombrement du phytoplancton est réalisé selon la méthode d’Utermöhl [6] et l’observation est effectuée dans des cuves à sédimentation de 10 mL sous microscope inversé, de type Leica DM IRB, après une sédimentation de 24 h. La détermination est faite à l’aide de clés d’identification systématique appropriées [7–12]. Les résultats des densités sont exprimés en nombre de cellules par litre (cell/L).
Pour avoir une vision globale de l’organisation spatio-temporelle des populations dans la région étudiée, les paramètres suivants ont été déterminés :
- • la richesse spécifique S qui représente le nombre d’espèces recensées par station ;
- • l’indice de Shannon H [13], exprimé en bit, qui permet d’apprécier le degré de maturité du peuplement. C’est ainsi qu’une diversité faible caractérise un peuplement jeune à haut pouvoir de multiplication, avec dominance nette d’une ou d’un petit nombre d’espèces alors qu’une diversité élevée caractérise des populations mûres ou séniles présentant une composition spécifique complexe [14]. Cet indice est calculé en utilisant la formule suivante :
L’étude de la diversité a été complétée par des diagrammes rang-fréquence (DRF) [15]. Ces diagrammes ont pour but de comparer et de visualiser la variabilité spatiale de la structure démographique des peuplements phytoplanctonique pendant l’hiver et l’été 2002.
Les paramètres de structure des peuplements (richesse spécifique, diversité spécifique et densité cellulaire) ont été comparés à l’aide d’une analyse de variance (Anova) à l’aide du logiciel Excel.
Afin d’avoir une image synthétique de l’ensemble des affinités entre les espèces, d’une part, et entre les stations, d’autre part, une analyse factorielle des correspondances AFC [16] a été entreprise à l’aide du logiciel ADE4 (CNRS, université Lyon I). Seuls les taxons présentant un pourcentage d’abondance supérieur à 1 % et une fréquence supérieure à 13 % ont été pris en considération. Les densités phytoplanctoniques sont transformées en log (n + 1) afin de minimiser les écarts entre les valeurs.
3 Résultats
3.1 Structure des peuplements du phytoplancton
Au total, 142 taxons ont été recensés pendant la période d’étude, dont 32 sont rencontrés exclusivement en été et 33 en hiver. Les Diatomées avec 86 taxa et les Dinoflagellés avec 54 taxa dominent largement le peuplement. Les autres groupes (les Coccolithophoridés, Silicoflagellés, Euglénophycées et Raphydophycées) se partagent le reste des espèces (Tableau 1). La composition spécifique des quatre radiales se trouve largement dominée par les formes ubiquistes, d’autres sont océaniques et néritiques. La richesse spécifique totale est plus importante au sud qu’au nord. En hiver et en été 2002, le nombre maximal d’espèces recensées est respectivement de 73 taxons (radiale III) et 71 taxons (radiale IV) (Tableau 2A). Statistiquement, aucune différence significative n’a été observée entre les quatre radiales ni entre les deux saisons (Tableau 2B).
Liste taxinomique des espèces.
| Liste des espèces | 32°30′N | 29°N | 24°30′N | 24°N |
| Diatomées | ||||
| Achnanthes brevipes C.A. Agardh, 1824a | + | |||
| Achnantes sp. | + | + | + | + |
| Amphora sp. | + | + | + | + |
| Asterionellopsis glacialis (Castracane) F.E. Round (in Round et al., 1990) | + | + | + | + |
| Asterolampra spp. Eherenberg, 1844a | + | |||
| Bellerochea sp. | + | + | + | + |
| Chaetoceros decipiense Cleve, 1873b | + | |||
| Chaetoceros densus Cleve, 1897b | + | |||
| Chaetoceros didymus Ehrenberg, 1845 | + | + | + | |
| Chaetoceros socialis Lauder, 1864b | + | + | ||
| Chaetoceros spp. Ehrenberg, 1844 | + | + | + | + |
| Climacodium frauenfeldianum Grunow, 1868a | + | + | ||
| Corethron criophilum Castracane (vide Boyer, 1927)b | + | |||
| Coscinodiscus spp. Ehrenberg, 1839 | + | + | + | + |
| Cylindrotheca clostrium (Ehrenberg) Reimann et Lewin, 1964 | + | + | + | + |
| Detonula spp. Schutt ex De Toni, 1894 | + | + | ||
| Diatomée sp1 | + | + | + | |
| Diploneis bombus Ehrenberg, 1844 | + | + | + | + |
| Diploneis spp. Ehrenberg, 1844 | + | + | + | |
| Dithylum brigthwelii (West) Grunow (vide van Heurck), 1880–1885b | + | |||
| Entomoneis spp. Ehrenberg, 1845a | + | + | ||
| Eucampia cornuta (Cleve) Grunow, 1883a | + | |||
| Eucampia zodiacus Eherenberg, 1841b | + | |||
| Gomphonema spp. Ehrenberg, 1832a | + | |||
| Grammatophora marina (Lyngbye) Kützing, 1844b | + | |||
| Guinardia delicatula Cleve, 1900 | + | + | + | + |
| Guinardia flaciida (Castracane) H. Peragallo, 1892 | + | + | + | + |
| Guinardia sp.a | + | + | ||
| Guinardia striata (Stolterfoth) Hasle com.nov, 1879 | + | + | + | + |
| Gyrosigma spp. Hassall, 1843b | + | |||
| Hantzschia amhioxys (Ehrenberg) Grunow, 1880b | + | + | ||
| Helicotheca tamesis (Shrubsole) Ricard, 1890 | + | + | + | + |
| Hemiaulus hauckii Grunow in Van Heurck, 1882a | + | |||
| Hemiaulus proteus Heiberg, 1863 | + | + | + | + |
| Hemiaulus sinensis Gréville, 1865b | + | |||
| Hemiaulus spp. Heiberg, 1863a | + | + | ||
| Hyalodiscus radiatus (O’Meara) Grunow, in Cleve et Grunow, 1880b | + | |||
| Lauderia annulata Cleve, 1873 | + | + | + | |
| Leptocylindrus danicus Cleve, 1889 | + | + | + | + |
| Leptocylindrus minimus Gran, 1915 | + | + | + | + |
| Licmophora ehrenbergii (Kutzing) Grunow, 1867 | + | + | ||
| Lyrella sp.a | + | |||
| Melosira spp. C.A.Agardh, 1824 | + | + | + | + |
| Navicula neoventricosa Hustedt, 1966b | + | |||
| Navicula spp. Bory, 1822 | + | + | + | + |
| Nitzschia panduriformis Gregory, 1857 | + | |||
| Nitzschia spp. Hassall, 1845 | + | + | + | + |
| Odontella spp. Greville, 1866 | + | + | + | |
| Opephora spp. Petit, 1888a | + | |||
| Paralia sulcata (Eherenberg) Cleve, 1838 | + | + | + | + |
| Plagiodiscus martensianus Grunow et Eulenstein Ricard, 1987b | + | |||
| Pleurosigma spp. Wm. Smith, 1852 | + | + | + | + |
| Podosira stelligera (J.W. Bailey) A. Mann, 1907a | + | + | + | |
| Proboscia alata (Brightwell) Sundstrom, 1986 | + | + | + | + |
| Pseudo Nitzschia delicatissima Cleve, 1897 | + | + | + | + |
| Pseudo Nitzschia heinii Manguin, 1957b | + | + | ||
| Pseudo Nitzschia pungens (Grunow ex Cleve) Hasle 1993b | + | |||
| Pseudo Nitzschia seriata (Cleve) H. Peragallo in H et M. Peragallo 1897–1908 | + | + | ||
| Rhizosolenia clevei var. communis Sundstrom, 1984a | + | |||
| Rhizosolenia curvata Zacharias, 1905 | + | + | + | |
| Rhizosolenia hebetata f. semispina Hensen, 1887 | + | |||
| Rhizosolenia imbricata Brightwell, 1858 | + | + | ||
| Rhizosolenia polydactyla Castracane f plydactyla, 1886a | + | |||
| Rhizosolenia setigera Brithwell, 1858b | + | |||
| Rhizosolenia simplex Karsten, 1905a | + | |||
| Rhizosolenia spp. Brightwell, 1858 | + | + | + | + |
| Rhizosolenia styliformis Brightwell, 1858a | + | + | ||
| Skeletonema costatum (Greville) P.T. Cleve, 1878 | + | + | + | + |
| Skeletonema spp. Greville, 1865a | + | + | + | + |
| Striatella spp. C.A. Agardh, 1832a | + | |||
| Terpsinoe musica Schmidt, 1890a | + | |||
| Thalassionema nitzschioides (Grunow) Mereschkowsky, 1902 | + | + | + | + |
| Thalassionema spp. Grunow ex Mereschkowsky, 1902 | + | + | + | + |
| Thalassiosira spp. (Cleve, 1873) emend. Hasle, 1973 | + | + | + | + |
| Thalassiothrix longissima Cleve et Grunow, 1880a | + | |||
| Trigonium spp. Cleve, 1868a | + | |||
| Dinoflagellés | ||||
| Alexandrium spp. Halim, 1960 | + | + | + | + |
| Amphidinium spp. Claéparéde et Lachmann 1859b | + | |||
| Ceratium candelabrum (Ehrenberg) Stein, 1883a | + | |||
| Ceratium caudata Saville-Kent 1881b | + | |||
| Ceratium furca (Eherenberg) Claparéde et Lachmann, 1859 | + | + | + | + |
| Ceratium fusus (Eherenberg) Dujardin, 1841 | + | + | + | |
| Ceratium horridum (Cleve) Gran, 1902a | + | |||
| Ceratium lineatum (Ehrenberg) Cleve, 1899 | + | + | + | |
| Ceratium macroceros (Eherenberg) Vanhoffen, 1897b | + | |||
| Ceratium pentagonum Gourret, 1883a | + | |||
| Ceratium spp. Schrank, 1793 | + | + | + | |
| Ceratium tripos (O.F. Muller) Nitzsch, 1817 | + | + | + | |
| Dinophysis acuminata Claparéde et Lachman, 1859 | + | + | + | + |
| Dinophysis acuta Eherenberg, 1839a | + | |||
| Dinophysis caudata Saville-Kent, 1881 | + | + | ||
| Dinophysis infundibulis Schiller, 1928b | + | |||
| Dinophysis rudgei (Murray et Whitting) Abé, 1967 | + | + | ||
| Dinophysis sp.b | + | |||
| Gonyaulax grindleyi Reinecke, 1967 | + | |||
| Gonyaulax spp. Diesing, 1866 | + | + | + | + |
| Gymnodinium catenatum Graham, 1943b | + | |||
| Gymnodinium spp. Stein, 1878 | + | + | + | + |
| Gyrodinium spp. Kofoid et Swezy, 1921 | + | + | + | + |
| Heterocapsa circularisquama Stein, 1883 | + | + | + | + |
| Karenia mikimotoi Miyake et Koninami ex oda, 1953 G. Hasen et Moestrup, 2000 | + | + | + | |
| Katodinium glaucum (Lebour) Loeblich III, 1965b | + | + | ||
| Noctiluca scintillans (Macartney) Kofoid et Swezy, 1921b | + | + | + | + |
| Ostreopsis spp. Schmidt, 1901 | + | + | + | + |
| Oxytoxum mediterraneum Schiller, 1937b | + | |||
| Oxytoxum spp. Stein, 1883 | + | + | + | + |
| Oxytoxum tesselatum Koltun, 1967a | + | |||
| Preperidinium meunieri (Pavillard) Elbrächter 1993 | + | + | ||
| Pronoctiluca spp. Fabr-Domergue, 1889 | + | + | + | |
| Prorocentrum cf micans Ehrenberg, 1833 | + | + | ||
| Prorocentrum cf sigmoides Bohm, 1933 | + | + | ||
| Prorocentrum compressum (Bailey) Abé ex Dodge, 1975a | + | |||
| Prorocentrum gracile Schutt, 1895b | + | |||
| Prorocentrum imarginatum Fukuyo, 1981b | + | |||
| Prorocentrum mexicanum Tafall, 1942a | + | |||
| Prorocentrum minimum (Pavillard) Schiller, 1933a | + | + | ||
| Prorocentrum rostratum Stein, 1883 | + | + | + | + |
| Prorocentrum triestinum Schiller, 1918b | + | |||
| Protoceratium spp. Bergh, 1881 | + | + | + | |
| Protoperidinium areolatum (Peters) Balech, 1974b | + | |||
| Protoperidinium bipes (Paulsen) Balech, 1974b | + | |||
| Protoperidinium compressum (Abé) Balech, 1974b | + | |||
| Protoperidinium conicum (Gran) Balech, 1974 | + | + | + | + |
| Protoperidinium diabolus (Cleve) Balech, 1974 | + | |||
| Protoperidinium minutum (Kofoid) Loeblich III, 1970 | + | |||
| Protoperidinium oceanicum (VanHoffen) Balech, 1973a | + | |||
| Protoperidinium pyriforme (Paulsen) Balech, 1974 | + | + | + | |
| Protoperidinium spp. Bergh, 1881 | + | + | + | + |
| Protoperidinium steinii (Jørgensen) Balech, 1974 | + | |||
| Pyrocystis lunula (Schutt) Schutt, 1896a | + | |||
| Pyrophacus spp. Stein, 1883 | + | + | + | |
| Scrippsiella spp. Balech ex Loeblich, 1965 | + | + | + | + |
| Coccolithophoridés | ||||
| Coccolithus spp. Schwarz, 1894 | + | + | + | + |
| Zygosphaera spp. Kamptner 1936, emend. Heidal, 1982a | + | |||
| Discosphera tubifer (Murray et Blackman) Ostenfeld, 1900 | + | + | + | + |
| Rhabdosphaera claviger Murray et Blackman, 1898 | + | |||
| Pleurochrysis spp. Pringsheim 1955, emend. Gayral et Fresnel, 1983a | + | |||
| Euglénophycées | ||||
| Euglena spp. Eherenberg, 1838 | + | + | + | + |
| Eutreptiella spp. Cunha, 1914 | + | + | + | + |
| Silicoflagellés | ||||
| Dictyocha fibula Ehrenberg, 1839 | + | + | + | + |
| Dictyauca octonaria Ekrenberg, 1854b | + | |||
| Raphydophycées | ||||
| Chatonella spp. Biecheler, 1936 | + | + | + | + |
a Espèces recensées uniquement en hiver.
b Espèces recensées uniquement en été.
(A) : nombre total d’espèces phytoplanctoniques au niveau de chaque radiale pendant l’hiver et l’été. (B) : résultat de l’analyse de variance (Anova) du nombre total d’espèces entre les radiales et entre les deux saisons.
| (A) | ||||
| Radiale I | Radiale II | Radiale III | Radiale IV | |
| Hiver | 60 | 63 | 73 | 66 |
| Été | 63 | 61 | 65 | 71 |
| (B) | ||||
| Variation inter-radiales | Variation saisonnière | |||
| F | p | F | p | |
| 2,575 | n.s. | 0,020 | n.s. |
En hiver 2002, au nord de la zone d’étude (radiales I et II), la richesse spécifique maximale est notée à 30 m et elle est respectivement de 19 taxons au large et 20 taxons au niveau de la côte. Au sud, la richesse est plus importante. Le maximum au niveau de chaque radiale (III et IV) est enregistré à la côte et il est respectivement de 29 taxons en surface et de 27 taxons, observé à 10 m (Fig. 2A). L’analyse de variance a montré une différence significative de la richesse spécifique entre les différentes stations (Tableau 3). En revanche, aucune différence significative n’a été observée entre les niveaux échantillonnés dans chaque radiale (Tableau 4).

Variabilité verticale de la richesse spécifique : (A) en hiver et (B) en été.
Résultats de l’Anova appliquée sur les paramètres de structure des peuplements pour tester la différence entre les stations en hiver et en été.
| Source de variation : stations | ||||
| Hiver | Été | |||
| F | p | F | p | |
| Richesse spécifique | 3,16 | ** | 3,57 | ** |
| Diversité spécifique | 4,07 | *** | 1,72 | n.s. |
| Densité | 0,65 | n.s. | 0,55 | n.s. |
Résultats de l’Anova appliquée sur les paramètres de structure des peuplements pour tester la différence entre les niveaux bathymétriques par radiale en hiver et en été.
| Source de variation : profondeur | ||||||||||||||||
| Hiver | Été | |||||||||||||||
| Paramètres | Radiale I | Radiale II | Radiale III | Radiale IV | Radiale I | Radiale II | Radiale III | Radiale IV | ||||||||
| F | p | F | p | F | p | F | p | F | p | F | p | F | p | F | p | |
| Richesse spécifique | 2,65 | n.s. | 1,61 | n.s. | 1,66 | n.s. | 1,47 | n.s. | 6,45 | * | 2,58 | n.s. | 1,41 | n.s. | 1,72 | n.s. |
| Diversité spécifique | 0,97 | n.s. | 0,33 | n.s. | 2,07 | n.s. | 0,18 | n.s. | 1,96 | n.s. | 1,52 | n.s. | 2,22 | n.s. | 4,48 | * |
| Densité | 62,98 | *** | 3,72 | * | 5,27 | * | 4,07 | * | 0,071 | * | 0,68 | n.s. | 1,13 | n.s. | 1,13 | n.s. |
En été 2002, le maximum de richesse spécifique est côtier, localisé à 10 m pour les quatre radiales. Cependant, seule la radiale III présente une différence verticale significative de la richesse spécifique (Tableau 4). Toutefois, le sud reste plus riche en espèces, avec un maximum de 32 taxons, noté à la radiale IV (Fig. 2B). La variabilité spatiale de la richesse spécifique a montré une différence hautement significative (Tableau 3).
L’analyse de la diversité spécifique a montré qu’au niveau des quatre radiales, les valeurs de l’indice de Shannon dépassent généralement 2 bits durant les deux saisons et au niveau de toute la colonne d’eau (Fig. 3A et B). Le maximum de diversité est généralement côtier, noté entre 10 m et 30 m de profondeur au niveau de toutes les radiales à l’exception de la radiale II où le maximum est observé en surface. L’indice maximal de diversité hivernale est de 4,11 bits, celui estival est de 3,93 bits, notés respectivement au niveau des radiales IV et III. L’analyse de variance effectuée pendant les deux saisons n’a pas montré une différence significative de diversité entre les niveaux de profondeur, excepté en été, à la radiale IV (Tableau 4). En revanche, la différence entre les stations a été, a priori, significative pendant la saison froide (Tableau 3).

Variabilité verticale de la diversité spécifique : (A) en hiver et (B) en été.
Les diagrammes rang-fréquence établis pour chacune des 15 stations pendant chaque saison (Fig. 4) ont montré que, pendant la saison froide, les peuplements de surface (0 et 10 m) ont présenté des profils de stade 2 (maturité du système) au niveau des stations côtières, tandis qu’au large, les DRF montrent plutôt une allure de stade 1 (peuplement juvénile) et une allure caractéristique d’une situation intermédiaire entre les stades 1 et 2 de Frontier. Dans la couche de 30 m, la majorité des stations prennent une allure de stade 2, indiquant une diversité maximale. Vers 50 m, mis à part les stations 6 et 2 qui restent en stade 2, les autres stations ont des profils intermédiaires entre le stade 1 et 2.
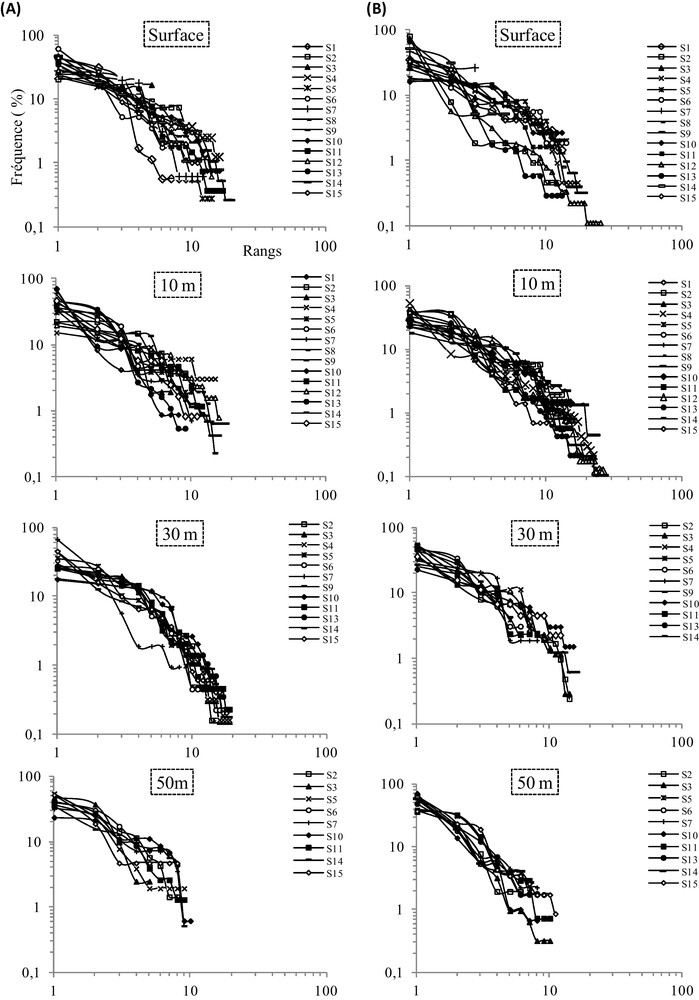
Diagrammes rang-fréquence du peuplement phytoplanctonique au niveau des stations d’étude par niveau de profondeur : (A) en hiver et (B) en été 2002.
Durant la saison chaude, dans les eaux de surface, la majorité des stations sont soit en stade 1 soit en situation intermédiaire entre les stades 1 et 2, excepté pour les stations 8, 10 et 15 qui semblent représentatives du stade 2. À 10 m de profondeur, la distinction entre les stations côtières et celles du large est plus marquée. En effet, les stations côtières présentent une allure typique du stade 2 alors que celles du large restent en situation intermédiaire entre les stades 1 et 2. En allant vers le fond (30 et 50 m), la majorité des stations reprennent l’aspect pionnier du stade 1 de Frontier.
3.2 Distribution spatiale de la densité phytoplanctonique pendant l’hiver et l’été 2002
Pendant la saison froide, les densités algales maximales sont notées à 30 m au niveau des quatre radiales. Au sud, les valeurs dépassent généralement 20 000 cell/L (le maximum est de 68 600 cell/L enregistré au large de la radiale IV) alors qu’au nord, les valeurs fluctuent généralement entre 700 et 10 000 cell/L avec une densité maximale côtière au niveau de la radiale II (68 000 cell/L) (Fig. 5A).
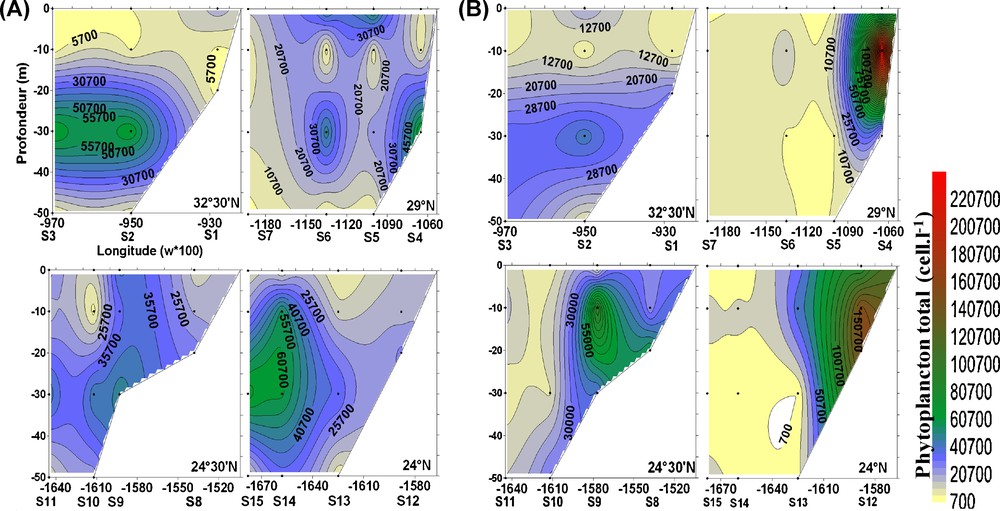
Variabilité verticale et côte-large des densités totales du phytoplancton : (A) en hiver et (B) en été.
La saison d’été est caractérisée par des maxima côtiers de densités, notés à 10 m pour les quatre radiales, excepté pour la radiale I où le maximum est à 30 m. Au sud, les valeurs varient entre 900 et 165 500 cell/L, alors qu’au nord, les densités micro-algales ne dépassent pas 43 000 cell/L. La forte densité (254 100 cell/L) rencontrée au niveau de la radiale II est due à la prolifération exceptionnelle de Pseudonitzschia delicatissima (Fig. 5B).
Statistiquement, aucune différence significative des densités n’est perceptible entre les stations ni en hiver ni en été (Tableau 3). Cependant, une différence significative entre les niveaux de profondeur est observée en hiver dans les quatre radiales alors qu’en été cette différence n’est révélée qu’au niveau de la radiale I (Tableau 4).
3.3 Affinité spatio-temporelle entre les différentes espèces recensées
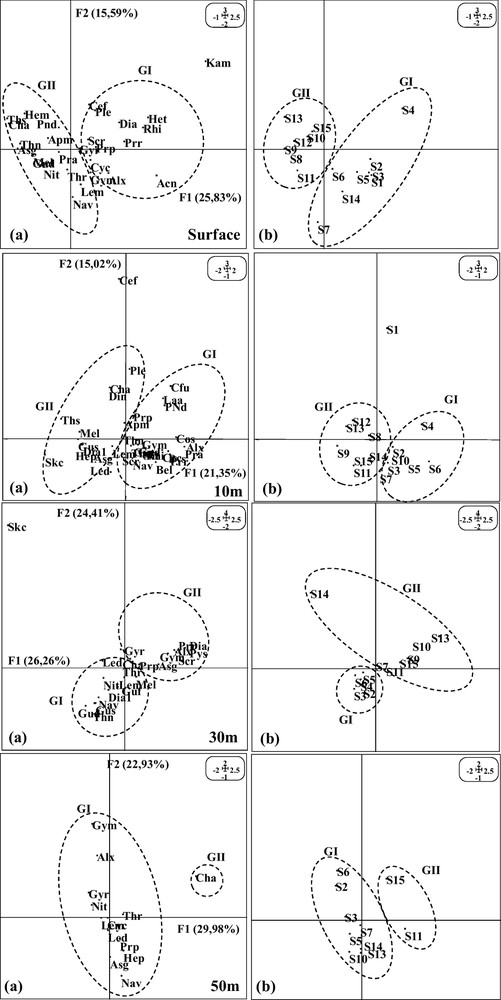
Le plan F1 × F2 explique 40 %, 43 %, 48 % et 62 % de l’inertie totale en hiver (Fig. 6) et 41 %, 36 %, 51 % et 53 % de l’inertie totale en été (Fig. 7), respectivement en surface, 10 m, 30 m et 50 m de profondeur. Des associations spatiales d’espèces ont été identifiées à différents niveaux de profondeur.
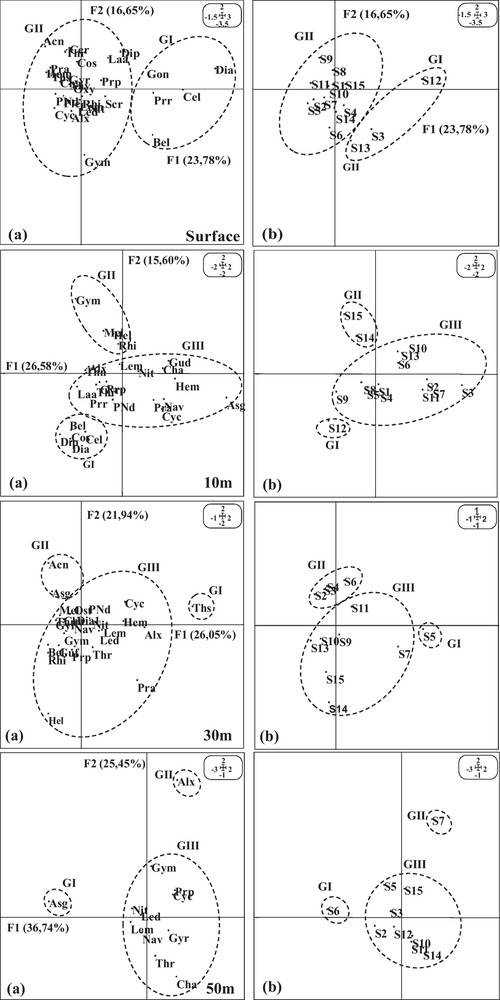
Projection des points espèces (a) et stations (b) sur le plan factoriel F1 × F2 par niveau de profondeur (hiver 2002).
Projection des points espèces (a) et stations (b) sur le plan factoriel F1 × F2 par niveau de profondeur (été 2002).
3.3.1 Situation hivernale
Les stations de la zone sud, principalement celles de la radiale IV, sont nettement démarquées dans les couches superficielles (0 et 10 m). La station côtière 12 (Groupe I) est caractérisée par une forte abondance de dinoflagellés principalement Dinophysis acuminata, Ceratium lineatum et Prorocentrum spp. Les stations du large 14 et 15 (Groupe II), caractérisées par leurs fortes densités algales, sont marquées par une dominance des espèces d’eaux froides Rhizosolenia et Melosira et particulièrement les espèces du genre Gymnodinium, dont la majorité est côtière. La présence de ces dernières dans ces stations pourrait témoigner d’une dérive des eaux littorales vers le large.
Dans les couches profondes (30 et 50 m), les stations de la zone nord sont plus distinguées dans le plan de projection (Groupes I et II). Elles sont caractérisées par une forte abondance des espèces Asterionellopsis glacialis et Thalassionema nitzshioides, espèces d’eaux froides, considérées comme de principaux marqueurs de l’upwelling. La station 7 située au large est, en outre, marquée à 50 m par une abondance d’Alexandrium spp.
Le reste des stations constituant le groupe II en surface et le groupe III aux autres strates semble présenter des caractéristiques floristiques similaires.
3.3.2 Situation estivale
Un gradient nord-sud est nettement visible aux différents niveaux de la colonne d’eau. Inversement à la saison froide, les stations de la zone nord se distinguent plus dans les couches superficielles alors que celles de la zone sud se démarquent en profondeur.
Dans les couches superficielles, les stations des radiales nord (Groupe I) sont marquées par un développement des dinoflagellés : D. acuminata, Prorocentrum spp., Alexandrium, Heterocapsa circularisquama, Ceratium furca et Protoperidinium. La majorité de ces espèces, dont la concentration a été assez importante, sont potentiellement toxiques et/ou ichtyotoxiques. Les stations des radiales sud (Groupe II) sont, en revanche, caractérisées par une dominance des diatomées accompagnatrices de la remontrée des eaux froides. Il s’agit essentiellement des espèces pélagiques (Leptocylindrus minimus, Leptocylindrus danicus et Chaetoceros spp.), benthiques à tychopélagiques (Melosira, Cylindrotheca clostrium, Thalassiosira, et Nitzschia) et néritiques d’eaux froides (A. glacialis et Thalassionema nitzschioides).
Dans les couches profondes et particulièrement à 30 m, les espèces Leptocylindrus minimus, Leptocylindrus danicus, Chaetoceros spp., Melosira et Nitzschia caractérisent les stations du nord. Celles du sud sont, en revanche, marquées par la présence des dinoflagellés (Protoperidinium, Alexandrium et Scrippsiella). À 50 m, la composition phytoplanctonique des stations est plus homogène avec un léger détachement des stations sud 11 et 15 (Groupe II), dû à une abondance de Chaetoceros spp.
4 Discussion et conclusion
Les radiales prospectées au cours de ce travail sont situées sur les principaux centres actifs d’upwelling le long du plateau continental. La variation spatio-temporelle de la remontée des eaux profondes contrôle la structure et l’abondance des communautés phytoplanctoniques dans chaque écosystème.
L’étude de la composition spécifique du peuplement du phytoplancton des quatre radiales prospectées (32°30′N, 29°N, 24°30′N et 24°N) à différents niveaux (surface, 10, 30 et 50 m de profondeur), en hiver et en été 2002, nous a permis de recenser 142 taxons répartis en six groupes. Quatre-vingt-six taxons sont des Diatomées, 54 des Dinoflagellés, cinq des Coccolithophoridés, deux des Euglénophycées, deux des Silicoflagellés et un Raphidophycé.
Les diatomées dominent largement le peuplement phytoplanctonique avec plus de 84 % du total, et ce aux différents niveaux de la colonne d’eau échantillonnés. Les dinoflagellés viennent au second plan, avec généralement 10 %. Ce résultat corrobore celui de Somoue [4], qui a montré que les diatomées constituent plus de 70 % de la communauté phytoplanctonique à chaque niveau de profondeur échantillonné de la zone comprise entre Cap Blanc et Cap Boujdor. Selon [17–19], le rapport diatomées/dinoflagellés dépend étroitement du brassage vertical de la colonne d’eau qui favorise le développement des diatomées. La croissance des dinoflagellés étant, au contraire, associée à une stratification de la colonne d’eau. Ainsi, les diatomées prolifèrent de préférence dans les milieux fertiles, vu leur grand pouvoir compétitif, vis-à-vis de l’utilisation des nutriments, par rapport aux autres groupes phytoplanctoniques [20].
L’analyse de la richesse et de la diversité des zones prospectées a montré que les peuplements côtiers sont les plus structurés et riches en espèces aussi bien en hiver qu’en été 2002. L’exception est faite en été, à 24°N, où les peuplements, aux différents niveaux de la colonne d’eau, étaient plus équilibrés au large. Près de la côte, la faible diversité spécifique enregistrée au niveau de cette radiale est due à une forte poussée de Melosira et Chaetoceros. La variation spatiale de ces deux indices de structure du peuplement (richesse et diversité) a montré des différences significatives entre les stations prospectées. En effet, les fortes valeurs sont observées dans les stations des radiales sud (24°30′N et 24°N) pendant les deux saisons. La variation verticale dans chaque radiale a, en revanche, révélé une homogénéité entre les différents niveaux bathymétriques.
L’examen des diagrammes rang-fréquence obtenus pour toutes les stations aux différents niveaux de la colonne d’eau permet de les situer par rapport aux trois stades de Frontier. En effet, les DRF ont montré que pendant les deux saisons, les peuplements fluctuent spatialement autour du stade 1, stade 2 et des stades intermédiaires entre les deux, avec une absence du stade 3 qui indique un état de maturité maximale du peuplement. En hiver 2002, les peuplements de surface présentent un stade 2, indiquant un état de maturité en milieu côtier, alors qu’au large, les peuplements sont en stade juvénile (stade1). Vers 30 m, l’ensemble des stations prennent le stade 2. En été 2002, les peuplements ont généralement tendance à se maintenir entre le stade juvénile (stade 1) et dans un état plus ou moins proche de l’état de maturité (stade2). Le stade 2 semble, en revanche, s’établir à 10 m au niveau des stations côtières.
En termes de densité phytoplanctonique, sa variabilité spatio-temporelle aux différentes radiales a révélé des maxima estivaux enregistrés principalement près de la côte durant les deux saisons. L’exception est faite en hiver à 32°30′N et à 24°N, où les densités phytoplanctoniques maximales étaient notées vers le large. La densité hivernale élevée rencontrée au large de la radiale 24°N pourrait être expliquée par la présence d’un filament provoqué par des courants chauds au niveau de la baie de Dakhla [21], favorisant l’exportation des eaux froides riches en nutriments vers le large de la radiale. Cependant, Somoue [4], a signalé que cette forte concentration algale peut être expliquée par une remontée d’eaux froides au large de Dakhla.
En outre, la forte productivité estivale côtière s’explique par l’activité intense de l’upwelling côtier en été par rapport à l’hiver, au niveau des différentes radiales [22,23]. Cette forte activité de résurgence a été confirmée par l’analyse de la variabilité verticale des densités du phytoplancton au niveau de chaque radiale, qui a révélé l’absence de différence significative entre les niveaux échantillonnés, dénotant une certaine homogénéité du phytoplancton due à un fort mélange vertical de la masse d’eau. En revanche, en hiver, la variation verticale des densités était significativement différente, avec des maxima enregistrés à 30 m de profondeur aux quatre radiales. Cela peut être expliqué par la faible activité de résurgence en cette période le long de la côte atlantique marocaine [23].
Généralement, les densités phytoplanctoniques sont élevées dans le sud de la zone d’étude (radiales 24°30′N et 24°N), bien que la variation inter-stations n’était pas assez significative. En effet, la zone sud (26°N–24°N) se caractérise par un upwelling plus intense que celui du nord (32°30′N–28°N) contribuant à une production primaire plus élevée [3,24,25]. Il est à noter par ailleurs, que la zone nord (29°N–28°N) est soutenue par un intense processus de reminéralisation qui constitue une source importante d’enrichissement en éléments minéraux en période estivale [26]. Cela a été confirmé au niveau de la radiale 29°N, qui a révélé une forte densité côtière marquée par un bloom de Pseudonitzshia spp. D’après Parsons et Dortch [27], ces espèces se développent en priorité dans les milieux trop fertiles dont l’enrichissement en éléments minéraux est principalement dû à la reminéralisation de la matière organique, suggérant une production régénérée de phytoplancton [28].
L’analyse factorielle des densités du phytoplancton nous a permis de mettre en évidence différentes associations spatio-temporelles d’espèces phytoplanctoniques selon leurs affinités. Certaines de ces associations ont témoigné de la présence de la remontée des eaux froides au niveau des secteurs prospectés.
Pendant la saison d’hiver, la distinction des stations de la radiale sud 24°N dans les couches superficielles (0–10 m) est due à une abondance des dinoflagellés à la côte, indiquant des masses d’eaux chaudes à faible turbulence [29,30] et la coexistence, au large, des espèces d’eaux froides pélagiques (Rhizosolenia) et benthiques (Melosira) et des espèces côtières (Gymnodinium). Cette distribution des espèces semble témoigner d’une dérive des eaux de résurgence vers le large.
Par ailleurs, dans les couches profondes (30–50 m), les stations du nord sont marquées par une abondance de Thalassionema nitzschioides et A. glacialis, espèces indicatrices de la résurgence des eaux profondes [31,32]. Leur localisation en profondeur témoigne de la faible activité d’upwelling dans la zone nord.
Pendant la saison chaude, un gradient nord-sud est bien visible aux différents niveaux de la colonne d’eau. Les stations du sud ont été caractérisées, dans les couches superficielles, par une abondance des espèces Melosira, Thalassionema nitzschioides, Chaetoceros, Leptocylindrus minimus, A. glacialis et Nitzchia, qui constituent un mélange entre formes benthiques et pélagiques d’eaux froides. Ces dernières ont été mentionnées par plusieurs auteurs [33–38] comme caractéristiques des périodes d’upwelling. Leur localisation en surface est due au fort mélange vertical, mettant en évidence un upwelling de forte intensité. En profondeur, les stations sud ont été plutôt marquées par la présence des dinoflagellés.
Un schéma inverse s’observe pour les stations du nord. En effet, ces dernières se caractérisent par un développement de dinoflagellés (Protoperidinium, Alexandrium et Scrippsiella) en surface, indiquant une faible turbulence des masses d’eaux superficielles [29,30], et une abondance d’espèces d’upwelling (Chaetoceros spp., Leptocylindrus minimus et Nitzschia) en profondeur signalant une faible intensité de résurgence.
Les résultats de l’analyse factorielle des correspondances confirment ce qui a été observé dans l’analyse descriptive saisonnière, verticale et côte-large du peuplement phytoplanctonique. Ainsi, l’activité de l’upwelling détermine en grande partie la variabilité spatio-temporelle qualitative et quantitative des peuplements algaux des écosystèmes étudiés.
Les radiales sud, particulièrement la radiale 24°N, s’avèrent plus productives que celles du nord, notamment en été où l’intensité d’upwelling est plus importante. Il faut noter, par ailleurs, que bien que la zone nord, située entre 28°N et 29°N, soit sous l’influence d’eaux upwellées moins riches en nutriments (origine de la remontée ne dépassant pas 75 m [3]), elle est, cependant, enrichie par des processus intenses de reminéralisation [26] témoignant de l’effet non négligeable de ces derniers dans la productivité de la zone.
En outre, l’analyse des affinités spatio-temporelles entre les principales espèces phytoplanctoniques a montré que les espèces Melosira, Thalassionema nitzschioides, A. glacialis, Chaetoceros, Leptocylindrus minimus et Nitzchia peuvent être considérées comme de principales indicatrices d’upwelling dans les écosystèmes étudiés. L’étude réalisée sur les écosystèmes d’upwelling au niveau de Cap Blanc (côte NO africaine) et sur la côte du Pérou (15°S) [39] a montré que les peuplements phytoplanctoniques de ces régions étaient dominés par Thalassiosira, Chaetoceros, Rhizosolenia et Nitzschia. Ces espèces sont, en outre, les plus citées dans la littérature comme dominantes dans les régions d’upwellings côtiers [40,41].
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Les auteurs remercient toute l’équipe du laboratoire d’océanographie biologique de l’Institut National de Recherche Halieutique (INRH, centre de Casablanca, Maroc) pour l’aide très efficace et pour l’appui logistique apportée à la réalisation de ce travail. Nous ne manquons pas de remercier tout l’équipage qui a participé aux campagnes d’échantillonnage à bord du Navire Al Amir Moulay Abdellah.


