1 Introduction
De nombreuses parties du monde, plus particulièrement à proximité des zones urbaines et industrielles, sont fortement polluées par des métaux lourds généralement issus de l’activité humaine. De tous ces métaux lourds présents, le Cd, le Cu, le Hg, le Ni, le Pb et le Zn sont les plus dangereux. De nos jours, l’usage des fertilisants minéraux et des produits phytosanitaires, ainsi que l’utilisation des boues et des eaux usées figurent parmi les principales sources de contamination des sols cultivés par le cadmium [1,2].
En conditions de stress métallique, l’une des caractéristiques remarquables de certains végétaux supérieurs est leur aptitude à concentrer l’excès de métaux absorbés au niveau de certains organes [3–5]. À l’intérieur de la cellule, l’excès de métaux absorbés peut faire l’objet d’une association à des ligands organiques afin de maintenir ces ions à un niveau d’activité particulièrement bas dans le cytosol. L’association avec des acides organiques ou inorganiques ou la séquestration dans les organites spécialisés semble être parmi les moyens de détoxication intracellulaires utilisés par les plantes supérieures [1,6–9].
Parmi les autres procédés de bioprotection figure aussi la synthèse de peptides de « stress métalliques » tels que les phytochélatines qui peuvent assurer le transport de ces métaux vers le compartiment vacuolaire [8,10,11]. Cependant, ces éléments métalliques peuvent être aussi transportés vers les feuilles via le xylème où ils seront également accumulés et (ou) redistribués vers les organes reproductifs ou végétatifs jeunes, ainsi que de nouveau vers les racines [12–14].
Pour contrer la toxicité métallique, les cellules de la plante contiennent des antioxydants tels que : l’α-tocophérol, le β-carotène, le glutathion (GSH) et l’ascorbate en plus d’autres enzymes antioxydantes : superoxyde dismutase (SOD), ascorbate peroxydase (APX), catalase (CAT) et glutathion réductase (GR) qui participent dans l’élimination des espèces réactives de l’oxygène [15,16].
Puisque le cadmium est un élément chimique analogue à l’élément zinc, nous avons cherché dans ce travail à analyser le comportement de plants de tomates exposés, d’une part, au cadmium et zinc séparément et, d’autre part, à la combinaison des deux métaux. Nous avons souhaité savoir quel était l’impact du cadmium sur l’accumulation du zinc par la plante au niveau de ces racines et des feuilles. De plus, nous avons analysé l’impact de cette pollution sur le système de défense « antioxydant » de la plante en mesurant quelques activités enzymatiques jouant un rôle majeur dans cette défense.
2 Matériels et méthodes
2.1 Conditions de culture
Les graines de tomate (Lycopersicon esculentum, var. Rio-grandé) ont été désinfectées par une solution d’eau oxygénée à 10 % (v/v), rincées abondamment à l’eau distillée, puis mises à germer dans des boîtes de Pétri tapissées de papier filtre imbibé d’eau distillée. La germination est réalisée à l’obscurité et à 25 ± 1 °C. Les plantules âgées de sept jours sont ensuite repiquées et maintenues sur des solutions nutritives de base dont le pH est maintenu entre 5,5 et 6,5. La composition du milieu de culture est KNO3 : 100,1 mg/L ; KH2PO4 : 136,09 mg/L ; citrate de fer : 38,91 mg/L ; ZnSO4 : 0,28 mg/L ; H3BO3 : 1,85 mg/L ; MgSO4 : 246,4 mg/L ; CaCL2 : 147 mg/L ; CuSO4 : 0,25 mg/L et MnSO4 : 0,84 mg/L.
Après 12 jours de culture, les plantules sont transférées sur le même milieu additionné ou non de différentes concentrations de CdCl2 et de ZnSO4 (0, 50, 100, 250, 500 μM) séparément et des concentrations combinées de Cd/Zn ou on a choisi une valeur constante de Cd de 100 μM associée à des concentrations croissantes de zinc de 0, 50, 100, 250 et 500 μM et ce pendant sept jours.
2.2 Techniques analytiques
2.2.1 Analyse des métaux
Le système racinaire ainsi que la partie aérienne préalablement séchés à l’étuve à 70 °C, jusqu’à obtention d’un poids constant (entre 24 et 72 h), sont soumis individuellement à une minéralisation à chaud par l’acide nitrique HNO3 à 70 % [17]. Après évaporation complète du mélange et obtention d’un résidu sec de couleur blanchâtre, un volume standard (20 mL) d’une solution d’acide nitrique à 1 % (v/v) est ajouté au résidu sec. Le dosage des minéraux est fait sur l’extrait nitrique à l’aide d’un spectrophotomètre d’absorption atomique.
2.2.2 Taux des chlorophylles (a et b)
L’extraction des chlorophylles est effectuée selon la méthode [18], qui consiste en une macération du végétal dans de l’acétone. Le traitement des échantillons se fait comme suit : 1 g de feuilles coupées en petits morceaux est broyé dans un mortier avec 20 mL d’acétone à 80 % et environ 100 mg de bicarbonate de calcium (CaCO3). Après le broyage total, la solution est ensuite filtrée et mise dans des boîtes noires afin d’éviter l’oxydation des chlorophylles par la lumière. La lecture se fait à l’aide d’un spectrophotomètre (Jenway 6300) aux deux longueurs d’onde 645 nm et 663 nm, après étalonnage de l’appareil avec la solution témoin d’acétone à 80 %. Les valeurs des taux de chlorophylles sont calculées à l’aide de l’équation [19].
2.2.3 Dosages enzymatiques
2.2.3.1 Préparation de l’extrait enzymatique
Des racines fraîches de tomate (1 g), qui ont subi un traitement par le cadmium et/ou le zinc pendant sept jours, sont broyées à froid dans un mortier avec 5 mL de tampon phosphate (80 mM, pH 7,5). L’homogénat est ensuite filtré à l’aide d’une toile adéquate avant de procéder à une centrifugation à froid de 12 000 g pendant 20 min (centrifugeuse Sigma 3–16 K). Le surnageant obtenu est utilisé comme extrait pour la détermination des différentes activités enzymatiques.
2.2.3.2 Dosage de l’activité catalase
Le dosage spectrophotométrique de l’activité CAT est réalisé suivant la méthode [20]. La décroissance de l’absorbance est enregistrée pendant 3 min (spectrophotomètre Jenway 6300) pour une longueur d’onde de 240 nm et un coefficient d’extinction molaire ɛ = 39 400 M−1 cm−1 L. Pour un volume final de 3 mL, le mélange réactionnel contient : 100 μL de l’extrait enzymatique brut, 50 μl de peroxyde d’hydrogène H202 à 0,3 % et 2850 μL de tampon phosphate (50 mM, pH = 7,2). L’étalonnage de l’appareil se fait en l’absence de l’extrait enzymatique. La réaction est déclenchée par l’addition d’eau oxygénée. L’activité catalase est exprimée en nmol/min/mg de protéines.
2.2.3.3 Dosage de l’activité glutathion-S-transférase (GST)
Le dosage de la GST est réalisé par la méthode [21]. Les échantillons sont homogénéisés dans un tampon phosphate 100 mM à pH 6,5 et centrifugés à 9000 g pendant 30 min. La méthode consiste à mesurer les activités GST en présence d’un mélange chloro-dinitro benzene (CDNB) 20 mM – Glutathion (GSH) 100 mM. La variation de la densité optique due à l’apparition du complexe CDNB-GSH est mesurée toutes les 15 secondes pendant deux minutes à 340 nm (spectrophotomètre Jenway 6300). L’activité de la GST est exprimée en nmole/min/mg de protéines.
2.2.3.4 Dosage de l’activité ascorbate-peroxydase
Le dosage spectrophotométrique de l’activité APX est réalisé suivant le protocole adopté par [22]. Le volume réactionnel final de 3 mL contient : 100 μL d’extrait enzymatique, 50 μL d’H2O2 à 0,3 % et 2850 mL de tampon phosphate de sodium et potassium 50 mM, pH 7,2 contenant 0,5 mM d’ascorbate. L’étalonnage de l’appareil se fait en l’absence de l’extrait enzymatique. La lecture est effectuée à 290 nm (spectrophotomètre GeneSys 8) pendant une minute et ce pour un coefficient d’extinction linéique molaire ɛ = 2800 M−1 cm−1. L’activité APX est exprimée en nmol/min/mg de protéines.
3 Résultats
3.1 Analyse des métaux
3.1.1 Analyse des métaux dans les racines et feuilles de plants de tomate traités avec du cadmium ou du zinc
La Fig. 1a montre que l’accumulation du Cd dans les racines et les feuilles augmente avec les concentrations croissantes du traitement par le métal. Cette accumulation est plus importante dans les racines que dans les feuilles où elle atteint son maximum (13 422 ± 0,048 μg/g de MS) à la plus forte concentration de Cd utilisée (500 μM). La répartition du Cd accumulé à l’intérieur de la plante montre que la majorité de cet élément se trouve piégée dans les racines avec un pourcentage qui varie entre 71 % et 80 % du Cd total absorbé par la plante.

Accumulation du Cd (a) et du Zn (b) dans les racines et feuilles de tomate traitées par le Cd ou le Zn pendant sept jours.
Le traitement par le Zn (Fig. 1b) présente des résultats similaires à ceux obtenus pour le Cd où le système racinaire accumule beaucoup plus de Zn que les parties aériennes. Par exemple, pour la dose de 50 μM, la teneur en Zn dans les feuilles n’est que 4480 ± 0,5 μg/g de MS alors qu’elle est de 10 369 ± 0,01 μg/g de MS dans les racines. Le pourcentage du Zn présent dans les feuilles varie entre 19 et 30 % du Zn total absorbé par la plante.
3.1.2 Analyse des métaux dans les racines et feuilles de plants de tomate traités avec du cadmium et du zinc simultanément
Lors d’un traitement simultané au Cd et Zn, les accumulations de ces métaux à l’intérieur de la plante dépendent étroitement de la concentration de ces métaux dans la solution nutritive et de la nature de l’organe. En termes de teneur, les racines accumulent plus de Cd et de Zn que les tissus foliaires (Fig. 2). Cette accumulation atteint son maximum pour les deux métaux simultanément aux plus fortes concentrations utilisées : 100 μM de Cd associée à 500 μM de Zn. La concentration racinaire de Cd est de 12 023 ± 0,35 μg/g de MS alors que celle de Zn est de 26 971 ± 1,3 μg/g MS.
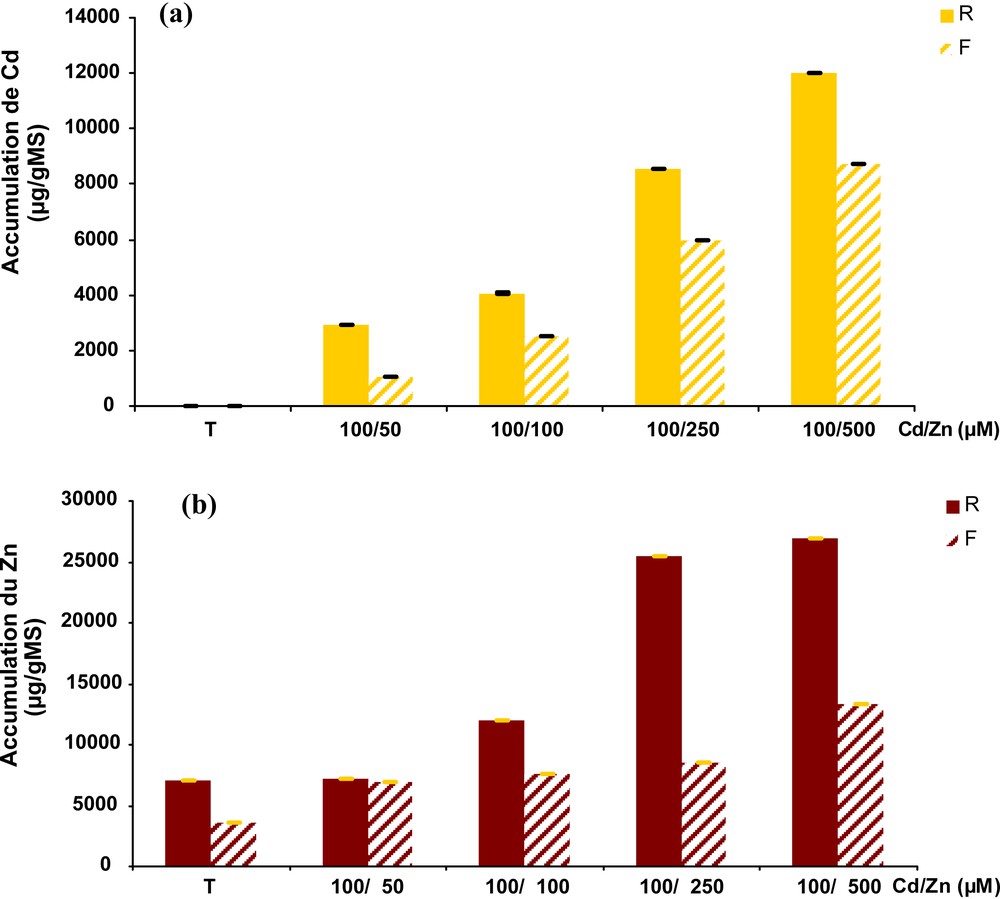
Accumulation du Cd (a) et du Zn (b) dans les racines et feuilles de tomate traitées par le Cd et le Zn simultanément pendant sept jours.
La comparaison des teneurs en Cd des plantes traitées en absence (Fig. 1) et en présence de Zn (Fig. 2) permet de mettre en évidence plusieurs phénomènes. Lorsque la concentration de traitement en Zn est inférieure ou égale à celle de Cd (c’est-à-dire 50 ou 100 μM), la teneur en Cd dans les racines reste inchangée, voire diminuée alors que la concentration foliaire aurait tendance à augmenter par rapport au traitement seul (100 μM de Cd). En revanche, lorsque la concentration de traitement de Zn est supérieure à celle de Cd (c’est-à-dire 250 et 500 μM), on assiste à une augmentation spectaculaire de la teneur en Cd dans les racines et dans les feuilles. Dans les racines, la teneur varie de 4387 ± 0,067 μg/g MS (valeur en présence de 100 μM Cd seule) à 8581 ± 0,09 μg/g MS en présence de 100 μM de Cd et 250 μM de Zn et, à 12 032 ± 0,35 μg/g de MS en présence de 100 μM de Cd associée à 500 μM de Zn. Dans les feuilles, la teneur en Cd est de 1237 ± 0,05 μg/g en absence de Zn (100 μM de Cd) et atteint des valeurs de 5963 ± 0,93 et 8713 ± 1,03 μg/g en présence de concentration de traitement de Zn de 250 et 500 μM.
En revanche, la présence de Cd dans le milieu de culture diminue l’assimilation du Zn par la plante (Fig. 2b). Quand la concentration du milieu est de 100 μM en Zn, la teneur de ce métal est de l’ordre de 20 310 ± 0,91 μg/g de MS dans les racines (Fig. 1b), alors qu’elle passe à 12 011 ± 0,76 μg/g de MS en présence de 100 μM Cd. À 250 μM de Zn et plus, la teneur en Zn, dans les racines, semble avoir atteint un plateau qui est de l’ordre de 25 000 μg/g de MS (Fig. 2b) alors que sans le Cd cette teneur peut atteindre 45 000 ± 0,98 μg/g de MS (Fig 1b). En revanche, au niveau des feuilles, la présence du Cd améliore l’accumulation de Zn qui augmente au fur et à mesure qu’on ajoute du Zn dans le milieu de culture qui peut atteindre 13 271 ± 0,94 μg/g de MS à 100 μM de Cd/500 μM de Zn au lieu de 10 222 ± 0,13 μg/g de MS en cas de traitement seul par le Zn (Fig. 1b).
3.2 Impact des différents traitements sur la synthèse des chlorophylles
D’après la Fig. 3a, on constate que le traitement par le Cd provoque une baisse progressive du taux de chlorophylle « a » qui atteint plus de 90 % à la plus forte concentration. Le même phénomène est observé pour la chlorophylle « b » (Fig. 3b).

Effet du Cd, du Zn et de la combinaison Cd/Zn sur les chlorophylles a (a) et b (b) chez la tomate traitée pendant sept jours.
Contrairement au Cd, la présence du Zn (oligoélément indispensable dans différentes fonctions de la plante) augmente le taux de chlorophylle « a » pour les faibles doses (50 et 100 μM) et au-delà de ces concentrations, il diminue pour atteindre une valeur minimale (8,43 μg/g de MF) à 500 μM. Alors que le taux de chlorophylle « b » semble diminuer à la concentration de Zn de 50 μM pour ensuite augmenter pour les concentrations de Zn supérieur ou égal à 100 μM.
Pour le traitement combiné en Cd/Zn, on observe une baisse des chlorophylles (a et b) par rapport au témoin. Cette diminution s’accentue au fur et à mesure que l’on ajoute du Zn dans le milieu de culture qui peut atteindre les 80 % à la plus forte concentration (100/500 μM).
3.3 Analyse des activités enzymatiques : catalase, glutathion-S-transférase et ascorbate peroxydase chez les racines de tomate traitées pendant sept jours par le cadmium ou le zinc séparément et par le cadmium combiné au zinc
La catalase participe à la dégradation de H2O2 généré par le Cd ou par tout autre stress oxydatif [23]. D’après la Fig. 4 on observe que le traitement par le Cd stimule l’activité enzymatique CAT à la plus faible concentration (50 μM) et au-delà de cette dernière, cette activité est inhibée. Alors qu’en présence de Zn, l’activité catalase n’est stimulée qu’à la plus forte concentration (500 μM). Enfin, le traitement combiné présente une forte induction de cette activité et qui peut atteindre son maximum 0,375 nmole/min/μg protéines à 100 μM de Cd/500 μM de Zn (≈ trois fois le contrôle).
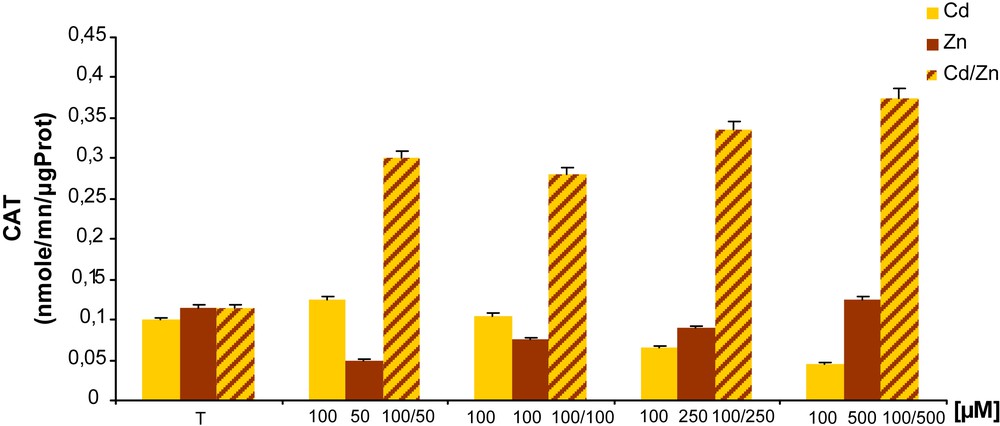
Effet du Cd, du Zn et de la combinaison Cd/Zn sur l’activité catalase chez les racines de tomate traitées pendant sept jours.
D’après la Fig. 5, l’analyse de l’activité GST dans les plants de tomate traités par le Cd et par l’association Cd/Zn montre une stimulation de cette activité en fonction des concentrations croissantes des métaux alors qu’elle est plutôt inhibée aux plus fortes concentrations. En présence du Zn, l’activité GST n’est augmentée qu’à 100 μM avec une valeur de 73,8 nmole/mn/mg protéines.
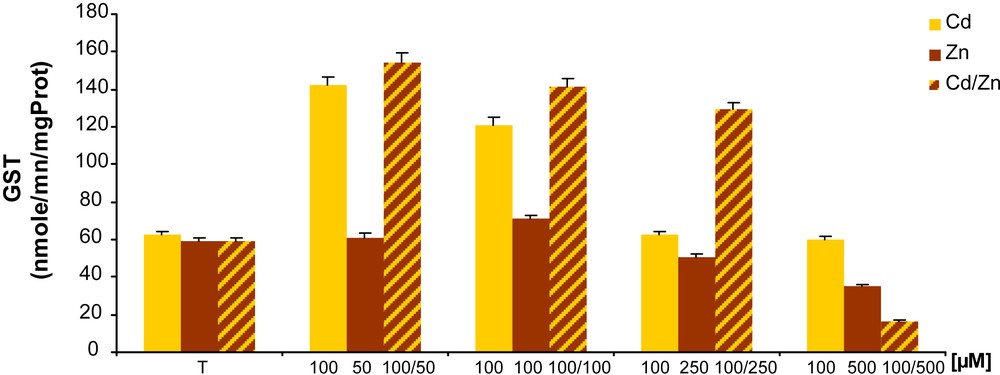
Effet du Cd, du Zn et de la combinaison Cd/Zn sur l’activité glutathion-S-transférase chez les racines de tomate traitées pendant sept jours.
L’induction de l’activité APX, enzyme très important dans le système de défense, est une réponse au stress oxydant chez les végétaux. L’APX protège la cellule contre les dommages oxydatives provoqués par H2O2. Les résultats obtenus et illustrés sur la Fig. 6, montrent que l’activité APX est fortement induite dans le traitement par le Cd et qui atteint son maximum (2,11 nmole/min/mg protéines) à 50 μM. Cette activité diminue au fur et à mesure qu’on ajoute du Cd dans le milieu de culture, tout en restant supérieure à celle décelée dans le contrôle. Au contraire, la présence de Zn inhibe l’activité APX aux faibles concentrations (50 et 100 μM) alors qu’une induction est observée aux concentrations supérieures.
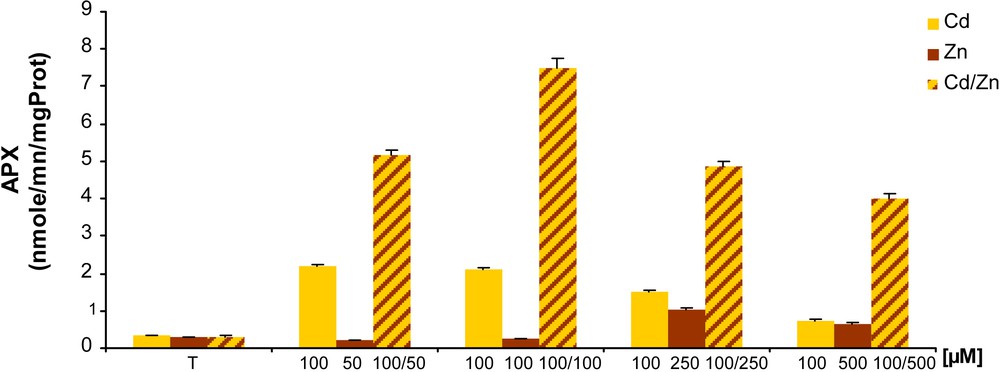
Effet du Cd, du Zn et de la combinaison Cd/Zn sur l’activité ascorbate peroxydase chez les racines de tomate traitées pendant sept jours.
Enfin, en présence de Cd et de Zn simultanément, l’activité APX augmente de façon très importante. Elle passe de la valeur de 0,315 dans le contrôle à 5,15 et 7,51 nmol/min/mg de protéines pour les doses 50 et 100 μM en cadmium et zinc, respectivement.
4 Discussion
Nos résultats montrent que la majeure partie du Cd absorbé se trouve accumulé au niveau des racines de plants de tomate et sont en accord avec d’autres travaux, notamment ceux obtenus par [9,14]. La présence de zinc dans le milieu de culture se traduit également par son accumulation dans les racines beaucoup plus que dans les feuilles. L’ensemble de ces observations permet de confirmer l’hypothèse selon laquelle les racines de certains végétaux supérieurs peuvent servir d’organe piège s’interposant à l’exportation des polluants métalliques vers les parties aériennes, sites de divers processus physiologiques vitaux [9,13,24,25].
Nous avons également montré que le traitement combiné de Cd associé au Zn induit des perturbations dans la teneur en Cd et en Zn dans les feuilles et les racines des plants de tomate. La présence du Zn à faible concentration (e.g. 50 μM), associée au Cd (100 μM) dans le milieu de culture, fait peu varier l’accumulation de ce dernier qui reste faible par rapport à un traitement seul de Cd au niveau des racines et des feuilles. En revanche, lorsque le Zn est en quantité équivalente au Cd (Cd 100 μM/Zn 100 μM), on observe une augmentation des teneurs en Cd et Zn dans les feuilles et une diminution au niveau des racines, comparativement aux traitements seuls. Au niveau de l’entrée des métaux dans les racines, il existe au niveau du plasmalemme une compétition entre le transport du Zn et du Cd parce que ces deux métaux vont se disputer les mêmes transporteurs [4]. Dans ce cas les transporteurs de Zn étant peu sélectifs, en présence d’une proportion égale de Cd par rapport au Zn, l’entrée dans les racines du Cd et du Zn est restreinte. Cela a conduit certains auteurs à parler de l’action antagoniste du Zn par rapport à l’absorption du Cd et par conséquent de mettre en évidence un rôle protecteur du Zn chez les plantes exposés à un stress oxydant induit par le Cd [26–28]. Par ailleurs, il apparaît que cette compétition au niveau des transporteurs qui chargent le xylème en métaux semble ne pas exister puisqu’on observe dans ces conditions expérimentales une quantité plus importante de Zn et de Cd dans les parties aériennes. Cela pourrait être dû au fait que ces éléments métalliques à l’intérieur de la plante soient pris en charge par des transporteurs plus spécifiques [29].
Enfin, lorsque la concentration en Zn dans le milieu de culture est supérieure à celle du Cd, on observe une augmentation considérable de ce dernier dans les racines et dans les feuilles essentiellement pour la concentration (Cd 100 μM/Zn 250 μM), alors que son absorption est freinée dans les racines et double dans les feuilles à la plus forte concentration (Cd 100 μM et Zn 500 μM). Cela laisse à penser que la compétition du Zn par rapport au Cd n’existe plus dans ces conditions expérimentales sans doute par le fait que le Cd peut rentrer dans la plante par d’autres transporteurs tels que le transport de Fer IRT1 [30]. En revanche, l’effet de compétition qu’exerce le Cd sur le Zn au niveau de l’entrée du Zn a toujours lieu puisque la présence de Cd dans le milieu de culture diminue l’assimilation du Zn par la plante.
Le dosage de la chlorophylle dans les feuilles de tomate exposées au Cd et à l’association Cd/Zn montre une forte diminution de sa quantité en fonction des différentes concentrations du métal. Parallèlement, on observe que le Zn stimule la biosynthèse des chlorophylles à faibles concentrations et l’inhibe aux fortes concentrations. Il semble que l’addition des deux stress a un effet plus délétère sur la composition en chlorophylles que l’action du stress Cd seul alors que le Zn seul n’a que peu d’effet sur la biosynthèse des chlorophylles. L’addition de Zn (par exemple à la concentration de 500 μM) à une concentration de 100 μM de Cd, a un effet plus drastique qu’une concentration de cadmium à 500 μM ou on observe une importante accumulation de Cd dans les feuilles. La teneur de ce dernier est de l’ordre de 8500 μg/g MS en présence de 100 μM Cd/500 μM Zn dans le milieu de culture alors qu’elle est de l’ordre de 3000 μg/g de MS avec 500 μM de Cd dans le milieu de culture. Cette concentration plus importante de Cd dans les feuilles se traduit par un effet plus sévère sur la teneur en chlorophylles qui pourrait être expliqué par l’existence d’un dommage oxydatif et des perturbations des potentiels électrochimique et membranaire (ΔμH+ et ΔΨ) induit par l’accumulation des métaux lourds [31,32].
L’analyse biochimique de l’activité GST met en évidence une stimulation à différents traitements (Cd et Cd/Zn) traduisant un phénomène de résistance des cellules racinaires chez la tomate. Alors que le zinc seul, par sa nature en tant qu’oligoélément indispensable à différentes fonctions de la plante, n’induit pas de stress oxydant au niveau des racines d’où l’inhibition constatée.
L’activité CAT chez les racines de tomate traitée par le Cd montre que les faibles concentrations stimulent celle-ci. Cela pourrait s’expliquer par le fait qu’aux faibles concentrations de Cd, il y a déclanchement des systèmes de détoxication qui pour la plupart sont formés d’enzymes dont la catalase. Aux fortes concentrations de Cd, les systèmes en question sont dépassés et les enzymes sont complètement inhibées [33,34]. D’un autre côté, l’activité CAT est inhibée à différentes concentrations de Zn avec une légère induction à 500 μM. Cela nous permet d’appuyer certaines hypothèses qui montrent que les fortes concentrations de Zn induisent une forte toxicité qui peut déstabiliser la balance métabolique [28,35]. Tandis que le traitement combiné provoque une forte stimulation à différentes concentrations. Ces observations mettent en évidence un phénomène de tolérance qui serait à l’origine de l’adaptation des plantes aux xénobiotiques traduit ainsi par une stimulation de l’activité enzymatique CAT.
Enfin, l’augmentation de l’activité APX observée sous stress oxydatif engendré par le Cd ou Cd/Zn met clairement en évidence son rôle dans l’élimination de l’eau oxygéné (H2O2) formée suite à l’accumulation du Cd dans les racines de la tomate. Nos résultats sont comparables à ceux obtenus par [9,36–41]. Parallèlement, le traitement par le Zn ne semble pas présenter un quelconque stress pour la cellule et ce à faibles concentrations du fait que cet élément est indispensable au fonctionnement de la cellule. Les fortes doses de Zn engendrent une toxicité sévère qui se traduit par une mise en place chez les cellules des plants traités d’un système de défense qui se manifeste par une stimulation de l’activité APX.
Il faut savoir que la faible réponse de l’activité CAT en réponse au stress induit par le Cd est compensée par l’activité APX qui semble être plus sollicitée. Ces deux activités sont des « éliminateurs » d’H202, et les variations de leurs activités respectives dans les racines sont directement liées à leur fonction à éliminer l’H202 [8,42].
5 Conclusion
La teneur endogène en Cd dans la plante dépend étroitement de sa concentration dans le milieu de culture. Le niveau d’accumulation du métal n’est pas le même dans les différents organes de la plante. En effet, le système racinaire accumule beaucoup plus de Cd que la partie aérienne et il est considéré comme une barrière pour la translocation du Cd jusqu’aux feuilles chez les plantes supérieures. Le traitement combiné Cd/Zn appliqué aux différentes parties de la plante montre que ces dernières participent amplement à la modification de l’accumulation et la compartimentation de ces métaux.
Nos résultats montrent une importante augmentation de l’accumulation du Cd et du Zn chez les racines de plants de tomate traitées par les deux métaux séparément comparés à leur concentration chez les feuilles. La présence du Cd et Zn simultanément dans le milieu de culture en fonction de différents rapports de concentration a permis de mettre en évidence différents phénomènes. La présence des deux métaux, lorsque la concentration de Zn est inférieure à celle de Cd, n’a pas d’impact sur l’absorption du Cd dans les racines, en revanche, elle augmente sa présence dans les feuilles. Quand les concentrations externes sont équivalentes, cela se traduit par une augmentation des teneurs en Cd et Zn dans les feuilles et une diminution des deux teneurs au niveau des racines. En revanche, la présence de Zn dans le milieu de culture en plus grande quantité que le Cd augmente la teneur du Cd dans les racines et dans les feuilles. Nous avons également constaté que la présence de Cd dans le milieu perturbe l’homéostasie du Zn. La teneur en Zn au niveau des racines est moindre alors qu’elle augmente au niveau des feuilles.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.


