1 Introduction
La désertification affecte plus de deux milliards de personnes sur la planète, et cette situation devrait s’aggraver sous les effets conjugués d’une pression anthropique croissante, d’une gestion anarchique des sols et de l’eau et des changements climatiques annoncés. Cette surexploitation des ressources naturelles aboutit principalement à une altération des caractéristiques écologiques du milieu, dont les premiers symptômes tangibles sont enregistrés au niveau du couvert végétal (faible densité de recouvrement, diversité appauvrie, baisse de la productivité de l’agro-système, etc.) [1]. Ces dégradations facilitent également les processus d’érosion hydrique et éolienne, qui se manifestent par une altération des caractéristiques physiques, chimiques et biologiques des sols [2,3]. En effet, il a été clairement établi que ces processus affectaient la microflore tellurique, tant au niveau de sa structure que de sa diversité fonctionnelle [4,5]. Parmi les composantes microbiennes sensibles à ces dégradations figurent les champignons mycorhiziens [6]. Ces symbiotes fongiques sont considérés comme des éléments clés dans le fonctionnement du sol [7]. Ils sont impliqués dans le déterminisme biologique des principaux cycles biogéochimiques assurant le maintien de la fertilité des sols [3]. La symbiose mycorhizienne améliore significativement la croissance de la plante, en favorisant sa nutrition minérale et son état sanitaire [8]. L’établissement de la symbiose mycorhizienne influence également quantitativement et qualitativement les caractéristiques de la microflore tellurique, conduisant à la formation d’un compartiment microbien spécifique, communément appelé « mycorhizosphère » [9–12]. Elle a également un impact positif sur l’établissement des endosymbioses racinaires fixatrices d’azote, tant avec les légumineuses qu’avec les plantes actinorhiziennes. L’ensemble de ces résultats montre que la symbiose mycorhizienne doit être considérée comme une composante majeure dans l’établissement de pratiques culturales visant à assurer une gestion durable des terres. Toutefois, du fait des interactions multiples existant entre le cortège mycorhizien, la plante et la microflore tellurique, les stratégies d’ingénierie écologique susceptibles d’être proposées doivent prendre en considération les caractéristiques biotiques et abiotiques du milieu afin d’opérer sa restauration, sa réhabilitation ou sa réaffectation en fonction de la situation rencontrée [13].
Ce chapitre a pour principaux objectifs :
- • de suggérer des critères d’intervention visant à promouvoir durablement le potentiel infectieux mycorhizogène (PIM) des sols en fonction de l’état de dégradation du milieu ;
- • de présenter quelques exemples de pratiques culturales susceptibles d’assurer le maintien du fonctionnement de la symbiose mycorhizienne au sein d’écosystèmes agricoles ou naturels plus ou moins dégradés.
Ces stratégies seront plus particulièrement développées en prenant comme modèles biologiques les plantes fixatrices d’azote connues pour leur adaptation à des conditions environnementales hostiles (carences en azote minéral), leur effet positif sur la fertilité des sols (plus particulièrement en azote) et la productivité de l’écosystème [14–18]. Ces végétaux sont également classés dans le groupe des espèces hypermycotrophes [19], qui ont, par conséquent, la capacité de promouvoir la multiplication des symbiotes fongiques et ainsi d’améliorer le PIM des sols.
2 Les stratégies d’ingénierie écologique basées sur la gestion durable du potentiel infectieux mycorhizogène
Le modèle de dégradation d’un écosystème est présenté sur la Fig. 1. Il va d’un milieu non dégradé jusqu’à un écosystème très gravement dégradé [13]. Il a été démontré que ces étapes de dégradation sont étroitement corrélées à une baisse du PIM des sols, tant au niveau de l’abondance que de la diversité des symbiotes fongiques subsistants [20]. La symbiose mycorhizienne étant considérée comme une composante majeure dans les processus biologiques régissant l’évolution spatio-temporelle des écosystèmes, elle contribuera également au maintien de la capacité de résilience du milieu en regard des contraintes environnementales [21]. La stabilité d’un écosystème est fonction de deux paramètres : sa résistance envers des perturbations externes et sa résilience, qui caractérise sa capacité à recouvrer les caractéristiques originelles qui lui étaient propres avant la manifestation de la perturbation [22]. Dans cet article, nous considérerons la notion de résilience comme une variable quantitative (un écosystème est plus ou moins résilient pour un paramètre donné) et non comme une variable qualitative et générique [23].
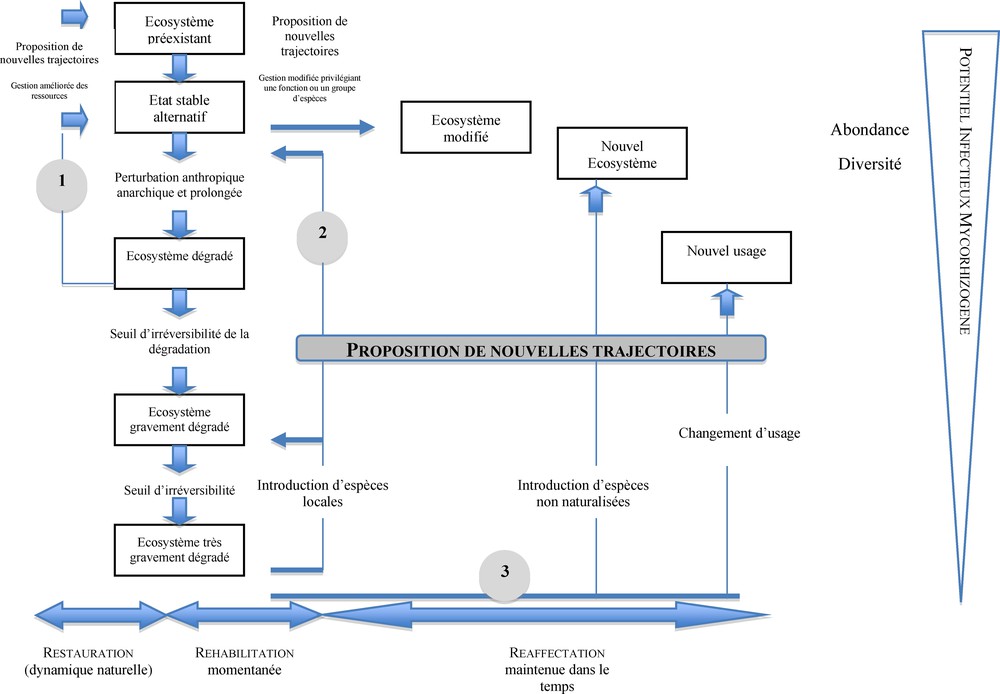
Description du modèle de dégradation des écosystèmes associée à l’évolution du potentiel infectieux mycorhizogène et les voies majeures proposées pour y remédier.
D’après [13].
En conséquence et en fonction de l’ampleur des perturbations enregistrées, la gestion du PIM du sol peut être envisagée en fonction des stratégies suivantes :
- • agro-écosystème dégradé : gestion du PIM via la mise en place de techniques culturales appropriées visant à promouvoir l’impact de la symbiose mycorhizienne sur la productivité de l’agro-écosystème (restauration et réhabilitation, axes 1 et 2, Fig. 1) ;
- • agro-écosystème très gravement dégradé : adoption de la technique de mycorhization contrôlée associée à l’introduction d’espèces végétales et de symbiotes mycorhiziens exotiques au milieu (réaffectation, axe 3, Fig. 1).
3 La gestion du potentiel infectieux mycorhizogène par la valorisation de la biodiversité végétale locale
3.1 Rotations culturales
La rotation culturale basée sur la succession légumineuses/céréales engendre généralement une augmentation du pH du sol, une élévation du PIM et de la teneur en N biodisponible et, parallèlement, améliore la qualité sanitaire du milieu de culture [24]. La conjugaison de ces impacts aboutit à une amélioration significative de la productivité de la culture de céréales associée [24]. De nombreuses études ont été réalisées afin d’évaluer l’impact de ces rotations culturales légumineuses/céréales sur les teneurs en azote biodisponible pour les plantes [25]. Toutefois, dans les zones arides et semi-arides, les carences en phosphore sont considérées comme les principaux facteurs limitant la productivité des cultures céréalières. Dans ce contexte, les impacts sur l’environnement tellurique des rotations culturales associant des successions légumineuses/céréales pourraient favoriser l’enrichissement du sol en P biodisponible [26]. Outre l’impact des légumineuses sur les caractéristiques abiotiques du milieu favorisant la mobilisation du P soluble [27], ces plantes peuvent également améliorer le PIM du sol et faciliter l’expression de la symbiose mycorhizienne sur la culture céréalière [24,28]. En étudiant l’impact d’une rotation culturale associant le niébé (Vigna unguiculata) et le mil au Niger, Bagayoko et al. [24] ont montré une amélioration de 22 % du rendement en grains de la culture céréalière. Ces effets bénéfiques étaient, de plus, fortement corrélés aux taux de colonisation des symbiotes fongiques sur les racines de mil.
3.2 Établissement d’îlots de fertilité biologiques par l’introduction de plantes nurses dans les itinéraires culturaux
Dans des environnements hostiles, certaines plantes pionnières ou rudérales peuvent faciliter le développement d’autres espèces végétales [29–31]. Ce type d’interactions positives (ou facilitatrices) interspécifiques a été rapporté dans une large gamme de conditions démontrant l’importance de ce processus dans la dynamique des communautés végétales et la structure de la strate épigée [32–35]. En milieu méditerranéen, les dégradations d’origine anthropique au niveau du couvert végétal engendrent des modifications dans la structure, la dynamique et la diversité spécifique de la strate épigée [36]. Dans ces conditions, le développement des plantes peut être facilité par la présence d’arbustes pionniers, qui vont matérialiser, autour des cultures adjacentes, un microhabitat qui va les protéger des radiations solaires, des variations de température et améliorer la fertilité des sols [34]. Par exemple, ces espèces arbustives facilitent la germination et la croissance juvénile des essences forestières, plus particulièrement dans les écosystèmes de type méditerranéen [37]. Ce type d’interaction a été nommé « effet plante nurse » (nurse plant effect) [38–40]. De nombreuses études ont mis en exergue l’importance de ce phénomène dans les processus de recolonisation par la végétation des milieux ouverts [34,41].
Les plantes nurses améliorent le développement d’autres végétaux, en matérialisant des micro-habitats favorables à la germination des semences et/ou aux besoins des plantes. Elles améliorent les conditions environnementales, permettant ainsi l’installation d’espèces végétales moins tolérantes aux stress d’origine abiotique [37,42]. Cet effet « nurse » (ou facilitateur) est d’une importance toute particulière en milieu méditerranéen, où l’aggravation des processus de désertification entraîne des dysfonctionnements au niveau des activités microbiennes du sol [4].
Cette partie du chapitre a pour principaux objectifs de répertorier les exemples de valorisation de l’effet « plante nurse » dans des opérations de reboisement en milieu méditerranéen, en insistant plus particulièrement sur l’impact de ces espèces végétales sur les caractéristiques microbiennes telluriques et du PIM. Bien que focalisée sur l’amélioration d’itinéraires sylvicoles, cette gestion du couvert végétal, en associant plusieurs groupes fonctionnels de plantes, peut également être retenue dans les systèmes agroforestiers, et ainsi améliorer la productivité de la culture associée.
3.2.1 Sélection des plantes nurses
Des enquêtes en milieu naturel doivent être réalisées afin de sélectionner les espèces végétales susceptibles de promouvoir la croissance des essences forestières ciblées. Les écosystèmes méditerranéens dégradés présentent une couverture végétale hétérogène formée par des poches de végétation (ou patches). Ces taches de végétation constituent des îlots de fertilité [43,44], qui peuvent promouvoir le développement de différentes espèces végétales natives du milieu [34,45]. Certaines plantes méditerranéennes présentent une grande dépendance mycorhizienne et ont la faculté de promouvoir la multiplication des propagules mycorhiziennes dans le sol [46]. Dans les milieux arides et semi-arides, les légumineuses sont généralement considérées comme des plantes nurses pouvant faciliter la survie et le développement de certaines essences forestières en améliorant la teneur en azote des sols, mais également, du fait de leur haute mycotrophie, en contribuant au maintien du PIM [47]. De récents travaux menés au Maroc ont aussi évalué l’effet « plante nurse » de plusieurs espèces arbustives non légumineuses. Ces travaux ont montré que les caractéristiques microbiologiques et chimiques des sols étaient favorablement influencées par Lavandula spp. ou Thymus satureioides au sein d’une formation dégradée de Cupressus atlantica [48]. En comparant ces données avec celles d’un sol nu (non recouvert par la végétation), les résultats ont montré que le potentiel mycorhizien était beaucoup plus élevé dans le sol issu de ces poches de végétation colonisées par les espèces arbustives étudiées. Azcon et Barea [49] avaient, par ailleurs, montré que les racines de lavande étaient infectées par des champignons mycorhiziens à arbuscules (CMA) et que cette plante présentait une dépendance mycorhizienne élevée, en accord avec des travaux précédents faisant état de la lavande comme « mycorhizienne obligatoire » [7] ou comme « hautement dépendante de la symbiose mycorhizienne » [19]. L’essence forestière (C. atlantica) et les espèces arbustives étudiées permettaient aussi une stimulation de la multiplication des propagules fongiques mycorhiziennes dans le sol, et par conséquent un PIM plus élevé sous les espèces végétales étudiées [48]. Le nombre probable de propagules mycorhiziennes pour 100 g de sol était compris entre 7,82 (sol nu), 179,7 (L. dentata et C. atlantica) et 244,5 (L. stoechas et T. satureioides). Toutes ces propagules (spores, hyphes et fragments de racines mycorhizées) sont considérées comme des sources d’inoculum fongique [6]. Ce type d’étude a aussi été réalisé avec le caroubier (Ceratonia siliqua) et Retama sphaerocarpa, une légumineuse arbustive fréquemment observée dans les régions méditerranéennes en climat semi-aride. Cette légumineuse développe un système racinaire profond [50] et fixe l’azote atmosphérique via la symbiose avec Rhizobium [51]. Les résultats corroborent ceux obtenus avec Lavandula spp., T. satureioides et C. atlantica, puisque les teneurs en N, P et C sont supérieures dans le sol influencé par R. sphaerocarpa comparé au sol nu.
3.2.2 L’effet « plante nurse » et le développement juvénile des essences forestières méditerranéennes
3.2.2.1 Expériences en serre
L’impact de certaines espèces arbustives sur la croissance juvénile de plusieurs essences forestières méditerranéennes telles que C. atlantica, Ceratonia silica et Acacia raddiana a été étudié en conditions contrôlées. Ouahmane et al. [48] ont observé que la hauteur, le diamètre au collet, les teneurs en N, P et K des feuilles, l’intensité de mycorhization des racines de jeunes plantules de C. atlantica étaient significativement plus élevés lorsque les semis de C. atlantica étaient plantés dans des sols prélevés sous T. satureioides, Lavandula spp. et C. atlantica que dans le sol nu après six mois de culture en serre (Tableau 1). Concernant les croissances aériennes et racinaires, un effet positif des sols prélevés sous les espèces précédemment citées a aussi été observé (Tableau 1).
Croissance et colonisation mycorhizienne des plants de Cupressus atlantica se développant dans des sols collectés sous L. dentata, L. stoechas, Thymus satureioides, C. atlantica et dans un sol nu après six mois de plantation en serre.
| Témoin | Espèces végétales | ||||
| L. dentata | L. stoechas | T. satureioides | C. atlantica | ||
| Hauteur (cm) | 14,2a(1) | 18,6b | 21,0c,d | 23,0d | 19,4b,c |
| Diamètre au collet (mm) | 2,02a | 2,72b,c | 2,72b,c | 2,94c | 2,54b |
| Biomasse aérienne (mg poids sec) | 330a | 634b,c | 738c | 666bc | 486a,b |
| Biomasse racinaire (mg poids sec) | 76a | 176c | 157b,c | 115a,bc | 104a,b |
| N (mg par plant) | 0,785a | 1,559b | 1,823c | 2,029d | 1,480b |
| P (mg par plant) | 0,033a | 0,107c | 0,115c | 0,147d | 0,090b |
| K (mg par plant) | 3,71a | 9,54b | 26,53c | 25,16c | 8,58b |
| Colonisation mycorhizienne (%) | 35a | 48b | 50b | 75c | 54b |
3.2.2.2 Expériences au champ
L’effet facilitateur de quelques espèces arbustives sur des essences forestières méditerranéennes a été essentiellement étudié en conditions contrôlées mais, à notre connaissance, peu de données sont disponibles sur ce type d’interaction entre plantes en milieu méditerranéen. Une expérience in situ a été réalisée dans le haut Atlas marocain afin de tester l’hypothèse visant à établir que l’association plante nurse/essence forestière améliorerait, non seulement la croissance de l’espèce forestière, mais également des caractéristiques microbiennes du sol de plantation et du PIM comparé aux performances des itinéraires sylvicoles classiques [52]. Après deux années de plantation, les résultats attestent que le dispositif associant deux espèces végétales améliore la croissance des plants de C. atlantica ainsi que les caractéristiques microbiennes telluriques. Le réseau mycélien formé par les CMA, l’activité microbienne totale, l’activité déshydrogénase, l’abondance des bactéries solubilisatrices de phosphates inorganiques et la nutrition en N et P des plants de C. atlantica étaient significativement supérieurs en présence de L. stoechas que dans les autres traitements (Tableau 2). Ce type d’étude a été élargi à d’autres modèles biologiques ; des données scientifiques sont disponibles pour identifier des couples essence forestière/plante nurse performants quant à leur comportement dans des situations de stress (Tableau 3).
Caractéristiques biochimiques des sols et teneurs en azote et en phosphore des parties aériennes dans les traitements (i) de plants de Cupressus atlantica non inoculés et (ii) de plants de C. atlantica associé à L. stoechas.
| Non inoculé | Associé à L. stoechas | |
| Teneur en N des feuilles (g g−1 poids sec) | 4,76 (0,32)(1),a,(2) | 6,25 (0,19)b |
| Teneur en P des feuilles (g g−1 poids sec) | 0,343 (0,028)a | 0,415 (0,036)b |
| Activité microbienne totale (mg de fluorescéine diacétate h−1 g−1 de sol) | 12,4 (0,33)a | 23,2 (2,5)b |
| Activité déshydrogénase (mg INTF g−1 sol h−1) | 36,9 (1,69)a | 51,9 (6,5)b |
Liste des espèces nurses préconisées pour la régénération naturelle de certaines essences forestières au Maroc.
| Espèces nurses | Arbres | |||||||
| Acacia raddiana | Rhus tripartitum | Pistacia atlantica | Pinus halepensis | Quercus rotundifolia | Fraxinus dimorpha | Juniperos pnoenicea | Juniperus thurifera | |
| Adenocarpus anagyrifolius var. leiocarpus | X | X | X | |||||
| Adenocarpus barquel | X | X | X | X | ||||
| Alyssum spinosum | X | X | X | |||||
| Anarrhinum fruticosul ssp. demnatense | X | X | X | X | ||||
| Anvillea radiata | X | X | ||||||
| Arenaria pungens ssp. parviflora | X | |||||||
| Artemisia atlantica ssp. maroccana | X | X | X | X | ||||
| Artemisia inculfa | X | X | X | |||||
| Artemisia mesatlantica | X | X | X | |||||
| Artemisia negrel | X | X | X | |||||
| Astragalus armatus ssp. tragacanthoides | X | |||||||
| Atriplex halimus | X | X | ||||||
| Berberis hispanica | X | X | X | |||||
| Bupleurum atlanticum | X | X | X | |||||
| Bupleurum spinosum | X | X | X | X | ||||
| Buxus balearica | X | X | X | |||||
| Calligonum cornosum | X | X | ||||||
| Carthamus fruticosus | X | X | X | X | X | |||
| Chamaerops argentea | X | X | ||||||
| Convolvulus trabutianus | X | X | ||||||
| Cytisus balansae | X | X | X | |||||
| Erinacea antinyllis | X | |||||||
| Genista demnatensis | X | X | X | X | ||||
| Genista retamoides | X | X | ||||||
| Genista soorpius ssp. myriantha | X | X | X | X | ||||
| Globularia nainil | X | X | ||||||
| Marrubium litardierei | X | X | X | |||||
| Ononis angustissima | X | X | X | |||||
| Ononis antiquorum | X | X | ||||||
| Ononis atlanficum | X | X | X | |||||
| Ormenis scariosa | X | X | X | |||||
| Panicum turgidum | X | |||||||
| Pennisetum dichotomum | X | |||||||
| Prunus prostrata | X | X | X | |||||
| Retama dasycarpa | X | X | ||||||
| Retama raetam | X | |||||||
| Retama sphoerocarpa | X | X | ||||||
| Ribes uva-crispa | X | X | X | |||||
| Santolina rosmarinifolia var. canescens | X | X | X | X | ||||
| Stipa tenacissima | X | X | X | |||||
| Teucrium malenconianum | X | X | ||||||
| Thymus commutatus | X | X | ||||||
| Velia mairel | X | |||||||
| Ziziphus lotus | X | X | X |
4 La mycorhization contrôlée
Il est maintenant parfaitement admis que le développement optimal d’une plante est atteint lorsque le taux d’infection mycorhizienne est élevé [53]. De nombreux travaux ont également démontré que l’effet de la mycorhization dépendait des symbiotes associés. Ces résultats ont permis de définir une pratique culturale, appelée « mycorhization contrôlée », basée sur la sélection de souches fongiques performantes suivant un paramètre donné (par exemple, amélioration de la croissance, résistance au stress salin, etc.) pour améliorer la productivité durable de systèmes culturaux agricoles ou forestiers. L’efficacité de la mycorhization contrôlée est fonction de deux paramètres principaux : la fertilité du sol et les caractéristiques du PIM du site. Cette technique d’inoculation est donc particulièrement efficace dans des milieux gravement dégradés où la diversité et l’abondance des propagules mycorhiziennes sont très faibles (Fig. 1). Cette stratégie de réaffectation du milieu trouve sa pleine expression en foresterie ou en agroforesterie, alors que des contraintes techniques limitent son utilisation chez les plantes de grande culture. Cette conception de la valorisation de la symbiose, en sélectionnant des symbiotes performants, compétitifs vis-à-vis de la microflore native et fréquemment inoculés à des espèces exotiques, a été remise en question ces dernières années, du fait principalement de la démonstration de l’importance de la conservation de la diversité des peuplements indigènes de microorganismes pour assurer un fonctionnement optimal du sol. En effet, Dabire et al. [54] ont observé que l’introduction dans le sol d’une souche de champignon mycorhizien hautement compétitrice pouvait entraîner une baisse significative de la diversité fonctionnelle de la microflore tellurique et donc fragiliser le sol en regard de contraintes environnementales.
5 Conclusion et perspectives
L’ensemble des résultats présentés dans ce chapitre montre que la gestion du potentiel mycorhizien du sol constitue des approches performantes pour améliorer la qualité des sols dans des conditions environnementales diverses en milieu méditerranéen et tropical. Cependant, cette pratique d’ingénierie écologique doit être raisonnée en fonction des caractéristiques du milieu, mais également en fonction des objectifs affichés (restauration, réhabilitation ou réaffectation du milieu). Étant donné que l’abondance, mais aussi la diversité des peuplements mycorhiziens constituent les principaux indicateurs de l’efficacité de la symbiose sur le développement de la plante, il est recommandé de valoriser les ressources naturelles mycorhiziennes résilientes dans un environnement donné et de redonner au PIM un niveau compatible avec une productivité optimale du système cultural. Cette gestion in situ peut être réalisée via des rotations culturales associant des plantes hautement mycotrophes ou en utilisant des espèces végétales endémiques et hautement adaptées aux conditions défavorables caractérisant ces milieux dégradés (carences minérales, déficit en eau, etc.). La mycorhization contrôlée et, en conséquence, la simplification induite de la communauté mycorhizienne doit être réservée à des situations très particulières, dans lesquelles le système a perdu ses caractéristiques originelles (par exemple, les sites post-miniers) et où l’intervention humaine est obligatoire.
Afin de raisonner au mieux la valorisation des ressources mycorhiziennes des sols, il est nécessaire d’améliorer nos connaissances sur les processus biologiques régissant l’évolution spatio-temporelle de la strate épigée et le rôle de la symbiose mycorhizienne dans les mécanismes assurant la capacité de résilience des éco- et agro-systèmes.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.


