1 Introduction
Le chêne-liège est l’une des espèces forestières les plus importantes au Maroc, s’étendant sur une superficie de près de 350 000 ha, principalement dans les régions de la Maâmora, du Plateau central et du Rif [1]. La subéraie est très appréciée pour la diversité de ses produits (bois, liège, glands doux, miel, champignons, plantes médicinales, espace de pique-nique…), et offre une importante protection des sols grâce au couvert végétal permanent, ce qui en fait un arbre d’une grande importance socio-économique et écologique. Cependant, le fonctionnement des subéraies est fortement menacé par l’aggravation des conditions climatiques (sécheresse) et l’accentuation des pressions anthropiques (surpâturage, surexploitation, ramassage du sous-bois par la population riveraine…) [2], se traduisant par une chute de la productivité, une diminution de la régénération naturelle et une augmentation des attaques parasitaires [3]. La diminution du processus de régénération naturelle aboutit généralement à une baisse significative de la densité du peuplement.
Les champignons ectomycorhiziens (EcMs), paramètre clé du fonctionnement biologique des écosystèmes forestiers, peuvent être fortement impactés. Ces champignons jouent un rôle indispensable dans le développement des essences ectotrophes tel que Quercus suber [4,5], et leur distribution dans le sol est généralement observée sous forme de mosaïque assujettie à la présence des espèces ectotrophes [6]. L’appauvrissement de l’abondance des propagules fongiques EcMs peut entraîner un ralentissement de la croissance des jeunes régénérations et leur fragilisation vis-à-vis de stress environnementaux. Cette richesse en propagules fongiques étant assujettie à la présence d’arbres adultes ectotrophes, toute modification de la structure du couvert forestier (ex. densité, vieillissement) a des répercussions majeures sur la structure des communautés de champignons EcMs, et par conséquent sur les services écosystémiques auxquels ces communautés contribuent [6]. Plusieurs études portant sur l’inventaire des champignons EcMs ont été réalisées dans les écosystèmes forestiers au Maroc [7–9]. Cependant, ces études ont été essentiellement basées sur la diversité des carpophores, reflétant une part infime de la diversité des champignons EcMs dans les sols forestiers. De plus, l’impact de la gestion des subéraies et donc du couvert forestier a été très peu pris en compte, alors que ses variations (âge et phénologie des arbres, densité de peuplement, coupe à blanc, invasion biologique, ouverture de la canopée, pâturage, urbanisation, feu) affectent fortement la dynamique et la structure des communautés de champignons EcMs [10–14].
La présente étude a pour objectif de caractériser l’impact du mode de gestion de la subéraie sur les communautés de champignons ectomycorhiziens (EcMs) associées au chêne-liège, par comparaison de deux sites :
- • un site exploité soumis à différentes pressions anthropiques (récolte du chêne-liège, coupe du bois, pâturage) ;
- • un site protégé non soumis à des pressions anthropiques.
Une des différences majeures observées au niveau du couvert forestier est la différence de densité du peuplement de chêne-liège, avec une faible densité au niveau du site exploité et une forte densité au niveau du site protégé. Cette étude a été réalisée dans la subéraie de la Maâmora, car elle constitue la subéraie marocaine la plus fortement impactée par les pressions anthropiques. L’analyse de la diversité des champignons EcMs par des approches morphologiques et moléculaires a été effectuée au cours de la période estivale et hivernale au niveau des racines de chênes-lièges.
2 Méthodes
2.1 Site d’étude et échantillonnage des champignons EcMs
La subéraie de la Maâmora, située au nord-ouest du Maroc, en bordure de l’océan Atlantique, a été sélectionnée comme site d’étude en raison de son importance écologique (sites d’intérêt biologique et écologique [15]). Cette subéraie appartient à l’étage thermo-méditerranéen, qui se caractérise par des étés chauds et secs et des hivers doux et humides. Les températures moyennes mensuelles sont de l’ordre de 12 °C (janvier) à 25 °C (juillet–août) [1]. Les précipitations annuelles moyennes sont de l’ordre de 500 mm. Les sols de cette subéraie sont acides, constitués dans leur quasi-totalité par une couche de sable en surface reposant sur une assise marno-argileuse imperméable du Tortonien. La richesse en matière organique des sols est très variable selon les localités et dépend principalement de la présence ou de l’absence du couvert forestier [1].
Au sein de cette subéraie, deux sites expérimentaux, distants de 21,6 km, ont été définis. Le site I (34°12′34″N, 6°35′57″W) est un site non protégé en cours d’exploitation (récolte du chêne-liège, coup du bois et pâturage) présentant une faible densité d’arbres, d’environ 50 individus adultes à l’hectare. Aucune régénération n’a pu être observée. Le site II (34°1′39″N, 6°32′49″W) correspond à un site clôturé et protégé (sans exploitation ou pâturage), avec une forte densité d’arbres, d’environ 290 individus à l’hectare.
Des échantillons de racines de chêne-liège (avec sol adhérant) ont été collectés sur chaque site pendant l’été (juillet 2010) et l’hiver suivant (janvier 2011). Au niveau de chaque site, une surface d’étude a été définie (30 m de longueur et 7,5 m de largeur, soit 225 m2), dans laquelle 10 échantillons racinaires de chêne-liège, distants l’un de l’autre de 7,5 m, ont été prélevés selon la méthode préconisée par Horton et Bruns [16], puis conservés à +4 °C jusqu’à leur traitement. Les échantillons ont ensuite été lavés soigneusement, puis observés sous la loupe binoculaire afin de réaliser une analyse morphologique des ectomycorhizes [17] et déterminer les types de morphotypes (MTs) et leur abondance (NMT/Ntotal ; N correspond au nombre d’apex EcMs). Le taux de mycorhization global par échantillon a été estimé selon Necto/Ntotal, avec Necto correspondant au nombre d’apex EcMs total et Ntotal au nombre d’apex mycorhizés et non mycorhizés. Au moins deux ectomycorhizes représentatives de chaque MT ont été séchés et conservés à −20 °C pour identification moléculaire ultérieure.
2.2 Extraction d’ADN, amplification et séquençage de l’ITS1 de champignons EcMs
Pour chaque représentant de MT, l’ADN total a été extrait à partir du kit Dneasy Plant Mini Kit (Qiagen, France). Plusieurs modifications ont été apportées au protocole proposé par le fournisseur, afin d’optimiser la qualité et le rendement d’extraction (ajout de 20–30 mg de polyvinylpolypyrrolidon (PVPP) lors du broyage, préchauffage du tampon AE à +65 °C).
Une étape d’amplification des espaceurs internes transcrits (ITS1 et ITS2) de l’ADN ribosomique (ADNr) a été effectuée en utilisant les amorces ITS1F et ITS4 [18] et le kit d’amplification MyTaq™ HS Red Mix (Bioline, France) en se référant aux recommandations du fournisseur. Les conditions d’amplifications ont été les suivantes : 94 °C (5 min), suivie de 35 cycles de 94 °C (30 s), 55 °C (30 s) et 72 °C (1 min), et 72 °C (7 min). Après purification des produits d’amplification par le kit Qiaquick PCR Purification kit (Qiagen, France) selon les recommandations du fournisseur, la région ITS1 a été séquencée dans les laboratoires du Centre national de la recherche scientifique et technique (CNRST) de Rabat, dans l’unité d’appui technique à la recherche scientifique (UATRS).
2.3 Analyse phylogénétique des séquences ITS1 de champignons EcMs
Les séquences obtenues ont été comparées aux séquences déposées dans la base de données UNITE (https://unite.ut.ee/) en utilisant l’option massBLASTer. Pour chaque séquence ITS1, la séquence de référence présentant le taux de similarité le plus élevé dans UNITE a été utilisée pour l’analyse phylogénétique. Cette dernière a été effectuée selon la procédure proposée dans phylogeny.fr (http://www.phylogeny.fr/) [19], option « One-Click mode », basée sur la méthode statistique de maximum de vraisemblance du programme PhyML.
2.4 Analyses statistiques
Afin de caractériser l’impact de la densité de peuplement et de la saison sur la communauté de champignons EcMs, la richesse (nombre de MTs), la diversité (indice de Shannon) et la structure de la communauté de champignons EcMs, ainsi que le taux de mycorhization ont été estimés. Les analyses statistiques ont été effectuées par ANOVA à deux facteurs suivie du test post-hoc Tukey HSD (seuil de confiance de 95 %), disponible dans le package stats du logiciel R (https://www.r-project.org/). Les données de taux de mycorhization ont été préalablement transformées par la fonction arcsin. L’abondance des champignons EcMs a été normalisée pour chaque morphotype par le nombre total d’apex EcM dans un échantillon donné, puis transformée par la fonction arcsin. À partir de la matrice d’abondance normalisée, l’indice de Bray–Curtis a été calculé afin d’estimer la dissimilarité entre les communautés de champignons EcMs. La significativité de la dissimilarité en fonction du mode de gestion et de la période de prélèvement a été évaluée par PerMANOVA (p < 0,05) en utilisant le package vegan [fonction adonis] disponible dans le logiciel R. La détermination de l’association de champignons EcMs avec un mode de gestion donné ou une période de prélèvement a été effectuée en utilisant le package indicpsecies [20] disponible dans le logiciel R. L’index IndVal.g a été sélectionné afin d’estimer la significativité de l’association entre un ou plusieurs taxa EcMs [fonction combinespecies] et les modes de gestion (exploité et protégé) ou les saisons (hiver et été) [fonction multipatt]. Cette procédure permet de déterminer des valeurs d’association plus robustes qu’en considérant les taxa EcMs séparément [21]. Deux types de probabilités ont été calculés, c.-à-d. A (spécificité) qui représente la probabilité pour un échantillon d’appartenir à un groupe (c.-à-d. exploité/protégé pour le mode de gestion ou hiver/été pour la saison), étant donné que le ou les taxa EcMs ont été détectés, et B (sensibilité), qui représente la probabilité de trouver le ou les taxa EcMs dans différents échantillons appartenant à un groupe donné.
3 Résultats
3.1 Structure des communautés de champignons EcMs
Un total de 7096 ectomycorhizes a été échantillonné. L’analyse morphologique des ectomycorhizes de chêne-liège au sein des deux sites d’études a révélé la présence de 11 morphotypes (MTs). L’amplification de la région ITS1 a été obtenue pour l’ensemble des représentants MTs, à l’exception du MT11. L’analyse phylogénétique des séquences ITS1 correspondantes a montré la présence de champignons EcMs appartenant aux Ascomycètes (6 MTs) et Basidiomycètes (4 MTs), affiliés à six ordres, c.-à-d. Russulales, Telephorales, Boletales, Heliotales, Pezizales et Hysteriales (Fig. 1). Le morphotype MT10, qui était très proche phylogénétiquement d’une séquence de référence appelée « Uncultured Pezizales » (numéro d’accession HF565061.1), correspond à un clade appartenant à l’ordre des Héliotales et non des Pezizales.

Analyse phylogénétique basée par la méthode de maximum de vraisemblance des séquences ITS1 provenant de morphotypes d’ectomycorhizes de chêne-liège dans la subéraie de la Maâmora. Pour chaque morphotype est indiquée (à droite) son abondance relative dans les sites d’études pour la période estivale et hivernale, c.-à-d. le site exploité densité en été (bleu), le site protégé en été (orange), le site exploité en hiver (gris), le site protégé en hiver (jaune).
La totalité des morphotypes a été détectée dans les deux sites, mais seulement cinq (MTs 1, 2, 5, 8 et 9) aux deux périodes d’échantillonnage (Fig. 1). Six morphotypes (MTs 3, 4, 6, 7, et 10) ont été détectés seulement en hiver (Fig. 1). Le MT11, qui n’a pu être identifié de manière moléculaire, a été détecté seulement en été dans la parcelle exploitée. Sur un total de 7096 ectomycorhizes échantillonnées, le MT2 affilié au genre Cenococcum représentait le MT prédominant, avec 45–73 % de la communauté fongique (Fig. 2).
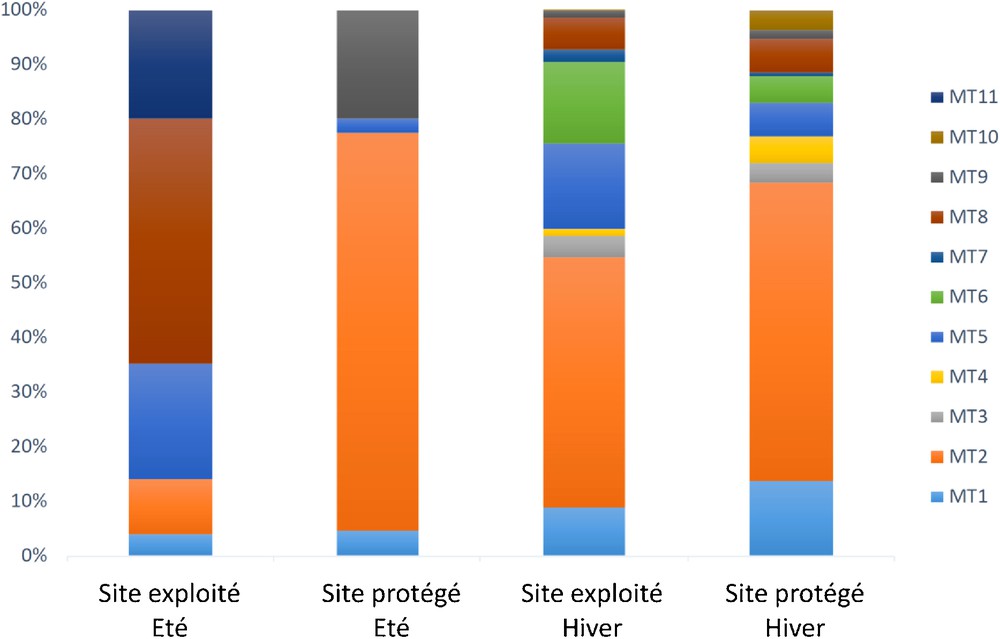
Fréquence des morphotypes EcMs associés au chêne-liège en fonction du mode de gestion (exploité ou protégé) et de la saison (été ou hiver).
3.2 Impact du mode de gestion et de la saison sur les communautés de champignons EcMs
La richesse et la diversité de la communauté de champignons EcMs, ainsi que le taux de mycorhization, ont été mesurés au niveau de l’ensemble des échantillons racinaires de chêne-liège. Un impact majeur de la période d’échantillonnage a été observé sur l’ensemble des paramètres mesurés, avec notamment des niveaux de richesse significativement plus forts en hiver en comparaison de l’été (Tableau 1). Un impact beaucoup plus restreint du mode de gestion, significativement dépendant de la période d’échantillonnage, a été mis en évidence sur les niveaux de richesse et les taux de mycorhization en hiver et en été, respectivement (Tableau 1).
Impact du mode de gestion et de la période d’échantillonnage sur la richesse, diversité et taux de mycorhization des communautés de champignons EcMs associées au chêne-liège.
| Nombre de MTs (Richesse)a | Shannon (diversité)b | Taux de mycorhization (%) | |
| Gestion | ns | ns | ns |
| Saison | *** | *** | * |
| Gestion × saison | ** | * | *** |
| Site exploité – été | 2,6 ± 1,4a,c | 0,65 ± 0,42a,c | 47,2 ± 19,7a |
| Site protégé – été | 1,7 ± 0,7a | 0,41 ± 0,40a | 26,1 ± 10,9b |
| Site exploité – hiver | 5,2 ± 2,5b | 0,98 ± 0,34b,c | 20,9 ± 8,8b |
| Site protégé – hiver | 7,4 ± 1,5c | 1,31 ± 0,25b | 34,4 ± 11,9a,b |
a Les statistiques ont été effectuées en utilisant le test ANOVA 2-facteurs. ***p < 0,001 ; **p < 0,01 ; *p < 0,05 ; ns p > 0,05. Le test post-hoc Tukey's HSD (seuil de confiance de 95 %) a été utilisé afin de comparer les différents sites. Les facteurs utilisés sont le mode de gestion (exploité ou protégé) et la saison d’échantillonnage (été et hiver). Les données dans une même colonne suivies d’une même lettre sont non significativement différentes selon le test Tukey HSD.
b L’indice de diversité Shannon a été estimé à partir des données d’abondance de chaque morphotype après normalisation (NMT/Ntotal). N correspond au nombre d’apex EcM.
c Les valeurs indiquent la moyenne ± écart-type de la moyenne.
De même que pour le taux de mycorhization, un impact significatif du mode de gestion sur la structure de la communauté EcMs a été seulement observé en été (Tableau 2). Une très faible fréquence de Cenococcum était observée dans le site exploité comparé au site protégé, à contrario de Tomentella (Fig. 2). Une association significative de plusieurs taxa EcMs ou combinaisons de taxa EcMs avec un mode de gestion ou la période d’échantillonnage a été obtenue (Tableau 3). Le plus grand nombre de taxa EcMs indicateurs (13) était associé à la période hivernale. Quatre taxa EcMs (Russula) ou combinaisons de taxa EcMs (Russula + Pachyphloeus, Russula + Cenococcum, Tomentella + Pachyphloeus, Russula + Tomentella) ont montré une forte spécificité (A > 0,8) et sensibilité (B > 0,7). La combinaison de taxa Russula + Pachyphloeus montrait la plus forte valeur d’association (IndVal.g = 0,894), Russula seul présentant une valeur d’association plus faible (IndVal.g = 0,860). Aucun taxa EcM n’a été significativement associé à la période estivale. Seulement huit taxa EcMs ou combinaisons de taxa EcMs étaient significativement associés à un mode de gestion, notamment Tomentella au site exploité, et Pachyphloeus, seul ou avec Cenococcum, au site protégé.
Impact du mode de gestion de la subéraie (site exploité ou protégé) et de la période d’échantillonnage (été ou hiver) sur la structure des communautés de champignons EcMs (MT) associées au chêne-liège.
| Saison | Facteurs | Df | SS | MS | F. Model | R 2 | p-value a |
| Hiver–été | Gestion | 1 | 1,3320 | 1,33197 | 10,4697 | 0,16628 | 0,001*** |
| Saison | 1 | 1,0789 | 1,07888 | 8,4803 | 0,13468 | 0,001*** | |
| Gestion × saison | 1 | 1,0196 | 1,01962 | 8,0145 | 0,12729 | 0,001*** | |
| Résidus | 36 | 4,5800 | 0,12722 | 0,57175 | |||
| Total | 39 | 8,0105 | 1,00000 | ||||
| Hiver | Gestion | 1 | 0,1559 | 0,15590 | 1,3195 | 0,0683 | 0,28ns |
| Résidus | 18 | 2,1267 | 0,11815 | 0,9317 | |||
| Total | 19 | 2,2826 | 1,00000 | ||||
| Été | Gestion | 2 | 2,1957 | 2,19569 | 16,11 | 0,47229 | 0,001*** |
| Residuals | 18 | 2,4533 | 0,13629 | 0,52771 | |||
| Total | 19 | 4,6490 | 1,00000 |
a Les statistiques ont été effectuées en utilisant le test PerMANOVA (p < 0,05). La dissimilarité entre les communautés de champignons EcMs a été mesurée en fonction de l’indice de Bray–Curtis calculé à partir de la matrice d’abondance des MTs. ***p < 0,001 ; **p < 0,01 ; *p < 0,05 ; ns p > 0,05.
Évaluation de la significativité d’association des champignons EcMs avec le mode de gestion ou la saison.
| Gestion/saison | Taxa EcMs indicateursa | A | B | IndVal.g | p-value b |
| Exploité | Tomentella | 0,8011 | 0,8500 | 0,825 | 0,002 ** |
| Tomentella + Scleroderma | 0,8395 | 0,5500 | 0,680 | 0,012* | |
| Protégé | Pachyphloeus | 0,8181 | 0,7500 | 0,783 | 0,049 * |
| Cenococcum + Pachyphloeus | 0,8109 | 0,7500 | 0,780 | 0,049 * | |
| Heliotales | 0,8705 | 0,3000 | 0,511 | 0,049* | |
| Heliotales + Cenococcum | 0,8705 | 0,3000 | 0,511 | 0,049* | |
| Russula + Heliotales | 0,8691 | 0,3000 | 0,511 | 0,049* | |
| Scleroderma + Heliotales | 0,9222 | 0,2500 | 0,480 | 0,049* | |
| Hiver | Russula + Pachyphloeus | 1,0000 | 0,8000 | 0,894 | 0,001 *** |
| Russula | 0,8209 | 0,9000 | 0,860 | 0,001 *** | |
| Rusula + Cenococcum | 0,8532 | 0,8500 | 0,852 | 0,001 *** | |
| Tomentella + Pachyphloeus | 1,0000 | 0,7000 | 0,837 | 0,001 *** | |
| Rusula + Tomentella | 0,8547 | 0,7000 | 0,774 | 0,001 *** | |
| Scleroderma + Pachyphloeus | 0,7886 | 0,6000 | 0,688 | 0,002** | |
| Russula + Scleroderma | 0,8188 | 0,5500 | 0,671 | 0,006** | |
| Heliotales | 1,0000 | 0,4000 | 0,632 | 0,002** | |
| Russula + Heliotales | 1,0000 | 0,4000 | 0,632 | 0,002** | |
| Heliotales + Cenococcum | 1,0000 | 0,4000 | 0,632 | 0,002** | |
| Heliotales + Pachyphloeus | 1,0000 | 0,4000 | 0,632 | 0,002** | |
| Tomentella + Heliotales | 1,0000 | 0,3500 | 0,592 | 0,007** | |
| Scleroderma + Heliotales | 1,0000 | 0,3000 | 0,548 | 0,013* |
a Les morphotypes (MTs) ont été regroupés par genre suite à l’assignation taxonomique détaillée sur la Fig. 1. Les taxa EcMs ou combinaisons de taxa EcMs présents dans au moins 70 % des échantillons d’un groupe donné (B > 0,7) sont indiqués en gras.
b Les statistiques ont été effectuées en utilisant la modèle IndVal.g (seuil de significativité à p < 0,05). Les valeurs de p-value correspondent à la significativité pour chaque espèce indicatrice d’une condition donnée ; ***p < 0,001 ; **p < 0,01 ; *p < 0,05 ; ns p > 0,05.
4 Discussion
L’effet simultané des pressions croissantes de l’homme sur les écosystèmes forestiers méditerranéens et l’aggravation des conditions climatiques ont entraîné un fort recul du couvert forestier, accentuant les phénomènes de désertification et de perte de biodiversité [22,23]. La limitation de leur impact est fortement liée à notre capacité à prédire les changements en termes de fonctionnement. L’obtention de bio-indicateurs robustes apparaît comme une des clés pour la mise en place de stratégies de conservation adaptées. Dans le cas particulier des subéraies, les partenaires EcMs constituent des modèles de choix en raison de leur importance pour la croissance et nutrition du chêne-liège [5]. Dans la présente étude, l’analyse de sites forestiers dans la subéraie de la Maâmora, protégés (sans exploitation du chêne-liège et de son couvert) ou non (récolte du chêne-liège, coupe du bois et pâturage), et caractérisés au niveau de leur couvert forestier par de fortes différences de densité de peuplement, a permis de mettre en évidence l’impact du mode de gestion de la subéraie en fonction de la saison sur la communauté de champignons EcMs.
La saison a été le paramètre environnemental affectant le plus fortement la communauté de champignons EcMs, confirmant de précédentes observations obtenues dans différents écosystèmes forestiers à base de chênes [24–27], avec notamment l’augmentation de la richesse en hiver comparée à l’été [25,26]. Néanmoins, l’effet de la saison sur les communautés de champignons EcMs est variable suivant les années et les taxa EcMs [24,25,27], limitant les comparaisons entre études, et soulignant la nécessité de mettre en place des suivis sur le long terme de parcelles forestières témoins [28].
L’impact du mode de gestion sur la communauté de champignons EcMs était fortement dépendant de la saison, notamment sur la structure de la communauté EcMs et sur le taux de mycorhization des chênes-lièges en été. Ces résultats renforcent l’hypothèse de l’action d’une communauté de champignons EcMs spécifique adaptée à des conditions hydriques défavorables en réponse à des perturbations [10,12,26], et soulignent l’importance d’un suivi de la communauté de champignons EcMs pendant des épisodes de sécheresse afin de mieux prédire les impacts des changements globaux [10,22,27].
La recherche de champignons EcMs indicateurs d’une perturbation est un enjeu majeur pour améliorer la durabilité des subéraies méditerranéennes face aux changements globaux. La pertinence du ratio Ascomycètes/Basidiomycètes comme bio-indicateurs pour suivre l’impact de pratiques culturales sur la communauté fongique totale du sol a ainsi été évaluée [29]. Cependant, la réponse des communautés de champignons EcMs à des perturbations montre de grandes variabilités suivant les taxa [24,27,30], limitant la pertinence des indicateurs fongiques globaux. Dans la présente étude, quatre champignons EcMs (Cenococcum, Pachyphloeus, Tomentella, Russula) présentant des types d’exploration relativement peu développés (court ou par contact) [31], ont été significativement associés, seuls ou en combinaisons, à un mode de gestion et/ou à une saison. Les champignons EcMs affiliés à Scleroderma et présentant un type d’exploration très développé ont, quant à eux, montré une faible association avec le mode de gestion ou la saison. Les champignons EcMs caractérisés par des types d’exploration peu développés ont été principalement associés à des forêts présentant des densités racinaires élevées [32].
Cenococcum est un des champignons EcMs les plus abondants parmi la communauté de champignons EcMs associée au chêne-liège, corroborant de précédentes observations dans les chênaies méditerranéennes [10,33–35]. Son statut de généraliste dans le fonctionnement biologique des écosystèmes est souvent discuté en raison de son ubiquité [36], mais aucun signal écologique robuste n’a été mis en évidence dans les subéraies [10,24]. Dans la présente étude, Cenococcum seul n’a pu être associé à un mode de gestion ou à une saison, mais sa coprésence avec d’autres champignons EcMs (Pachyploeus ou Russula) apparaît comme indicatrice d’un site non perturbé présentant une forte densité d’arbres, ainsi que de la période hivernale. Ce résultat peut paraître surprenant, puisque Cenococcum a généralement été étudié en raison de ses propriétés de résistance à la chaleur et à la sécheresse, et de son rôle significatif dans la résistance des plantes aux contraintes hydriques [37,38]. Ce paradoxe pourrait être dû à la forte diversité intraspécifique et donc potentiellement fonctionnelle de Cenococcum [39–41], conduisant à un signal écologique complexe de Cenococcum dépendant de la diversité des individus au sein de la communauté de champignons EcMs. A contrario, deux types de champignons EcMs, Tomentella et Pachyphloeus, étaient significativement associés au mode de gestion. Le genre Pachyphloeus, appartenant aux Pezizales, est très peu documenté dans la littérature. Ce champignon hypogé est retrouvé dans les chênaies, mais est rarement détecté sur les racines [42]. Les Pezizales hypogés sont décrits comme prédominants parmi la composante fongique résistante du sol (spores et propagules) au sein des forêts matures [43], corroborant sa prédominance dans le site non perturbé. Le genre Tomentella (Thelephoraceae) est le genre le plus abondant dans les parcelles d’étude après Cenococcum. La prédominance des Tomentella a été mise en évidence dans différentes subéraies [10,34], avec de forte fluctuation géographique au sein de subéraies, mais aucun signal écologique spécifique n’avait été mis en évidence [10].
Les variations saisonnières sont le facteur ayant impacté le plus largement la communauté de champignons EcMs, notamment Russula. Le potentiel rôle de Russula dans les subéraies avait été suggéré au regard du syndrome du déclin, entraînant entre autres une augmentation de la mortalité des chênes et une diminution de leur aire de distribution [24,44], mais ses variations en fonction des saisons, et donc des fluctuations de ressources en eau, n’étaient pas très significatives [25]. Son importance pour la résistance des chênes à des conditions de sécheresse avait été abordée [10], mais cette dernière étude n’était basée que sur la forte abondance de Russula pendant la période estivale, sans comparaison avec la période hivernale. Tomentella présentait quant à lui un lien plus évident avec les variations saisonnières et sa prédominance en hiver [25]. Dans la présente étude, le statut de Tomentella au regard de la saison n’était significatif que quand il était associé avec Russula.
5 Conclusion
Ces travaux confirment les impacts du mode de gestion sur la composante ectomycorhizienne associée au chêne-liège et leur potentielle accentuation selon les conditions climatiques (saison). La saison estivale apparaît comme la période la plus critique en termes de changements de la communauté de champignons EcMs en réponse à une forte perturbation du couvert forestier (site exploité versus site protégé, faible densité de peuplement vs forte densité). Cette étude a aussi permis de préciser notre perception du rôle écologique de champignons EcMs prédominants dans les subéraies (Cenococcum, Tomentella et Russula) ainsi que la mise en lumière de groupes sous-estimés (Pachyphloeus). Leur potentiel statut de bio-indicateurs d’une perturbation environnementale renforce la pertinence d’intégrer la diversité ectomycorhizienne dans le développement de modèles écologiques prédictifs afin de mieux évaluer et répondre à l’impact des changements globaux sur les subéraies méditerranéennes.


