Abridged English version
Gray mould is a fungal disease caused by Botrytis cinerea, which is a parasitic fungus of many higher plants. This fungus has the distinction of being able to address various plants as soon as weather conditions are favourable. It is able to grow both in saprophyte on plant debris, that parasite at the expense of a living plant. The damages caused by this fungus are economically important, as it destroys each year a portion of strawberries, cucumbers, and tomato crops. In Morocco, this disease is listed among the most dreaded diseases of tomato in the greenhouse. Besides, grey mould is present in 96% of Moroccan exploitations.
Botrytis cinerea is mainly controlled by fungicides. However, the use of chemicals is not without consequences on the environment and human health; in addition, it promotes the emergence of resistant pathogenic strains. Therefore, alternatives have become increasingly planned against this pathogen. These alternatives are generally biopesticides or biocontrol agents, which can be defined as pesticides whose active ingredient is a living organism or one of its derivatives. They can also be substances of natural origin such as plant extracts, pheromones, etc. Thus, the crude extracts of the plants start to have a lot of interest as potential sources of natural bioactive molecules. They showed antifungal activity against a wide spectrum of pathogenic fungi. In this context, the objective of this work is to test in vitro and in vivo the effect of aqueous extracts of four medicinal and aromatic plants (Cymbopogon citratus, Lavandula officinalis, Thymus vulgaris and Melissa officinalis) against tomato grey mould, and also to analyse their chemical composition.
In vitro aqueous extracts were tested for their inhibitory effect on the three life stages of B. cinerea: spore germination, mycelial growth, and sporulation.
These aqueous extracts were tested in vivo for their antifungal potency for the plant and the fruit of the tomato.
Our in vitro results show that all studied aqueous extracts inhibited the three stages of development of B. cinerea, but to different degrees and are dose dependent. On spore germination, the aqueous extract of Lavandula officinalis was the most effective in inhibiting 79.65% ± 2.17 of spore germination at a concentration of 1 mg/mL. As for the effect on mycelial growth and sporulation of Botrytis cinerea, the aqueous extract of Cymbopogon citratus, Thymus vulgaris have proven most effective, while the aqueous extract of Melissa officinalis has proved less effective, in particular on mycelial growth and sporulation of Botrytis cinerea. Generally, comparing the effect of the aqueous extracts studied on the three life stages of Botrytis cinerea, it is noted that they all exert a significant inhibitory effect, especially on spore germination and sporulation, which reaches for some aqueous extracts 98.99 ± 1% and 85.99 ± 1.52%, respectively, rather than on the growth or percent inhibition of all the studied aqueous extracts, which does not exceed 50%. These results are encouraging because some studies have shown that epidemics caused by Botrytis cinerea are initiated largely by conidia produced locally within the culture, which allows the fungus to infect the different parts of the plant including the fruits.
As for in vivo tests on the plant, the aqueous extract of Thymus vulgaris and Cymbopogon citratus gave high inhibitory effects that are similar statistically, while the extracts of Lavandula officinalis and Melissa officinalis have no inhibitory effect on Botrytis cinerea. On the fruit, the Cymbopogon citratus aqueous extract shows a high inhibitory power on Botrytis cinerea, relative to the aqueous extract of Thymus vulgaris and Lavandula officinalis; the Melissa officinalis extract still remains without marked inhibitory effect.
By analysing the chemical composition of the aqueous extracts studied, it appears that all the studied aqueous extracts contain gallic tannins with a higher concentration in aqueous extracts of Thymus vulgaris and Melissa officinalis. About saponins, all the studied aqueous extracts contain these metabolites, except the aqueous extracts of Melissa officinalis. The presence of saponins in a more concentrated way is noticed in aqueous extracts of Thymus vulgaris and Lavandula officinalis. The assay of total polyphenols shows that there is a significant difference between the content of total phenols in the aqueous extract of Melissa officinalis (0.78 ± 0.09 mg/g) compared with other aqueous extracts. As for the flavonoids, they represent 97.9% of total phenols in aqueous extracts of Cymbopogon citratus, while flavonoids rates in other aqueous extracts studied do not exceed 25%. In the light of the results obtained and as a result of their antifungal effects demonstrated in vivo against B. cinerea, it appears that aqueous extracts of Cymbopogon citratus and Thymus vulgaris are the most effective and feasible for biological control against grey mould.
In conclusion, it appears that the use of aqueous extracts of plants in the fight against B. cinerea is promising given their effectiveness and environmental safety. The aqueous extracts are also cheaper and cost-effective compared with essential oils that contain volatile substances, therefore, having a temporary effect.
1 Introduction
La pourriture grise est une maladie causée par Botrytis cinerea, un champignon parasite de très nombreux végétaux supérieurs [1]. Ce champignon a la particularité d’être polyphage et ainsi de s’attaquer à diverses plantes dès que les conditions climatiques lui sont favorables [2]. Il est capable de se développer aussi bien en saprophyte, sur des débris végétaux, qu’en parasite, aux dépends d’une plante vivante. La pourriture grise due à ce champignon est économiquement importante, car elle détruit chaque année une partie des récoltes viticoles et horticoles (fraises, concombres, tomates…). Au Maroc, la pourriture grise est répertoriée parmi les maladies les plus redoutables en culture de tomate sous serre. D’ailleurs la pourriture grise est présente dans 96 % des exploitations marocaines [3]. Botrytis cinerea est contrôlée essentiellement par des fongicides. Cependant le recours aux produits chimiques n’est pas sans conséquences sur l’environnement et la santé de l’homme, en outre, il favorise l’apparition de souches pathogènes résistantes [4]. Par conséquent, d’autres alternatives sont de plus en plus envisagées pour lutter contre ce pathogène. Ces alternatives sont généralement des biopesticides ou des agents de lutte biologique, qui peuvent être définis comme des produits phytosanitaires dont le principe actif est un organisme vivant ou l’un de ses dérivés. Ils peuvent aussi être des substances d’origine naturelle telles que des extraits végétaux, phéromones, etc. [5]. Ainsi, les extraits bruts des plantes commencent à avoir beaucoup d’intérêt comme source potentielle de molécules naturelles bioactives. Ils ont montré une activité antifongique contre un large spectre des champignons pathogènes [6,7].
Dans ce cadre, l’objectif de ce travail consiste à tester in vitro et in vivo l’effet des extraits aqueux de quatre plantes médicinales et aromatiques contre la pourriture grise de la tomate, et aussi à analyser leur composition chimique.
2 Matériel et méthodes
2.1 Matériel biologique
2.1.1 Agent pathogène
Des plants de tomate infectés par la pourriture grise ont été collectés de la région de Chichaoua (Marrakech). Neuf isolats de l’agent pathogène B. cinerea ont été isolés des différentes parties de la plante. Ils ont été purifiés et identifiés, puis testés pour leur pouvoir pathogène. Parmi les neufs isolats, l’isolat Bt1 s’est avéré le plus pathogène, et a par conséquent retenu pour l’expérimentation.
2.1.2 Plantes médicinales et aromatiques
Quatre plantes médicinales et aromatiques (Thymus vulgaris, Melissa officinalis, Lavandula officinalis, Cymbopogon citratus) ont été collectées dans la pépinière de la faculté des sciences et techniques de Tanger, puis identifiées par le professeur M. Bakkali selon le catalogue des plantes vasculaires et les manuels de détermination de ces dernières [8].
2.1.3 Plants de tomate
La variété Campbell 33 a été choisie pour l’expérimentation. Les pépinières de tomate ont été réalisées dans le sable stérile, selon la méthode décrite par Mouria et al. [9]. Les plantes obtenues sont arrosées régulièrement et maintenues dans une chambre de culture sous des conditions déterminées et contrôlées (21 °C, photopériode de 16 h), pour servir à l’expérimentation.
2.2 Préparation des extraits aqueux
Les plantes médicinales ont été séchées à l’abri de la lumière, puis broyées pour préparer des infusions en portant à ébullition, pendant 15 min, 16 g de la poudre de chaque plant dans 100 mL d’eau distillée. L’extrait obtenu a été filtré, puis centrifugé pour éliminer les débris des plantes. Le surnageant a été récupéré et filtré sous vide, puis conservé à l’obscurité à 4 °C.
2.3 Effet antifongique, des extraits aqueux, in vitro
L’activité antifongique des extraits aqueux a été étudiée, selon la méthode de contact direct, sur la germination des spores, la croissance mycélienne et la sporulation.
2.3.1 Effet des extraits aqueux sur la germination des spores
Les extraits aqueux sont ajoutés au milieu gélosé en surfusion (45 °C), à des concentrations de 1, 2, 4, 8 mg/mL. Après sa solidification, 10 μL d’une suspension de spores (104 spores/mL d’eau distillée stérile) sont étalés aseptiquement à la surface de ce milieu. Après 48 h d’incubation à 21 ± 2 °C et à l’obscurité, le comptage des spores germées est effectué sous microscope, sur un total de 100 spores.
2.3.2 Effet des extraits aqueux sur la croissance mycélienne et la sporulation
Des quantités appropriées de chaque extrait aqueux sont ajoutées au milieu de culture stérile encore liquide pour obtenir des concentrations finales de 1, 2, 4 et 8 mg/mL. Après solidification, un explant mycélien de B. cinerea âgé de 14 j est déposé au centre de chaque boîte. La croissance mycélienne est évaluée après cinq jours d’incubation à 23 ± 2 °C par mesure du diamètre moyen du thalle.
Tous les thalles ayant servi pour évaluer la croissance mycélienne et ayant été incubés pendant 14 jours ont été utilisés pour l’évaluation de l’intensité de la sporulation. Dix disques de 5 mm de diamètre ont été prélevés de la bordure d’un même thalle, écrasés et agités dans 1 mL d’eau distillée stérile. L’intensité de la sporulation est évaluée par comptage des spores à l’aide d’une cellule de Malassez.
2.3.3 Évaluation de l’activité inhibitrice
Dans chaque test l’indice antifongique (IAF) de chaque extrait est déterminé par la formule suivante :
IAF (%) = [(X–Xi)/X] × 100
Avec X l’estimation de la germination, de la croissance ou de la sporulation en absence des extraits aqueux et Xi l’estimation de la germination, de la croissance ou de la sporulation en présence des extraits aqueux.
2.4 Efficacité des extraits aqueux sur Botrytis cinerea, in vivo
2.4.1 Essai sur les plantes
Des plantules de tomate âgées de 30 j ont été traitées par pulvérisation de 1 mL d’extrait aqueux sur les feuilles. Après 24 h, un explant mycélien de 2 mm de diamètre a été déposé sur l’une des jeunes feuilles de chaque plante. Les plantules ont été ensuite placées dans une chambre de culture à 23 ± 2 °C. Une humidité élevée a été assurée par la couverture des feuilles traitées et inoculées par des housses en plastique. Après 15 j, l’efficacité des extraits aqueux des plantes médicinales est évaluée par la mesure du diamètre moyen de la pourriture au niveau des feuilles.
2.4.2 Essai sur le fruit
Des fruits de tomate, de la variété Campbell 33, uniformes et sains, ont été stérilisés par l’éthanol à 70°, puis rincés avec de l’eau distillée stérile et séchés avec du papier filtre stérile. Des blessures de 3 mm de profondeur ont été réalisées avec des aiguilles de 2 mm de diamètre en trois points différentes de la zone équatoriale. Une goutte de 20 μL de chaque extrait est placée dans les blessures. Après 2 h, un explant mycélien de 2 mm de diamètre a également été déposé dans celles-ci. Les fruits sont ensuite placés à l’obscurité dans des conditions d’humidité élevée en les couvrant par des housses en plastique. Après une période de 7 j d’incubation dans une chambre de culture à 21 ± 2 °C, le diamètre moyen de la pourriture a été mesuré.
2.5 Tests phytochimiques
Les extraits aqueux étudiés ont été soumis à des analyses qualitatives et quantitatives de certains métabolites secondaires, celles-ci étant basées sur des réactions de coloration et/ou de précipitation.
2.5.1 Analyses qualitatives
2.5.1.1 Recherche des tanins
Les tanins ont été mis en évidence en mélangeant 1 mL de l’extrait avec quelques gouttes de FeCl3 (1 %, préparé au méthanol). Après agitation de l’extrait, la couleur vire au bleu noir en présence des tanins galliques et au brun verdâtre en présence des tanins catéchiques [10].
2.5.1.2 Recherche des saponines
Les saponines ont été mises en évidence en agitant 10 mL d’extrait placé dans un tube à essais pendant 15 s. Après 15 min de repos, la hauteur de la mousse persistante, supérieure à 1 cm indique la présence de saponines [11].
2.5.2 Analyses quantitatives
2.5.2.1 Dosage des phénols totaux
La teneur en phénols totaux des extraits aqueux étudiés a été déterminée par la méthode de Folin–Ciocalteu [12]. Un volume de 200 μL d’extrait aqueux a été mélangé avec 1 mL du réactif de Folin–Ciocalteu récemment préparé (dilué 10 fois) et 0,8 mL de Na2CO3 à 7,5 %. L’ensemble a été incubé à température ambiante pendant 30 min et la lecture a été effectuée à 765 nm à l’aide d’un spectrophotomètre. Les résultats sont exprimés en milligrammes équivalent d’acide gallique par gramme de matière végétale sèche.
2.5.2.2 Dosage des flavonoïdes
La teneur en flavonoïdes des extraits aqueux a été déterminée en utilisant la méthode colorimétrique au trichlorure d’aluminium [13]. Un volume de 100 μL de l’extrait aqueux a été mélangé avec 0,4 mL d’eau distillée, puis avec 0,03 mL d’une solution de nitrite de sodium NaNO2 à 5 %. Après 5 min, 0,02 mL d’une solution d’AlCl3 à 10 % a été ajouté. Après 5 min, 0,2 mL d’une solution de Na2CO3 1 M et 0,25 mL d’eau distillée ont été ajouté au mélange. L’ensemble a été agité à l’aide d’un vortex et l’absorbance a été mesurée à 510 nm. Les résultats sont exprimés en milligrammes équivalents de catéchine par gramme de matière végétale sèche.
2.6 Analyse statistique
Toutes les expériences réalisées ont été répétées deux fois avec trois répétitions pour les tests in vitro et sept répétitions pour les tests in vivo. Les résultats obtenus ont subi une analyse de la variance (Anova) selon le test Post-hoc de Tukey (p = 0,05) en utilisant le programme de statistique STATISTICA 8 (version 5,1 Edition 2008, STATSOFT).
3 Résultats
3.1 Effet in vitro, des extraits aqueux des plantes aromatiques et médicinales
Tous les extraits aqueux étudiés ont inhibé les trois stades de développement de B. cinerea, mais à des degrés différents et les effets sont dépendants de la dose (Fig. 1). En ce qui concerne la germination des spores, l’extrait aqueux de Lavandula officinalis s’est montré le plus efficace, avec une inhibition de 79,65 % ± 2,17 à la concentration de 1 mg/mL. Quant à l’effet sur la croissance mycélienne et la sporulation de Botrytis cinerea, les extrait aqueux de Cymbopogon citratus et de Thymus vulgaris se sont révélés les plus efficaces, tandis que l’extrait aqueux de Melissa officinalis s’est révélé moins efficace. D’une manière générale, en comparant l’effet des extraits aqueux étudiés sur les trois stades de vie de Botrytis cinerea, on remarque que les effets inhibiteurs les plus importants concernant la germination et la sporulation, atteignent pour certains extraits aqueux, soit 98,99 ± 1 % et 85,99 ± 1,52 % respectivement. En revanche, sur la croissance, le pourcentage d’inhibition de tous les extraits aqueux étudiés ne dépasse pas 50 %.
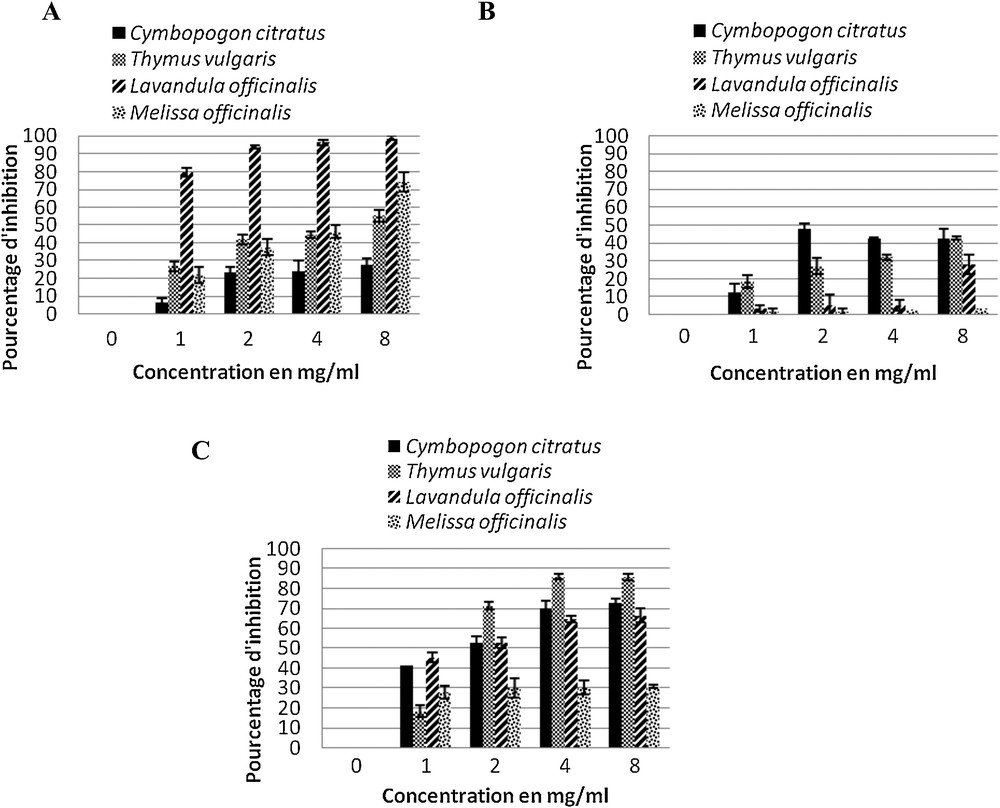
Effet antifongique des extraits aqueux sur la germination (A), la croissance mycélienne (B) et la sporulation (C). Les tests ont été réalisés à raison de six répétitions avec une analyse de la variance (Anova) selon le test post-hoc de Tukey (p = 0,05).
3.2 Effet in vivo des extraits aqueux des plantes aromatiques et médicinales
Les résultats de l’effet antifongique des quatre extraits aqueux sont reportés dans le Tableau 1. Sur la plante, au niveau des feuilles, les extraits aqueux de Thymus vulgaris et de Cymbopogon citratus se sont révélés avoir des effets inhibiteurs élevés et statistiquement similaires. En revanche, les extraits aqueux de Lavandula officinalis et de Melissa officinalis n’ont pratiquement pas d’effet inhibiteur sur Botrytis, puisqu’il n’y a pas de différences significatives avec le témoin positif.
Activité antifongique des quatre extraits aqueux contre B. cinerea, in vivo.
| Extraits aqueux | Diamètre moyen de la pourriture sur la feuille (en cm) | Diamètre moyen de la pourriture du fruit (en cm) | Diamètre moyen de la zone sporulée sur le fruit (en cm) |
| Cymbopogon citratus | 0,87 ± 0,49 (a) | 1,75 ± 0,44 (b) | 0,35 ± 0,11 (ab) |
| Thymus vulgaris | 0,42 ± 0,66 (a) | 3,12 ± 0,39 (c) | 0 ± 0 (a) |
| Lavandula officinalis | 2,67 ± 0,39 (b) | 2,87 ± 0,32 (c) | 1,17 ± 0,19 (b) |
| Melissa officinalis | 3,2 ± 0,39 (b) | 4,22 ± 0,23 (d) | 2,21 ± 0,85 (c) |
| Témoin B. c | 3,17 ± 0,75 (b) | 5,87 ± 0,86 (e) | 2,75 ± 0,62 (c) |
| Témoin négatif | 0 ± 0 (a) | 0 ± 0 (a) | 0 ± 0 (a) |
Sur le fruit, l’extrait aqueux de Cymbopogon citratus montre un pouvoir inhibiteur élevé sur le développement de la pourriture, suivi par l’extrait aqueux de Lavandula officinalis, puis par celui de Thymus vulgaris, tandis que ce dernier inhibe totalement la sporulation de Botrytis cinerea (Fig. 2E). L’extrait aqueux de Melissa officinalis demeure sans effet inhibiteur marqué.

Effet des extraits aqueux sur la croissance et la sporulation de Botrytis cinerea sur les fruits de tomate. A. Témoin (Botrytis cinerea). B. Témoin négatif. C. Fruit traité par l’extrait aqueux de Lavandula officinalis. D. Fruit traité par l’extrait aqueux de Cymbopogon citratus. E. Fruit traité par l’extrait aqueux de Thymus vulgaris, fruit pourri totalement en absence des touffes grises des conidiophores. F. Fruit traité par l’extrait aqueux de Melissa officinalis, fruit pourri avec des touffes de conidiophore abondantes. G. Observation microscopique des touffes de conidiophores prélevées sur le fruit traité par l’extrait aqueux de Melissa officinalis (G × 400, liquide de montage : bleu coton).
L’inhibition de la sporulation de Botrytis cinerea sur le fruit par l’extrait aqueux de Thymus vulgaris confirme les résultats obtenus sur la sporulation in vitro où l’effet inhibiteur de l’extrait aqueux de Thymus vulgaris atteint 85,83 % ± 1,73 (Fig. 1C).
3.3 Tests phytochimiques
Le Tableau 2 indique que tous les extraits aqueux étudiés contiennent des tanins galliques, avec une concentration plus élevée dans les extraits de Thymus vulgaris et de Melissa officinalis. Concernant les saponines, tous les extraits aqueux étudiés contiennent ces métabolites, à l’exception de ceux de Melissa officinalis. La présence des saponines, d’une façon plus concentrée, est remarquée dans les extraits aqueux de Thymus vulgaris et de Lavandula officinalis (Tableau 2).
Teneur en tanins et saponines.
| Extrait aqueux | Tanins | Saponines | |
| Tanins galliques | Tanins catéchiques | ||
| Cymbopogon citratus | + | − | + |
| Thymus vulgaris | ++ | − | ++ |
| Lavandula officinalis. | + | − | ++ |
| Melissa officinalis | ++ | − | − |
Le dosage des polyphénols totaux (Tableau 3) montre qu’il y a une différence significative entre la teneur en phénols totaux dans l’extrait aqueux de Melissa officinalis, (0,78 ± 0,09 mg/g) par rapport aux autres extraits aqueux. Quant aux flavonoïdes, ils représentent 97,9 % des phénols totaux dans les extraits aqueux de Cymbopogon citratus, tandis que les taux de flavonoïdes dans les autres extraits aqueux étudiés ne dépassent pas 25 %.
Teneur en polyphénols totaux et flavonoïdes.
| Extrait aqueux | Teneurs en flavonoïdes (mg d’équivalents de catéchine/mL) ® | Teneurs en phénols totaux (mg d’équivalents d’acide gallique/mL) © | (®/©) × 100 |
| Cymbopogon citratus | 0,046 ± 0,006 (a) | 0,047 ± 0,005 (a) | 97,9 % |
| Thymus vulgaris | 0,002 ± 0,001 (b) | 0,008 ± 0,002 (a) | 25 % |
| Lavandula officinalis | 0,06 ± 0,02 (b) | 0,41 ± 0,064 (b) | 14,63 % |
| Melissa officinalis | 0,11 ± 0,01 (c) | 0,78 ± 0,09 (c) | 14,10 % |
4 Discussion et conclusion
À la lumière des résultats obtenus in vitro, les quatre extraits aqueux étudiés (Lavandula officinalis, Thymus vulgaris, Cymbopogon citratus et Melissa officinalis) exercent un effet antifongique, dose dépendant et différent d’un extrait aqueux à l’autre sur les trois stades du développement de B. cinerea, à savoir la germination des spores, la croissance mycélienne et la sporulation. L’inhibition de la croissance du pathogène par les extraits aqueux est due au fait que ces extraits possèdent des composés organiques naturels ayant des activités antifongiques. Cette action est attribuée à des métabolites secondaires tels que les polyphénols et les triterpénoïdes [14]. La différence de l’activité antifongique entre les extraits aqueux étudiés devait être liée à la différence de la composition chimique entre chaque extrait aqueux.
D’après les résultats obtenus, il s’avère que les extraits aqueux de Lavandula officinalis et de Melissa officinalis sont les plus efficaces sur la germination des spores, tandis que les extraits aqueux de Thymus vulgaris et Cymbopogon citratus sont les plus efficaces sur la croissance mycélienne et la sporulation. Ainsi, en minimisant l’intensité de la sporulation, qui prend une part importante dans la dissémination du champignon, les extraits aqueux de Thymus vulgaris, Cymbopogon citratus et Lavandula officinalis possèdent tous une activité antifongique puissante contre Botrytis cinerea par rapport à l’extrait aqueux de Melissa officinalis, puisqu’ils ont tous montré un pourcentage d’inhibition de la sporulation supérieur à 60 % à une concentration de 8 mg/mL, alors que celui de l’extrait aqueux de Melissa officinalis ne dépasse pas 30 %. En se référant aux résultats des tests phytochimiques, on remarque que les extraits aqueux de Thymus vulgaris, Cymbopogon citratus et Lavandula officinalis contiennent des saponines, mais que celles-ci sont absentes dans l’extrait aqueux de Melissa officinalis. Ces saponines sont généralement composées des terpénoïdes, composants principaux des huiles essentielles. D’ailleurs, dans la littérature, les huiles essentielles les plus étudiées pour leurs propriétés antifongiques proviennent de la famille des Labiatae, comme le thym, la lavande, etc. [15], ce que confirment les résultats obtenus in vitro dans cette étude. Les saponines sont connues pour leur pouvoir d’interaction avec les stérols, les protéines et les phospholipides des membranes cellulaires des champignons [16], provoquant ainsi une perte de l’intégrité structurale de la membrane cellulaire et une augmentation de la perméabilité ionique [17].
L’efficacité inhibitrice de l’extrait aqueux de Lavandula officinalis et de Melissa, qui a été observée in vitro, a diminué considérablement in vivo chez Lavandula officinalis et a même disparu chez Melissa officinalis.
Ce sont les extraits aqueux de Cymbopogon citratus et de Thymus vulgaris qui se sont montrés les plus efficaces contre B. cinerea in vivo, probablement, grâce à leur teneur en saponines mises en évidence par les tests phytochimiques, en plus d’autres métabolites éventuellement présents dans ces deux extraits aqueux, notamment les terpènes qui sont les composants majeurs des huiles essentielles et qui peuvent être retrouvés à faibles doses dans les extraits aqueux. Cela est prouvé par Gopinath et al. [18], qui ont mis en évidence l’existence des terpénoïdes dans l’extrait aqueux de Cymbopogon citratus. Le pouvoir antifongique des terpénoïdes est démontré. Leur mécanisme n’est pas bien connu, mais il a été suggéré qu’ils pourraient induire une destruction de la membrane du microorganisme par une action lipophilique [19], causant ainsi une perte du contrôle de la pression osmotique [20,21]. Dans ce sens, Reddy et al. [22] ont démontré le potentiel antifongique élevé de l’huile essentielle de Thymus vulgaris comme agent protecteur de Fragaria ananassa contre la pourriture causée par Botrytis cinerea et Rhizopus stolonifer. De leur côté, Onawumi et al. [23], Chaumont et al. [24] et Koba et al. [25] ont démontré l’action antifongique des huiles essentielles de Cymbopogon citratus. Vu que les terpènes sont les constituants majeurs des huiles essentielles, ces résultats confirment la suggestion que l’activité antifongique des extraits aqueux de Cymbopogon citratus et de Thymus vulgaris est due à leur teneur en certaines molécules terpénoïques.
L’activité antifongique des extraits aqueux étudiés est attribuée également à leur teneur en polyphénols. Bien que ces molécules soient connues par leur pouvoir antioxydant, plusieurs études ont démontré leur activité antifongique [26]. Leur mécanisme de toxicité vis-à-vis des champignons est basé sur l’inactivation des enzymes fongiques qui contiennent un groupement thiol dans leur site actif [19,27,28]. Parmi les polyphénols, on trouve de nombreux flavonoïdes possédant une activité antifongique [29]. Quelle que soit la classe de flavonoïdes considérée, il apparaît que le caractère lipophile de ces composés augmente l’activité, permettant aux molécules de pénétrer plus facilement à travers la membrane fongique [29,30]. Il est évident que les polyphénols sont polaires et solubles dans l’eau, et par conséquent présents dans les extraits aqueux. D’ailleurs, les tests phytochimiques ont mis en évidence des polyphénols dans tous les extraits aqueux étudiés. Si on compare les teneurs en polyphénols, on remarque que l’extrait aqueux de Melissa officinalis, qui s’est montré le moins efficace contre B. cinerea aussi bien in vitro qu’in vivo, révèle une forte teneur en polyphénols et en flavonoïdes, alors que ceux de Cymbopogon citratus et Thymus vulgaris, les plus efficaces contre B. cinerea in vitro et in vivo, n’en contiennent qu’une faible quantité. On déduit que les polyphénols peuvent agir qualitativement plus que quantitativement. Ainsi, l’extrait aqueux de Thymus vulgaris, bien qu’ayant une faible teneur en polyphénol et en flavonoïdes, est efficace. On pourrait attribuer cette activité à la nature de ses polyphénols, en fait le thymol, la substance majeure présente chez Thymus vulgaris [31]. D’autres travaux ont souligné l’efficacité antifongique des phénols terpéniques, et plus particulièrement celle du thymol et/ou du carvacrol [32–37]. Ces terpènes phénoliques agissent aussi en se fixant sur les groupes amine et hydroxylamine des protéines membranaires microbiennes, provoquant l’altération de la perméabilité et la fuite des constituants intracellulaires [38–41]. Cela explique la forte activité antifongique de l’extrait aqueux de Thymus vulgaris, malgré sa faible teneur en polyphénols par rapport aux autres extraits aqueux étudiés. Cependant, l’efficacité optimale d’un extrait peut ne pas être due seulement à un constituant actif principal, mais à l’action combinée (synergie) de différents composés contenus dans cet extrait [42]. À la lumière de ces investigations réalisées et au vu des effets antifongiques démontrés in vivo contre B. cinerea, il s’avère que les extraits aqueux de Cymbopogon citratus et de Thymus vulgaris sont les plus efficaces et les plus envisageables pour la lutte biologique contre la pourriture grise, notamment l’extrait aqueux de Thymus vulgaris qui, en inhibant la sporulation sur le fruit, peut limiter la dissémination de la pathologie dans les champs.
En conclusion, il s’avère que l’emploi des extraits aqueux des plantes dans la lutte contre B. cinerea est prometteur compte tenu de leur efficacité et de leur innocuité vis-à-vis de l’environnement. Les extraits aqueux sont également moins chers et plus rentables par rapport aux huiles essentielles, d’autant que ces dernières contiennent des substances volatiles et donc exercent un effet temporaire.


