1 Introduction
Le pin d’Alep (Pinus halepensis Mill.) est une essence du pourtour méditerranéen [1,2]. De par ses vastes étendues, il s’adapte à plusieurs types de sols et d’altitudes [3,4]. Dans le Sud de l’Europe, il occupe des altitudes qui varient de 0 à 1000 m. En revanche, en Afrique du Nord, il culmine jusqu’à 2000 m d’altitude dans les reliquats des forêts de l’Atlas saharien [3], témoignant ainsi d’une grande plasticité climatique [1,5] : il est observé depuis les chaînes littorales de Catalogne, en Espagne, avec un climat humide, jusqu’aux limites du Sahara en Afrique du Nord, avec un climat semi-aride [6,7]. Entre ces larges étendues méditerranéennes, le pin d’Alep peut refléter une grande variation démographique et dendrométriques liée aux caractéristiques stationnels de chaque région [1].
En plus du stress climatique lié à l’exposition à des hautes températures [8,9], le pin d’Alep est exposé à un ennemi biologique agressif, en l’occurrence la chenille processionnaire (CP, Thaumetopoea pityocampa Schiff. Lepidoptera, Notodontidae), qui en est le principal ravageur [10,11]. Elle est responsable de la défoliation de la cime [12,13], elle réduit la croissance radiale et la croissance en hauteur de plusieurs espèces de conifères [14,15]. Elle diminue, de ce fait, la productivité du bois [16,17], et elle affecte les paramètres de reproduction [11]. La plupart des études [2,17–19] se focalisent ainsi sur l’effet de ce ravageur sur l’état de santé des espèces du genre Pinus et du genre Cedrus et sur son impact sur la croissance et la productivité sylvicole.
Bien que la distribution du pin d’Alep soit strictement méditerranéenne, la CP est présente bien au-delà de cette région climatique, car elle s’attaque à d’autres essences de pin (pin noir, pin maritime et pin sylvestre) largement présents en Europe [20]. De plus, le réchauffement climatique lui permet de progresser vers le nord et en altitude [21]. Le climat a toujours été impliqué dans les pullulations de la CP [11,22], même sur les hautes pinèdes frontalières, au Sahara notamment, avec l’augmentation de la température globale plus palpable sur les zones désertiques [23]. En effet, avec le réchauffement climatique actuel, les précipitations sont de plus en plus faibles et les températures maximales de l’été sont plus élevées, en particulier dans les limites sud des aires de distribution du pin d’Alep. Ce qui suppose (i) que ces pinèdes exposées à la sécheresse deviennent moins favorables pour la CP que les autres pinèdes du Nord, (ii) que la forte intensité de la présence de la CP peut modifier quelques caractéristiques dendrométriques des arbres les plus attaqués.
Dans cette étude, une attention particulière est portée, d’une part, à la variation du taux d’infestation par la CP et de sa densité chez le pin d’Alep avec les facteurs climatiques (augmentation de la température, baisse des précipitations) et, d’autre part, à l’effet de la CP sur les paramètres dendrométriques des pinèdes isolées et stressées dans les hauteurs des limites sud de ses aires de distribution biogéographique.
2 Matériel et méthodes
L’étude a été menée dans trois pinèdes naturelles et claires de la région de Djelfa (forêt de Djellal, Senalba Chergui et Senalba Gharbi), dans les hauts plateaux de l’Atlas saharien (987 à 1536 m d’altitude). Ces forêts sont situées aussi sur la bordure sud des aires de répartition biogéographique du pin d’Alep et les limites méridionales de la région méditerranéenne [1]. L’action anthropique est représentée par les travaux sylvicoles (taille, élagage) et les travaux d’aménagement assurés par les services de la conservation des forêts, en plus des coupes illicites, des incendies et du surpâturage pratiqué par les riverains.
Dans la zone d’étude, le pin d’Alep forme des populations dominantes, clairsemées, mais plus fréquemment en mélange avec le chêne vert (Quercus rotundifolia Lam.), le genévrier de Phénicie (Juniperus phoenicea L.) et le genévrier oxycèdre (Juniperus oxycedrus L. subsp. rufescens LK) comme sous-bois [24]. Les données climatiques de la station de Djelfa (1144 m d’altitude) indiquent que cette région prédésertique se caractérise par un bioclimat semi-aride, chaud et sec en été et froid en hiver avec un indice d’aridité de De Martonne de 12,93. La température moyenne annuelle se situe autour de 14,63 °C et les précipitations sont irrégulières (la moyenne du cumul des précipitations annuelles est d’environ 318 mm).
Dans cette étude, nous avons considéré le mois de septembre comme le début du cycle de la CP, correspondant à la période de la ponte et au début de l’éclosion [20]. De ce fait, nous avons considéré que l’année commence depuis le mois de septembre de l’année précédente pour s’achever au mois d’août de l’année en cours. Les jours de canicule représentent, pour notre cas, les jours où la température maximale a été supérieure à 32 °C, une température considérée dangereuse pour les œufs en incubation et pour les chenilles en cours d’évolution [20].
Un total de 300 arbres a été mesuré dans des parcelles échantillonnées afin de caractériser quelques paramètres dendrométriques (circonférence à 1,30 m du sol, hauteur totale, hauteur de la première branche, rayon du houppier) et d’estimer le nombre des nids de CP chaque année entre 2013 et 2015. Le choix des arbres a été réalisé sans tenir compte de leur état sanitaire apparent. À partir du premier arbre sain marqué comme référence dans chaque pinède, le reste des arbres a été sélectionné par la méthode du plus proche voisin [25].
L’effet de l’action de la CP sur nos pinèdes a été étudié à partir des mesures dendrométriques, de la détermination du taux d’infestation par la CP (pourcentage des pins infestés) et de la densité de celle-ci par arbre et par hectare [15,26].
De plus, l’effet de la défoliation par la CP a été étudié sur les arbres mesurés. Le degré de défoliation a été évalué visuellement [14] en s’appuyant sur le volume des aiguilles perdues par rapport aux aiguilles attachées sur les rameaux.
Les analyses de variance (One-Way Anova) ont été réalisées par le test Kruskal–Wallis, afin de tester la différence entre la densité de CP par arbre d’une année à une autre, et la variation des classes du rayon du houppier avec la hauteur totale. Le test Khi2 a été appliqué pour analyser la variation des moyennes annuelles des températures, le nombre de jours de gelée et de canicule et le cumul des précipitations. Les corrélations de Pearson ont été utilisées pour mesurer le degré de liaison entre la densité des nids de CP par arbre avec les paramètres dendrométriques considérés. Pour l’étude de tous ces paramètres, nous avons utilisé le logiciel Statistix-8.
3 Résultats
Le taux d’infestation par la CP de pin d’Alep a été en moyenne de 7,82 %. Il a été significativement variable d’une année à une autre (χ2 = 10,13 ; P = 0,0062) ; il a été plus élevé en 2013–2014 (14,72 %) qu’en 2012–2013 (2,33 %) et 2014–2015 (6,40 %). La moyenne de la densité de CP par arbre a été de 2,74 ± 2,61 nids/arbre. Elle varie de 1 à 18 nids d’un arbre à un autre. Le test de Kruskal–Wallis indique que la densité de CP par arbre n’a pas été significativement variable d’une année à une autre (H2 = 3,01 ; ddl = 65 ; P = 0,2252), même si la densité été légèrement plus élevée en 2013–2014 (2,91 nids/arbre). En revanche, la densité des nids de CP par hectare a été significativement variable entre les trois années étudiées (χ2 = 32,28 ; P = 0,0001). La densité de CP par hectare a été largement plus élevée au cours de l’année 2013–2014 (40,63 nids/ha) par rapport à l’année 2012–2013 (4,22 nids/ha) et l’année 2014–2015 (17,15 nids/ha) (Fig. 1).

Variation interannuelle du taux d’infestation par la CP et densité de la chenille par hectare.
Les facteurs climatiques (cumul de précipitation, nombre de jours de gelée, nombre de jours de canicule et moyenne des températures minimales et maximales annuelles) ont varié significativement avec la densité de CP par hectare (Tableau 1). Au cours de l’année 2013–2014, les précipitations (310,72 mm) étaient significativement plus élevées que les années précédente (219,20 mm) et suivante (204,74 mm). Pourtant, ces dernières présentent des cumuls plus faibles que la moyenne (318,46 mm). De même, l’année 2013–2014 présente moins de jours de gelée que 2012–2013 et 2014–2015 (Tableau 1). En revanche, les moyennes des températures minimales et maximales annuelles affichent une augmentation continue (Tableau 1).
Variation interannuelle des facteurs climatiques dans la région de Djelfa.
| Année (septembre–août) |
Cumul de précipitations (mm) | Nombre de jours de gelée | Moyenne des températures minimales (°C) | Moyenne des températures maximales (°C) | Nombre de jours de canicule |
| 2012–2013 | 219,20 | 49 | 8,85 | 20,43 | 78 |
| 2013–2014 | 310,72 | 24 | 9,28 | 21,09 | 55 |
| 2014–2015 | 204,74 | 33 | 9,41 | 21,32 | 60 |
| Test | χ2 = 17,83 ; P = 0,0001 | χ2 = 37,96 ; P ≤ 0,0001 | χ2 = 11,13 ; P = 0,0038 | χ2 = 17 ; P = 0,0002 | χ2 = 33,65 ; P ≤ 0,0001 |
La densité de CP par arbre a été significativement et positivement corrélée avec le taux de défoliation (r = 0,1179 ; ddl = 297 ; P ≤ 0,0001) (Fig. 2).
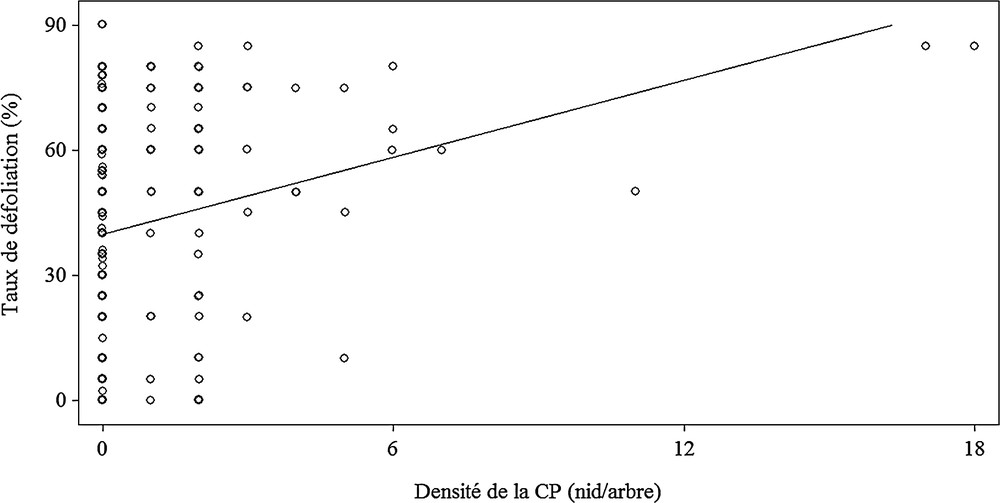
Relation entre la densité de la chenille processionnaire par arbre et le taux de défoliation du houppier du pin d’Alep dans la région de Djelfa (Algérie).
En outre, les paramètres dendrométriques ont été auto-corrélés, d’une part, avec la densité de CP par arbre et, d’autre part, avec le taux de défoliation. La densité de CP par arbre a été significativement et négativement corrélée avec l’ensemble des paramètres dendrométriques étudiés : elle a été significativement et négativement corrélée avec la hauteur des arbres (r = −0,1054 ; ddl = 297 ; P ≤ 0,0001), avec la hauteur de la première branche (r = −0,1280 ; ddl = 297, P ≤ 0,0001) et avec le rayon du houppier (r = −0,0687 ; ddl = 297 ; P ≤ 0,0081). Cette dernière relation a été exposée par la formule de la régression linéaire RH (rayon du houppier) = 1,86–0,05 × CP.
Par ailleurs, la défoliation a été négativement et significativement corrélée avec le rayon du houppier (r = −0,0538 ; ddl = 297 ; P ≤ 0,0375), mais elle a été positivement et significativement corrélée avec la hauteur totale des arbres (r = 0,1751 ; ddl = 297 ; P ≤ 0,0001) et la hauteur de la première branche (r = 0,0527 ; ddl = 297 ; P ≤ 0,0415).
Le test de Kruskal–Wallis indique que le rayon du houppier a varié significativement avec les classes de densité de CP par arbre (H2 = 8,50 ; ddl = 297 ; P = 0,0143). De même, la hauteur totale a varié significativement avec les classes de densité de CP par arbre (H2 = 25,01 ; ddl = 297 ; P ≤ 0,0001) (Fig. 3).
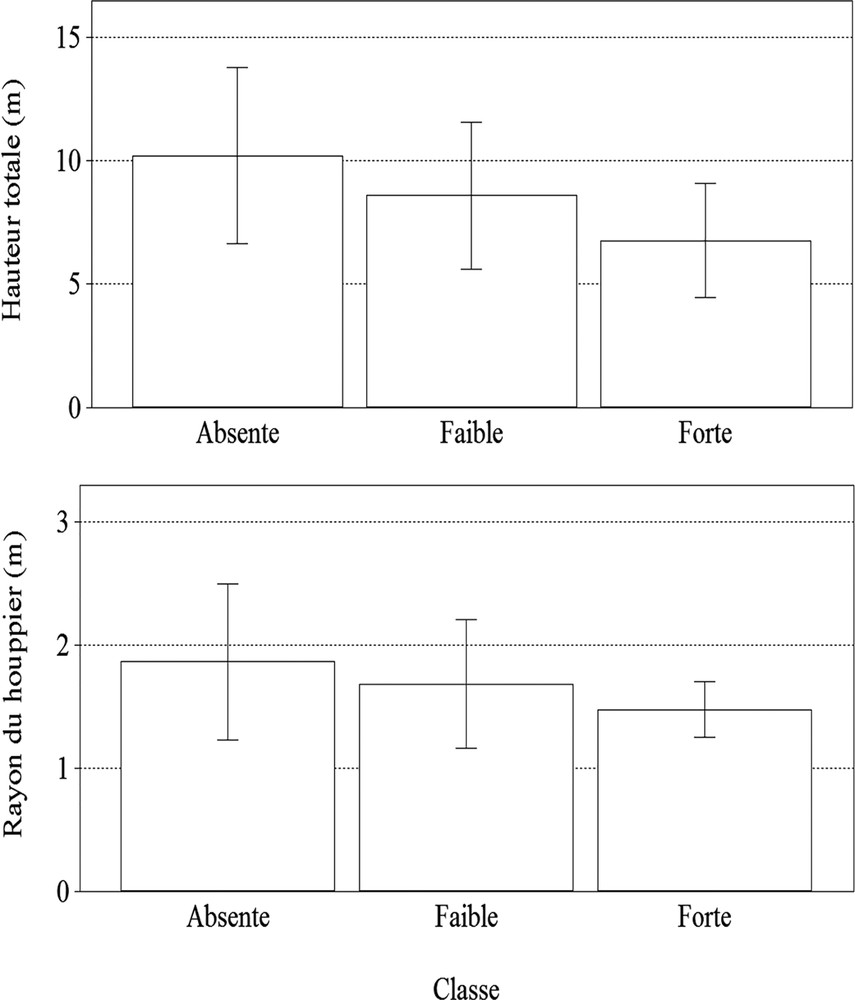
Variation de la hauteur totale (en haut) et de rayon du houppier (en bas) des arbres selon les classes de densité des nids de la CP par arbre (absente : 0 nid ; faible : 1–5 nids ; forte > 5 nids).
4 Discussion
L’état de santé du pin d’Alep a été essentiellement lié à la CP, son principal ravageur [11], qui se nourrit de ses aiguilles à différents stades et provoque une défoliation considérable [14,27]. Des dommages peuvent également être induits par l’hylésine Tomicus destruens Woll. (Coleoptera, Scolytidae) sur le pin d’Alep de notre région, ce qui peut entraîner le dépérissement des pins attaqués [28].
Le taux d’infestation du pin d’Alep par la CP de la région semi-aride de Djelfa a été largement plus faible que chez les autres populations de pins d’Europe (Tableau 2), notamment dans les plantations de pin maritime du parc naturel régional des Landes de Gascogne, en France, sur les côtes atlantiques, [26], et plus faible aussi que dans les pinèdes de la Catalogne [27] et celles du Sud de l’Espagne, sur les côtes méditerranéennes [15]. Il a été plus faible encore qu’au niveau du peuplement du pin noir de la forêt de Bartin, sur la mer Noire, en Turquie [18]. Il semble que le climat subhumide à hiver doux est le plus favorable pour l’infestation des arbres de conifères par la CP, notamment dans les forêts de la Turquie et d’Espagne (37,29 à 64,43 %), qui se trouvent dans le centre latitudinal de la région Méditerranéenne. En revanche, dans ses limites nord (France, 14,86 %) et sud (Algérie, 7,82 %), le taux d’infestation tend à diminuer. Le climat, qui constitue un facteur limitant pour la croissance des conifères [29], présente un effet complexe sur l’ajustement de la CP [30].
Taux d’infestation (TI) des conifères du pourtour méditerranéen par la chenille processionnaire et densité de ses nids (D) par arbre.
| Pays | Région (ville) | Bioclimat (Emberger) | TI | D | Référence | |
| France | Landes de Gascogne | Humide à hiver doux | 14,86 | 1,36 | [26] | |
| Italie | Campobasso, Molise | Subhumide à hiver frais | – | 2,88 | [41] | |
| Espagne | Lleida, Catalogne | Subhumide à hiver doux | 65,43 | 3,40 | [27] | |
| Mora de Rubielos | Subhumide à hiver froid | – | 3,00 | [19] | ||
| Hoya de Guadix | Semi-aride à hiver frais | 55,62 | 3,18 | [15] | ||
| Turquie | Kahramanmaras District | Subhumide à hiver froid | – | 5,75 | [42] | |
| Bartin | Humide à hiver doux | 37,29 | – | [18] | ||
| Algérie | Chréa | Subhumide à hiver doux | – | 5,96 | [34] | |
| Bordj Bou Arreridj | Semi-aride à hiver froid et été sec | – | 1,60 | [43] | ||
| Djelfa | Reboisement | – | 2,60 | [44] | ||
| – | 1,43 | [45] | ||||
| Forêt naturelle | – | 0,37 | [45] | |||
| 7,82 | 2,74 | Ce travail |
L’infestation du pin d’Alep de notre région par la CP a été variable d’une année à une autre. Le taux le plus élevé (14,72 %) a été enregistré en 2013–2014, une année relativement plus humide avec un hiver plus chaud, ce qui témoigne que la prévalence de la chenille est étroitement liée aux conditions climatiques, notamment la température [31,32], en plus de l’affinité de la chenille pour l’espèce hôte [15].
De plus, les pinèdes de notre région se trouvent, sur la bordure sud de la Méditerranée, exposées aux influences climatiques du désert (canicules et vent de sirocco en été). Elles sont de plus en plus isolées dans les hauteurs, où les conditions climatiques sont moins favorables que dans l’aire optimale [33]. D’après Jacquet et al. [13], la densité de CP par arbre baisse avec l’altitude. Effectivement, la densité des nids par arbre dans nos forêts semi-arides a été plus faible (0,37 à 2,74 nids/arbre) par rapport à la cédraie de Chréa, dans le Nord de l’Algérie (5,96 nids/arbre), sous un climat subhumide [34]. Elle a été également plus faible que celles des pinèdes du centre de la Méditerranée (2,88 à 5,75 nids/arbre) et comparable à celles des pinèdes du Sud de la France (1,36 nids/arbre) (Tableau 2). Ainsi, il semble que la densité de CP est plus élevée dans le centre de la région méditerranéenne que dans les forêts des extrêmes limites nord et sud. La synthèse du Tableau 2 montre aussi que la CP présente une large adaptation climatique ; depuis l’étage bioclimatique semi-aride dans le sud jusqu’à l’étage humide dans le Nord de ses aires de répartition, et depuis les basses pinèdes côtières à hiver doux jusqu’aux pinèdes d’altitude à hiver froid.
En plus des gradients latitudinal et altitudinal, la densité des arbres et la diversité des essences forestières peuvent faire varier le taux d’infestation par la CP et la densité de celle-ci, avec une préférence pour les arbres isolés et de crête [20] et pour ceux de la périphérie [35]. Bien que la CP possède un cycle plus ou moins régulier (sept à neuf ans) dans les régions tempérées [36], l’augmentation des températures estivales dans la bordure sud peut prolonger la diapause de plusieurs années [20], ce qui peut expliquer la variation interannuelle du taux d’infestation par la CP et de la densité de celle-ci dans notre région.
Dans les parcelles étudiées, le pin d’Alep dominant se trouve à des altitudes qui oscillent de 900 à 1600 m. Ainsi, l’élévation en altitude dans l’Atlas saharien conduit à une augmentation des précipitations et à une baisse de la température [37], malgré la résistance de la CP à de très basses températures en hiver [20]. Effectivement, selon Hoch et al. [38], des larves de CP survivent individuellement à une température de −7 °C, et peuvent résister jusqu’à −17 °C, regroupées dans leurs nids.
L’effet du climat sur la CP reste plus complexe [30] ; il a été montré que la hausse des moyennes des températures minimales durant les mois les plus froids permettait à la CP de mieux survivre à la limite nord de son aire de distribution et à sa limite altitudinale en Europe, ce qui lui permet de se propager [20,30]. Les mêmes auteurs indiquent que les températures maximales de l’été peuvent avoir un effet négatif sur la CP.
Les corrélations négatives entre la densité de la CP et les paramètres dendrométriques pourraient traduire l’effet de celle-ci sur la croissance verticale et horizontale du pin d’Alep et vice-versa, d’où l’impact probable des attaques sur la réduction du rayon du houppier, qui recule de 5 cm avec l’augmentation de chaque nid de CP. Dans ce contexte, Arnaldo et al. [14] rapportent que la baisse de l’accroissement de la biomasse a été liée à l’intensité des attaques, avec des pertes de croissance en volume et en hauteur jusqu’à 31 % [39]. De plus, Carus [17] ajoute que la réduction de la croissance radiale de Pinus brutia par la CP a été associée au climat.
Le taux d’infestation est également à l’image des efforts d’entretien et d’élimination mécanique des nids de CP par les services locaux des forêts. Ce qui influencerait le choix des femelles pour l’endroit de la ponte sur les arbres. Il semble, dans notre cas, que les arbres les plus hauts, ou du moins ceux dont la première branche est très élevée par rapport au sol, présentent moins de nids de CP. D’après Huchon et Démolin [20], les femelles gravides effectuent un choix sélectif à l’intérieur du peuplement, en comparant le diamètre et la structure des aiguilles. Pérez-Contreras et al. [15] affirment que le choix des arbres pour la ponte est lié à leur état de santé, et les femelles adultes préfèrent l’extrémité du houppier la plus exposée à la lumière pour la ponte. De plus, le choix des femelles est lié à leur taille ; les plus petites sélectionnent les pins les plus courts et les plus grandes choisissent ceux les plus élevés [40].
En outre, la densité des nids de CP a été négativement corrélée avec la hauteur de la première branche. Cette relation laisse supposer, d’une part, que les arbres les plus hauts et dont les premières branches sont le plus soulevées du sol échappent considérablement aux papillons gravides au cours de la ponte, qui choisissent les branches les plus basses [15,40] et que, d’autre part, ce choix des adultes pour la ponte, puis la pullulation des chenilles à différents stades, conduit probablement ces derniers à définir un profil d’arbre de plus en plus élancé.
D’une façon globale, en absence d’informations sur les possibilités de diapauses prolongées dans nos pinèdes, la variation du taux d’infestation par la CP et de la densité de celle-ci au cours des trois années d’étude pourrait éventuellement être le résultat d’une période de latence du cycle de pullulation. Des études diachroniques prolongées sur le taux d’infestation par la CP et la densité de celle-ci pourront mieux expliquer cette variation.
Remerciements
Ce travail a été réalisé grâce à l’appui de la conservation des forêts de Djelfa, de l’université de Annaba et de l’université de Laghouat. Les auteurs tiennent à remercier le Dr C. Robinet (Inra, France) et le Dr H. Mouissa (université de Djelfa), ainsi que les évaluateurs anonymes pour leurs critiques constructives.


