1. Introduction: Auxin as a master regulator of root growth during gravity response
Auxin is a key factor in regulating root growth upon gravistimulation. It is mainly produced in the leaves and then transported downward to the root tip through the auxin carrier PIN FORMED 1 (PIN1; [1, 2]). In the scenario where the root is aligned with the gravity vector, auxin is distributed equally on both sides of the root tip by other auxin carriers, such as PIN3, 4 and 7 [3]. During the gravity response, auxin is mainly transported and accumulated to the lower side of the root (Figure 1, Panel 1–2; [4, 5]). The higher auxin concentration promotes the activation of the “non-genomic” auxin signaling pathway in the root epidermis which in turn triggers ROP6 activation [6, 7]. This cellular signaling cascade inhibits the endocytosis of cargo proteins and reorganizes microtubules in order to restrain cellular growth (Figure 1, Panel 3; [8, 9]). This pathway creates a differential growth, which on the upper part is not affected while in the lower is decreased. Together, this local regulation of cellular growth promotes bending at the organ level in order to realign the root according to the gravity vector (Figure 1, Panel 2).
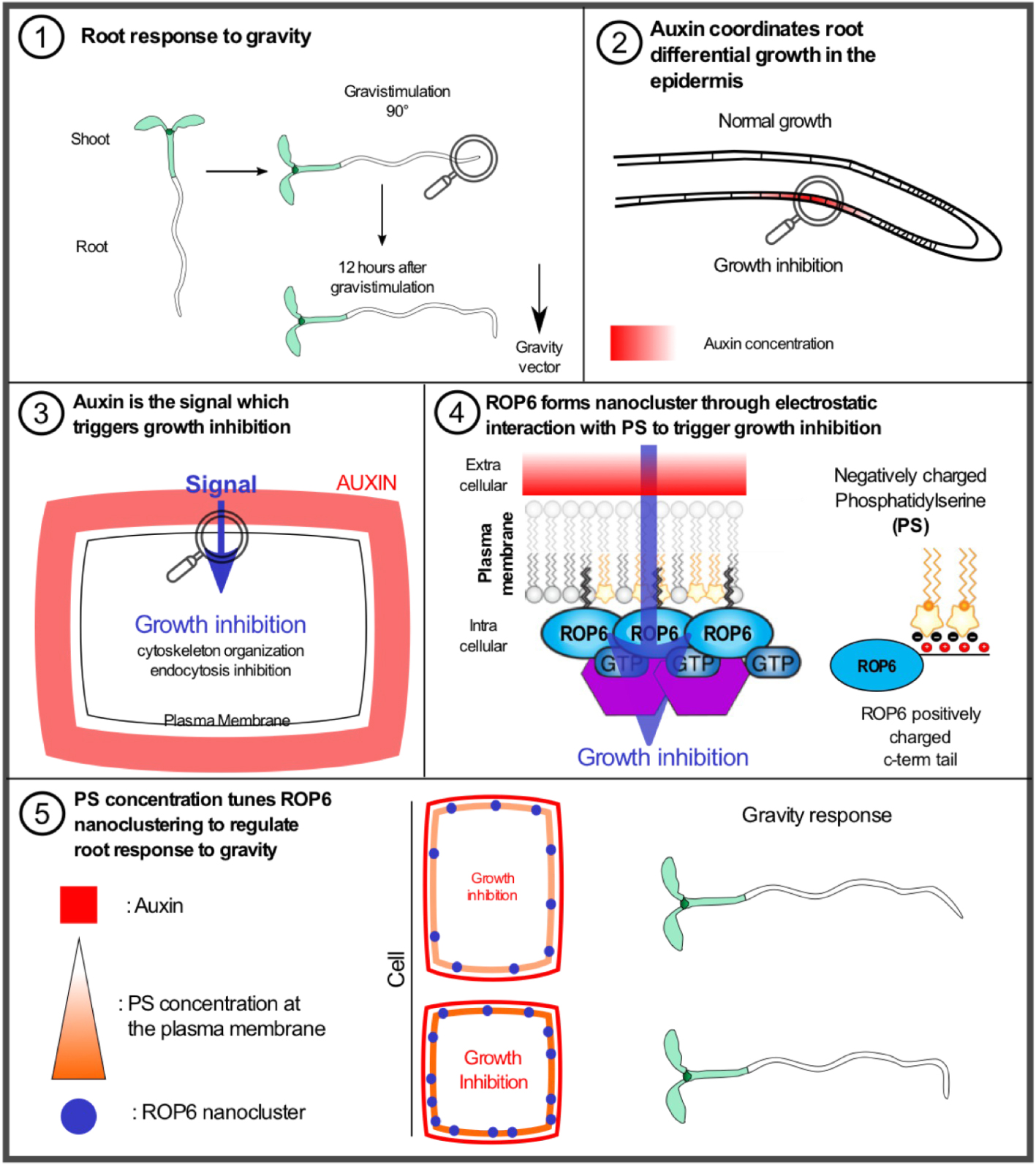
Explanatory panel of the role of phosphatidylserine in tuning the root response to the gravity through ROP6-dependent nanoclustering. (1) Root response to gravity: scheme highlighting that the root aligns according to the gravity vector in 12 h. (2) Auxin coordinates root differential growth in the epidermis: under gravistimulation the auxin is transported and accumulated to the lower part in the epidermis. (3) Auxin is the signal which triggers growth inhibition: the accumulation of auxin is perceived extracellularly to organize the cytoskeleton and inhibit the endocytosis in order to trigger growth inhibition. (4) ROP6 forms nanocluster through electrostatic interaction with phosphatidylserine (PS) to trigger growth inhibition: the auxin signal is integrated at the plasma membrane by the formation of ROP6 nanocluster which is dependent on PS, ROP6 and PS interact directly through electrostatic interaction which are required for nanocluster formation. (5) PS concentration tunes ROP6 nanoclustering to regulate root response to gravity: depending on the level of plasma membrane-associated PS the number of ROP6 nanocluster varies which in turn modulate root response to gravity. Masquer
Explanatory panel of the role of phosphatidylserine in tuning the root response to the gravity through ROP6-dependent nanoclustering. (1) Root response to gravity: scheme highlighting that the root aligns according to the gravity vector in 12 h. (2) Auxin coordinates root ... Lire la suite
2. Results
2.1. Phosphatidylserine levels tune the root response to gravity
Focusing on the developmental role of membrane-associated anionic lipids using genetically encoded biosensors, we observed that the endogenous levels of auxin positively correlates with the concentration of phosphatidylserine at the plasma membrane. Moreover, plants devoided of phosphatidylserine, phosphatidylserine synthase 1 (pss1) mutants, present major defects in gravity response [10, 11, 12]. On this basis, we hypothesized a role of phosphatidylserine in gravitropism. To tackle this assumption, we developed a biochemical and genetic approach by creating plant, which contain different endogenous levels of phosphatidylserine. The gravitropic response of these plants showed a positive correlation between the phosphatidylserine levels and root ability to respond more or less rapidly to the gravity. To corroborate this finding, we looked at the downstream cellular gravity responses (i.e. inhibition of endocytosis, reorganization of microtubule cytoskeleton) and observed, again, a direct correlation. Taking together these results suggest that the phosphatidylserine can tune the response to gravity and that it might play a role in the “non-genomic” auxin signaling pathway.
2.2. Phosphatidylserine is a player in the “non-genomic” auxin signaling pathway
Rop6 is a GTPase which is able to switch from an active form when bound to guanosine diphosphate (GTP), to the inactive form, when bound to guanosine diphosphate (GDP). Importantly, the constitutive active version of ROP6 which is GTP-locked (ROP6-CA), as well as, the over-expression of ROP6 (ROP6-OX), promote a faster response to gravity [8, 9, 10, 11, 12, 13]. Taking advantage of this phenotypic read out and that pss1 does not respond to the gravity, we tested the genetic interaction between these two components. Expressing either ROP6-CA or ROP6-OX in pss1 mutant plants, we observed a pss1-like phenotype, leading us to the conclusion that phosphatidylserine is required for the activation of ROP6. Moreover, these results challenge the dogma of GTPase activation. The canonical pathway for GTPase activation is that the active form of the GTPase is sufficient to trigger the downstream signaling. Our results, showed that the phosphatidylserine is required for ROP6 activation. We decided then to further characterize how the phosphatidylserine can regulate ROP6 activation.
2.3. Phosphatidylserine regulates ROP6 activity by the formation of ROP6 nanoclusters
As ROP6 and phosphatidylserine co-exist at the plasma membrane, we wanted to decipher ROP6 membrane dynamics in response to gravistimulation in presence or absence of ROP6. To mimic the increase of auxin in the epidermal root cells upon gravitropic response, we applied exogenous auxin in short time frames (5 min) simplifying the experimental set up. To monitor ROP6 dynamic changes, we developed a super resolution microscopy technic based on the photo-activation of ROP6-tagged fluorescent protein allowing us to study single molecule dynamics at 25 nm of resolution. This technic uncovered that ROP6 is organized in nanoclusters of about 50 to 70 nm in response to auxin treatment, while showing no cluster in the mock treatment contrôle (Figure 1, Panel 4). In plants containing no phosphatidylserine, the formation and stabilization of ROP6 in nanoclusters was prevented, which showed that this lipid is required for ROP6 nanocluster formation in response to auxin. To strengthen this result, we wondered whether the phosphatidylserine is able to directly control ROP6 nanoclustering. To assess this hypothesis, we used the constitutive active form of ROP6, which does not need auxin to be activated and expressed it in plants producing more phosphatidylserine. Recording the ROP6-CA dynamics at the nanoscale, we observed, on one hand, that ROP6-CA is already organized in nanoclusters in the absence of exogenous auxin, and on the other hand that the number of ROP6-CA nanoclusters was greatly enhanced in the presence of a heighten phosphatidylserine content at the plasma membrane contrôle (Figure 1, Panel 5). These results highlight that the activation of ROP6 not only promotes its activation but that phosphatidylserine also directly tunes the number of ROP6 nanoclusters, and hence the strength of the output signal. Phosphatidylserine is rate-limiting in ROP6 nanocluster formation, however, the exact molecular mechanism of nanocluster formation is still unknown.
2.4. Phosphatidylserine-depend ROP6 nanoclustering relies on electrostatic interactions
Getting inspired from the vast literature on GTPase, notably the oncogenic protein K-ras, we were able to establish the direct link between the phosphatidylserine and ROP6 [14]. K-ras is known to interact directly with anionic lipids through electrostatic interaction via its polycationic C-terminal tail and the negative charges carried by the lipids [15]. Whereas ROP6 does not belong to the Ras GTPase family, it has a polycationic tail, like all plant ROPs [11]. Biochemical assays, showed that ROP6 interacts directly with the phosphatidylserine in vitro contrôle (Figure 1, Panel 4). Besides, mutations of the positive charges in the polycationic tail prevent this interaction. While the over expression of ROP6 leads to a faster gravitropic response, the over expression of ROP6 with a mutated polybasic region does not. Importantly, using imaging method based on Forster Resonance Electron Transfer to monitor ROP6 biochemical activity, we showed that mutations in the polybasic region do not affect ROP6 intrinsic activity, arguing that the absence of phenotype is independent of the GTPase activity. Altogether, these experiments suggest that ROP6 and the phosphatidylserine are able to interact directly via electrostatic interactions, which are required for ROP6 activity independently of the GTPase activity (Figure 1, Panel 4). Using the super resolution microscopy technic, we further characterized the importance of the electrostatic interaction in regulating ROP6 nanoclustering. The mutated version of ROP6 in the polycationic tail was still localized at the plasma membrane but was unable to form efficient nanoclusters in response to auxin, showing that electrostatic interactions are required to form ROP6 nanocluster. Finally, using dual-color imaging at the plasma membrane, we showed that ROP6 and phosphatidylserine co-exist in the same nanocluster upon auxin treatment. Consistently, we observed that they colocalized in presence of auxin but not in its absence. Altogether, we demonstrated that the ROP6 polycationic region interact with phosphatidylserine in presence of auxin to form nanoclusters and trigger downstream signaling (Figure 1).
3. Conclusion
To conclude, we combined different approaches to uncover, from the macroscopic to the nanoscopic scales, how an environmental cue, such as gravity, impacts plant architecture. Studying the involvement of the GTPase in the response to gravity, we uncovered an unexpected mechanism regulating GTPase activity. Notably, we found that the activation of the GTPase into its active form is not sufficient to trigger downstream signaling. Besides, phosphatidylserine, which is thought to be a membrane structural lipid, is a key component in membrane protein organization and dynamics. Finally, the regulation of endogenous cellular phosphatidylserine level tunes directly the signaling by acting on nanocluster formation, which we envision as signaling platforms that allow to control signal specificity, strength and duration.
French version
1. Introduction : Modulation de la croissance racinaire via l’auxine en réponse à la gravité
Une hormone spécifique des plantes, l’auxine est l’un des facteurs clef de l’adaptation de la croissance en fonction de la gravité. L’auxine est principalement produite par les feuilles. Elle est ensuite acheminée jusqu’à la pointe racinaire par le transporteur d’auxine PIN FORMED 1 (PIN1 ; [1, 2]). Lorsque la racine est alignée avec le vecteur de gravité, l’auxine, via d’autres transporteurs de la famille PIN (PIN3, 4 et 7), est distribuée également de part et d’autre de la racine permettant une croissance équilibrée des deux côtés de la racine [3]. Lorsque la racine perçoit un changement d’alignement, l’auxine est alors principalement transportée et accumulée du côté inférieur de la racine (Figure 1, Panel 1–2; [4, 5]). Cette forte concentration d’auxine va ensuite promouvoir l’activation de la voie « non-génomique » de l’auxine dans l’épiderme racinaire. Elle va déclencher, au niveau de la membrane plasmique, l’activation de ROP6 [6, 7]. Cette cascade d’événements agit au niveau cellulaire en inhibant l’endocytose de protéines cargos et en régulant l’organisation des microtubules pour freiner la croissance cellulaire (Figure 1, Panel 3; [8, 9]). Cette voie de signalisation a pour effet de créer une croissance différentielle ; la face supérieure de la racine maintient une croissance normale alors qu’elle est réduite au niveau de la face inférieure, assurant ainsi la torsion de la racine en vue de s’aligner à nouveau avec le vecteur de gravité (Figure 1, Panel 2).
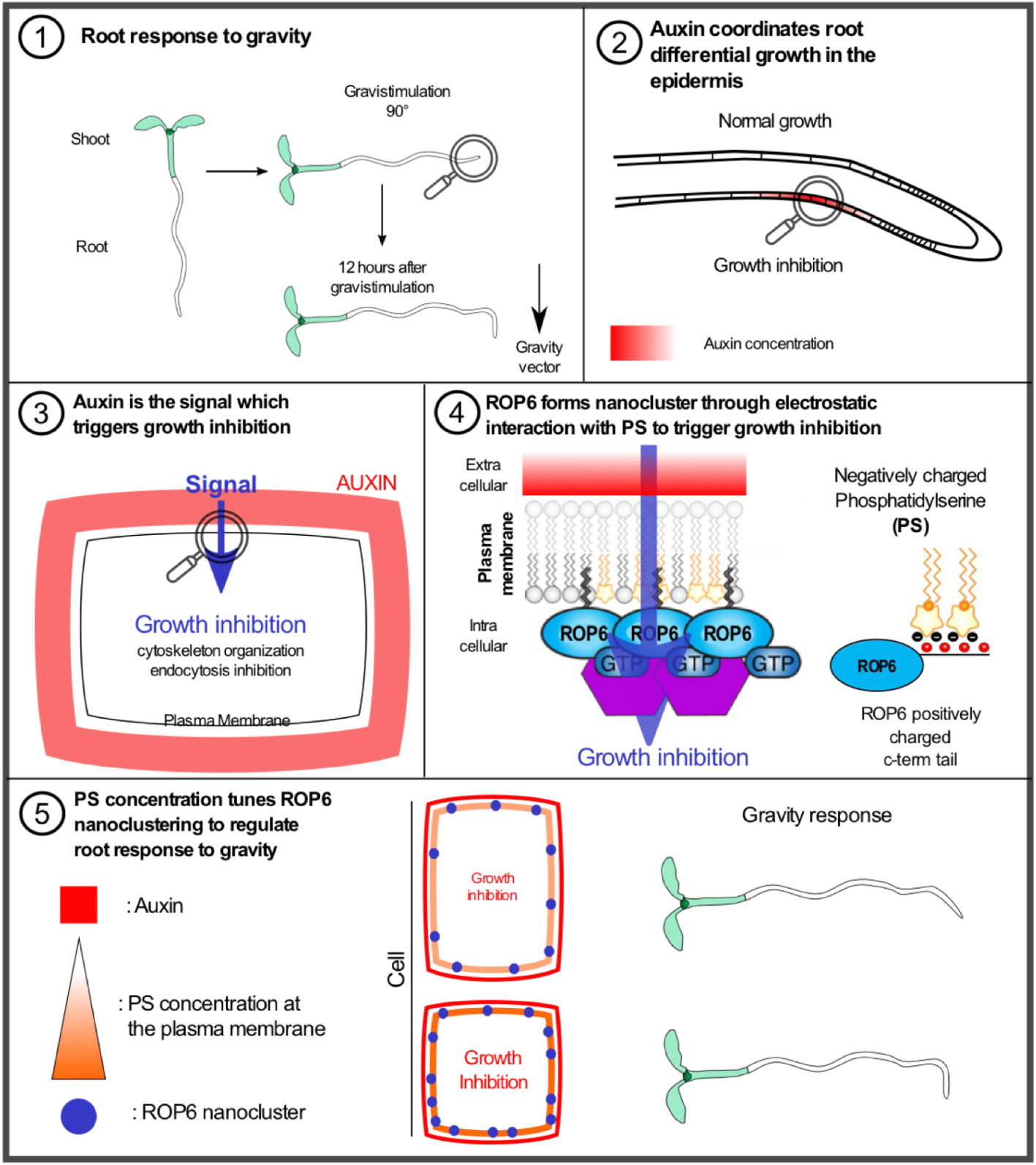
Schéma explicatif du rôle de la phosphatidylsérine dans la formation de nanoclusters de ROP6 pour réguler la réponse de la racine à la gravité. (1) Réponse de la racine à la gravité : schéma mettant en lumière la réorientation de la racine selon le vecteur de gravite. (2) L’auxine coordonne la croissance différentielle dans l’épiderme : durant la gravistimulation l’auxine est transportée et accumulée dans la zone inferieure de l’épiderme racinaire. (3) L'auxine est le signal qui déclenche l’arrêt de la croissance : l’accumulation d’auxine est perçue au niveau extracellulaire pour réorganiser le cytosquelette ainsi que promouvoir l’inhibition de l’endocytose dans le but d’inhiber la croissance racinaire. (4) ROP6 forme des nanoclusters via des interactions électrostatiques avec la phosphatidylserine (PS) pour déclencher la régulation de la croissance racinaire : le signal provenant de l’auxine est intégré au niveau de la membrane plasmique par la formation de nanoclusters de ROP6 qui dépendent de la PS, ROP6 et PS interagissent directement par l’action d’interactions électrostatiques requises pour la formation de nanoclusters. (5) La réponse à la gravité dépend de la concentration de PS à la membrane plasmique, qui régule proportionnellement le nombre de nanoclusters de ROP6 formés. Masquer
Schéma explicatif du rôle de la phosphatidylsérine dans la formation de nanoclusters de ROP6 pour réguler la réponse de la racine à la gravité. (1) Réponse de la racine à la gravité : schéma mettant en lumière la réorientation de la ... Lire la suite
2. Résultats
2.1. L’importance de la phosphatidylsérine pour la réponse à la gravité
En utilisant des biosenseurs génétiques, nous nous sommes aperçus que les niveaux endogènes d’auxine corrèlent positivement avec la quantité de phosphatidylsérine à la membrane plasmique. En parallèle, une plante mutante, phosphatidylserine synthase 1 (pss1), ne contenant plus de phosphatidylsérine, présente des défauts majeurs de réponse à la gravité [10, 11, 12]. Ces observations sont le point d’ancrage de l’hypothèse du rôle de la phosphatidylsérine dans la régulation de la réponse à la gravité. Pour établir un lien entre ces deux composants, nous avons utilisé une approche génétique et biochimique. Nous avons généré une batterie de plantes contenant plus ou moins de phosphatidylsérine pour déterminer son rôle lors de la réponse à la gravité. Cette expérience a démontré que selon le niveau de phosphatidylsérine, les racines répondent plus ou moins à la gravistimulation. Pour appuyer cette corrélation, nous avons étudié les réponses cellulaires induites par l’auxine et régulées par ROP6. Une corrélation positive entre l’inhibition de l’endocytose et l’organisation des microtubules avec le niveau de phosphatidylsérine a une nouvelle fois été trouvée. Ces résultats suggéraient un lien entre la fonction de ROP6 en réponse à l’auxine et la concentration de phosphatidylsérine. Nous nous sommes alors attelés à établir le lien génétique entre la fonction de ROP6 et la phosphatidylsérine.
2.2. La phosphatidylsérine est un acteur de la voie « non-génomique » de l’auxine
ROP6 est une GTPase qui peut être soit sous sa forme active guanosine triphosphate (GTP) ou sous sa forme inactive guanosine diphosphate (GDP). De manière importante, la version constitutive active, ROP6-CA, qui est constamment liée au GTP, ainsi que la surexpression de ROP6 entraînent une réponse plus rapide à la gravité et permettent d’étudier le lien génétique existant entre cette voie et la phosphatidylsérine [8, 13]. La surexpression de ROP6 ou de ROP6-CA dans le mutant pss1 dépourvu de phosphatidylsérine phénocopie le mutant pss1 montrant que la phosphatidylsérine est requise pour l’activation de ROP6. Ces résultats remettent en question le dogme selon lequel une GTPase, sous sa forme GTP, est activée et suffisante pour déclencher la voie de signalisation en aval. Par la suite, nous avons alors cherché à comprendre comment la phosphatidylsérine peut réguler l’activité de ROP6 au niveau moléculaire.
2.3. La phosphatidylsérine régule l’activation de ROP6 par la formation de nanoclusters de ROP6
Assumant que l’interaction entre ROP6 et la phosphatidylsérine se fait au niveau de la membrane plasmique due à leur co-localisation dans ce compartiment, nous avons voulu décortiquer la dynamique de ROP6 lors de la gravistimulation en présence et absence de phosphatidylsérine. Pour se faire, une application exogène d’auxine a été réalisée à des temps très courts (5 min) pour mimer son augmentation dans le tissu épidermique lors de la réponse à la gravité. Pour analyser les changements de dynamique de ROP6 lors de traitement à l’auxine, nous avons développé une technique de microscopie à super résolution. Cette technique, basée sur la photo-activation de molécules étiquetées de ROP6 permet d’étudier la dynamique protéique à une résolution de 25 nm. Celle-ci a notamment montré que lors d’un traitement exogène à l’auxine, ROP6 est organisée en clusters allant de 50 à 70 nm, appelé nanoclusters, alors qu’ils sont absents en condition contrôle (Figure 1, Panel 4). Dans les plantes ne contenant pas de phosphatidylsérine, la formation et stabilisation de nanoclusters n’est pas promue lors de l’ajout d’auxine. Cette expérience nous renseigne non seulement sur le fait que la GTPase doit être activée mais aussi organisée et stabilisée en nanocluster pour permettre la signalisation. Les expériences précédentes ayant démontré que le niveau de phosphatidylsérine corrèle positivement avec l’activation de la voie de signalisation dépendante de ROP6, nous avons alors voulu savoir si la quantité de phosphatidylsérine est capable d’influencer la dynamique de ROP6. Pour se faire, nous avons utilisé ROP6-CA qui est activée à l’état basal en absence d’auxine. En utilisant la technique de super résolution, nous avons observé, d’une part, que ROP6-CA est déjà organisée en nanocluster en absence d’auxine, confirmant que son activation promeut la formation de nanocluster. D’autre part, que le nombre de nanoclusters dans une plante accumulant plus de phosphatidylsérine est beaucoup plus important (Figure 1, Panel 5). Cela montre qu’il y a une corrélation directe entre le niveau de phosphatidylsérine, le nombre de nanoclusters et la signalisation. Cependant, le mécanisme induisant la formation des nanoclusters de ROP6 par la phosphatidylsérine reste inconnu.
2.4. Les interactions électrostatiques permettent la formation de nanoclusters de ROP6 par la phosphatidylsérine
En prenant appui sur la littérature animale de la régulation des GTPases, notamment la protéine oncogène K-ras, nous avons pu tester le lien direct entre la phosphatidylsérine et ROP6 [14]. K-ras est démontré pour interagir avec des lipides anioniques via des interactions électrostatiques entre la région polycationique localisée au niveau C-terminal et la charge négative portée par les lipides [15]. Bien que ROP6 ne fasse pas partie de la famille des Ras GTPases, celle-ci, comme l’ensemble des ROPs, arbore une queue polycationique [11]. Par une approche biochimique nous avons montré, d’une part que ROP6 peut interagir directement avec la phosphatidylsérine, et d’autre part, que la région polycationique est requise pour cette interaction (Figure 1, Panel 4). En effet, la version mutée abrogeant les charges positives n’interagit plus avec la phosphatidylsérine. Nous avons noté que la surexpression de la version mutée de ROP6 ne présente aucun phénotype au niveau de la réponse de la racine à la gravité ni au niveau cellulaire. De manière importante, une expérience d’imagerie basée sur du Forster Resonance Electron Transfer montre que les mutations n’affectent pas l’activité intrinsèque de ROP6 confirmant que l’absence de phénotypes est indépendante de l’activité GTPase. Ces expérimentations suggèrent, d’une part que ROP6 peut interagir de manière directe avec la phosphatidylsérine via des interactions électrostatiques et d’autre part qu’elles sont requises pour la voie de signalisation de l’auxine (Figure 1, Panel 4). Pour étudier si les interactions électrostatiques sont importantes pour la formation de nanoclusters, nous avons suivi la dynamique de la version de ROP6 mutée lors de l’ajout d’auxine en utilisant la microscopie de super résolution. Nous avons alors observé que la version mutée de ROP6, bien que présente à la membrane plasmique, n’est pas capable de former des nanoclusters en réponse à l’auxine. Finalement, nous avons réalisé de l’imagerie in vivo en deux couleurs au niveau de la membrane plasmique pour tester la présence de ROP6 et de la phosphatidylsérine au niveau des nanoclusters. De manière consistante, nous avons observé que des biosenseurs de phosphatidylsérine co-localisent avec ROP6 à l’intérieur des nanoclusters membranaires en réponse à l’auxine, mais pas en absence de cette hormone. L’ensemble de ces expérimentations montre que la région polycationique de ROP6 interagit directement avec la phosphatidylsérine, ce qui est requis pour la localisation de ROP6 dans les nanoclusters et permet ainsi de promouvoir la signalisation en aval de cette GTPase (Figure 1).
3. Conclusion
Pour conclure, nous avons décrit un mécanisme qui permet l’intégration d’une variable environnementale de l’échelle macroscopique à nanoscopique en combinant des approches diverses. Au long de cette étude, plusieurs résultats clefs ont été mis en lumière. Notamment que la forme active de la GTPase n’est pas suffisante pour déclencher la voie de signalisation en aval. Mais encore que la phosphatidylsérine, restreint jusqu’alors à un rôle structurel dans la membrane plasmique, est un lipide clef dans l’organisation protéique de la membrane plasmique. Mais aussi que la régulation de la quantité cellulaire de phosphatidylsérine endogène est capable de réguler directement des voies de signalisation via la formation de nanoclusters, décrits comme des plateformes de signalisation.



 CC-BY 4.0
CC-BY 4.0
Vous devez vous connecter pour continuer.
S'authentifier