“All consciousness is memory, conservation and accumulation of the past in the present.” H. Bergson (L’énergie spirituelle)
1. Introduction
Memory is the backbone of the mind. Neurological conditions like Alzheimer’s disease or Korsakoff syndrome tragically illustrate the importance of explicit memory not only as a component of personality, but also in simple activities of daily life. Among the network of brain structures that are central to declarative memory: the hippocampus and neighboring (parahippocampal, entorhinal) cortex are key to storing episodes of an individual’s life. Lesions of the region induce a severe anterograde amnesia in the rat, monkey or human [1, 2, 3, 4, 5, 6], as was notoriously shown by the patient Henry Molaison. While the long-term consolidation of memory is likely to take place in the neocortex, the hippocampus, a site of multimodal convergence, is necessary to organize these engrams. By linking different aspects of sensory, motor, or affective experience, the hippocampus contributes to storing episodes of an individual’s life. This structure has been studied in great detail in the rodent, where the hippocampus has been shown to harbor “place cells” [7], whose activities encodes far beyond the animal’s position in space. Specifically, each of these cells exhibits a preferential firing when an animal is in a specific place in a given environment, thereby encoding the space in which the animal moves. However, hippocampal cells also capture other dimensions than physical space such as auditive space [8], the goal pursued during the journey to a specific trajectory [9, 10, 11], or even the time of day of a journey [12]. This suggests that hippocampal cells encode situations that are key to guide behavior in many settings. Nevertheless, the extent to which the hippocampus represents knowledge about a specific environment or a more generic, conceptual knowledge is still unknown. We addressed this question in the monkey, a species closer to us than the rat, while the animals learnt to find their way in a virtual maze.
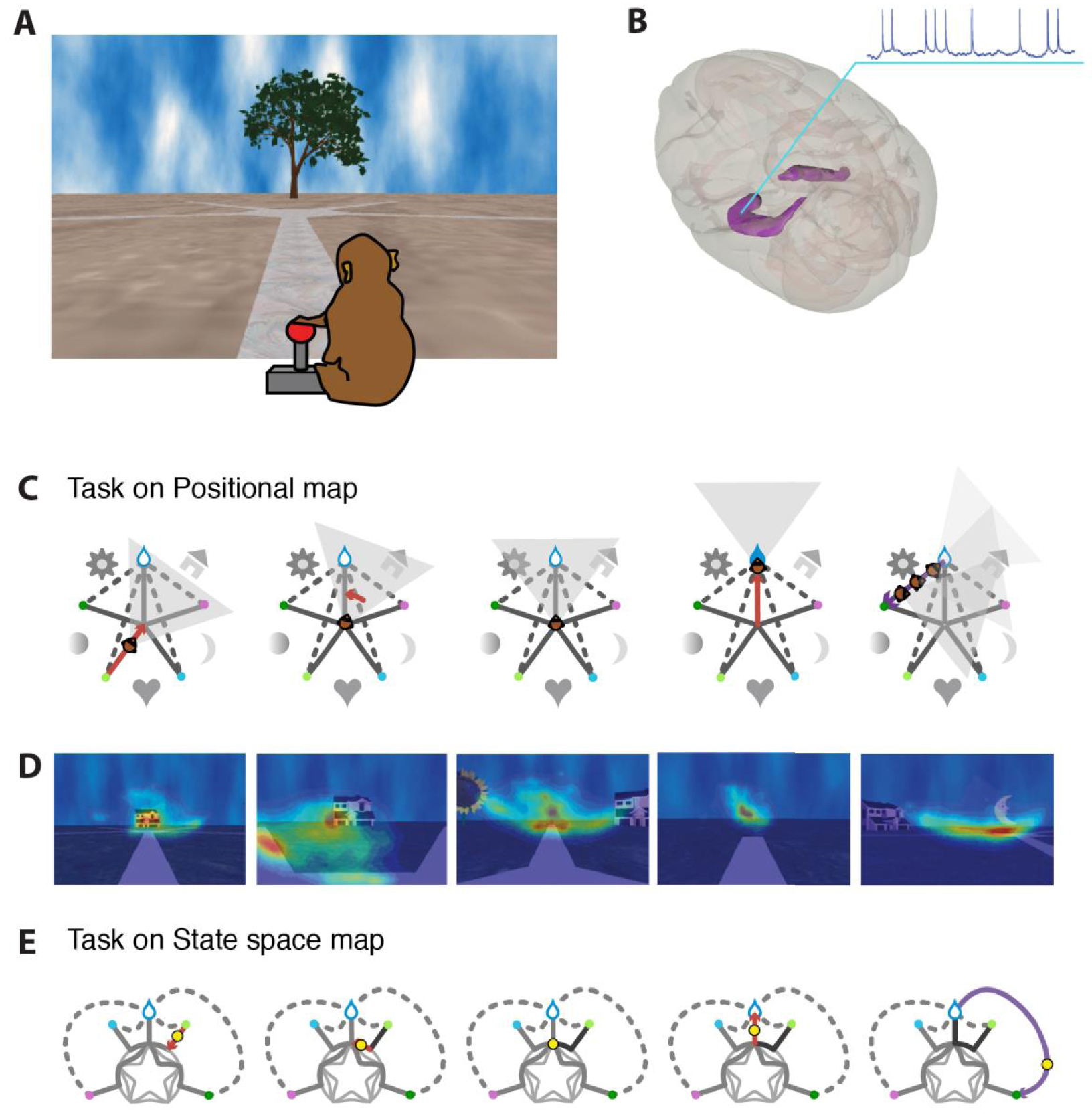
A. Illustration of the task. The animal is immersed in a virtual 3D environment in which it moves using a joystick. Allowed motions are along the figured paths of this 5-arm star maze. Visual landmarks are situated between the maze arms (here only the tree in front is visible). B. We recorded neurons from the hippocampus, bilaterally. C. Schematic depiction of a successful trial: the monkey moves along the entry arm (identified here by the light green dot), rotates in the center, moves along the exit arm towards the reward (blue drop), then is replaced to another starting point. D. Heatmaps of the animal’s gaze during such a trial, overlapped on the viewed scene. E. Graph of the valid moves in the maze. Any successful trial corresponds to a path connecting the entry point to the rewarded exit; the inner rosette corresponds to all the possible rotations at the center of the maze. This graph is a visual depiction of a part of the state space of the task (error moves were not analyzed since too infrequent). Masquer
A. Illustration of the task. The animal is immersed in a virtual 3D environment in which it moves using a joystick. Allowed motions are along the figured paths of this 5-arm star maze. Visual landmarks are situated between the maze ... Lire la suite
2. Materials and methods
Two rhesus macaques were placed in front of a large screen on which a three-dimensional visual scene was projected; the animals viewed this 70°-wide scene in 3D through synchronized shutter glasses, and controlled their virtual movements with a joystick. They thus explored a large simple maze in the shape of a five-pointed star, searching for a hidden liquid reward that was present at the end of one of the maze arms. To help the animals find their way, unique visual landmarks were positioned in the space between each arm (Figure 1A, C). These landmarks and the (actual and virtual) ego-motion signals were the only cues available to locate the reward, which they had to discover by trial and error. When they reached the end of a path, the animals were reallocated to a randomly assigned start along a straight trajectory exterior to the maze, preventing the animals from retracing it in reverse after a correct choice (Figure 1C).
In each work session, the monkey explored both a familiar maze in which the animal’s success rate exceeded 90%, and a novel maze that displayed never-seen visual landmarks, in two randomly ordered blocks of trials. While the animals had required over 6 weeks of training to reach proficiency in the familiar maze, they quickly generalized to the novel mazes, consistently reaching the reward above chance in a dozen trials.
The use of such a virtual environment allowed us to test the nature of spatial representations in a controlled manner while measuring eye movements and brain activity. Eye movement was recorded at 60 Hz with an ASL eye tracker. Neuronal activity was recorded with a Plexon amplifier coupled to a Spike2 acquisition system, using tungsten electrodes or Plexon U-Probe arrays. Out of 189 cells recorded throughout the hippocampus (mostly CA1 and CA3), 101 had a peak firing above 1 Hz and fired more than 100 spikes over the successful trials in both environments. All experimental procedures were approved by the veterinary animal care committee and the local ethics committee.
3. Results
3.1. A widely conjunctive representation of space
Viewed as a function of the location of the animal in the maze, hippocampal cells activity was similar to the place cells generally described in the rodent. Nevertheless, cells often fired when a given visual landmark appeared or when the animal gazed at it, thereby encoding sensory activity relevant to the orientation of the animal in the maze. Actually, when cell activity was viewed in a space expressing the resolution of the task as the selection of a path in the graph of available moves (state space, Figure 1E) the information content of the cells was maximal and the firing sparsest. This amounts to saying that cells fired not only with position orientation or view, but in a task-situated manner, as a conjunction of sensory, motor, and motivational cues. For example, a cell could fire differently for the same position and orientation in the center of the maze depending on the action of the monkey in relation to the reward. A cell could also fire for a specific visual cue, but differently depending on the egocentric position of the cue, and depending on the position and action of the animal (Figure 2B, C). What could appear superficially as a place cell is generally such a multiplexing cell. We direct the reader to [13] for a more detailed description of this research.
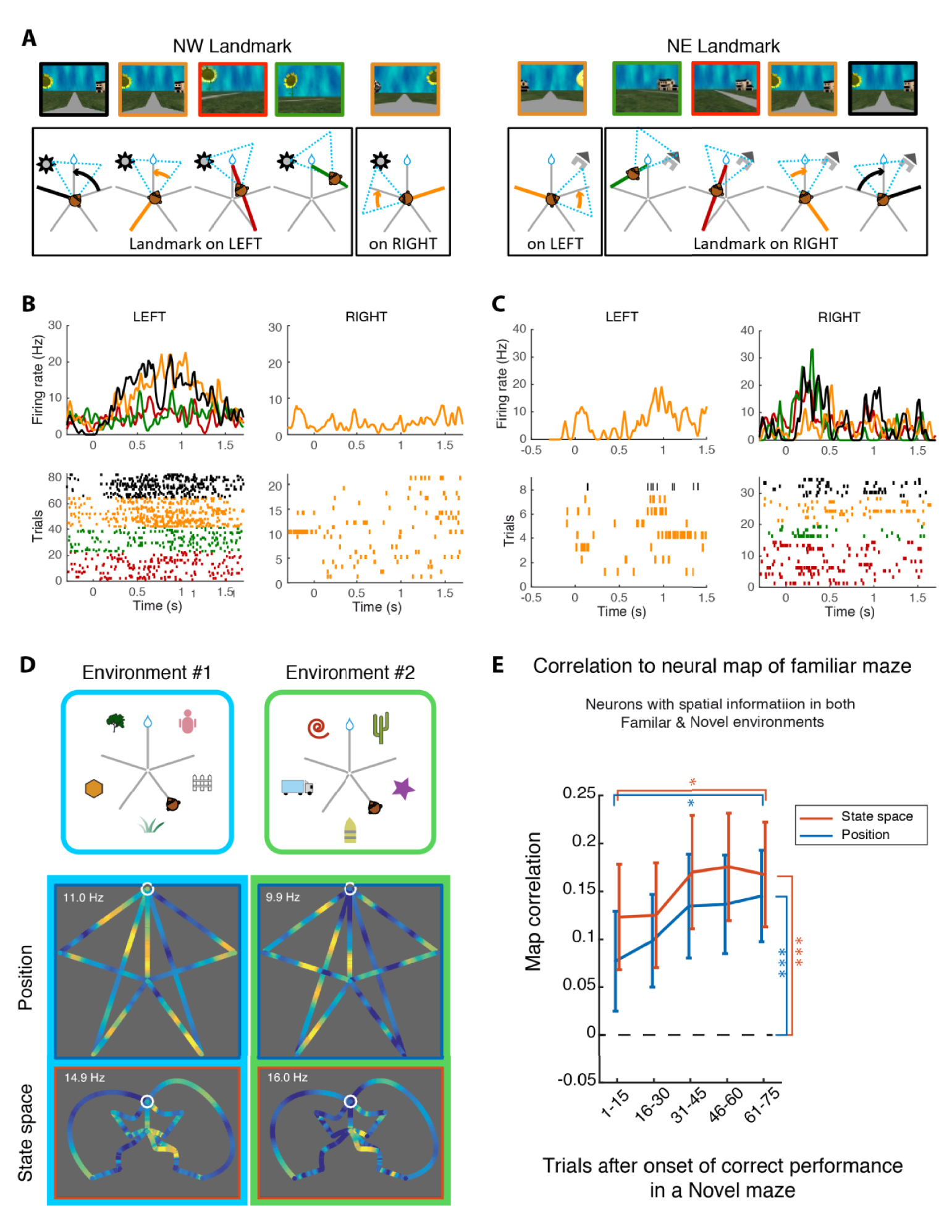
A. Illustration of the different ways a monkey could see a given landmark appear in the visual field. B and C. Two example neurons that fire differently for the same landmark depending on the task context (color code as in panel A). Activity rises usually ∼150 ms after the onset of stimulus appearance. D. Example of “schema cell” with correlated firing in two isomorphic environments. E. Increase in correlation between Familiar and Novel maze maps across the trials exploring the Novel maze (success rate did not significantly increase in the same period). Masquer
A. Illustration of the different ways a monkey could see a given landmark appear in the visual field. B and C. Two example neurons that fire differently for the same landmark depending on the task context (color code as in ... Lire la suite
These results confirm the view that the hippocampus is part of a relational memory system, linking the different elements of information that are relevant to the successful behavior of the animal. In particular, it demonstrates how memory episodes are grounded in action and, as is the case here, situated in a motivational context.
3.2. Hippocampus encodes both episodic memories and schemas
How does hippocampal firing change between the familiar and an isomorphic but novel environment? Correlating the neural maps of each environment aligned on the position of the reward, we discovered that about 2/3 of cells fired in an environment-specific way. These neurons “remapped” between the two mazes, probably coding the cues that were unique to each context (landmarks). The remaining third of cells fired in a significantly correlated way between the two environments (Figure 2D). Moreover, as exploration progressed across trials in the novel environment, the correlation between maps followed a similar time course (Figure 2E). This suggests that these maps express the implicit geometrical organization of a star maze around the invisible reward, or in other words, its logical or conceptual nature. By reference to the work of Bartlett [14] and Piaget [15], we termed these cells “schema cells” [16].
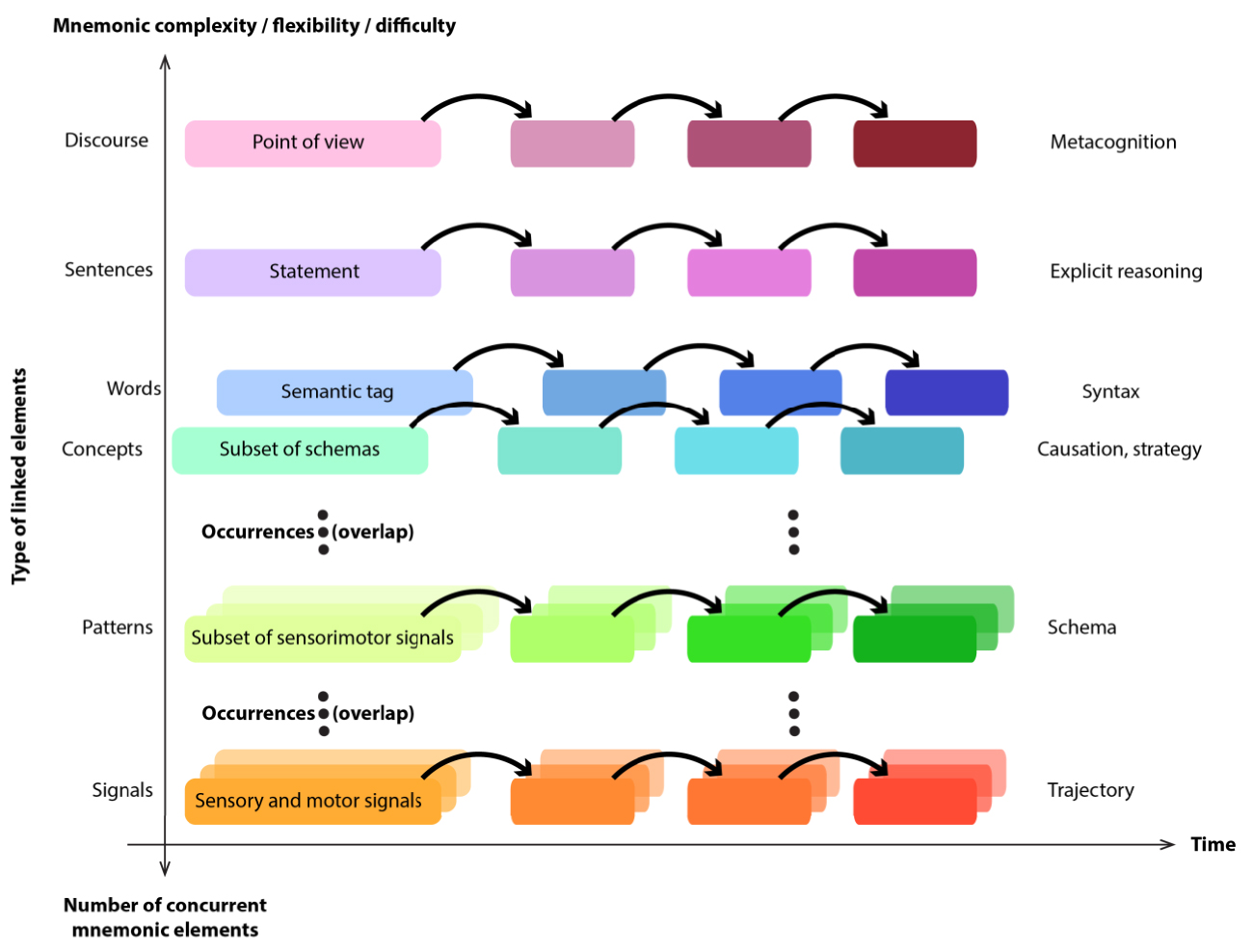
A tentative unification of the different declarative memory forms across the notions of item conjunction and temporal chaining. Each level bootstraps on the preceding one, using sets of transitions across the lower level as building blocks.
4. Are concepts patterns of linked memories?
In order to successfully master the maze task, the animal needed to hold in memory both the environment-specific data (“the reward is to the left of the sunflower”) and the general schema of the task (“It is a 5-arm star maze, there is a reward to be gained, hidden somewhere at the end of one of these paths, and moving the joystick in the appropriate direction will lead there”). Our observations suggest that the hippocampus represents both memory types. We suggest that episodic memories store single or repeated occurrences of a given environment through intermingled representations of co-occurring elements (combinatorial patterns), while schemas store the partial overlaps between these patterns of cues. More generally, we suggest that concepts can be viewed as patterns of recurring elements, stored in the same way as spatial, temporal, or identity elements. For example, in the same way as a place in a given city can be represented as the intersection of data on key landmarks (“the Arc de triomphe in your back, at the closest right corner of the Louvre pyramid”), a concept could be an intersection between recurring experiences (“a visual element between two maze arms” is the concept of landmark in the limited world of our task). In this framework, in the same way as an episodic element can be anchored on another episodic element (“at that place at the Louvre I met him for the first time”), the hippocampus would participate in anchoring one concept on another concept. This bootstrapping process could lead to the encoding of very rich episodic memories or very elaborated concepts. How does this relate to semantic memory, which differs from episodic memory? Indeed, amnesic patients often display preserved semantic memory and loss of episodic memory (although the converse also exists, see e.g. [17]). This apparent behavioral dissociation observed in amnesic patients could mostly result of the specialization of neocortex for storing long term memories. A recent study in the human shows that specific lesions of the hippocampus mostly impair the recall of newly formed episodic memories, with a preservation of personal semantic memory [18]. We predict that such patients should exhibit similar deficits in the recall of newly formed concepts.
Pushing our reasoning still further, the neural underpinnings of all forms of declarative memory, be it episodic, spatial, semantic, or lexical, may share a common neural architecture in which the hippocampus would play a similar role (Figure 3). This is obviously impossible to test with animals. Nevertheless, reflecting back on our results, that monkey hippocampus could participate in storing a conceptual memory is not surprising. Some primates such as West African green monkeys, for example, have been reported to use dedicated calls to label the categories of predators (snake, panther or eagle) to which the recipient monkeys react according to their meaning. Further, recently, it was shown that the vocal call associated the notion of “aerial danger” that usually corresponds to eagles, has been extended to cover human-flown drones [19]. These calls are not essentially different from words designating categories. Nevertheless, no other primate than the human masters language, the ability to freely string these words into complex utterances. We wonder whether this special ability could be a consequence of the increased interaction between the hippocampal—memory system and the highly developed neocortex in humans. That expansion of connections, materialized by a relatively higher proportion of cells in CA1, the output of hippocampus to cortex, relative to other fields [20], would allow a deeper bootstrap from elementary cue conjunctions all the way to elaborated meta-concepts that underlie language grammars, while also improving the speed and flexibility of concept associations.
French version
1. Introduction
La mémoire est l’épine dorsale de l’esprit. Des maladies neurologiques comme la maladie d’Alzheimer ou le syndrome de Korsakoff illustrent tragiquement l’importance de la mémoire explicite non seulement comme composante de la personnalité, mais aussi dans les activités simples de la vie quotidienne. Au sein du réseau de structures cérébrales qui sont au centre de la mémoire déclarative, l’hippocampe et le cortex voisin (parahippocampique, entorhinal) sont des régions essentielles permettant le stockage en mémoire des épisodes de la vie d’un individu. Les lésions de cette région induisent une sévère amnésie antérograde chez le rat, le singe ou l’homme [1, 2, 3, 4, 5, 6], comme illustré tragiquement par le cas du patient Henry Molaison. Alors que la consolidation à long terme de la mémoire intervient vraisemblablement dans le néocortex, l’hippocampe est nécessaire pour organiser les engrammes en reliant différents aspects de l’expérience sensorielle, motrice ou affective. Ceci a été étudié en détail chez le rongeur, où on a montré que l’hippocampe contient des « cellules de lieu » [7] dont l’activité dépasse largement le seul codage de l’espace. Ces cellules s’activent préférentiellement lorsqu’un animal se trouve à un endroit spécifique dans un environnement donné, codant ainsi l’espace dans lequel l’animal se déplace. Toutefois, on s’est aperçu que les cellules de l’hippocampe capturent également d’autres dimensions que l’espace physique, comme l’espace auditif [8], ou même le but lié à un trajet [9, 10, 11] ou le moment de la journée dans lequel ce trajet a lieu [12]. Cela suggère que, de manière très générale, les cellules de l’hippocampe encodent des situations qui sont essentielles pour guider le comportement. Ces travaux décrivent comment des neurones hippocampiques encodent le souvenir d’un environnement particulier ; mais ces neurones pourraient-ils aussi participer d’une connaissance conceptuelle plus générique construite au cours des apprentissages ? Nous faisons l’hypothèse que l’hippocampe contient des cellules qui permettent d’ancrer les souvenirs sur des bases structurelles communes à différentes expériences. Nous avons abordé cette question chez le macaque (une espèce plus proche de l’homme que le rat), en exploitant les possibilités offertes par les outils de réalité virtuelle pour enregistrer les neurones alors que l’animal explorait différents labyrinthes virtuels à la recherche de récompenses.
2. Matériels et méthodes
Deux macaques rhésus étaient placés devant un grand écran (70°) sur lequel était projetée une scène visuelle en trois dimensions perçue en 3D grâce à des lunettes à obturation synchronisée. Les animaux contrôlaient leurs mouvements dans l’environnement virtuel avec un joystick. Ils ont ainsi exploré un grand labyrinthe simple en forme d’étoile à cinq branches, à la recherche d’une récompense cachée qui se trouvait au bout d’un des bras du labyrinthe. Cette récompense consistait en l’obtention de jus de fruits dès lors que l’animal arrivait dans la bonne zone du labyrinthe. Pour aider les animaux à trouver leur chemin, des points de repère visuels uniques étaient placés dans l’espace entre chaque bras (Figure 1A, C). Ces points de repère et les indices des mouvements propres (flux optique, actions) étaient les seules informations disponibles pour localiser la récompense, que les animaux devaient découvrir par essais et erreurs. Lorsqu’ils atteignaient une extrémité du labyrinthe, les animaux étaient réaffectés aléatoirement à une autre extrémité pour un nouvel essai, le long d’une trajectoire rectiligne extérieure au labyrinthe ; il leur était donc impossible de suivre ce chemin en sens inverse après un choix correct (Figure 1C), ce qui les forçait à se repérer dans l’espace.
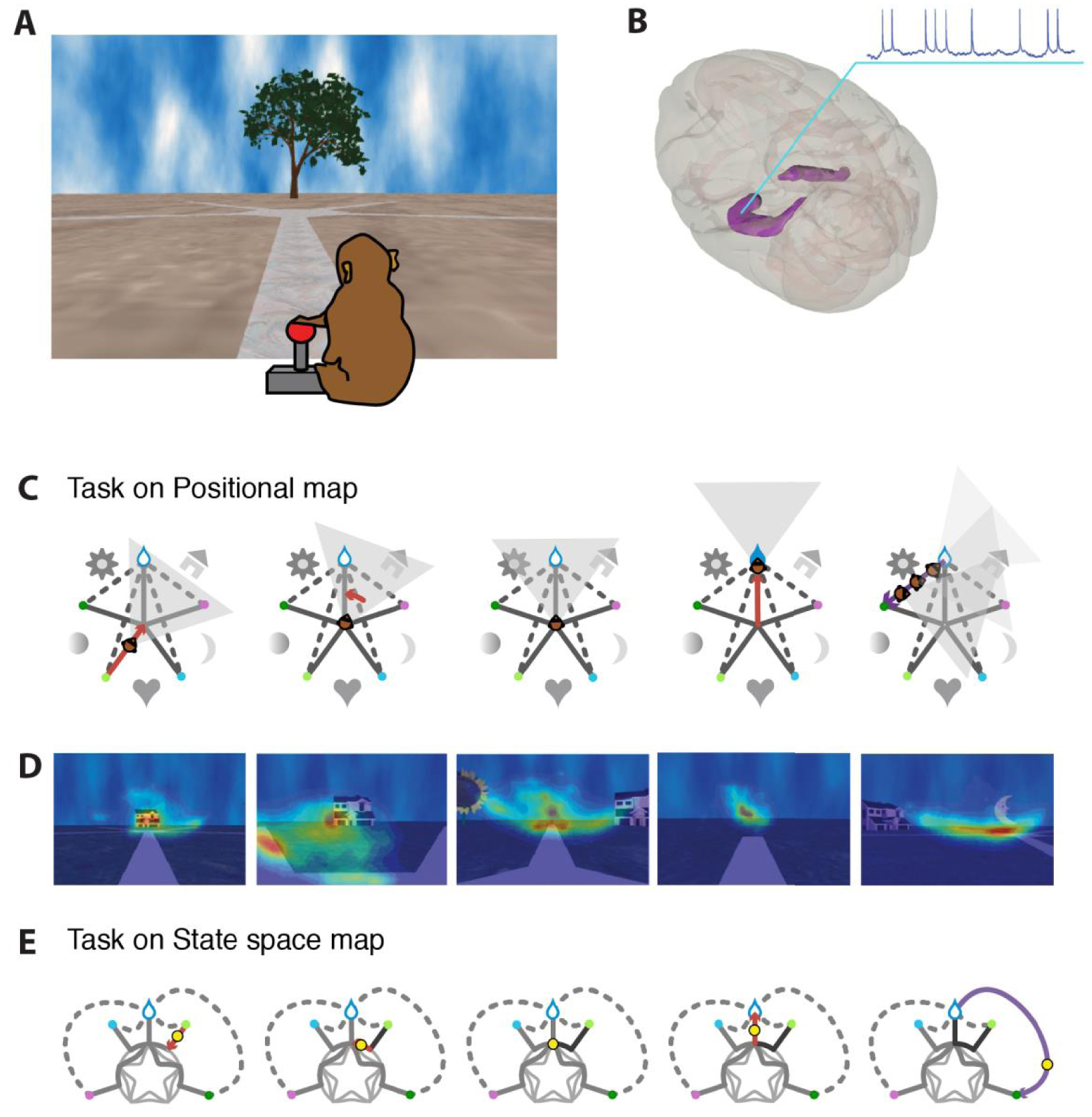
A. Illustration de la tâche. L’animal est immergé dans un environnement virtuel en 3D dans lequel il se déplace à l’aide d’un joystick. Les mouvements autorisés se font le long des chemins de ce labyrinthe à 5 branches. Des points de repère visuels sont situés entre les branches du labyrinthe (ici, seul l’arbre qui se trouve devant l’animal est visible). B. Nous avons enregistré des neurones de l’hippocampe, bilatéralement. C. Représentation schématique d’un essai réussi : le singe se déplace le long du bras d’entrée (identifié ici par le point vert clair), tourne au centre, se déplace le long du bras de sortie vers la récompense (goutte bleue), puis est replacé à un autre point de départ. D. Cartes de densité des points de regard de l’animal pendant un tel essai, superposées sur la scène visualisée. E. Graphe des déplacements valides dans le labyrinthe. Tout essai réussi correspond à un chemin reliant le point d’entrée à la sortie récompensée ; la rosette intérieure correspond à toutes les rotations possibles au centre de l’étoile. Ce graphe est une représentation visuelle d’une partie de l’espace d’état de la tâche (les mouvements erronés n’ont pas été analysés car trop peu fréquents). Masquer
A. Illustration de la tâche. L’animal est immergé dans un environnement virtuel en 3D dans lequel il se déplace à l’aide d’un joystick. Les mouvements autorisés se font le long des chemins de ce labyrinthe à 5 branches. Des points ... Lire la suite
À chaque séance de travail, un animal explorait à la fois un labyrinthe familier dans lequel le taux de réussite de l’animal dépassait 90%, et un labyrinthe inédit qui affichait des points de repère visuels jamais vus ; l’ordre des sessions était aléatoire. Bien que les animaux aient eu initialement besoin de plus de 6 semaines d’entraînement pour atteindre une performance satisfaisante dans le labyrinthe familier, ils étaient ensuite capables de généraliser cet apprentissage aux labyrinthes nouveaux, atteignant typiquement la récompense avec une régularité qui dépassait le hasard après une douzaine d’essais.
L’utilisation d’un environnement virtuel nous a permis de tester la nature des représentations spatiales de manière contrôlée tout en mesurant les mouvements des yeux et l’activité cérébrale. Les mouvements des yeux étaient enregistrés à 60 Hz à l’aide d’un oculomètre ASL. L’activité neuronale était enregistrée avec un amplificateur Plexon couplé à un système d’acquisition Spike2, à l’aide d’électrodes en tungstène ou d’électrodes laminaires à contacts multiples (U-probes Plexon). Sur les 189 cellules enregistrées dans tout l’hippocampe (principalement CA1 et CA3), nous en avons analysé 101 dont la décharge maximale était supérieure à 1 Hz et qui avaient émis plus de 100 potentiels d’action au cours des essais récompensés dans les deux environnements. Toutes les procédures expérimentales ont été approuvées par le comité vétérinaire de protection des animaux et le comité d’éthique local.
3. Résultats
3.1. Une représentation de l’espace largement conjonctive
Considérée en fonction de l’emplacement de l’animal dans le labyrinthe, l’activité des cellules de l’hippocampe était similaire à celle des cellules de lieu décrites chez le rongeur. Néanmoins, l’activité des cellules augmentait souvent lorsqu’un repère visuel donné apparaissait ou lorsque l’animal le regardait, codant ainsi une activité sensorielle pertinente pour l’orientation de l’animal dans le labyrinthe. En fait, lorsque l’activité des cellules était représentée dans un « espace d’état », c’est-à-dire un espace dans lequel résoudre la tâche est équivalent à sélectionner un chemin dans le graphe des déplacements possibles (Figure 1E), le contenu en information des cellules était maximal et la décharge la plus éparse. Ceci exprime le fait que les cellules s’activaient non seulement pour une position ou une orientation, mais aussi en fonction d’une conjonction d’indices sensoriels, moteurs et motivationnels qui permettaient de résoudre la tâche. Par exemple, dans la même position et orientation au centre du labyrinthe, une cellule pouvait présenter une activité sélective en fonction de l’action du singe par rapport à la récompense. Une cellule pouvait également encoder un indice visuel spécifique, différemment selon le point de vue depuis lequel cet indice est perçu, et selon la position et l’action de l’animal (Figure 2B, C). Ce qui pourrait apparaître superficiellement comme une cellule de lieu est généralement une telle cellule multiplexée. Nous renvoyons le lecteur à la référence [13] pour une description plus détaillée de ces travaux.
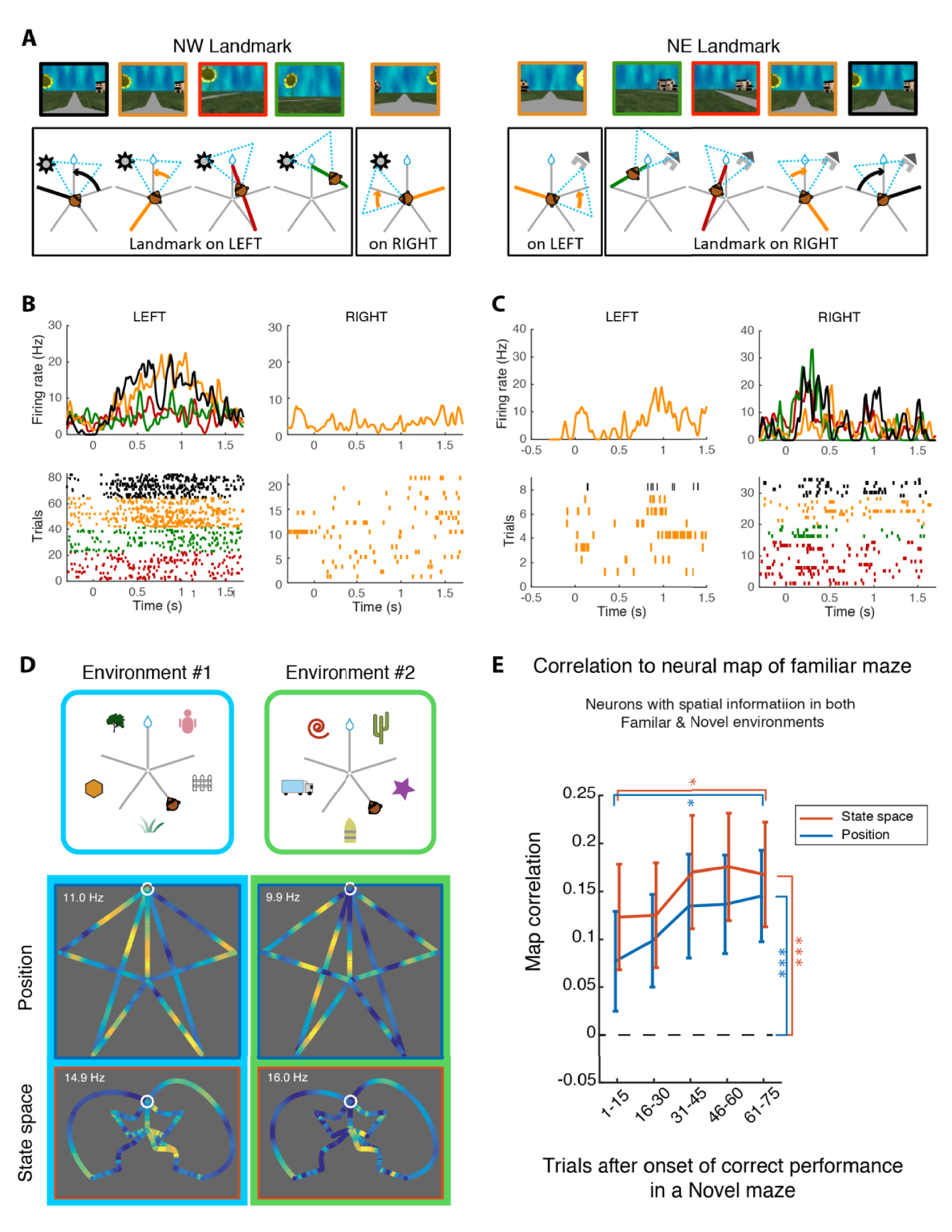
A. Illustration des différentes façons dont un singe pourrait voir apparaître un point de repère donné dans le champ visuel. B et C. Deux exemples de neurones qui déchargent différemment pour le même point de repère en fonction du contexte de la tâche (code couleur comme dans le panneau A). L’activité augmente généralement ∼150 ms après le début de l’apparition du stimulus. D. Exemple de « cellule de schéma » qui décharge de manière corrélée dans deux environnements isomorphes. E. Augmentation de la corrélation entre les cartes des labyrinthes « Familier » et « Inédit » au cours des essais dans le labyrinthe « Inédit » (dans le même temps, le taux de réussite n’augmente pas de manière significative). Masquer
A. Illustration des différentes façons dont un singe pourrait voir apparaître un point de repère donné dans le champ visuel. B et C. Deux exemples de neurones qui déchargent différemment pour le même point de repère en fonction du contexte ... Lire la suite
Nos observations corroborent l’idée selon laquelle l’hippocampe fait partie d’un système de mémoire relationnelle, reliant les différents éléments d’information qui sont pertinents pour le comportement adéquat de l’animal. En particulier, ils montrent comment les épisodes de la mémoire sont ancrés dans l’action et, comme c’est le cas ici, situés dans un contexte motivationnel.
3.2. L’hippocampe encode à la fois des souvenirs épisodiques et des schémas
Nos animaux exploraient à la fois un environnement familier et un environnement isomorphe mais dont les points de repère étaient entièrement nouveaux. Comment l’activité de l’hippocampe se modifiait-elle entre ces deux espaces ? En corrélant les cartes neurales de chaque environnement, alignées sur la position de la récompense, nous avons découvert qu’environ deux tiers des cellules déchargeaient spécifiquement pour un l’environnement. Ces neurones qui cartographient les deux labyrinthes de façon différente encodent probablement les aspects uniques à chaque contexte tel que les points de repère situés entre les branches de l’étoile. Le tiers restant des cellules s’activaient de manière significativement corrélée entre les deux environnements (Figure 2D). De plus, au fur et à mesure que l’exploration progressait au cours des essais dans le nouvel environnement, la corrélation entre les cartes augmentait (Figure 2E). Cela suggère que ces cellules expriment l’organisation géométrique implicite d’un labyrinthe en étoile autour de la récompense invisible, ou en d’autres termes, sa nature logique ou conceptuelle. En référence aux travaux de Bartlett [14] et Piaget [15], nous avons appelé ces cellules les « cellules de schéma » [16].
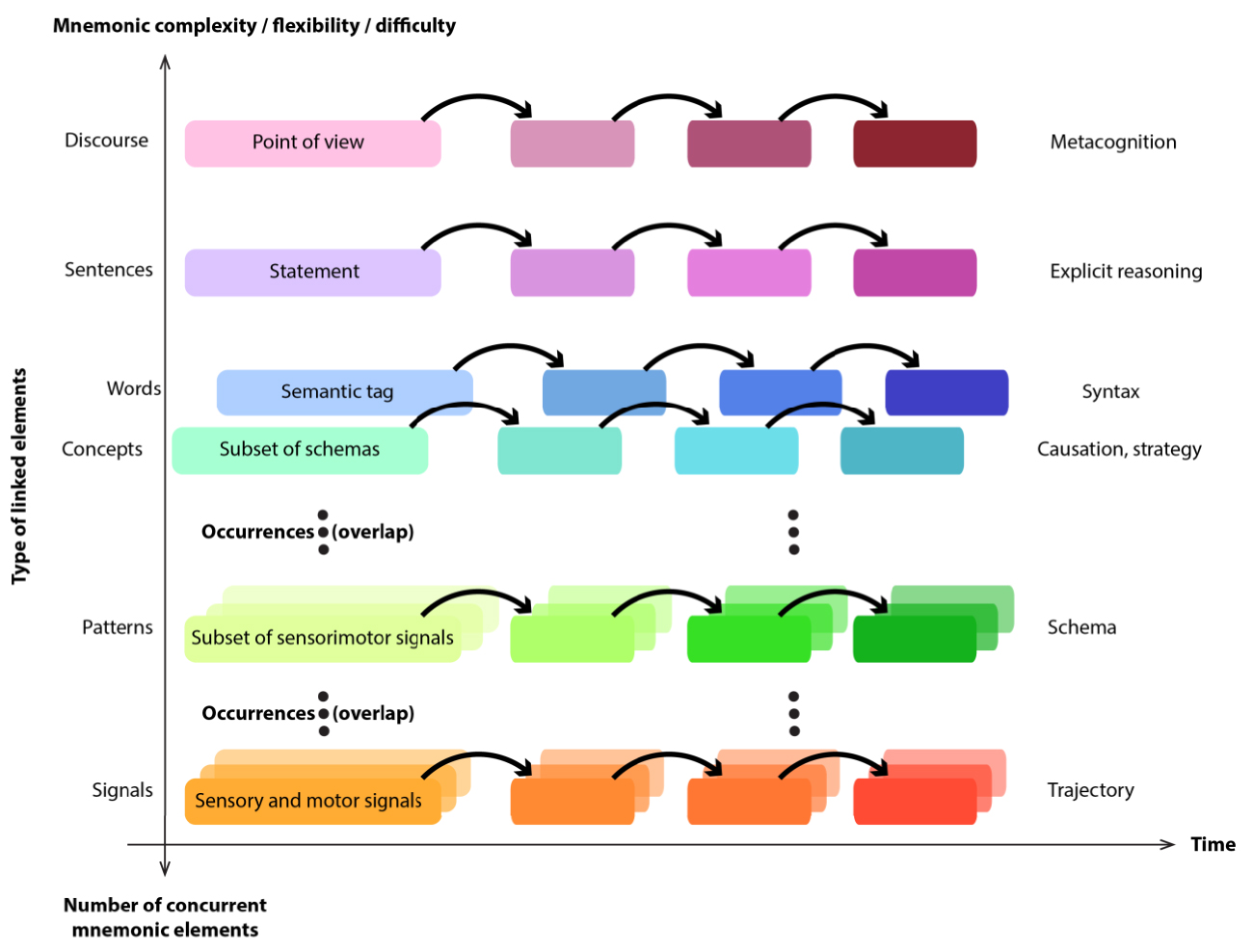
Une tentative d’unification des différentes formes de mémoire déclarative à travers les notions de conjonction d’éléments et d’enchaînement temporel. Chaque niveau s’ancre sur le précédent, en utilisant des ensembles de transitions à travers le niveau inférieur comme blocs élémentaires de construction.
4. Les concepts sont-ils des patterns de souvenirs reliés entre eux ?
Afin de réaliser avec succès la tâche du labyrinthe, l’animal devait garder en mémoire à la fois les données spécifiques à l’environnement (« la récompense est à gauche du tournesol ») et le schéma général de la tâche (« c’est un labyrinthe en étoile à 5 branches, il y a une récompense à gagner, cachée quelque part au bout d’un de ces chemins, et le fait de déplacer le joystick dans la direction appropriée y mènera »). Nos observations suggèrent que l’hippocampe représente les deux types de mémoire. Les souvenirs épisodiques d’occurrences uniques ou répétées d’un environnement donné pourraient être formés par les représentations entremêlées d’éléments co-occurrents (patterns combinatoires), tandis que les schémas stockeraient les homologies partielles entre ces patterns. Plus généralement, nous suggérons que les concepts peuvent être considérés comme des patterns d’éléments récurrents, stockés de la même manière que les éléments spatiaux, temporels ou d’identité. Par exemple, de la même manière qu’un lieu peut être représenté comme l’intersection de données sur des points de repère clés (« Le musée du Louvre se trouve à côté du fleuve la Seine, et du parc des Tuileries »), un concept serait l’intersection des expériences récurrentes : (« les châteaux royaux sont de très larges demeures souvent bordées de jardins agrémentés de lacs, et proches de voies fluviales »). Dans ce cadre, de la même manière qu’un élément épisodique peut être ancré sur un autre élément épisodique (« à cet endroit du Louvre où je l’ai rencontré pour la première fois »), l’hippocampe participerait à l’ancrage d’un concept sur un autre concept. Ce processus d’amorçage pourrait conduire à l’encodage de souvenirs épisodiques très riches ou de concepts très élaborés. Quel est le rapport avec la mémoire sémantique, qui diffère de la mémoire épisodique ? En effet, les patients amnésiques présentent souvent une mémoire sémantique préservée et une perte de mémoire épisodique (bien que l’inverse existe également, voir par exemple [17]). Cette dissociation comportementale apparente observée chez les patients amnésiques pourrait résulter de la spécialisation du néocortex dans le stockage des mémoires à long terme. Une étude récente chez l’homme montre que des lésions spécifiques de l’hippocampe affectent principalement le rappel de souvenirs épisodiques nouvellement formés, avec une préservation de la mémoire sémantique personnelle [18]. Si notre analyse est correcte, ces patients devraient présenter des déficits similaires dans le rappel de concepts nouvellement formés.
En poussant notre raisonnement encore plus loin, les bases neurales de toutes les formes de mémoire déclarative, qu’elles soient épisodiques, spatiales, sémantiques ou lexicales, pourraient partager une architecture neurale commune dans laquelle l’hippocampe jouerait un rôle similaire (Figure 3). Cela est évidemment impossible à tester chez l’animal. Toutefois, si l’on revient à nos résultats, il n’est pas si surprenant que l’hippocampe du singe puisse participer au stockage d’une mémoire conceptuelle. Certains primates comme les singes verts d’Afrique de l’Ouest, par exemple, utilisent des vocalisations spécifiques pour désigner une catégorie de prédateurs (serpent, panthère ou aigle) qui déclenchent des comportements adaptés chez les singes récepteurs. On s’est récemment aperçu que la vocalisation associée à la notion de « danger aérien » qui correspond généralement aux aigles, a été étendue aux drones [19]. Ces vocalisations ne sont ainsi pas très éloignées de nos mots qui désignent des catégories. Bien sûr, aucun autre primate que l’homme ne maîtrise le langage, c’est-à-dire la capacité à enchaîner librement ces mots en des énoncés complexes. Nous spéculons que cette capacité spéciale pourrait être une conséquence de l’interaction accrue entre le système de mémoire de l’hippocampe et le néocortex hautement développé chez les humains. Cette expansion des connexions, matérialisée par une proportion relativement plus élevée de cellules dans le CA1, la sortie de l’hippocampe vers le cortex, par rapport à d’autres subdivisions hippocampiques [20], permettrait un développement sémantique depuis les simples conjonctions de repères jusqu’aux méta-concepts élaborés qui sous-tendent les grammaires du langage — tout en améliorant également la vitesse et la flexibilité des associations de concepts.



 CC-BY 4.0
CC-BY 4.0