1. Introduction
Understanding the mechanisms which regulate nucleus positioning and deciphering which information this positioning conveys constitutes a major research axis in Reproductive as well as in Developmental biology. In fact, in most species, the position of the nucleus at the end of oocyte growth predefines the axes of the future embryo. Thus, in nematode, sea urchin, Xenopus and zebrafish, the oocyte nucleus marks the animal pole, which will instruct future embryo axes, and in Drosophila, it defines the future dorso-ventral axis of the embryo.
However, this is not the case in mammals where the nucleus is found perfectly centered at the end of oocyte growth in the ovary. This centering of the nucleus is even more surprising as oocytes then perform two extremely asymmetrical divisions, with off-centering of their chromosomes (Figure 1). Even more surprisingly, in the oocyte from mouse and human, there is even a correlation between centering of the nucleus and the success of meiotic divisions [1, 2].
The work of Maria Almonacid, under the supervision of Marie-Hélène Verlhac at the CIRB, Collège de France, sought to better understand this unexpected link between centering of the nucleus and successful meiosis in the mammalian oocyte [3].
2. Centering of the oocyte nucleus via an actin-dependent gradient of pressure
The mouse oocyte, a large spherical cell of 80 μm, lacks the characteristics (centrosomes and associated microtubules, differentiated cortex) that normally allow polarization, definition of its geometric center and nucleus positioning [4]. However, it manages to perfectly center its nucleus, a size that is comparable to the one of a somatic cell (30 μm). During previous work, Maria Almonacid and Marie-Hélène Verlhac, in collaboration with bio-physicists Timo Betz (Institut Curie, Paris) and theoreticians Raphaël Voituriez (SU, Paris) and Nir Gov (Weizmann Institute, Tel Aviv), discovered a novel and very original mode of oocyte nucleus centering, which depends only on the actin cytoskeleton and not on microtubules, unlike in many other cell types [5].
Oocytes invalidated for the Formin 2 actin nucleator (Fmn2−∕−), an essential maternal gene, present off-centered nuclei. The reintroduction of Formin 2 allows the formation of an actin meshwork in the cytoplasm and causes the nucleus to center, in an extremely robust manner: all oocytes have their nucleus centered within 6 hours (Figure 2). This centering is dependent on the molecular actin motor, Myosin Vb, which generates the dynamics of the actin mesh (Figure 2). The role of Myosin Vb is twofold: it creates a gradient in the activity of the actin meshwork, which decreases from the cortex to the center, analogous to a gradient of pressure which generates a force that non-specifically pushes the nucleus to the center; it also fluidifies the cytoplasm by advection, creating a global motion of all cytoplasmic organels, hence an environment that is suitable for the motion of large objects such as the nucleus.
Oocyte Growth in Prophase of the first meiotic division (Prophase I) and preparation for early stages of development in Mammals.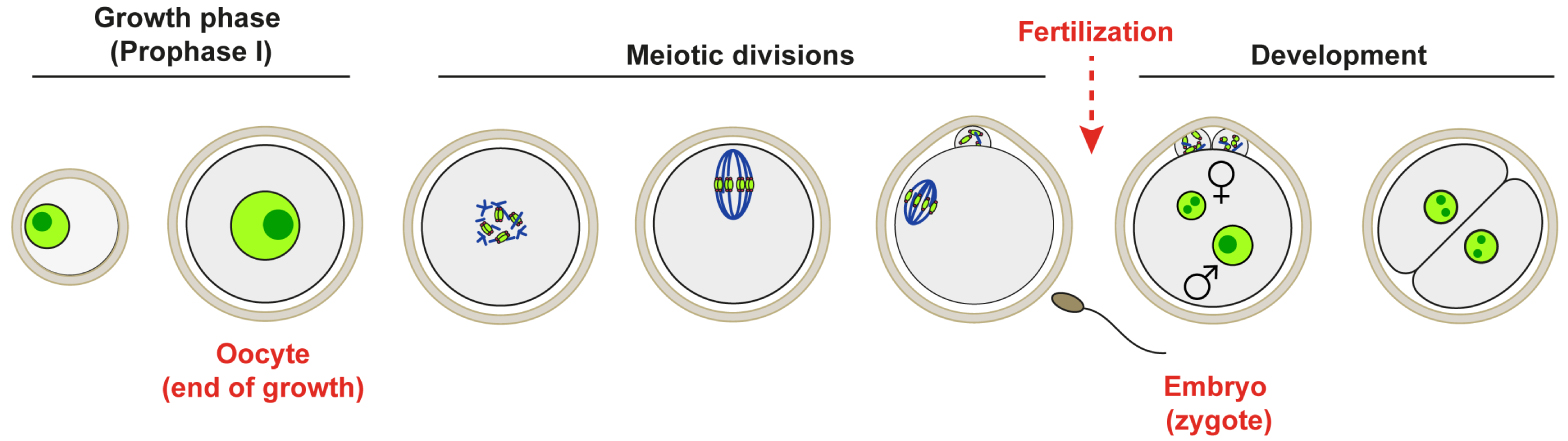
Centering of the nucleus by a cytoplasmic actin network in the mouse oocyte A: Left: Visualization of the actin network in mouse oocytes arrested in prophase I of meiosis. Left: Fmn2−∕− oocyte, absence of cytoplasmic actin network. Right: Restoration of the cytoplasmic actin network and centering of the nucleus after reintroduction of Formin 2 into Fmn2−∕− oocytes. In the original images, actin is white and chromatin is green. In the diagrams, the actin is in red and the nucleus in light green. The large dark green dot corresponds to the nucleolus. B: Model of positioning of the nucleus by the dynamics of the cytoplasmic actin network dependent on Myosin Vb. Left: Balance of forces acting on the nucleus. Fp: propulsive force proportional to the activity gradient of the 〈v2〉 actin network. Ff: friction force, proportional to the viscosity of the cytoplasm 𝜆 and opposed to the force of propulsion.V represents the velocity of the nucleus. Right: Activity gradient 〈v2〉 of the actin network causing the propulsive force Fp from the cortex to the center of the oocyte. Myosin Vb is purple, actin red, and the nucleus is green.
This mechanism mainly detects the size of objects [6]. So any object that is large enough can be transported over quite long distances, which is very beneficial in the case of large cells such as oocytes.
The robustness of this new nucleus centering mechanism has led Maria Almonacid and Marie-Hélène Verlhac to interrogate its physiological role in aspects of their work oriented towards Reproductive and Developmental biology [3].
Meiotic divisions and the first stages of embryonic development occur in the absence of transcription and depend exclusively on maternal transcripts accumulated in the oocyte during its growth (Figure 1). The oocyte growth phase, during which the nucleus is centered, corresponds to the last oocyte developmental stages where the composition of the transcriptome can still be regulated. Thus, the centering of the nucleus could potentially be involved in the regulation of oocyte transcription and the centering of the nucleus could predict the competency of the female gamete, namely its capacity to carry out meiotic divisions, and to produce a viable embryo, after fertilization.
3. The cytoplasmic actin network nucleated by Formin 2 impacts the position and also the architecture of the nucleus
Oocytes invalidated for Formin 2 have off-centered nuclei and also present deformed nuclei compared to control ones. They systematically exhibit an invagination and their chromatin appears less condensed. These combined defects tend to increase the contacts between the nuclear envelope and chromatin, contacts that are usually scarce in late-growing oocytes (Figure 3A).
Formin 2, nuclear architecture and expression of oocyte genes A: Nuclear architecture defects in Fmn2−∕− oocytes. Chromatin (in green) and Lamine A (in magenta) in the Fmn2+∕− (controls) and − ∕− nuclei. The white arrow indicates the characteristic invagination of the Fmn2−∕− nuclei. B: Differential expression of genes in Fmn2+∕− (controls) and − ∕− oocytes analyzed by RNAseq.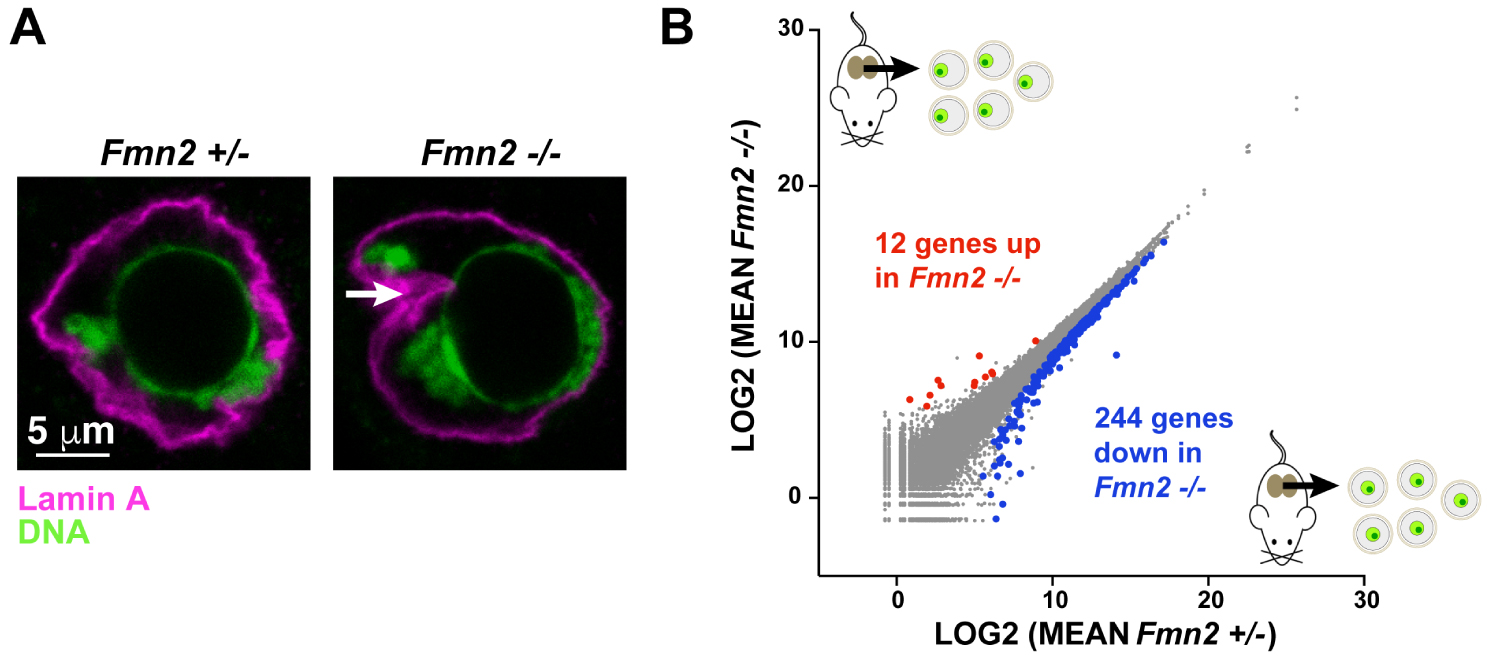
In collaboration with Auguste Genovesio (IBENS, ENS, Paris), a computational biology approach was developed to reconstruct nuclei from images acquired in 3D. This approach allowed the identification, in an unbiased manner, of parameters allowing to describe quantitatively the architecture of oocyte nuclei and thus distinguish different categories of nuclei on the sole basis of these parameters. In this way, the variations in nuclear architecture between different conditions (controls, Fmn2−∕−, Fmn2−∕− in which the entire Formin 2 or its actin nucleating domain FH1FH2 was reintroduced), could be precisely quantified.
Thus, the reintroduction of Formin 2 allows to induce nucleus centering and to completely restore nuclear shape and architecture. The reintroduction of the actin nucleating domain of Formin 2 alone restores a large part of this architecture, which shows that the cytoplasmic actin meshwork has a major contribution in maintaining the shape and architecture of the oocyte nucleus.
4. The cytoplasmic actin meshwork generates fluctuations of the nuclear envelope
The researchers then examined the nuclei at high temporal resolution using video microscopy of a nuclear probe and observed the highly dynamic nature of the nuclear envelope, which is subjected to large fluctuations in amplitude and frequency.
By this mean, they confirmed the nuclear architecture defects observed in the previously described 3D approach on fixed oocytes: the control nuclei adopt a regular shape while the Fmn2−∕− nuclei or of oocytes treated with an actin depolymerizing drug are asymmetrical, mostly smooth and inactive on 2/3 of their surface, and presenting an invagination where local fluctuations occur, corresponding to the remaining 1/3.
They also clarified the role of microtubules in the dynamics of the nucleus: they help stabilize the nuclear envelope. In their absence (treatment with a drug inducing microtubule depolymerization), the fluctuations of the envelope are amplified.
They also determined the origin of the invagination observed in nuclei from oocytes lacking a cytoplasmic actin network (Fmn2−∕− or treated with a drug). It corresponds to the presence of a major microtubule organizing center (MTOC) from which the microtubules contact and locally deform the envelope.
Eventually, they quantified and performed a frequency analysis of the nuclear envelope fluctuations, which made it possible to establish a model of the mechanical properties of the nuclear envelope, still in collaboration with Raphaël Voituriez (SU, Paris). It allowed to check that the differences in the extent of fluctuations between nuclei from controls, Fmn2−∕− and controls treated with a drug depolymerizing actin, do indeed come from cytoplasmic forces and from the dynamics of the actin network. These differences are not due to intrinsic differences in the mechanical properties of the envelope.
5. Fluctuations of the nuclear envelope are transmitted inside the nucleus and set the chromatin in motion
In order to study the impact of fluctuations of the nuclear envelope within the nucleus, the movement of chromatin was monitored by video microscopy at the same temporal resolution as the one determined for the study of nuclear envelope fluctuations.
A significant reduction in the amplitude of chromatin motion was observed in oocytes lacking a cytoplasmic actin network (Fmn2−∕− or treatment with a drug). FRAP (Fluorescence Recovery After Photobleaching) experiments, allowing to measure diffusion of fluorescent proteins, on the nuclear probe, which diffuses independently of chromatin, allowed to exclude a potential difference in viscosity inside control and Fmn2−∕− nuclei. This suggested that the difference in dynamics of chromatin depended strictly on the amplitude of the nuclear envelope fluctuations. In addition, a correlation between the proximity of chromatin to the nuclear envelope and the amount of motion could be established.
Thus, fluctuations of the nuclear envelope are transmitted inside the nucleus, albeit with energy dissipation, and affect the dynamics of objects inside the nucleus, such as chromatin.
6. The fluctuations of the nuclear envelope generated by cytoplasmic actin modulate gene expression
In order to determine whether this differential chromatin dynamics has consequences on gene expression, the researchers performed a comparative RNA sequencing (RNA seq) between control and Fmn2−∕− oocytes. This transcriptomic study revealed 256 genes differentially expressed in Fmn2−∕− (244 under- and 12 over-expressed, Figure 3B).
Most of these correspond to genes encoding proteins and a thorough analysis of their chromosomal locations revealed that they were distributed evenly throughout the genome, consistent with a global effect of envelope fluctuations impacting the genome from all directions.
In order to check whether these genes were indeed sensitive to nucleus centering, the level of expression of the most significantly deregulated genes were analyzed in oocytes whose nucleus was re-centered. This showed that the re-introduction of Formin 2 into Fmn2−∕− oocytes partially restores levels of expression of a few genes that were tested.
Recent advances in understanding nuclear organization have shown that chromatin can be active or repressed depending on whether it localizes to so-called A or B compartments and whether it is associated or not to Lamins at the inner nuclear envelope. Chromatin in A compartments is more open and active than in B, where it is more closed and harbors repressed marks. Lamin Associated Domains (LADs) are generally transcriptionally silent and chromatin is enriched in repressed marks (for a review see [7]). A cross-analysis of the list of deregulated genes with data from LADs and compartments in ES cells shows a preferential localization of these genes in active domains of chromatin (constitutive interLADs, which are regions never found associated to Lamins in a panel of different cell types [8] and A compartments [9]). This is consistent with a partial recovery of gene expression levels dependent on transcriptional activity, since it was not observed in the presence of transcription inhibitors. These results have also led to reconsider the dogma of a total shutdown of transcriptional activity at the end of oocyte growth, complementary to findings in Drosophila oocytes [10, 11]. Indeed, we provide evidence for persistent transcriptional loci whose activity depends on the presence of the actin mesh in fully grown mouse oocytes.
Eventually, the absence of actin filaments in the nucleus and the comparable levels of monomeric actin in the nuclei of control and Fmn2−∕− oocytes allows to rule out a contribution of nuclear actin in these processes.
Model of nuclear mechano-transduction in mouse oocytes. The pressing force generated by the dynamics of the actin network creates fluctuations in the nuclear envelope which are transmitted inside the nucleus and to chromatin, thereby modulating the transcription of some genes.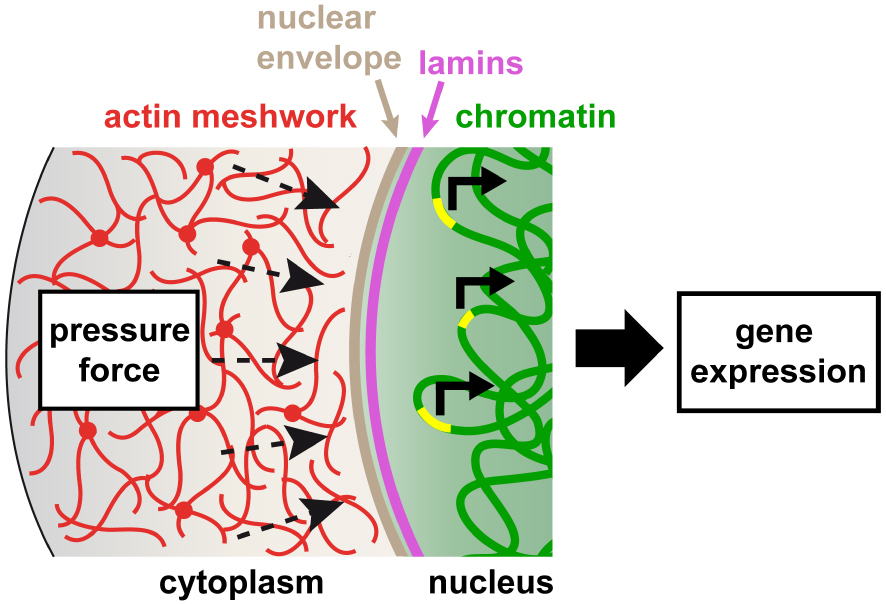
Taken together, these results argue in favor of an entirely new mechanism of gene regulation by mechano-transduction, driven by the dynamics of the cytoplasmic actin network impacting chromatin and gene expression inside the nucleus through fluctuations of the nuclear envelope.
7. Conclusion
This collaborative work between biologists, theoretical bio-physicists and statisticians has made it possible to better understand the link between nucleus centering and the success of meiotic divisions. The same physical phenomenon that centers the oocyte nucleus generates a unique type of mechano-transduction process in which the dynamics of the actin network in the cytoplasm agitates the nucleus by actively “massaging” its surface. This process allows the transmission of forces from the cytoplasm inside the nucleus, controlling the transcription of a certain set of genes (Figure 4) [3].
Meiotic divisions as well as early stages of embryo development occur at very low transcriptional levels, hence the success of the first stages of embryo development depends strictly on the amount of maternal mRNAs accumulated in the oocyte. This amount is impacted in the absence of the mechano-transduction process coming from the cytoplasm. Thus by finely modulating maternal mRNAs stores, nucleus centering is predictive of the quality of the female gamete and of its developmental potential after fertilization.
French version
1. Introduction
Comprendre les mécanismes régulant la position du noyau et connaître l’information contenue dans ce positionnement constitue un axe de Recherche important en Biologie du Développement et de la Reproduction. En effet, chez la plupart des espèces, la position du noyau en fin de croissance ovocytaire prédéfinit les axes du futur embryon. Ainsi, chez le nématode, l’oursin, le Xénope et le poisson-zèbre, le noyau ovocytaire marque l’emplacement du pôle animal, dont dépendront les futurs axes embryonnaires, et chez la Drosophile, il définit le futur axe dorso-ventral de l’embryon.
Or ce n’est pas le cas des Mammifères où le noyau se retrouve parfaitement centré en fin de croissance ovocytaire dans les ovaires. Ce centrage du noyau est d’autant plus étonnant que les ovocytes effectuent ensuite deux divisions extrêmement asymétriques, avec excentrage des chromosomes (Figure 1). Plus surprenant encore, dans l’ovocyte de souris et d’humain, il existe même une corrélation entre le centrage du noyau et le succès des divisions méiotiques [1, 2].
Croissance ovocytaire en Prophase de première division de Méiose (Prophase I) et préparation aux premières étapes du développement chez les Mammifères.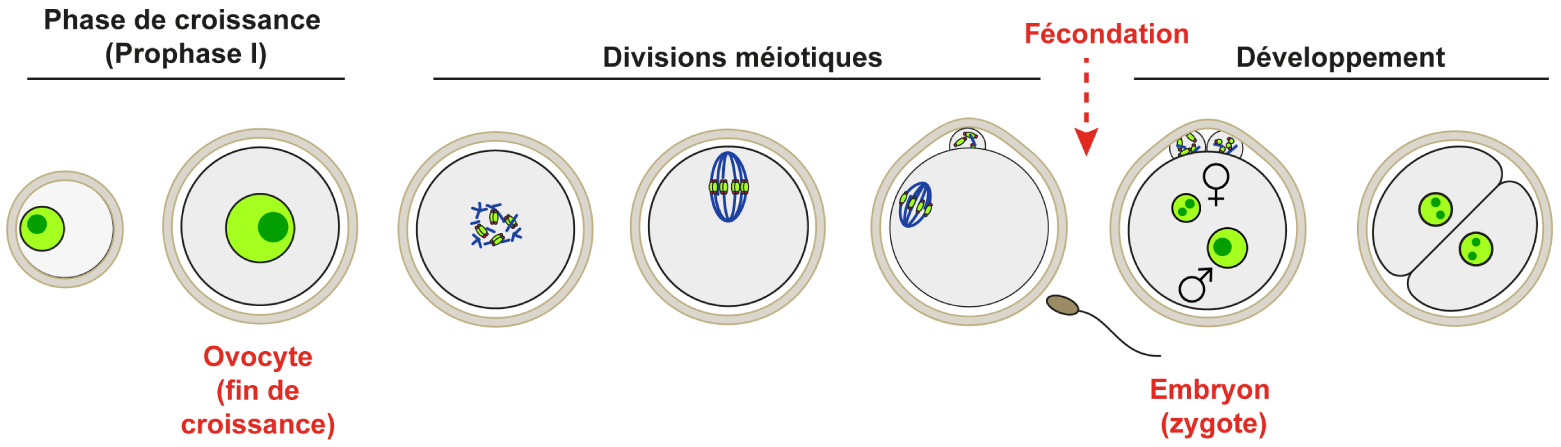
Les travaux de Maria Almonacid, sous la direction de Marie-Hélène Verlhac au CIRB, Collège de France, ont cherché à mieux comprendre ce lien paradoxal entre centrage du noyau et succès de la méiose dans l’ovocyte de Mammifère [3].
2. Centrage du noyau ovocytaire par l’actine sous l’effet d’un gradient de pression
L’ovocyte de souris, une grosse cellule sphérique de 80 μm, est dépourvu des caractéristiques (centrosomes et microtubules associés, cortex différencié) qui permettent normalement la polarisation cellulaire, la définition du centre géométrique et le positionnement du noyau [4]. Cependant, l’ovocyte parvient à parfaitement centrer son noyau, dont la taille est proche de celle d’une cellule somatique (30 μm). Au cours de travaux précédents, Maria Almonacid et Marie-Hélène Verlhac, en collaboration avec les bio-physiciens Timo Betz (Institut Curie, Paris) et les théoriciens Raphaël Voituriez (SU, Paris) et Nir Gov (Institut Weizmann, Tel Aviv), ont découvert ce mode de centrage du noyau, inédit et très original, qui dépend uniquement du cytosquelette d’actine et non des microtubules, contrairement à beaucoup d’autres types cellulaires [5].
Des ovocytes invalidés pour le nucléateur d’actine Formine 2 (Fmn2−∕−), un gène maternel essentiel, ont leur noyau excentré. La réintroduction de la Formine 2 permet la formation d’un réseau d’actine dans le cytoplasme et entraîne le recentrage du noyau, au cours d’un processus extrêmement robuste : tous les ovocytes ont leur noyau recentré en 6 heures (Figure 2). Ce centrage est dépendant du moteur moléculaire, la Myosine Vb, qui génère la dynamique du réseau d’actine (Figure 2). Le rôle de la Myosine Vb est double : elle crée un gradient d’activité du réseau d’actine, qui décroît du cortex vers le centre, analogue à un gradient de pression qui génère une force poussant de manière non-spécifique le noyau jusqu’au centre ; elle fluidifie également le cytoplasme par advection, entraînant un mouvement généralisé de tous les organelles, créant un environnement propice au déplacement vers le centre de gros objets comme le noyau.
Centrage du noyau par un réseau d’actine cytoplasmique dans l’ovocyte de souris A : Gauche : Visualisation du réseau d’actine dans des ovocytes de souris arrêtés en Prophase I. Gauche : ovocyte Fmn2−∕−, absence de réseau d’actine cytoplasmique. Droite : Restauration du réseau d’actine cytoplasmique et centrage du noyau après réintroduction de Formine 2 (Fmn2) dans des ovocytes Fmn2−∕−. Sur les images d’origine, l’actine est en blanc et la chromatine en vert. Sur les schémas, l’actine est en rouge et le noyau en vert clair. Le gros point vert foncé correspond au nucléole. B : Modèle de positionnement du noyau par la dynamique du réseau d’actine cytoplasmique dépendante de la Myosine Vb. Gauche : Bilan des forces s’exerçant sur le noyau. Fp : force de propulsion proportionnelle au gradient d’activité du réseau d’actine 𝛻〈v2〉. Ff : force de friction, proportionnelle à la viscosité du cytoplasme 𝜆 et opposée à la force de propulsion. V représente la vitesse du noyau. Droite : Gradient d’activité 𝛻〈v2〉 du réseau d’actine à l’origine de la force de propulsion Fp depuis le cortex vers le centre de l’ovocyte. La Myosine Vb est en violet, l’actine en rouge et le noyau en vert.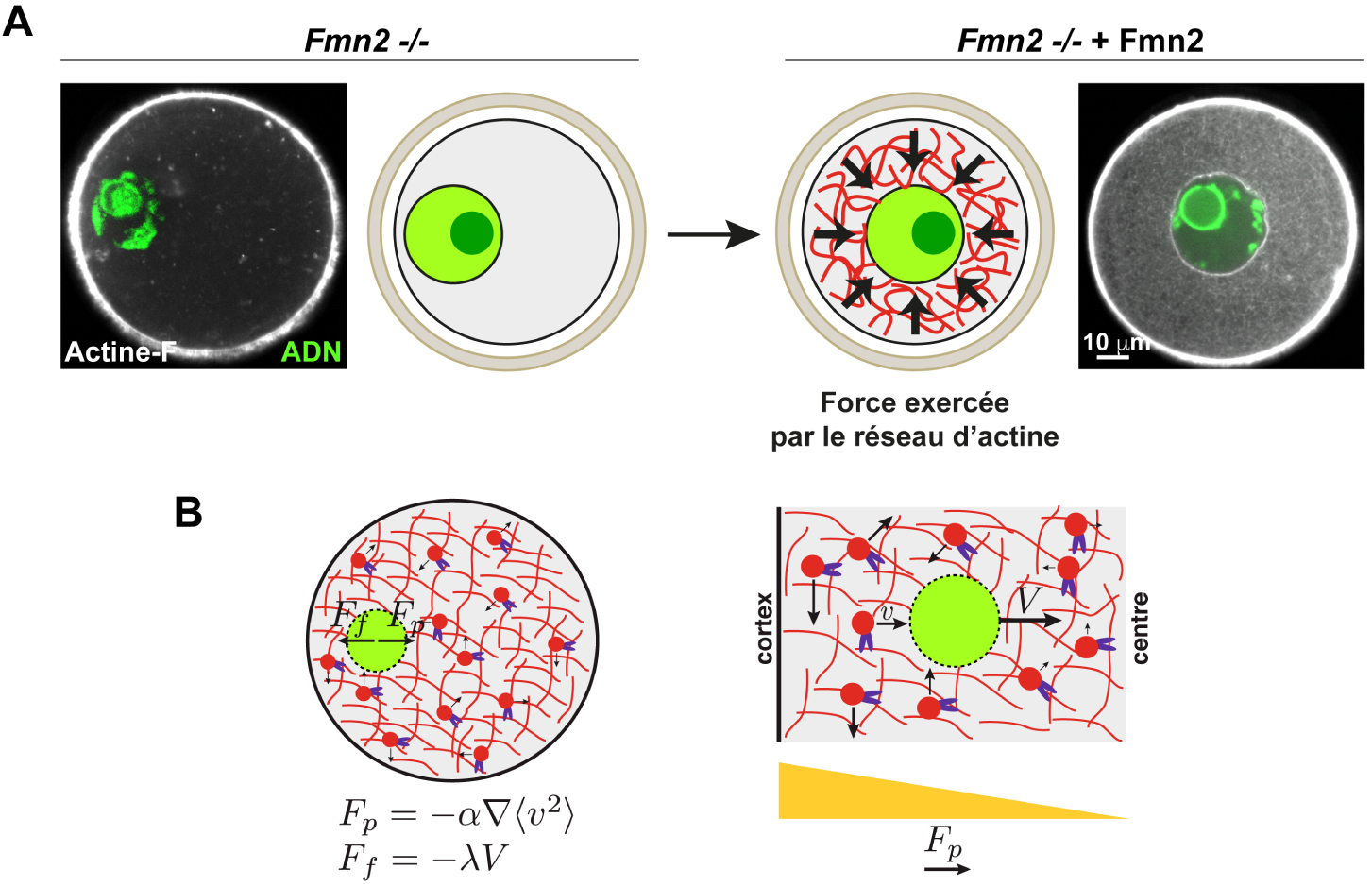
Ce mécanisme détecte surtout la taille des objets [6]. Ainsi n’importe quel objet suffisamment gros peut être transporté sur d’assez longues distances, ce qui est très avantageux dans le cas de grosses cellules comme les ovocytes.
La robustesse de ce nouveau mécanisme de centrage du noyau a amené Maria Almonacid et Marie-Hélène Verlhac à questionner son rôle physiologique lors de travaux orientés vers la biologie de la Reproduction et du Développement [3].
Formine 2, architecture nucléaire et expression des gènes ovocytaires A : Défauts d’architecture nucléaire dans les ovocytes Fmn2−∕−. Chromatine (en vert) et Lamine A (en magenta) dans les noyaux Fmn2+∕− (contrôles) et − ∕−. La flèche blanche indique l’invagination caractéristique des noyaux Fmn2−∕−. B : Expression différentielle des gènes dans les ovocytes Fmn2+∕− (contrôles) et − ∕− analysée par RNAseq (séquençage des ARNs).
Les divisions méiotiques et les premières étapes du développement embryonnaire se font en absence de transcription et dépendent exclusivement des transcrits maternels accumulés dans l’ovocyte pendant sa croissance (Figure 1). La phase de croissance ovocytaire, durant laquelle a lieu le centrage du noyau, est donc la dernière étape durant laquelle la composition du transcriptome peut être régulée dans l’ovocyte. Ainsi, le centrage du noyau pourrait potentiellement intervenir dans la régulation de la transcription ovocytaire et le centrage du noyau pourrait présager de la compétence du gamète femelle, c’est-à-dire de sa capacité à réaliser les divisions méiotiques, et à donner naissance, après fécondation, à un embryon capable d’un développement précoce correct.
3. Le réseau d’actine cytoplasmique nucléé par la Formine 2 impacte la position, mais aussi l’architecture du noyau
Les ovocytes invalidés pour la Formine 2 ont des noyaux excentrés, mais ont également des noyaux déformés par rapport à des ovocytes contrôles. Ces noyaux présentent systématiquement une invagination et leur chromatine apparaît moins condensée. Combinés, ces défauts ont pour effet d’augmenter les contacts entre l’enveloppe nucléaire et la chromatine, qui sont d’ordinaire peu nombreux dans les ovocytes en fin de croissance (Figure 3A).
En développant une approche de biologie computationnelle, en collaboration avec Auguste Genovesio (IBENS, ENS, Paris), une reconstruction des noyaux à partir d’images acquises en 3D a été réalisée, permettant d’identifier, sans à priori, des paramètres quantifiables décrivant l’architecture des noyaux ovocytaires et de distinguer ainsi différentes catégories de noyaux sur la seule base de ces paramètres. De cette manière, les variations d’architecture nucléaire entre différentes conditions (contrôles, Fmn2−∕−, Fmn2−∕− dans lesquels on a réintroduit la Formine 2 entière ou son domaine nucléateur d’actine FH1FH2), ont pu être quantifiées précisément.
Ainsi, la réintroduction de Formine 2 permet de recentrer le noyau, mais également d’en restaurer totalement la forme et l’architecture et la réintroduction du domaine nucléateur d’actine seul restaure une grande partie de cette architecture, ce qui montre que le réseau d’actine cytoplasmique contribue largement au maintien de la forme et de l’architecture du noyau ovocytaire.
4. Le réseau d’actine cytoplasmique génère des fluctuations de l’enveloppe nucléaire
Les chercheuses ont ensuite examiné les noyaux en vidéo-microscopie à haute fréquence d’acquisition en utilisant une sonde nucléaire et ont pu observer le caractère très dynamique de l’enveloppe nucléaire qui fait l’objet de fluctuations importantes en amplitude et en fréquence.
Elles ont ensuite confirmé en direct les défauts d’architecture nucléaire observés dans l’approche en 3D réalisée sur ovocytes fixés: les noyaux contrôles adoptent une forme régulière tandis que les noyaux Fmn2−∕− ou d’ovocytes traités avec une drogue dépolymérisant l’actine sont asymétriques, avec une zone lisse et peu active représentant les 2/3 de la surface du noyau, et une invagination qui est le siège de fluctuations locales, correspondant aux 1/3 restants.
Elles ont également clarifié le rôle des microtubules dans la dynamique du noyau : ils permettent de stabiliser l’enveloppe nucléaire. En leur absence (traitement avec une drogue ad hoc), les fluctuations de l’enveloppe sont amplifiées.
Elles ont aussi déterminé l’origine de l’invagination dans les noyaux d’ovocytes dépourvus de réseau d’actine cytoplasmique (Fmn2−∕− ou traités avec une drogue). Elle correspond à la présence d’un centre majeur d’organisation des microtubules (MTOC) à partir duquel les microtubules contactent et déforment localement l’enveloppe.
Enfin, elles ont quantifié et réalisé une analyse en fréquence des fluctuations, ce qui a permis d’établir un modèle des propriétés mécaniques de l’enveloppe nucléaire, toujours en collaboration avec Raphaël Voituriez (SU, Paris). Ceci a permis de vérifier que les différences en termes de fluctuations entre les noyaux contrôles et Fmn2−∕− ou traités avec une drogue dépolymérisant l’actine proviennent bien du cytoplasme et de la dynamique du réseau d’actine et ne sont pas dues à des différences intrinsèques des propriétés mécaniques de l’enveloppe.
5. Les fluctuations de l’enveloppe nucléaire sont transmises à l’intérieur du noyau et mettent la chromatine en mouvement
Afin d’étudier les répercussions des fluctuations de l’enveloppe nucléaire à l’intérieur du noyau, le mouvement de la chromatine a été suivi en vidéo-microscopie en utilisant une haute fréquence temporelle d’acquisition, identique à celle adoptée pour l’analyse des fluctuations de l’enveloppe nucléaire.
Une réduction importante des mouvements de la chromatine a été observée dans les ovocytes dépourvus de réseau d’actine cytoplasmique (Fmn2−∕− ou traitement avec une drogue). Des expériences de FRAP (Fluorescence Recovery After Photobleaching), permettant de mesurer la dynamique de diffusion d’une protéine fluorescente, sur la sonde nucléaire, qui diffuse indépendamment de la chromatine, ont permis d’exclure une potentielle différence de viscosité globale à l’intérieur des noyaux contrôles et Fmn2−∕−, suggérant que les dynamiques différentes de la chromatine s’expliquent par les fluctuations de l’enveloppe nucléaire. De plus, une corrélation entre proximité de la chromatine à l’enveloppe nucléaire et quantité de mouvement a pu être montrée.
Ainsi, les fluctuations de l’enveloppe nucléaire sont transmises à l’intérieur du noyau, certes avec une dissipation d’énergie, et ont des conséquences sur la dynamique des objets à l’intérieur du noyau, en particulier la chromatine.
6. Les fluctuations de l’enveloppe nucléaire générées par l’actine cytoplasmique modulent l’expression des gènes
Afin de déterminer si cette dynamique différentielle de la chromatine a des conséquences sur l’expression des gènes, les chercheuses ont réalisé un séquençage ARN (RNAseq) comparatif entre des ovocytes contrôles et Fmn2−∕−. Cette étude transcriptomique a révélé 256 gènes différentiellement exprimés dans les Fmn2−∕− (244 sous- et 12 sur-exprimés, Figure 3B).
Il s’agit pour la plupart de gènes codants et une analyse plus approfondie de la localisation de ces gènes sur les chromosomes a révélé qu’ils étaient répartis uniformément sur tout le génome, ce qui est cohérent avec un effet global des fluctuations de l’enveloppe dans toutes les directions.
Afin de vérifier si ces gènes étaient vraiment sensibles au centrage du noyau, les niveaux d’expression des gènes les plus significativement dérégulés ont été analysés dans des ovocytes dont le noyau a été recentré. Ceci a montré que la réintroduction de Formine 2 dans les ovocytes Fmn2−∕− permet de restaurer en partie les niveaux d’expression de ces gènes.
Modèle de mécano-transduction nucléaire dans l’ovocyte de souris. La force de pression générée par la dynamique du réseau d’actine crée des fluctuations de l’enveloppe nucléaire qui sont transmises à l’intérieur du noyau et à la chromatine, modulant ainsi la transcription de certains gènes.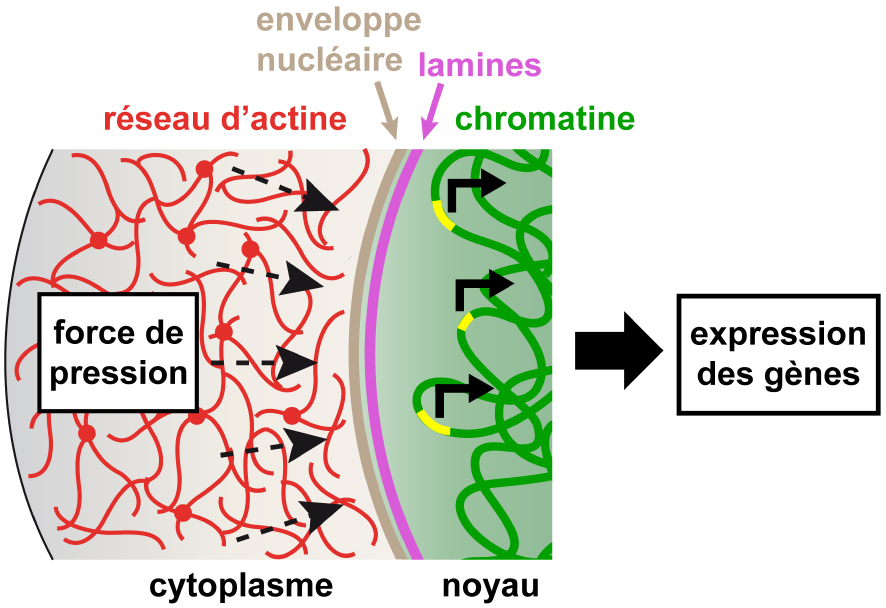
Les progrès récents dans la compréhension de l’organisation nucléaire ont montré que la chromatine peut être active ou réprimée selon sa localisation aux compartiments dits A ou B et son association ou non aux Lamines au niveau de l’enveloppe nucléaire interne. La chromatine est plus ouverte et active dans les compartiments A que dans les compartiments B, où elle est plus fermée et porte des marques répressives. Les domaines associés aux lamines (Lamin Associated Domains ou LADs en anglais) sont généralement silencieux sur le plan transcriptionnel et la chromatine est enrichie en marques répressives (pour une revue, voir [7]). Une analyse croisée de la liste des gènes dérégulés avec les données de LADs et de compartiments dans des cellules ES montre une localisation préférentielle de ces gènes dans des domaines actifs de la chromatine (interLADs constitutifs, qui sont des régions jamais trouvées en association aux Lamines dans un panel de différents types cellulaires [8] et compartiments A [9]). Ceci est en accord avec une restauration partielle des niveaux d’expression des gènes dépendante de l’activité transcriptionnelle, puisque n’ayant pas lieu en présence d’inhibiteurs de la transcription. Ces résultats ont aussi amené à questionner et nuancer le dogme de l’arrêt total de l’activité transcriptionnelle en fin de croissance ovocytaire, complémentairement à des découvertes faites dans l’ovocyte de Drosophile [10, 11]. Nos données montrent en effet la présence de loci transcriptionnels persistants détectés dans les ovocytes à ce stade et dépendants de la présence du réseau d’actine.
Enfin, l’absence de filaments d’actine dans le noyau et les niveaux comparables d’actine monomérique dans les noyaux d’ovocytes contrôles et Fmn2−∕− permettent d’écarter une contribution de l’actine nucléaire.
Pris ensemble, ces résultats plaident en faveur d’un mécanisme entièrement nouveau de régulation des gènes par mécano-transduction, sous l’effet de la dynamique du réseau cytoplasmique d’actine impactant la chromatine et l’expression des gènes à l’intérieur du noyau par le biais de fluctuations de l’enveloppe nucléaire.
7. Conclusion
Ce travail collaboratif entre biologistes, bio-physiciens théoriciens et statisticiens a permis de mieux comprendre le lien entre centrage du noyau et succès des divisions méiotiques. Le même phénomène physique qui centre le noyau ovocytaire génère un type de mécano-transduction unique en son genre dans lequel la dynamique du réseau d’actine dans le cytoplasme va agiter le noyau en « massant » activement sa surface, ce qui permet de transmettre les forces du cytoplasme à l’intérieur du noyau et de contrôler la transcription de certains gènes (Figure 4) [3].
Les étapes des divisions méiotiques ovocytaires ainsi que les premières étapes de développement embryonnaire précoce se faisant à de très bas niveaux transcriptionnels, le succès des premiers stades embryonnaires repose fondamentalement sur la quantité de transcrits maternels accumulés dans l’ovocyte. Cette quantité est impactée en absence de mécano-transduction d’origine cytoplasmique. Ainsi, en modulant finement le stock d’ARNs maternels, le centrage du noyau est prédictif de la qualité du gamète femelle et de son potentiel développemental après fécondation.



 CC-BY 4.0
CC-BY 4.0