1. Introduction
For vision, touch, taste and hearing, axonal projections from primary thalamic nuclei to the cortex define the so-called primary sensory cortical areas. These regions encode rich sensory information and have a crucial role for conscious perception in humans as can be judged at least from patients experiencing blindsight [1, 2]. In blindsight, patients with large primary visual cortex lesions have no awareness of objects in the related visual field but can perform basic visual tasks like locating object [2] or can experience visually induced emotional responses [3]. This suggests that the absence of primary sensory cortex impacts important perceptual functions while some sensory behaviors are preserved (see also [4] for auditory cortex lesions). However, because the preservation of some perceptual abilities can be due to a plastic recovery process, such case studies do not give information about the involvement of primary sensory cortex in these behaviors when the brain is intact. This aspect was more studied in animal models, particularly in rats or mice, in which rapid and efficient post-training inactivation is possible [5, 6, 7, 8]. Such experiments show that for the visual and somatosensory modalities, primary sensory cortex participates even to simple detection or discrimination behaviors [5, 6, 9, 10]. However some somatosensory cortex lesion experiments show that performance can rapidly recover after the lesion [5], suggesting as in blindsight that primary sensory cortex is dispensable for simple (but not complex [11, 12]) sensory behaviors. The same conclusion can be drawn in the auditory domain, as pre-training lesions also show that auditory cortex is dispensable for sound detection or simple discrimination [13, 14]. Nevertheless, in stark contrast to observations made for vision and touch in rodents, both in aversive [8, 15] and in appetitive [7, 16, 17] conditioning tasks, sound detection and even simple pure tone discrimination are largely resistant to post-training optogenetic inactivation or lesion targeted to auditory cortex. In addition, it was observed that cortex-independent auditory detection is associated with much shorter reaction times (∼100 ms) than cortex-dependent tasks (∼400 ms) [7]. One interpretation of these results is that, while visual and somatosensory cortex are associated to detections, auditory cortex is not used for detections, because it is easily bypassed by faster pathways. This would represent an interesting specificity of the auditory system. Alternatively, this discrepancy could be due to differences in the protocols used by the different teams for auditory, visual or somatosensory tasks.
In order to, to distinguish between these two possibilities, we used the protocol of an appetitive auditory Go/NoGo detection task and replaced the sound by a visual stimulus. This led to longer reaction times and higher sensitivity to transient cortical inactivation. Moreover, when sounds were superimposed to visual stimuli during the task, reaction times decreased and no sensitivity to auditory cortex inactivation was observed. This together confirms the idea that auditory cortex unlike visual cortex is not used by default for detections, due to the involvement of pathways that lead to faster reactions.
2. Results
2.1. Visual cortex is involved in visual detection in mice
In order to compare auditory and visual detection in the identical behavioral paradigm, we implemented an appetitive visual GO/NOGO detection task based on a task design used for auditory detection and discrimination (Figure 1A) [7]. Mice were trained to generate more than three licks after the onset of a visual stimulus and to minimize licking otherwise as was assessed with blank trials without visual stimuli (Figure 1A). As in the previously developed auditory GO/NOGO, each trial could start only if the mouse had not licked during a period of random duration ranging from 3 to 6 s. This both prevented mice to lick continuously and to use timing cues to lick in the right time window. The visual stimulus was a large disk abruptly appearing in front of the mouse and receding within 2 s. Reward was given on the third lick even before the end of the visual stimulus. After a few weeks of training the animals were able to synchronize licking to the stimulus (Figure 1B) clearly above chance levels evaluated in blank trials. This demonstrated that they detected the visual stimulus as a cue predicting reward. Comparing licking traces for the visual and blank stimuli, we could also precisely measure their decision time, as the time at which licking was significantly higher for the stimulus than for the blank (Figure 1C). Strikingly, decision time for this task was 460 ± 28 ms (mean ± SEM; Figure 1C), much longer than the 100–150 ms reported for simple cortex-independent auditory discrimination (i.e. detection of a well identifiable frequency) [7]. As cortex-dependent auditory discriminations were also reported to generate long decision times, we wondered whether our visual detection task was dependent on primary visual cortex. To test this, we injected 100 nL muscimol (1 mg/mL) or saline in the primary visual cortex contralateral to the eye facing the visual stimulus. On the first day of muscimol injection, visual detection performance was decreased to chance level (i.e. lick probability is similar in stimulated vs blank trials), while saline injection had no significant effect (Figure 1D). This indicates that visual cortex, when available, is recruited for a visual detection in mice, in line with previous reports in another task [9]. However, when visual cortex is not available, visual detection is still possible as we could verify by contralateral visual cortex lesion in one mouse, which, after recovery, was able to perform the detection task with similar decision time (Figure 1E). Although there might be biological variability in this result that we did not evaluate, this result bridges the blindsight phenomenon with our observation that post-training transient inactivation of visual cortex influences detection: when visual cortex is functional, it participates to visual detection but it is dispensable for such a simple task.
Visual detection involves visual cortex in mice. (A) Schematic (left), trial structure (top right) and reward schedule (bottom right) of the visual detection task (ITI = intertrial interval, FA = false alarm, CR = correct rejection). (B) Example lick raster plots for a training session in a naïve (left) and in a trained mouse (right). The gray shaded area indicates stimulus presentation. The corresponding peristimulus time histograms for licks and reward deliveries are shown below. (C) (top) Example of trial-averaged licking signal traces (voltage across the lick detection circuit) for a trained mouse. Trial averaging is performed over a session. Red line = trial with visual stimulus. Grey line = blank trials. Shaded area = standard error. (middle) P-value of a Wilcoxon ranked-sum test for the difference between the stimulus and blank traces. The earliest time point for which the p-value goes below 0.01 is defined as the decision time of the animal. (bottom) Decision time measured for four mice. (D) Response probabilities to lick above threshold criterion (3 licks) for visual stimulus trial subtracted by the response probability for blank trials in 3 mice, before injections (red bars) and after muscimol or saline injection in contralateral visual cortex (white bars). Performance is significantly lower than on the previous day for muscimol (Student t-test, p = 0.0487) but not for saline (Student t-test, p = 0.26) injections. (E) (left) Response probabilities (visual stimulus trials subtracted by blank trials) in one mouse, before (red bars) and after lesion of visual cortex (white bars). (right) Trial-averaged licking signal traces for the lesioned mouse, before and after lesion.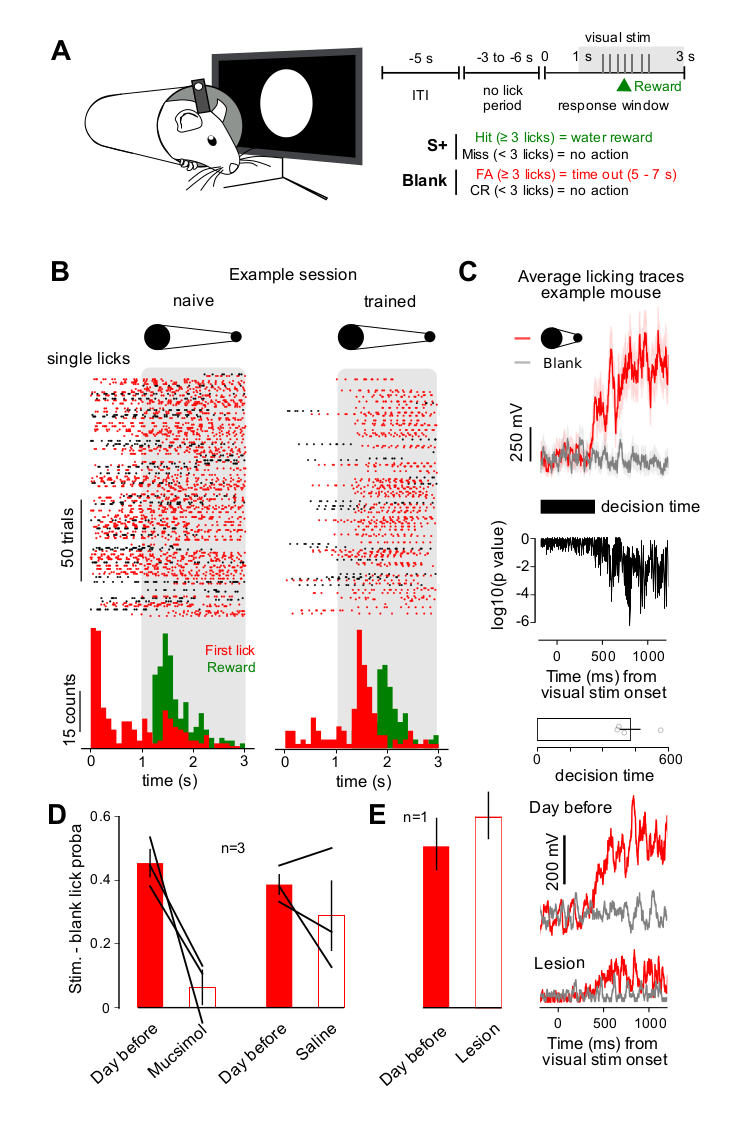
2.2. Auditory cortex is not involved in rapid auditory detection
In contrast to our results for visual cortex, auditory cortex inactivation during simple auditory Go/NoGo tasks leads only to a small decrease in task performance [7, 17]. In addition, observed reaction times are much shorter [7]. This suggests that alternative pathways avoiding auditory cortex can implement a rapid and potent sensori-motor association specifically for sounds, at least when the perceptual challenge is moderate. In order to corroborate this idea, we trained four mice to perform the same visual detection task but, after visual learning, we introduced sounds that were superimposed to visual stimuli (Figure 2A). In this task, the detected visual stimuli were receding or looming disks and the sounds were upward (looming) or downward (receding) intensity ramps, combined with each other to explore eventual multisensory congruency effects [18]. Instead of a congruent effect, we observed a slight increase in stimulus response probability when sounds are present, which was statistically significant for the down-ramping sound (Figure 2B). The boosting of stimulus response by sound was even more evident when quantifying stimulus-induced licking (Figure 2C). However, most strikingly, the clearest effect of sound stimulation during the task was a strong decrease of licking reaction time (from 453 ± 97 ms to 147 ± 45 ms, mean ± STD, n = 7 mice, Figure 2D), indicating that sounds in mice recruit a circuit enabling faster responses than achieved with visual stimuli. As suggested by a previous report [7], these fast responses should be independent of the auditory cortex. In order to verify this idea, we first verified that sound-induced boosting of visual responses is not a direct effect of auditory cortex on visual cortex representations. We conditionally expressed an inhibitory chemogenetic channel, hM4di, in neurons of the auditory cortex that project to the visual cortex. This was obtained thanks to a retrogradely propagating virus injected in visual cortex (CAV-Cre) combined to a Cre-dependent AAV virus expressing hM4di injected in auditory cortex. Infusion of the hM4dI agonist subcutaneously abolishes sound-induced boosting of visual cortex responses [18, 19]. However, this had no impact on the modulation of visual detection behavior by sounds in two mice (Figure 2E–F). We therefore wondered if increased response probability due to sounds was related to an association of auditory cortex activity with the behavioral response and fully silenced auditory cortex with a 100 nL (1 mg/mL) muscimol injection in the structure, 45 min before behavior. This also had no effect on the sound-induced increase in responsiveness to the stimulus. We therefore increased by tenfold the dose of muscimol, reaching a level at which a previous report had reported a strong impact of muscimol injection in auditory cortex on a sound discrimination task [20]. This actually led in one mouse to complete body ataxia, suggesting that muscimol had largely diffused out of auditory cortex, potentially to striatum. But interestingly, in another mouse we observed a strong decrease of the response to visual stimuli alone while responses to sounds (+ visual stimuli) were largely preserved. This suggests that muscimol had reached visual cortex (as in Figure 1) but not the structure mediating fast auditory responses to the sound associated to reward.
Auditory detection is cortex-independent and leads to shorter reaction times. (A) Mice were trained to a visual detection task in which they were rewarded when licking after a visual stimulus (looming or receding disk—duration 2 s). Visual stimuli were then superimposed with a looming or receding sound in 2∕3 of the trials. (B) Increase of visual stimulus detection rate (averaged over multiple sessions) when a coincident down-ramping sound is played (Wilcoxon signed rank test, p = 0.0156); a non-significant increase is also observed with the up-ramping sound (p = 0.375). (C) Same data as in (B) but licking response is now quantified as the number of licks per second before reward, avoiding the ceiling effect introduced when computing the probability of licking (response probability). (D) Lick rate over time (note that reward is delivered afterwards, at t = 2 s) averaged over all mice for the detection of receding (cyan) and looming (magenta) disk. The thick line shows the trained response to the visual stimulus alone. The thin solid and dashed lines shows the responses when an up- or down-ramping sound is played concomitantly. The steep rise in licking marking the onset of stimulus response is seen 100 to 500 ms earlier in the presence of sounds as compared to visual stimulation alone. This suggests that the sound does not simply boost the behavioral visual response via V1 representations but rather triggers a faster parallel pathway. (E) Lick probability during a single session (last before pharmacological manipulations) in two mice (mouse A and mouse B, different from the mice shown in A–D) trained to detect both the looming and receding disk, for the visual stimuli alone (left) and when superimposed to sounds (right). Note also that the low performance level of mouse B only reflects fluctuation of performance/motivation across sessions. The boosting of detection responses by sounds is however more evident in these conditions. (F) These two mice expressed hM4di in auditory cortex (AC) neurons that project to V1 (unilateral injection of CAV-Cre virus in V1 and flex-hM4di virus in AC, contralaterally to the eye facing the screen). Boosting of lick response by sounds was still seen after chemogenetic silencing. (G) It was also still seen after pharmacological silencing of AC (100 nL, 1 mg/mL). In one mouse, a 1000 nL muscimol injection in AC abolished visual responses (probably by silencing V1 due to drug spillover) but preserved some responses when sounds were present. In the other mouse, the 1000 nL injection led to strong motor impairments (no locomotion, no licking).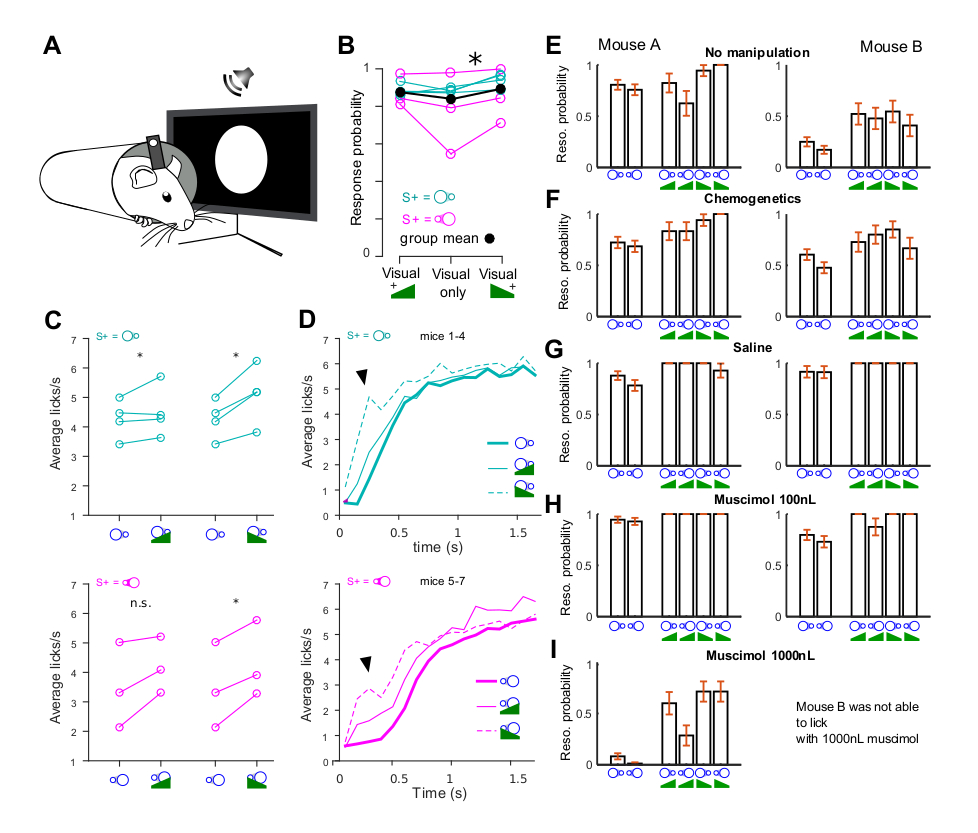
3. Discussion
Together our results show that visual cortex is involved in a visual stimulus detection task while auditory cortex is not involved in the detection of a sound during the same task. In addition, our data clearly indicate that the response in the sound detection happens much faster than in the visual stimulus detection. This indicates that, in mice, auditory detection is mediated by fast circuits which bypass primary cortical sensory areas, whereas visual detection happens through a slower visual cortex-dependent circuit. This result is in line with the recent observations that even in a simple task it is possible to affect visual perception by stimulating visual cortex in mice [21, 22], whereas auditory cortex stimulation at physiological level in a perceptually simple task does not affect auditory-driven responses [7]. What could be the pathways involved in auditory detection? It is known that some auditory reflexes are mediated by brainstem circuits directly. However, in the context of our experiments, the detection behavior is learnt by repeated trial and errors. Thalamic inactivation during a learnt simple Go/NoGo discrimination task abolishes behavioral performance [16]. This suggests that auditory detection is mediated by a thalamic projection, putatively to striatum [23]. It was suggested that fast and coarse decisions could be taken based on thalamic projection to decisional centers [14]. However, the reason why this is true for the auditory but the visual modality remains mysterious. One could only speculate that this may represent an ecological adaptation of the mouse, in which fast reactions to sounds may condition much more the survival than fast responses to visual stimuli.
4. Methods
4.1. Behavioral task
All animal procedures were approved by the French Ethical Committee (authorization 00275.01). Behavioral experiments were monitored and controlled using homemade software (Elphy, G. Sadoc, UNIC, France) coupled to a National Instruments card (PCIe-6351). Visual stimuli were delivered through a 17-inch screen placed 20 cm from the mouse eye. Sounds were amplified (SA1 Stereo power amp, Tucker-Davis Technologies) and delivered through high frequency loudspeakers (MF1-S, Tucker-Davis Technologies). Water delivery (5–6 μl) was controlled with a solenoid valve (LVM10R1-6B-1-Q, SMC). A voltage of 5 V was applied through an electric circuit joining the lick tube and aluminum foil on which the mouse was positioned, so that lick events could be monitored by measuring voltage through a series resistor in this circuit. Mice were head-fixed during all tasks thanks to a surgically implanted head-post, one week before training. Before starting the training procedure, mice were water restricted for two consecutive days. The first day of training consisted of a habituation period for head fixation and to reliably receive water by licking the lick port without any sound. S+ trials were presented with 80–90% probability, while the remaining trials were blank trials (no stimulus). A trial consisted of a random inter-trial interval (ITI) between 6 and 8 s to avoid prediction of stimulus appearance, a random “no lick” period between 3 and 5 s and a fixed response window of 1.5 s. Licking during the response window on an S+ trial above lick threshold (3–5 consecutive licks) was scored as a “hit” and triggered immediate water delivery. Licking below threshold was scored as a “miss” and the next trial immediately followed. Each behavioral session contained ∼150 rewarded trials allowing mice to obtain their daily water supply of ∼800 μl. 20% of the trials (blank trials) had no visual stimulus and were not rewarded. At the beginning of each session, ∼20 trials with “free rewards” were given independent of licking to motivate the mice. During the entire behavioral training period, food was available ad libitum and animal weight was monitored daily. Water restriction was interleaved with a 12 h ad libitum supply overnight every Friday.
4.2. Muscimol injection and lesion protocol
For muscimol or saline injection mice were anesthetized with isoflurane for 20 min during which muscimol (100 nL, 1 mg/mL, except otherwise stated) was slowly injected in the stereotaxically identified target area with a thin glass pipette (30 nL/min) using a Nanoliter Injector (WPI). The mouse was then allowed to recover for 30 min and then was placed in the behavior apparatus. The rostro-caudal, lateral and dorso-ventral stereotaxic coordinates from bregma were for primary visual cortex: −3.5, 2.5, 1 mm; and for auditory cortex: −2.5, 4, 2.2 mm. They were chosen to aim at the middle of the structures. Thermal lesions were performed unilaterally with a cauterizer at the stereotaxic coordinate of primary visual cortex and covered approximately its entire extent.
Data and code availability
The data that support out findings and the analysis code are available from the corresponding author upon reasonable request.
Author contributions
SC, MS and TD performed the experiments, SC and TD analyzed the data, SC, TD, BB designed the study and BB wrote the manuscript.
Conflicts of interest
We declare no conflict of interests.
Acknowledgements
We thank the Agence National de la Recherche (Sensemaker), the European Research Council (ERC CoG 770841), the DIM Neuroscience and the Ecole des Neurosciences de Paris for funding. BB also acknowledges the support of the Fondation pour l’Audition to the Institut de l’Audition.
French version
1. Introduction
Pour la vision, le toucher, le goût et l’audition, les projections axonales des noyaux thalamiques primaires vers le cortex définissent les zones corticales sensorielles dites primaires. Ces régions encodent des informations sensorielles riches et jouent un rôle crucial dans la perception consciente chez l’homme, comme on peut en juger au moins par les patients atteints de cécité [1, 2]. Dans le cas de la vision aveugle, les patients présentant des lésions importantes du cortex visuel primaire n’ont pas conscience des objets situés dans le champ visuel correspondant, mais peuvent effectuer des tâches visuelles de base comme la localisation d’un objet [2] ou peuvent ressentir des réponses émotionnelles induites par la vision [3]. Cela suggère que l’absence de cortex sensoriel primaire a un impact sur d’importantes fonctions perceptives alors que certains comportements sensoriels sont préservés (voir également [4] pour les lésions du cortex auditif). Cependant, comme la préservation de certaines capacités perceptives peut être due à un processus de récupération plastique, ces observations cliniques ne donnent pas d’informations sur l’implication du cortex sensoriel primaire dans ces comportements lorsque le cerveau est intact. Cet aspect a été davantage étudié chez des modèles animaux, notamment chez le rat ou la souris, chez qui une inactivation post-entraînement rapide et efficace est possible [5, 6, 7, 8]. Ces expériences montrent que pour les modalités visuelles et somatosensorielles, les cortex sensoriels primaires participent par défaut à des comportements simples de détection ou de discrimination [5, 6, 9, 10]. Cependant, certaines expériences de lésion du cortex somatosensoriel montrent que les performances comportementales peuvent rapidement augmenter après la lésion [5], ce qui suggère, comme pour la vision aveugle, que le cortex sensoriel primaire n’est pas nécessaire pour les comportements sensoriels simples (mais il est nécessaire pour les comportements complexes [11, 12]). La même conclusion peut être tirée dans le domaine auditif, puisque les lésions avant entraînement montrent également que le cortex auditif n’est pas nécessaire pour la détection des sons ou les discriminations simples [13, 14]. Néanmoins, contrairement aux observations faites pour la vision et le toucher chez les rongeurs, tant dans les tâches de conditionnement aversif [8, 15] que dans les tâches de conditionnement appétitif [7, 16, 17], la détection des sons et même la simple discrimination des sons purs sont largement résistantes à l’inactivation optogénétique post-entraînement ou à la lésion ciblée du cortex auditif. De plus, il a été observé que la détection auditive indépendante du cortex est associée à des temps de réaction beaucoup plus courts (∼100 ms) que les tâches dépendantes du cortex (∼400 ms) [7]. Une interprétation de ces résultats est que, alors que les cortex visuel et somatosensoriel sont associés aux détections, le cortex auditif n’est pas utilisé pour les détections, car il est facilement contourné par des voies plus rapides. Cela représenterait une spécificité intéressante du système auditif. Alternativement, cette divergence pourrait être due à des différences dans les protocoles utilisés par différentes équipes pour les tâches auditives, visuelles ou somatosensorielles.
Afin de distinguer ces deux possibilités, nous avons utilisé le protocole d’une tâche de détection auditive appétitive de type Go/NoGo et nous avons remplacé le son par un stimulus visuel. Cela a entraîné des temps de réaction plus longs et une sensibilité élevée à l’inactivation corticale transitoire. De plus, lorsqu’un son est superposé aux stimuli visuels dans la tâche, les temps de réaction diminuent et aucune sensibilité à l’inactivation du cortex auditif n’est observée. Cet ensemble de résultats confirme l’idée que le cortex auditif, contrairement au cortex visuel, n’est pas utilisé par défaut pour les détections, en raison, probablement, de l’implication de voies qui conduisent à des réactions plus rapides.
2. Résultats
2.1. Le cortex visuel est impliqué dans la détection visuelle chez la souris
Afin de comparer la détection auditive et visuelle dans un paradigme comportemental identique, nous avons mis en place une tâche de détection visuelle appétitive de type GO/NOGO basée sur un modèle de tâche utilisé pour la détection et la discrimination auditive (Figure 1A) [7]. Les souris ont été entraînées à générer plus de trois léchages après l’apparition d’un stimulus visuel et à minimiser le léchage dans le cas contraire, comme cela a été évalué avec des essais dits « vides » sans stimuli visuels (Figure 1A). Comme dans le GO/NOGO auditif précédemment développé, chaque essai ne pouvait commencer que si la souris n’avait pas léché pendant une période de durée aléatoire allant de 3 à 6 s. Cela permet à la fois d’empêcher les souris de se lécher continuellement mais aussi d’utiliser des indices temporels pour se lécher dans la bonne fenêtre temporelle. Le stimulus visuel est un grand disque apparaissant brusquement devant la souris et s’éloignant en 2 s. La récompense est donnée au troisième léchage, même avant la fin du stimulus visuel. Après quelques semaines d’entraînement, les animaux ont été capables de synchroniser le léchage avec le stimulus (Figure 1B) à des niveaux nettement supérieurs au hasard comme évalué dans des essais « vides », sans stimulus visuel. Cela démontre qu’ils ont détecté le stimulus visuel comme un indice prédisant la récompense. En comparant les traces de léchage pour les stimuli visuels et « vides », nous avons également pu mesurer précisément leur temps de décision, comme le moment où le léchage est significativement plus élevé en présence du stimulus qu’en l’absence de stimulus (Figure 1C). Il est frappant de constater que le temps de décision pour cette tâche est de 460 ± 28 ms (moyenne ± SEM; Figure 1C), bien plus long que les 100–150 ms rapportés pour la discrimination auditive simple indépendante du cortex (c’est-à-dire la détection d’une fréquence bien identifiable) [7]. Comme les discriminations auditives dépendantes du cortex génèrent également de longs temps de décision, nous nous sommes demandé si notre tâche de détection visuelle dépendait du cortex visuel primaire. Pour le vérifier, nous avons injecté 100 nL de muscimol (1 mg/mL) ou de solution saline dans le cortex visuel primaire controlatéral à l’œil faisant face au stimulus visuel. Le premier jour de l’injection de muscimol, les performances de détection visuelle ont été réduites au niveau du hasard (c’est-à-dire que la probabilité de lécher en présence de stimulus est au même niveau qu’en absence de stimulus), tandis que l’injection de solution saline n’a eu aucun effet significatif (Figure 1D). Cela indique que le cortex visuel, lorsqu’il est disponible, est recruté pour la détection visuelle chez la souris, conformément aux rapports précédents dans une autre tâche [9]. Cependant, lorsque le cortex visuel n’est pas disponible, la détection visuelle est toujours possible, comme nous avons pu le vérifier par une lésion du cortex visuel controlatéral chez une souris, qui, après récupération, a pu effectuer la tâche de détection avec un temps de décision similaire (Figure 1E). Abstraction faite de sa variabilité biologique que nous n’avons pas évaluée, ce résultat établit un lien entre le phénomène de vision aveugle et notre observation que l’inactivation transitoire du cortex visuel après l’entraînement influence la détection : lorsque le cortex visuel est fonctionnel, il participe à la détection visuelle mais il est possible de s’en passer pour une tâche aussi simple, si la fonction corticale est perdue.
La détection visuelle implique le cortex visuel chez la souris. (A) Schéma (à gauche), structure des essais (en haut à droite) et programme de récompense (en bas à droite) de la tâche de détection visuelle (ITI = intervalle inter-essais, FA = fausse alarme, CR = rejet correct). (B) Exemples de tracés matriciels de léchage pour une session d’entraînement chez une souris naïve (à gauche) et chez une souris entraînée (à droite). La zone grisée indique la présentation du stimulus. Les histogrammes de temps péristimulus correspondants pour les léchages et les délivrances de récompense sont présentés ci-dessous. (C) (en haut) Exemple de traces de signal de léchage (tension à travers le circuit de détection de léchage) pour une souris entraînée. La moyenne des essais est effectuée sur une session. Ligne rouge = essai avec stimulus visuel. Ligne grise = essais « vides ». Zone ombrée = erreur standard. (milieu) Valeur P d’un test de Wilcoxon pour la différence entre le stimulus et les traces pour les essais « vides ». Le point de temps le plus précoce pour lequel la valeur P est inférieure à 0,01 est défini comme le temps de décision de l’animal. (en bas) Temps de décision mesuré pour quatre souris. (D) Probabilités de réponse (nombre de léchage au-dessus du critère de seuil de 3 léchages) pour les essais avec stimulus visuel soustraites de la probabilité de réponse pour les essais « vides » chez 3 souris, avant les injections (barres rouges) et après injection de muscimol ou de solution saline dans le cortex visuel controlatéral (barres blanches). La performance est significativement plus faible que le jour précédent pour les injections de muscimol (test t de Student, p = 0,0487) mais pas pour les injections de solution saline (test t de Student, p = 0,26). (E) (gauche) Probabilités de réponse (essais avec stimulus visuel moins essais « vides ») chez une souris, avant (barres rouges) et après la lésion du cortex visuel (barres blanches). (droite) Traces du signal de léchage moyennées sur l’ensemble des essais récompensés et des essais « vides » pour la souris lésée, avant et après la lésion.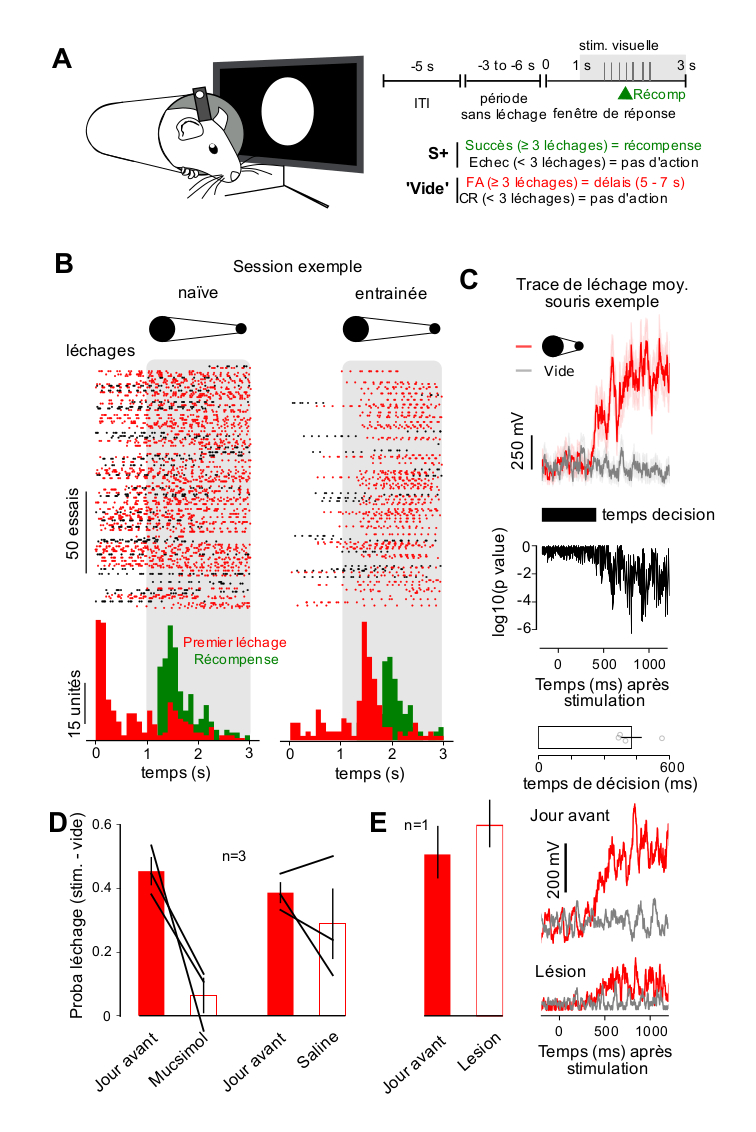
2.2. Le cortex auditif n’est pas impliqué dans la détection auditive rapide
Contrairement à nos résultats pour le cortex visuel, l’inactivation du cortex auditif pendant des tâches auditives simples de type Go/NoGo n’entraîne qu’une faible diminution de la performance pendant la tâche [7, 17]. En outre, les temps de réaction observés sont beaucoup plus courts [7]. Cela suggère que des voies alternatives évitant le cortex auditif peuvent mettre en œuvre une association sensorimotrice rapide et puissante spécifiquement pour les sons, du moins lorsque la difficulté perceptive est modérée. Afin de corroborer cette idée, nous avons entraîné quatre souris à effectuer la même tâche de détection visuelle mais, après l’apprentissage visuel, nous avons introduit des sons superposés aux stimuli visuels (Figure 2A). Dans cette tâche, les stimuli visuels détectés étaient des disques qui s’éloignaient ou se rapprochaient et les sons étaient des rampes d’intensité ascendante (rapprochement) ou descendante (éloignement), combinés entre eux pour explorer d’éventuels effets de congruence multisensorielle [18]. Au lieu d’un effet de congruence, nous avons observé une légère augmentation de la probabilité de réponse au stimulus en présence de sons, qui était statistiquement significative pour le son descendant (Figure 2B). L’augmentation de la réponse au stimulus par le son était encore plus évidente lors de la quantification des léchages induits par le stimulus (Figure 2C). Cependant, l’effet le plus frappant de la stimulation sonore pendant la tâche était une forte diminution du temps de réaction au léchage (de 453 ± 97 ms à 147 ± 45 ms, moyenne ± écart-type, n = 7 souris, Figure 2D), indiquant que les sons chez les souris recrutent un circuit permettant des réponses plus rapides que celles obtenues avec des stimuli visuels seuls. Comme le suggère un rapport précédent [7], ces réponses rapides devraient être indépendantes du cortex auditif. Afin de vérifier cette idée, nous avons d’abord vérifié que l’augmentation des réponses visuelles induite par les sons n’est pas un effet direct du cortex auditif sur les représentations du cortex visuel. Nous avons exprimé conditionnellement un canal chémogénétique inhibiteur, hM4di, dans les neurones du cortex auditif qui projettent vers le cortex visuel. Ceci a été obtenu grâce à un virus à propagation rétrograde injecté dans le cortex visuel (CAV-Cre) combiné à un virus AAV Cre-dépendant exprimant hM4di injecté dans le cortex auditif. L’infusion de l’agoniste hM4dI par voie sous-cutanée abolit le renforcement des réponses du cortex visuel induit par le son [18, 19]. Cependant, cela n’a eu aucun impact sur la modulation du comportement de détection visuelle par les sons chez deux souris (Figure 2E–F). Nous nous sommes donc demandé si l’augmentation de la probabilité de réponse due aux sons était liée à une association de l’activité du cortex auditif avec la réponse comportementale et avons inhibé l’activité du cortex auditif par une injection de muscimol de 100 nL (1 mg/mL) dans la structure, 45 min avant le comportement. Cela n’a pas non plus eu d’effet sur l’augmentation de la réactivité au stimulus induite par le son. Nous avons donc multiplié par dix la dose de muscimol, pour atteindre un niveau auquel un rapport précédent avait signalé un fort impact de l’injection de muscimol dans le cortex auditif sur une tâche de discrimination sonore [20]. Chez une des souris testées, cela a conduit à une ataxie corporelle complète, ce qui suggère que le muscimol a largement diffusé hors du cortex auditif, potentiellement vers le striatum. Mais il est intéressant de noter que chez une autre souris, nous avons observé une forte diminution de la réponse aux stimuli visuels seuls alors que les réponses aux sons (+ stimuli visuels) étaient largement préservées. Ceci suggère que le muscimol a atteint le cortex visuel (comme dans la Figure 1) mais pas la structure médiant les réponses auditives rapides au son associée à la récompense.
La détection auditive est indépendante du cortex et entraîne des temps de réaction plus courts. (A) Des souris ont été entraînées à une tâche de détection visuelle dans laquelle elles étaient récompensées lorsqu’elles léchaient après un stimulus visuel (disque approchant ou s’éloignant — durée 2 s). Les stimuli visuels ont ensuite été superposés à un son émergeant ou s’éloignant dans 2/3 des essais. (B) Augmentation du taux de détection du stimulus visuel (moyenné sur plusieurs sessions) lorsqu’un son descendant coïncident est joué (test de rang signé de Wilcoxon, p = 0.0156) ; une augmentation non significative est également observée avec le son montant (p = 0.375). (C) Mêmes données qu’en (B) mais la réponse de léchage est maintenant quantifiée comme le nombre de léchages par seconde avant la récompense, évitant l’effet de plafond introduit lors du calcul de la probabilité de léchage (probabilité de réponse). (D) Taux de léchage en fonction du temps (notez que la récompense est délivrée après, à t = 2 s), en moyenne sur toutes les souris pour la détection d’un disque qui s’éloigne (cyan) et qui s’approche (magenta). La ligne épaisse montre la réponse entraînée par le stimulus visuel seul. Les lignes fines pleines et pointillées montrent les réponses lorsqu’un son croissant ou décroissant est joué en même temps. La forte augmentation du léchage marquant le début de la réponse au stimulus est observée 100 à 500 ms plus tôt en présence de sons par rapport à la stimulation visuelle seule. Cela suggère que le son ne renforce pas simplement la réponse visuelle comportementale via les représentations V1, mais déclenche plutôt une voie parallèle plus rapide. (E) Probabilité de léchage lors de la dernière session avant manipulation pharmacologique chez deux souris (souris A et souris B, différentes des souris présentées en A–D) entraînées à détecter le disque qui s’approche et celui qui s’éloigne, pour les stimuli visuels seuls (à gauche) et lorsqu’ils sont superposés à des sons (à droite). La performance faible de la souris (B) ne reflète que les variations de performance/motivation des souris entre sessions. L’augmentation de la réponse de détection par les sons est cependant plus évidente dans ces conditions. (F) Ces deux souris ont exprimé hM4di dans les neurones du cortex auditif qui projettent vers le cortex visuel (injection unilatérale de virus CAV-Cre dans V1 et de virus flex-hM4di dans AC, de façon controlatérale à l’œil faisant face à l’écran). L’augmentation de la réponse au léchage par les sons était toujours observée après l’inhibition chémogénétique. (G) Elle a également été observée après l’inhibition pharmacologique de l’AC (100 nL, 1 mg/mL). Chez une souris, une injection de 1000 nL de muscimol dans l’AC a aboli les réponses visuelles (probablement en inhibant le cortex visuel en raison de la diffusion du muscimol à grande distance) mais a préservé certaines réponses lorsque des sons étaient présents. Chez l’autre souris, l’injection de 1000 nL a entraîné de fortes déficiences motrices (pas de locomotion, pas de léchage).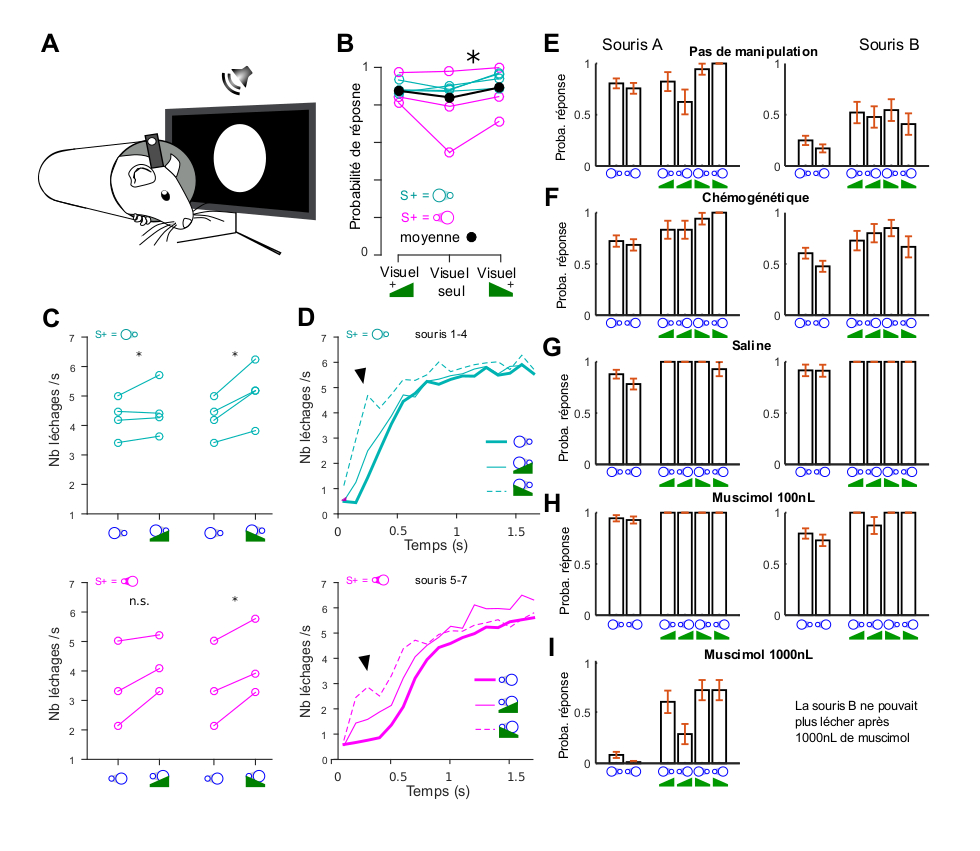
3. Discussion
Dans leur ensemble, nos résultats montrent que le cortex visuel est impliqué dans une tâche de détection de stimulus visuel alors que le cortex auditif n’est pas impliqué dans la détection d’un son au cours de la même tâche. En outre, nos données indiquent clairement que la réponse à la détection du son se produit beaucoup plus rapidement que celle résultant de la détection du stimulus visuel. Ceci indique que, chez la souris, la détection auditive est médiée par des circuits rapides qui contournent les aires sensorielles primaires corticales, alors que la détection visuelle se fait par un circuit plus lent dépendant du cortex visuel. Ce résultat est conforme aux observations récentes selon lesquelles, même dans une tâche simple, il est possible d’affecter la perception visuelle en stimulant le cortex visuel chez la souris [21, 22], alors que la stimulation du cortex auditif au niveau physiologique dans une tâche perceptivement simple n’affecte pas les réponses auditives [7]. Quelles pourraient être les voies impliquées dans la détection auditive ? Il est connu que certains réflexes auditifs sont directement médiés par les circuits du tronc cérébral. Cependant, dans le contexte de nos expériences, le comportement de détection est appris par essais et erreurs répétés. L’inactivation du thalamus pendant l’apprentissage d’une tâche de discrimination simple Go/NoGo abolit la performance comportementale [16]. Cela suggère que la détection auditive est médiée par une projection thalamique, probablement vers le striatum [23]. Il a longtemps été suggéré que des décisions rapides et ne nécessitant pas de précision pouvaient être prises sur la base d’une projection thalamique vers les centres décisionnels [14]. Cependant, la raison pour laquelle cela est vrai pour la modalité auditive mais pas pour la modalité visuelle reste mystérieuse. On ne peut que spéculer que cela peut représenter une adaptation écologique de la souris, si des réactions rapides aux sons conditionnent plus fortement la survie de l’animal que des réponses rapides aux stimuli visuels.
4. Méthodes
4.1. Tâche comportementale
Toutes les procédures expérimentales impliquant des animaux ont été approuvées par le comité d’éthique local (autorisation 00275.01). Les expériences comportementales ont été suivies et contrôlées à l’aide d’un logiciel développé par G. Sadoc (Elphy, UNIC, France) couplé à une carte National Instruments (PCIe-6351). Les stimuli visuels étaient délivrés par un écran de 17 pouces placé à 20 cm de l’œil de la souris. Les sons étaient amplifiés (amplificateur de puissance SA1 Stereo, Tucker-Davis Technologies) et délivrés par des haut-parleurs haute fréquence (MF1-S, Tucker-Davis Technologies). La distribution d’eau (5–6 μl) était contrôlée par une électrovanne (LVM10R1-6B-1-Q, SMC). Une tension de 5 V a été appliquée à travers un circuit électrique reliant le tube de léchage et la feuille d’aluminium sur laquelle la souris était positionnée, afin que les événements de léchage puissent être enregistrés en mesurant la tension à travers une résistance en série dans ce circuit. Pour permettre la fixation de la tête de l’animal, une semaine avant le démarrage des expériences de comportement, une procédure chirurgicale permettant l’implantation d’une pièce métallique sur l’os du crâne était réalisée. Avant de commencer la procédure d’entraînement, les souris ont été privées d’eau pendant deux jours consécutifs. Le premier jour de l’entraînement consistait en une période d’accoutumance à la fixation de la tête et à recevoir de l’eau de manière fiable en léchant le tube de léchage sans aucun stimulus. Les essais S+ étaient présentés avec une probabilité de 80–90%, tandis que les autres essais étaient des essais « vides » (sans stimulus). Un essai comprenait un intervalle inter-essai (ITI) aléatoire entre 6 et 8 s pour éviter la prédiction de l’apparition du stimulus, une période aléatoire sans léchage entre 3 et 5 s et une fenêtre de réponse fixe de 1.5 s. Le fait de lécher pendant la fenêtre de réponse lors d’un essai S+ au-dessus du seuil de léchage (3–5 léchages consécutifs) était considéré comme un « succès » et déclenchait la distribution immédiate d’eau. Le léchage en dessous du seuil de léchage était considéré comme un « échec » et l’essai suivant suivait immédiatement. Chaque session comportementale contenait ∼150 essais récompensés permettant aux souris d’obtenir leur quantité d’eau quotidienne de ∼800 μl. 20% des essais (essais vides) n’avaient pas de stimulus visuel et n’étaient pas récompensés. Au début de chaque session, ∼20 essais avec des « récompenses gratuites » ont été donnés indépendamment du léchage pour motiver les souris. Pendant toute la période de formation comportementale, la nourriture était disponible ad libitum et le poids des animaux était contrôlé quotidiennement. La restriction d’eau a été intercalée avec un approvisionnement ad libitum de 12 h pendant la nuit chaque vendredi.
4.2. Injection de muscimol
Pour l’injection de muscimol ou de solution saline, les souris ont été anesthésiées à l’isoflurane pendant 20 min au cours desquelles le muscimol (100 nL, 1 mg/mL, sauf indication contraire) a été lentement injecté dans la zone cible identifiée par stéréotaxie à l’aide d’une fine pipette en verre (30 nL/min) en utilisant un Nanoliter Injector (WPI). Nous avons ensuite laissé la souris récupérer pendant 30 min, puis nous l’avons placée dans l’appareil de comportement. Les coordonnées stéreotaxiques rostro-caudales, latérales et dorso-ventrales depuis le bregma étaient −3.5, 2.5, 1 mm pour le cortex visuel primaire et −2.5, 4, 2.2 mm pour le cortex auditif. Elles ont été choisies pour cibler le centre de ces structures. Les lésions thermiques du cortex ont été réalisées avec un cautérisateur de manière unilatérale et couvraient approximativement l’ensemble du cortex visuel primaire.
Disponibilité des données et des codes
Les données qui soutiennent nos résultats et le code d’analyse sont disponibles auprès de l’auteur correspondant sur demande.
Contributions des auteurs
SC, MS et TD ont réalisé les expériences, SC et TD ont analysé les données, SC, TD, BB ont conçu l’étude et BB a rédigé le manuscrit.
Conflit d’intérêt
Nous ne déclarons aucun conflit d’intérêts.
Remerciements
Nous remercions l’Agence Nationale de la Recherche (Sensemaker), le Conseil Européen de la Recherche (ERC CoG 770841), le DIM Neuroscience et l’Ecole des Neurosciences de Paris pour leur financement. BB remercie également la Fondation pour l’Audition pour son soutien à l’Institut de l’Audition.




 CC-BY 4.0
CC-BY 4.0