La version française de l'article est disponible à la suite de la version anglaise
Every day, every hour, cells of our own body divide to produce new cells. This cellular process of making “new” out of “old”, two cells out of one, is fundamental to life [1]. Cell division is required by both multicellular and unicellular organisms to multiple, create new organs, replace old damaged body cells, and ensure sexual reproduction. In multicellular organisms, there are two main types of cell division, meiosis which leads to the formation of haploid gamete cells (egg or sperm cells) and is required for sexual reproduction, and mitosis which leads to the production of two identical diploid daughter cells. The former allows the making of gametes in sexually-reproducing organisms, the latter allows the making of new somatic body cells. Cells of our own body divide all the time, and the same is true for plants, insects, fungi or micro-organisms such as bacteria. The molecular mechanisms controlling cellular multiplication are under tight control and failure in any step along the process can result in uncontrolled cell proliferation and lead to cancer for instance. But as they divide, cells are facing a difficult dilemma; they need to split apart, physically separate from their genetically twin sister while maintaining contact for cell–cell communication.
As cells undergo mitotic division, they will first duplicate their genome, segregate the two copies to opposite end of its interior space and then, through a complex cellular process, split into two daughter cells [2]. Depending on the organisms considered, the two daughter cells will either stay in close proximity (through cell–cell adhesion) or move apart from each other (cell migration). In any case, the very last step of cell division is the physical separation of the cytoplasm (interior) of the two daughter cells (including membranes and chromosomes), a stage refers to as abscission or the “final cut” [3]. But while cells split apart, they also need to stay connected to communicate not only with their twin sister but with the entire proximal cellular community in order to secure cohesive multicellular responses. Staying in touch with your neighbours is essential for any interacting multipartite groups including cells that live in communities (without direct cell–cell contact) or multicellular organisms [4]. As a result, the capacity of newly born cells to interact with others will be of critical importance for sensing their microenvironment. Cells that do not properly “connect”, will not be able to receive and decode molecular messages and as a result fail to understand their role in a multicellular context, including their own cellular identity. Whilst freshly divided cells are eager to break apart to acquire their own cell-autonomy, staying in touch with their relatives is the only way for them to “survive” in a multipartite community.
To this end, evolution gave rise to a variety of cell–cell communication modalities, all relying on the exchange of signaling molecules. These include the secretion of diffusible extracellular ligands such as hormones, growth factors, cytokine, neurotransmitters etc., which are perceived by receiver cells through receptor binding [4]. In this scenario, proximity between cells is common but not mandatory. An alternative way for cells to communicate is to create intercellular bridges between them allowing direct exchange of signaling molecules. In this case, cells are physically linked through membrane-lined channels, sort of tubes which establish highways for cell–cell communication. These intercellular bridges are present in several lineages of eucaryotic organisms including vertebrae, land plants, fungae, algae [4, 5, 6, 7, 8]. They present diversity in molecular composition, size, and structural organisation but they have one common point; they all create direct membrane and cytosolic continuity between cells.
Remarkably, a vast majority of these cytosolic bonds are actually formed during cell division and some of these bridges are large enough for organelles to pass through [9]. The creation of these intercellular connections, implies that, to maintain contact, cells must postpone or in some cases even bypass the very last step of cell division, the so called “final cut”, where all physical continuity is normally lost between daughter cells. At this time in their life cycle, cells are therefore facing a paradoxical situation, a seemingly absurd condition: all their resources are directed towards one goal; to split from their twin sister, yet they need to leverage this urge and maintain contact. To smooth their divorce, they need to conserve physical continuity.
The benefit of this unconsumed divorce, will help stem daughter cells to find out who they are and who they should become. Hence, stem cells have special requirements as they divide. They need to maintain stemness as they proliferate and then differentiate to produce various types of cells during development. In a stem cell niche, shortly after mitosis, daughter cells are facing an identity crisis as they must decide whether to keep their original cellular identity, (in other words remember who they are), or differentiate into a new cell type. A large part of this process is controlled through the spatio-temporal regulation of mitotic intercellular bridges. In mouse embryonic stem cells for instance, exit from pluripotency (i.e. a stage where cells have not yet fixed their developmental potentialities) occurs after completion of cell division and is correlated between daughter cells [10]. These cells maintain contact through cytosolic bridges for several hours post-mitosis and it is the abscission of these daughter-to-daughter channels that set the timing for triggering exit from naive pluripotency.
While intercellular bridges are common features connecting daughter cells across kingdoms, these usually end up being chopped off. In mammalian cells, the timing of cytokinetic abscission is regulated by a molecular machinery termed the abscission checkpoint which can delay the final cut by several hours if persistent chromatin is present in the intercellular bridges [3]. These checkpoints are in place to ensure chromatin integrity and completion of each cell-cycle before progression to the next one [11]. Abscission also responds to membrane tension [12], nuclear pore defects [13] and DNA replication stress [14], all being control points to make sure that abscission occurs at the right time and place.
Although, cell division normally proceeds to completion through abscission, in some cell types and organisms, cytokinesis remains incomplete [9]. The divorce is somehow suspended in time, hold on for ever, and the final cut is never happening. This incomplete cytokinesis occurs in clonal multicellular organisms such as animal, land plants, fungi, and algae, and gives rise to the creation of stable intercellular bridges which will be of vital importance for cells throughout their life. Stable cytokinetic cellular bonds are found in germlines (i.e. sexual gamete cells) of metazoans ranging from insects to humans [15]. During gametogenesis, gametes divide and form cluster of cells interconnected in syncytia (a large structure formed by the joining several cells). The evolutionary conservation of this process suggests that intimate interconnection is critical in germline cells, for instance for synchronisation of mitotic division, entry in meiosis, synchronised cell death and ultimately for fertility [9]. In insect cells such as Drosophila, these intercellular bridges, called ring canal, allow directional transport of nutrients, organelles, proteins etc. within the syncytia to promote the growth of selected cells into oocytes whereas the others will eventually retract and die [16]. In addition to germline cells, incomplete cytokinesis also exists in somatic tissues of invertebrates, such as land plants, algae and fungi. In land plants for instance incomplete cytokinesis leads to the establishment of an extensive intercellular network where hundreds of intercellular bridges, called plasmodesmata, are created between daughter cells as they divide [8]. These bridges can cover up to 15% of the cellular interface, connect virtually every single cell throughout the entire plant body, driving molecular exchanges. Strong alteration in the function or formation of plasmodesmata will lead to plant death.
The suppression of abscission (whether for a short- or long-lasting period) and the formation of intercellular bridges is a repetitive feature found in complex multicellular eucaryotes. This process has been recently suggested to be a basis for the evolution of clonal multicellularity by allowing cells to remain attached and communicate after division [9]. Both, cell division and cell–cell communication are critical facets of multicellularity, and as often in life, these two processes (divide and connect) are intertwined. Moving the cursor between these two variables allows diversity and adaptation. How do cells decide to go through complete versus incomplete cytokinesis is unknown, but as they divide, they have to leverage the need to physically separate and the need to stay connected. They need to ponder the benefits and costs of a “clear-cut” versus “open-door” divorce.
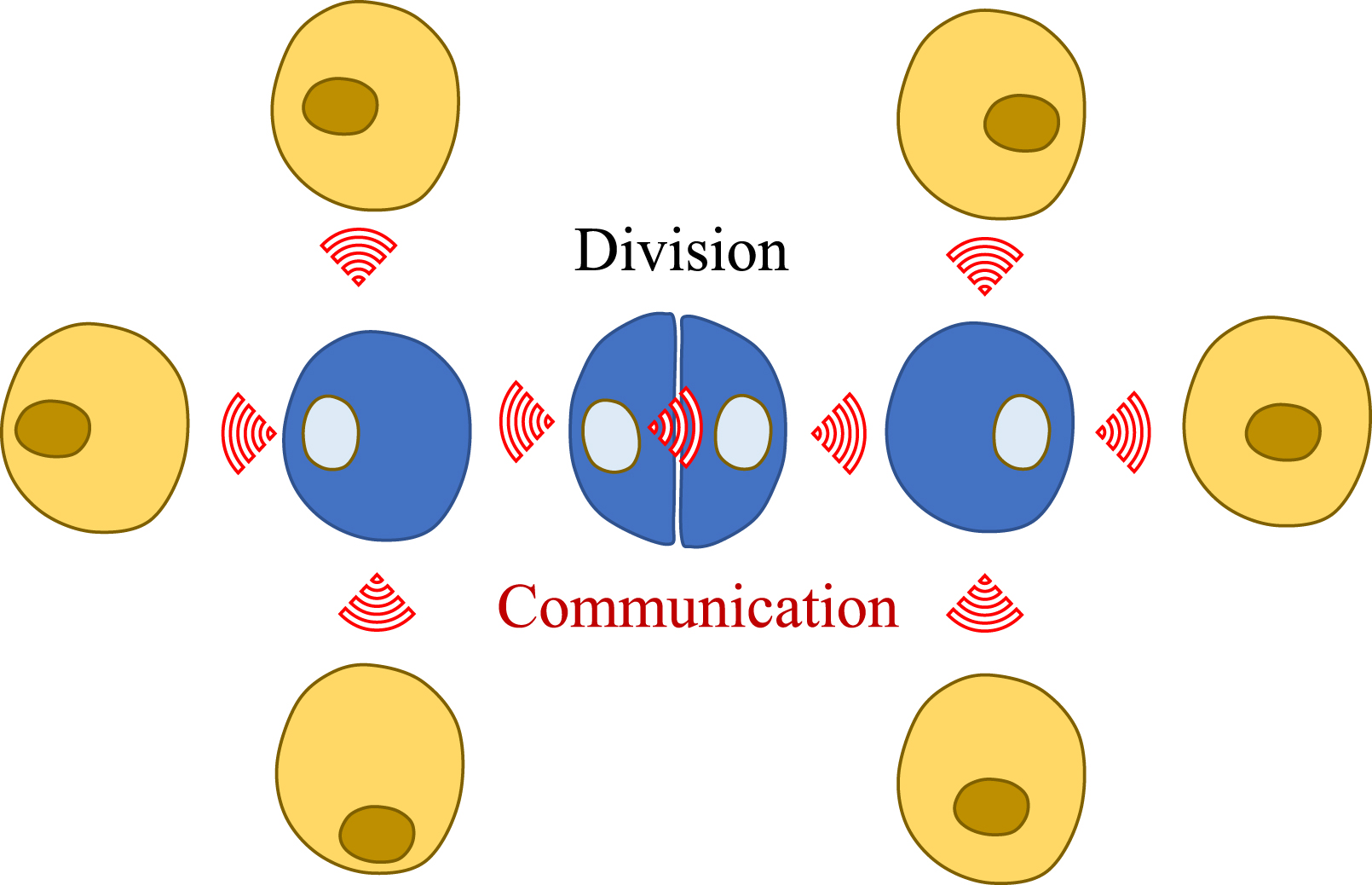
Cell division and communication are two fundamental facets of multicellularity. The two processes can be combined leading to the formation of intercellular bridges through incomplete cytokinesis.
Conflicts of interest
The author has no conflict of interest to declare.
Acknowledgments
I would like to thank Marie Cécile Caillaud, ENS Lyon for reading and commenting on the present manuscript and for the inspirational talks about the place of young scientists and women in science.
EMB’s team is supported by the National Agency for Research (Grant ANR PRPC - ANR-21-CE13-0016-01 DIVCON), the European Research Council (ERC) under the European Union’s Horizon 2020 research and innovation programme (grant agreement No. 772103-BRIDGING), the EMBO Young Investigator Program.
Version française
Chaque jour, chaque heure, les cellules de notre propre corps se divisent pour produire de nouvelles cellules. Ce processus cellulaire qui consiste à faire du « neuf » à partir du « vieux », deux cellules à partir d’une seule, est fondamental pour la vie [1]. Les organismes multicellulaires et unicellulaires ont besoin de la division cellulaire pour se multiplier, créer de nouveaux organes, remplacer les vieilles cellules endommagées et assurer la reproduction sexuelle. Chez les organismes multicellulaires, il existe deux principaux types de division cellulaire, la méiose qui conduit à la formation de cellules gamètes haploïdes (ovules ou spermatozoïdes) et est nécessaire à la reproduction sexuée, et la mitose qui conduit à la production de deux cellules filles diploïdes identiques. La première permet la fabrication des gamètes chez les organismes à reproduction sexuée, la seconde permet la fabrication de nouvelles cellules somatiques du corps. Les cellules de notre propre corps se divisent en permanence, et il en va de même pour les plantes, les insectes, les champignons ou les micro-organismes tels que les bactéries. Les mécanismes moléculaires qui régissent la multiplication cellulaire sont étroitement contrôlés et toute défaillance durant ce processus peut entraîner une prolifération cellulaire incontrôlée et provoquer un cancer, par exemple. Mais lorsqu’elles se divisent, les cellules sont confrontées à un dilemme difficile : elles doivent se séparer physiquement de leur sœur jumelle tout en maintenant le contact pour assurer la communication intercellulaire.
Lors de la division mitotique, les cellules vont d’abord dupliquer leur génome, physiquement séparer les deux copies, par un processus cellulaire complexe, se diviser en deux cellules filles [2]. Selon l’organisme considéré, les deux cellules filles resteront à proximité l’une de l’autre (par adhésion cellulaire) ou s’éloigneront l’une de l’autre (migration cellulaire). Dans tous les cas, la toute dernière étape de la division cellulaire est la séparation physique du cytoplasme (intérieur) des deux cellules filles (y compris les membranes et les chromosomes), une étape appelée abscission ou « coupe finale » [3]. Mais si les cellules se séparent, elles doivent aussi rester connectées pour communiquer non seulement avec leur sœur jumelle, mais aussi avec l’ensemble de la communauté cellulaire proximale afin de garantir la cohésion des réponses multicellulaires. Rester en contact avec ses voisins est essentiel pour tout groupe multipartite en interaction, y compris les cellules vivant en communauté (sans contact direct) ou les organismes multicellulaires [4]. Par conséquent, la capacité des cellules nouvellement nées à interagir avec les autres sera d’une importance capitale pour la détection de leur microenvironnement. Les cellules qui ne sont pas correctement « connectées » ne seront pas en mesure de recevoir et de décoder les messages moléculaires et, par conséquent, de comprendre leur rôle dans un contexte multicellulaire, y compris leur propre identité cellulaire. Alors que les cellules fraîchement divisées sont désireuses de se séparer pour acquérir leur propre autonomie cellulaire, rester en contact avec leurs proches est le seul moyen pour elles de « survivre » dans une communauté multipartite.
À cette fin, l’évolution a donné naissance à une variété de modalités de communication intercellulaire, toutes reposant sur l’échange de molécules de signalisation. Celles-ci comprennent la sécrétion de ligands extracellulaires diffusibles tels que les hormones, les facteurs de croissance, les cytokines, les neurotransmetteurs, etc., qui sont perçus par les cellules réceptrices grâce à la liaison des récepteurs [4]. Dans ce scénario, la proximité entre les cellules est courante mais pas obligatoire. Une autre fac˛on pour les cellules de communiquer consiste à créer entre elles des ponts intercellulaires permettant l’échange direct de molécules de signalisation. Dans ce cas, les cellules sont physiquement reliées par des canaux tapissés de membranes, sortes de tubes qui établissent des autoroutes pour la communication entre les cellules. Ces ponts intercellulaires sont présents dans plusieurs lignées d’organismes eucaryotes dont les vertèbres, les plantes terrestres, les champignons, les algues [4, 5, 6, 7, 8]. Ils présentent une diversité dans leur composition moléculaire, leur taille et leur organisation structurelle mais ils ont un point commun : ils créent tous une continuité membranaire et cytosolique directe entre les cellules.
Il est remarquable de constater qu’une grande majorité de ces liaisons cytosoliques sont en fait formées pendant la division cellulaire et que certains de ces ponts sont suffisamment larges pour laisser passer des organites [9]. La création de ces connexions intercellulaires implique que, pour maintenir le contact, les cellules doivent reporter ou, dans certains cas, contourner la toute dernière étape de la division cellulaire, c’est-à-dire la « coupe finale », où toute continuité physique est normalement perdue entre les cellules filles. À ce moment de leur cycle de vie, les cellules sont donc confrontées à une situation paradoxale, une condition apparemment absurde : toutes leurs ressources sont dirigées vers un seul objectif, celui de se séparer de leur sœur jumelle, et en même temps maintenir le contact. Pour faciliter leur divorce, les cellules filles doivent conserver une continuité physique.
Le bénéfice de ce divorce non consommé aidera les cellules filles souches à découvrir qui elles sont et qui elles doivent devenir. Les cellules souches ont donc des exigences particulières lorsqu’elles se divisent. Elles doivent conserver leur caractère de cellules souches pendant leur prolifération, puis se différencier pour produire divers types de cellules au cours du développement. Dans une niche de cellules souches, peu après la mitose, les cellules filles sont confrontées à une crise d’identité car elles sont obligées de décider si elles doivent conserver leur identité cellulaire d’origine (en d’autres termes, se rappeler qui elles sont) ou se différencier en un nouveau type cellulaire. Une grande partie de ce processus est contrôlée par la régulation spatio-temporelle des ponts intercellulaires mitotiques. Dans les cellules souches embryonnaires de souris, par exemple, la sortie de la pluripotence (c’est-à-dire un stade où les cellules n’ont pas encore fixé leurs potentialités de développement) se produit après la fin de la division cellulaire et est corrélée entre les cellules filles [10]. Ces cellules restent en contact par le biais de ponts cytosoliques pendant plusieurs heures après la mitose et c’est l’abscission de ces canaux de fille à fille qui fixe le moment du déclenchement de la sortie de la pluripotence naïve.
Bien que les ponts intercellulaires mitotiques soient des caractéristiques communes dans tous les règnes, ils finissent généralement par être coupés. Dans les cellules de mammifères, le moment de l’abscission cytocinétique est régulé par un mécanisme moléculaire appelé point de contrôle de l’abscission, qui peut retarder la coupe finale de plusieurs heures si de la chromatine persistante est présente dans les ponts intercellulaires [3]. Ces points de contrôle sont en place pour assurer l’intégrité de la chromatine et l’achèvement de chaque cycle cellulaire avant la progression vers le cycle suivant [11]. L’abscission répond également à la tension membranaire [12], aux défauts des pores nucléaires [13] et au stress de la réplication de l’ADN [14], autant de points de contrôle qui permettent de s’assurer que l’abscission se produit au bon moment et au bon endroit.
Bien que la division cellulaire s’achève normalement par l’abscission, dans certains types de cellules et d’organismes, la cytokinèse reste incomplète [9]. Le divorce est en quelque sorte suspendu dans le temps, il s’éternise, et la coupe finale n’a jamais lieu. Cette cytokinèse incomplète se produit dans les organismes multicellulaires clonaux tels que les animaux, les plantes terrestres, les champignons et les algues, et donne lieu à la création de ponts intercellulaires stables qui seront d’une importance vitale pour les cellules tout au long de leur vie. On trouve des liens cellulaires cytocinétiques stables dans les lignées germinales (c’est-à-dire les cellules des gamètes sexuels) des métazoaires, des insectes aux humains [15]. Pendant la gamétogenèse, les gamètes se divisent et forment des amas de cellules interconnectées en syncytia (une grande structure formée par la réunion de plusieurs cellules). La conservation de ce processus au cours de l’évolution suggère que l’interconnexion intime est essentielle dans les cellules de la lignée germinale, par exemple pour la synchronisation de la division mitotique, l’entrée dans la méiose, la mort cellulaire synchronisée et finalement la fertilité [9]. Dans les cellules d’insectes comme la drosophile, ces ponts intercellulaires, appelés canaux annulaires, permettent le transport directionnel de nutriments, d’organelles, de protéines, etc. au sein du syncytia pour favoriser la croissance de cellules sélectionnées en ovocytes, tandis que les autres finiront par se rétracter et mourir [16]. En plus des cellules germinales, la cytokinèse incomplète existe également dans les tissus somatiques des invertébrés, tels que les plantes terrestres, les algues et les champignons. Chez les plantes terrestres, par exemple, la cytokinèse incomplète entraîne l’établissement d’un vaste réseau intercellulaire où des centaines de ponts intercellulaires, appelés plasmodesmes, sont créés entre les cellules filles lors de leur division [8]. Ces ponts, qui peuvent couvrir jusqu’à 15% de l’interface cellulaire, relient pratiquement toutes les cellules de l’ensemble du corps végétal et favorisent les échanges moléculaires. Une forte altération de la fonction ou de la formation des plasmodesmes entraîne la mort de la plante.
La suppression de l’abscission (que ce soit pour une période courte ou longue) et la formation de ponts intercellulaires est une caractéristique récurrente trouvée chez les eucaryotes multicellulaires complexes. Il a récemment été suggéré que ce processus était à la base de l’évolution de la multicellularité clonale en permettant aux cellules de rester attachées et de communiquer après la division [9]. La division cellulaire et la communication cellule-cellule sont toutes deux des facettes essentielles de la multicellularité et, comme souvent dans la vie, ces deux processus (division et connexion) sont entrelacés. Le déplacement du curseur entre ces deux variables favorise la diversité et l’adaptation. On ne sait pas comment les cellules décident de passer par une cytokinèse complète ou incomplète, mais lorsqu’elles se divisent, elles doivent trouver un équilibre entre la nécessité de se séparer et celle de rester connectées. Elles doivent réfléchir aux avantages et aux coûts d’un divorce « net » ou « ouvert ».
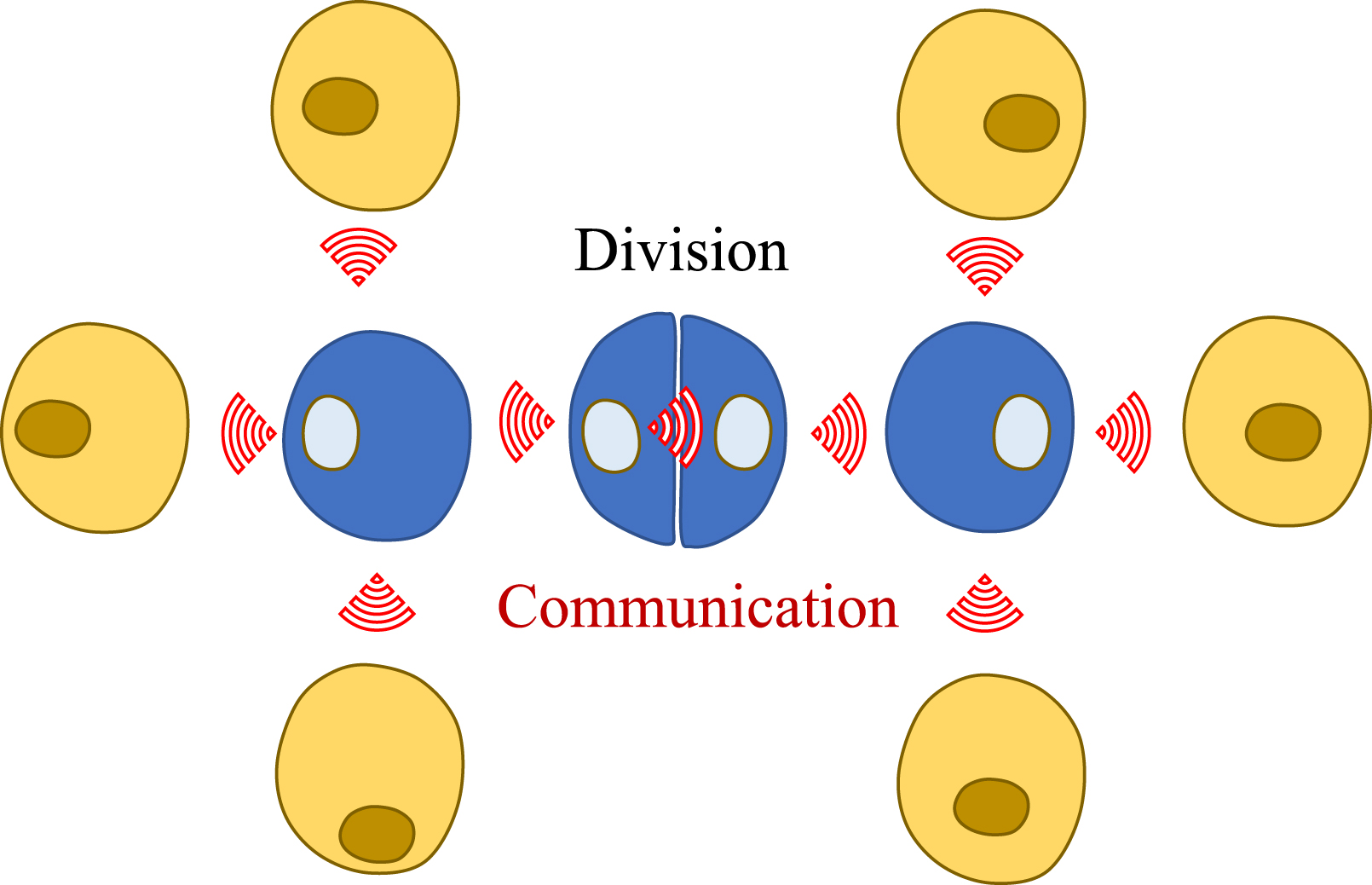
La division cellulaire et la communication sont deux facettes fondamentales de la multicellularité. Les deux processus peuvent être combinés et conduire à la formation de ponts intercellulaires par cytokinèse incomplète.
Conflit d’intérêt
L’auteur n’a aucun conflit d’intérêt à déclarer.
Remerciements
Je tiens à remercier Marie Cécile Caillaud, ENS Lyon pour avoir lu et commenté le présent manuscrit et pour les entretiens inspirants sur la place des jeunes scientifiques et des femmes dans la science.
E. L’équipe d’EMB est soutenue par l’Agence Nationale de la Recherche (Subvention ANR PRPC - ANR-21-CE13-0016-01 DIVCON), le Conseil Européen de la Recherche (ERC) dans le cadre du programme de recherche et d’innovation Horizon 2020 de l’Union Européenne (convention de subvention No. 772103-BRIDGING), le programme EMBO Young Investigator Program.




 CC-BY 4.0
CC-BY 4.0