Abridged English version
Plant diseases are caused by various agents, including virus, bacteria, mycoplasma, and fungi. Their control is achieved by various methods, and among them, there are chemical applications. However, in practice, the main compounds are fungicides, which are, with insecticides and herbicides, the three major groups of pesticides. Most of the fungicides act directly on essential fungal functions such as respiration, sterol biosynthesis or cell division. The compounds interfering with respiration inhibit spore germination and consequently exhibit protective activity. The oldest ones are non-specific thiol reactants such as copper derivatives, sulphur, dithiocarbamates (e.g. maneb, thiram) or trichoromethylthio derivatives (e.g., folpe). They inhibit several enzymes involved in respiration and this multisite action is believed to prevent the development of practical resistance. Specific inhibitors of complex III of the mitochondrial respiration chain have been recently launched. The main class consists of synthetic strobilurins (e.g., azoxystrobin, kresoxym-méthyl, trifloxystrobin, pyraclostrobin, pycoxystrobin), which are analogs of natural compounds produced by ligninolytic fungi. These strobilurins bind to ubiquinol oxydation centre of cytochrome b and a point mutation in codon 143 leads to resistance in several plant pathogens. Four main classes of sterol-biosynthesis-inhibiting fungicides can be distinguished according to their target sites. They are inhibitors of: (1) squalene epoxidation (e.g., pyributicarb), (2) 14α-demethylation or DMIs (e.g. epoxyconazole, prochloraz, tebuconazole), (3) Δ14-reduction and/or Δ8→Δ7-isomerisation (e.g. fenpropimorph, fenpropidin, spiroxamine), (4) C-4 demethylation (e.g., fenhexamid). Among them, the most wildly used are DMIs, whose target site is a cytochrome P450 monooxygenase; a mutation in codon 136 of the gene encoding this enzyme or an increased efflux of these inhibitors is responsible for acquired resistance. Benzimidazoles (e.g., carbendazim), phenylcarbamates (e.g., diethofencarb), and benzamides (e.g., zoxamid) inhibit the microtubule assembly and consequently block cell divisions. This effect seems to be related to their binding to β-tubulin, a main component of microtubules. Variability in this protein, especially at position 198 and 200, seems to govern selectivity and resistance to these antimicrotubular fungicides. Induction of disease resistance mechanisms in plant tissues constitutes another way to control pathogens. It can be achieved by phosphonates (e.g., fosethyl, Al), which stimulate the production of fungal elicitors. As for probenazole and its main metabolite saccharin or synthetic analogues of salicylic acid (e.g., acibenzolar-S-methyl), which directly act on plant metabolism, they exhibit practical activity against fungi and bacteria. Other types of plant activators are tested; they include natural compounds such as a β-1,3 glucan extracted from brown algae.
1 Introduction
Les produits phytosanitaires ou pesticides utilisés dans l'agriculture permettent de limiter le développement d'organismes susceptibles d'affecter les cultures et les récoltes. Les agresseurs peuvent être des virus, des bactéries, des champignons, des plantes (mauvaises herbes), des invertébrés (exemple : insectes, acariens, nématodes) et des vertébrés (exemple : rongeurs, oiseaux). À l'heure actuelle, la lutte chimique est dominée par trois classes de pesticides que sont les herbicides appliqués contre les mauvaises herbes, les insecticides contre les insectes et enfin les fongicides contre les champignons. Pour un chiffre d'affaire mondial d'environ 30 milliards d'euros, ces trois classes représentent respectivement 47 %, 29 % et 18 %. Cette répartition est fonction des zones géographiques : ainsi, en France, les pourcentages respectifs s'établissent respectivement à 38, 10 et 40 %, pour un chiffre d'affaire de 2 milliards d'euros. Au cours de ces dernières années, les ventes des produits phytosanitaires ont légèrement baissé et une forte restructuration de l'agrochimie s'est opérée. En effet, de nombreuses fusions ont eu lieu (exemple : Syngenta, Bayer Crop Science, BASF Agro, Dow Agroscience) et une rupture s'est produite entre agrochimie et pharmacie, alors que ces activités des sciences de la vie étaient traditionnellement conduites par les mêmes sociétés.
Actuellement, le coût de développement d'une nouvelle matière active est de l'ordre de 160 millions d'euros et il s'écoule souvent presque dix ans entre sa découverte et sa commercialisation. Ce montant élevé est lié au fait qu'il faille cribler un grand nombre de molécules, environ 100 000 aujourd'hui, pour déboucher sur un produit phytosanitaire associant un haut niveau d'efficacité à de faibles doses, avec des profils toxicologiques et écotoxicologiques favorables. Ceci implique notamment de prouver qu'il ne présente pas de toxicité aiguë ou chronique pour l'homme (en tant qu'applicateur ou consommateur) et les organismes non cibles et qu'il disparaı̂t rapidement de l'environnement [1]. Au cours de la dernière décennie, tant en Europe qu'aux États-Unis, les normes se sont fortement resserrées, avec comme conséquence une diminution du nombre de matières actives disponibles. Cette situation est susceptible d'engendrer une augmentation du coût de la protection phytosanitaire, mais aussi l'impossibilité de combattre certains agresseurs [2,3]. Quant aux phénomènes de résistance acquise, ils ont conduit, d'une part, les sociétés agrochimiques à coordonner leurs préconisations par classe de résistance croisée et, d'autre part, les instances européennes d'homologation à exiger des informations sur les risques de résistance pour toute nouvelle matière active [4].
Dans cet article, nous traiterons essentiellement des fongicides, en prenant des exemples parmi des matières actives agissant directement sur les champignons ou indirectement, par stimulation des réactions de défense des plantes contre ces microorganismes. Ceci nous permettra d'évoquer les débuts de la lutte chimique contre les champignons phytopathogènes, assurée par des produits minéraux à base de cuivre ou de soufre, puis la généralisation des fongicides organiques de synthèse depuis la fin de la seconde guerre mondiale. Les modes d'action biochimique de divers groupes de matières actives seront présentés, ainsi que les conséquences en termes de sélectivité et de résistance.
2 Les maladies fongiques et les principales classes de fongicides
Si la plupart des maladies fongiques des plantes sont provoquées par des organismes du règne des Champignons ou Eumycota, certaines d'entre elles le sont par protozoaires fongiformes appartenant au règne des Protozoa, et d'autres par des Oomycota rattachés au règne des Chromista. Les protozoaires fongiformes qui ont divergé très tôt des Eumycota possèdent la capacité de former des plasmodes. Les agents phytopathogènes de ce type sont principalement des Myxomycota (exemple : Plasmodiophora, Polymyxa, Spongospora), qui s'attaquent aux parties souterraines des plantes ; très peu de fongicides sont efficaces contre ces microorganismes. Les principaux représentants du règne des Chromista sont des algues (exemple : algues brunes, diatomées) ; bien que dépourvues d'activité photosynthétique, les Oomycota présentent de nombreuses similitudes (exemple : spores ciliées, parois cellulosiques) avec ces diverses algues. Ces Chromista fongiformes sont responsables de maladies foliaires majeures comme les mildious (exemple : Phytophthora infestans, Plasmopara viticola) ; certains sont également susceptibles d'attaquer les systèmes racinaires (exemple : Aphanomyces, Pythium). Quant aux Eumycota, ils constituent, avec les animaux (Animalia) et les plantes (Plantae), les trois règnes majeurs de la couronne terminale de l'arbre phylogénétique des Eucaryotes. En fait, les Eumycota et les Animalia dériveraient d'un ancêtre commun, ce qui pourrait notamment expliquer la présence de chitine chez des organismes de ces deux règnes. Les Chitridiomycota, vivant principalement dans des milieux aquatiques, sont probablement les premiers Eumycota, qui ont ensuite donné naissance aux Zygomycota (perte de flagelles). Par la suite, ceux-ci ont conduit aux deux grands phyla d'Eumycota, les Ascomycota et les Basidiomycota, qui ont accompagné l'évolution des végétaux terrestres. Quant aux Deuteromycota ou « Champignons imparfaits », ils correspondent, pour la plupart, à des Ascomycota ayant perdu leur capacité à se reproduire sexuellement. À l'heure actuelle, parmi les Eumycota, ce sont principalement des Ascomycota (exemple : antrachnoses, fusarioses, monilioses, oı̈diums, pourriture grise, pyriculariose, septorioses) et des Basidiomycota (exemple : caries, charbons, rhizoctones, rouilles) qui sont nuisibles aux cultures [5,6].
Plusieurs critères de classifications des fongicides ont été proposés en fonction de leurs modes d'action biologique (exemple : préventif/curatif), de leurs comportements dans les plantes (exemple : contact, pénétrant, systémique) ou de leurs structures chimiques. Mais, finalement, l'émergence des résistances a conduit les scientifiques, mais aussi les prescripteurs, à classer les matières actives selon leur mode d'action biochimique. Ainsi, parmi les fongicides agissant directement sur les champignons, il est possible de mettre en premier ceux qui réduisent la production d'énergie cellulaire, suite généralement à un effet sur les processus respiratoires. Par ailleurs, il en existe qui affectent la biosynthèse de composants majeurs, comme des glucides (exemple : chitine), des lipides (exemple : phospholipides, stérols), des mélanines, des acides aminés (exemple : méthionine), des protéines ou des acides nucléiques. Quelques matières actives perturbent la formation et/ou le fonctionnement des microtubules. Enfin, une dernière catégorie de fongicides est constituée par ceux dont le mode d'action n'est pas élucidé [7,8].
3 Les inhibiteurs respiratoires
Chez les champignons, comme chez tous les Eucaryotes, les processus respiratoires, correspondant au catabolisme oxydatif de molécules organiques comme des glucides, des lipides ou des protéines, sont la source d'énergie biodisponible sous forme d'ATP. Il se forme également des transporteurs d'électrons réduits, notamment le NADH et des métabolites essentiels comme l'acétate. Les mitochondries sont le siège des phases terminales et renferment notamment une série de transporteurs d'électrons qui constituent la chaı̂ne respiratoire, ainsi que l'ATP synthase. Plus d'un tiers des fongicides affectent ces processus ; ils ont en commun la propriété d'inhiber la germination des spores des champignons et aussi d'immobiliser les zoospores des Oomycota. En conséquence, ils se caractérisent tous par une forte activité préventive. Ces inhibiteurs respiratoires ont notamment marqué les débuts de la lutte chimique contre des maladies fongiques majeures comme des mildious ou des oı̈diums, grâce à des substances minérales à base de cuivre ou de soufre développées dès le XIXe siècle. Après la seconde guerre mondiale, la montée en puissance de la chimie de synthèse a débouché sur des familles chimiques importantes comme les dithiocarbamates (exemple : mancozèbe, manèbe, métirame-zinc, thirame) ou les N-trichlorométhylmercaptans (exemple : captane, folpel, dichlofluanide). Bien que ces fongicides présentent une grande diversité chimique, ils sont tous susceptibles d'interagir avec de nombreux systèmes enzymatiques et sont qualifiés de fongicides « multi-sites ». À l'inverse, de nombreuses matières actives possèdent une action plus spécifique ; il s'agit notamment d'inhibiteurs du complexe mitochondrial III [9].
Les produits multi-sites sont utilisés depuis plusieurs décennies en pulvérisation des parties aériennes des plantes ou en traitement des semences. Certains d'entre eux, comme les dithiocarbamates et les N-trichlorométhylmercaptans (Fig. 1) présentent un large champ d'action, incluant des Ascomycota, des Basidiomycota, ou des Oomycota. Des activités anti-bactériennes ont également été décelées, mais en France, seuls les produits cupriques sont effectivement utilisés contre les phytobactérioses. En fait, l'efficacité du cuivre serait due à son action directe sur les bactéries et aussi à un durcissement des surfaces foliaires, les rendant plus résistantes à la pénétration de ces microorganismes. Pour en revenir aux champignons, il a été prouvé que l'inhibition des spores, induite par ces produits multi-sites, est corrélée avec un blocage de leur consommation d'oxygène et du catabolisme des substances de réserve (lipides, glucides). Au niveau du catabolisme glucidique, ces produits multi-sites sont susceptibles d'inactiver des enzymes de la glycolyse (exemple : hexokinase, triose-P-deshydrogénase, pyruvate deshydrogénase), du cycle de Krebs (exemple : fumarase, cétoglutanate-deshydrogénase) et de la chaı̂ne respiratoire (exemple : complexes II et III). En fait, ces produits multi-sites ou leurs métabolites sont capables d'interagir avec de nombreux groupements chimiques, dont les thiols, ce qui explique notamment l'inhibition de la pyruvate deshydrogénase suite à l'inactivation de l'acide lipoı̈que [10,11]. Parmi les multi-sites mentionnés précédemment, il convient d'indiquer que les diverses formes de sel de cuivre peu solubles appliquées sur les cultures libèrent des ions Cu2+, directement responsables de la fongitoxicité. Quant au soufre élémentaire, sa réaction avec les groupements thiols et sa compétition avec l'oxygène au niveau de la chaı̂ne respiratoire expliquent son effet inhibiteur sur les processus respiratoires et génèrent de l'H2S. Dans le cas des N-trichlorométhylmercaptans, l'interaction avec les groupements thiols entraı̂ne la formation d'un amide non toxique et de thiophosgène, lui-même très réactif (Fig. 1). Enfin, pour un éthylène bisdithiocarbamate, comme le manèbe (polymère pratiquement insoluble dans l'eau et les solvants organiques), son activité antifongique est déterminée par l'éthylène diisothiocyanate et/ou le DIDT (5,6-dihydro-3H-imidazo[2,1-c-]-1,2,4-dithiazole-3-thione) [11,12] (Fig. 1). En définitive, la forte réactivité des produits multi-sites avec de nombreux constituants cellulaires les expose à des effets secondaires indésirables et est à l'origine du retrait de certains d'entre eux, comme les organomercuriques ou l'arsénite de sodium, ainsi qu'à des limitations pour plusieurs autres matières actives. De plus, les fongicides multi-sites ont une persistance d'action relativement faible, nécessitant des traitements fréquents, un renouvellement en cas de pluie et des doses élevées (plus 1 à 2 kg de matière active par hectare). En revanche, la quasi-absence de résistance acquise chez les champignons phytopathogènes permet à ces fongicides multi-sites d'être des partenaires importants dans l'élaboration de stratégies anti-résistance, notamment vis-à-vis des mildious.
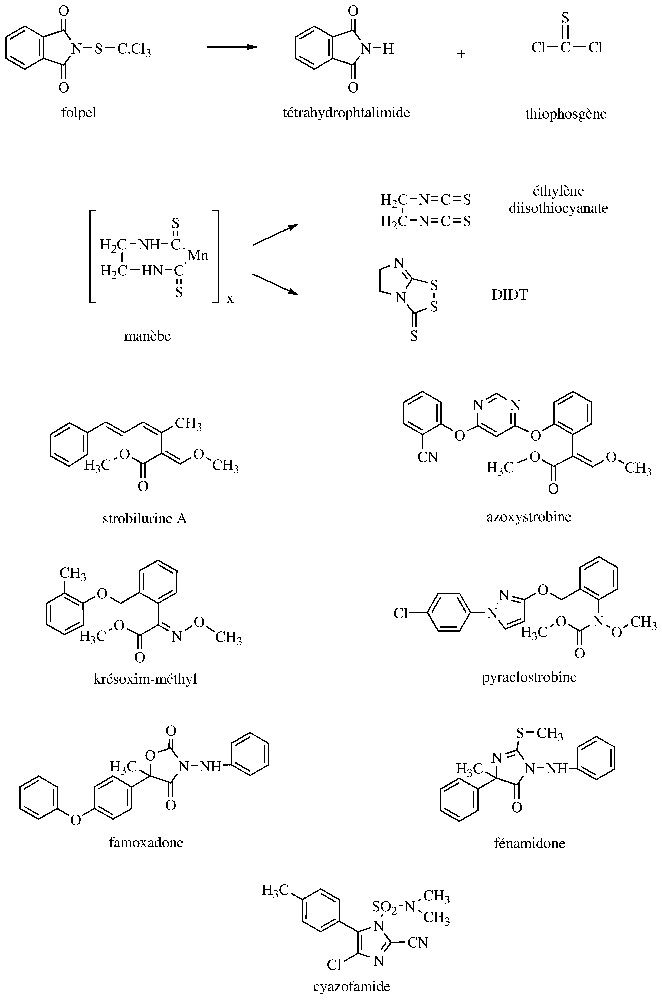
Structure de fongicides agissant sur la respiration.
Le complexe mitochondrial III, qui est formé d'une dizaine de sous-unités, dont le cytochrome b, assure le transfert des électrons du coenzyme Q au cytochrome c. Le cytochrome b, qui est par ailleurs la seule protéine du complexe III codée par un gène mitochondrial, comporte un centre réducteur du coenzyme Q, proche de la matrice mitochondriale (centre Qi ou Qn) et un centre d'oxydation du coenzyme Q proche de l'espace intermembranaire (centre Qo ou Qp). Il est actuellement possible de distinguer deux types d'inhibiteurs du complexe III, selon qu'ils se fixent sur la face interne (QiI) ou externe (QoI) du cytochrome b. Le premier inhibiteur à usage agricole a été l'antimycine A, un antibiotique non sélectif utilisé au Japon, pendant quelques années, contre la pyriculariose du riz. Cette substance est un QiI, au même titre que le diméfluazole, non développé pour des raisons toxicologiques, et la cyazofamide, deux cyanoimidazoles de synthèse particulièrement efficaces sur les Oomycota (Fig. 1). Ainsi, la cyazofamide s'utilise à des doses inférieures à contre les mildious de la vigne et de la pomme de terre ; elle demeure efficace vis-à-vis de souches résistantes aux QoI [1]. Selon Pillonel [13], l'inhibition du complexe III des Oomycota résulterait d'une liaison covalente de la sulfonamide de ces cyanoimidazoles sur le cytochrome b. Potentiellement plus prometteuses semblent être les strobilurines, une nouvelle génération de fongicides QoI, actifs sur de nombreux Ascomycota, Basidiomycota, Oomycota, rencontrés notamment sur le blé, l'orge, le riz, la vigne et le pommier [1,14]. La dénomination « strobilurines » indique que les matières actives de ce groupe sont des analogues synthétiques de molécules naturelles (exemple : strobilurine A) produites par de nombreux Basidiomycota, appartenant en particulier aux genres Strobilurus, Oudemansiella, Mycena, qui sont des champignons lignicoles rencontrés dans les forêts des zones tropicales et tempérées. Ces strobilurines naturelles ont été initialement découvertes par des chercheurs tchèques à la fin des années 1960 et leur mode d'action sur le complexe mitochondrial III (issu de cellules de vertébrés) a été élucidé une dizaine d'années plus tard par des universitaires allemands. Ces métabolites constituent probablement un système de défense des Basidiomycota producteurs vis-à-vis d'autres organismes colonisant les mêmes substrats. Les strobilurines naturelles sont toxiques in vitro pour de nombreux champignons phytopathogènes, mais leur instabilité à la lumière et/ou leur volatilité n'a pas permis de développements pratiques. De nombreux analogues structuraux ont alors été synthétisés et ont débouché, depuis cinq ans, sur des applications. Ces recherches ont notamment abouti à l'azoxystrobine, qui, comme les strobilurines naturelles, renferme comme toxophore un méthyl β-méthoxyacrilate. Toutefois, le développement du krésoxim-méthyl et de la métominostrobine, qui respectivement renferment un méthyl méthoxyiminoacétate et un méthyl méthoxyiminoacétamide, prouve qu'une flexibilité existe autour du toxophore [14,15]. Enfin, parmi les trois strobilurines les plus récentes, la pyraclostrobine, avec un méthyl méthoxycarbamate, présente un autre type de toxophore, alors que la picoxystrobine et le trifloxystrobine se rapprochent respectivement de l'azoxystrobine et du krésoxym-méthyl (Fig. 1). Ces strobilurines présentent un large spectre d'activité et sont douées d'une excellente action préventive. Ces propriétés les rapprochent des fongicides multi-sites, avec cependant des persistances d'actions plus longues et des doses d'utilisation environ dix fois plus faibles (50 à ). De plus, ces strobilurines, qui présentent toutes des transferts translaminaires, peuvent également, pour certaines, être véhiculées par le xylème (exemple : azoxystrobine, picoxystrobine) ou être redistribuées à l'extérieur en phase vapeur (exemple : azoxystrobine, krésoxim-méthyl, trifloxystrobine). Ces diverses propriétés favorisent la longue persistance des strobilurines et les activités curatives de certaines d'entre elles. Par ailleurs, sur les céréales, les strobilurines exercent des effets physiologiques se traduisant par un maintien prolongé de la coloration verte des feuilles traitées et entraı̂nent des augmentations significatives de rendement, voire parfois des améliorations qualitatives des récoltes. Cette action anti-sénescence est associée à une baisse de la teneur en éthylène, une augmentation de celles en cytokinines et NO. D'autres processus incluant l'assimilation du CO2 ou l'utilisation de l'azote sont également concernés [16]. Un second groupe d'inhibiteurs de Qol est constitué par une oxazolinedione, la famoxadone, et une imidazolinone, la fénamidone (Fig. 1). Ces molécules, qui dérivent d'une chimie développée initialement dans un laboratoire universitaire allemand, sont particulièrement efficaces contre les mildious ; des activités intéressantes sont également observées sur d'autres pathogènes (exemple : Alternaria, Septoria). Comme les strobilurines, ces deux fongicides présentent une forte action préventive et une longue persistance d'action ; ils s'utilisent à des doses comprises entre 50 et [14]. Au bout de quelques années d'utilisation, le groupe des Qol se trouve confronté à des problèmes de résistance acquise qui touchent notamment des agents responsables d'oı̈diums et de mildious. Il a été montré que, dans la plupart des cas, ce phénomène résulte d'une mutation ponctuelle au niveau du codon 143 du gène du cytochrome b. Les triplets GGT et GGA, qui codent pour une glycine chez les souches sensibles, sont remplacés par les triplets GCT ou GCA, qui codent pour une alanine chez les souches résistantes. Les niveaux de résistance sont élevés et il y a résistance croisée entre tous les Qol, mais pas avec les Qil. Chez certains Basidiomycota producteurs de strobilurines, la présence d'une alanine en 143 pourrait expliquer en partie leur résistance naturelle aux Qol, sachant toutefois que ce serait surtout la présence d'une isoleucine en 127 (au lieu d'une alanine ou d'une thréonine chez les organismes sensibles) qui conditionnerait ce phénomène [17]. En outre, chez certains Oomycota, la résistance acquise serait liée à la présence au codon 129 d'une leucine (triplet TTA) à la place d'une phénylalanine (triplet TTC). Par ailleurs, chez Venturia inaequalis, l'agent de la tavelure du pommier, la résistance à quelques strobilurines, dont le krésoxim-méthyl, résulterait d'une détoxication accrue, probablement par l'intermédiaire d'une estérase qui hydrolyse l'ester méthylique de ce type de Qol. Ce mécanisme est impliqué dans la métabolisation des strobilurines chez des organismes non cibles, notamment les vertébrés [12].
4 Les inhibiteurs de la biosynthèse des stérols
Les stérols fongiques sont synthétisés dans le cytoplasme et les phases terminales qui vont du squalène à l'ergostérol sont catalysées par des enzymes microsomales. Il convient d'indiquer ici que chez certains parasites obligatoires, le stérol majoritaire n'est pas l'ergostérol (exemple : ergosta-5, 24(28)-diénol chez les oı̈diums) et que de nombreux Oomycota ne synthétisent pas de stérols, du fait d'une squalène époxydase non fonctionnelle. Ces stérols sont des composants importants des membranes cellulaires, dont ils régulent la fluidité et les enzymes qu'elles renferment, comme les chitine synthases. Par ailleurs, il a été montré qu'une fraction intracellulaire pourrait intervenir dans la régulation des cycles cellulaires. Au vu des observations obtenues dans les domaines médicaux et agricoles, il s'avère que la biosynthèse de ces lipides isopréniques constitue une cible intéressante pour des fongicides souvent polyvalents (à l'exception des mildious).
Un premier groupe d'IBS (inhibiteurs de la biosynthèse des stérols) est susceptible d'inhiber, de manière non compétitive, la squalène époxydase, qui catalyse l'oxydation du squalène en 2,3-oxydosqualène. Il s'agit notamment d'allylamines (exemple : naftifine, terbinafine) et de thiocarbamates (exemple : tolnaftate, tolciclate) utilisés en médecine humaine. Quant au pyributicarbe, qui est également un thiocarbamate, il est appliqué au Japon sur le riz, à la fois comme herbicide et fongicide [8] (Fig. 2).
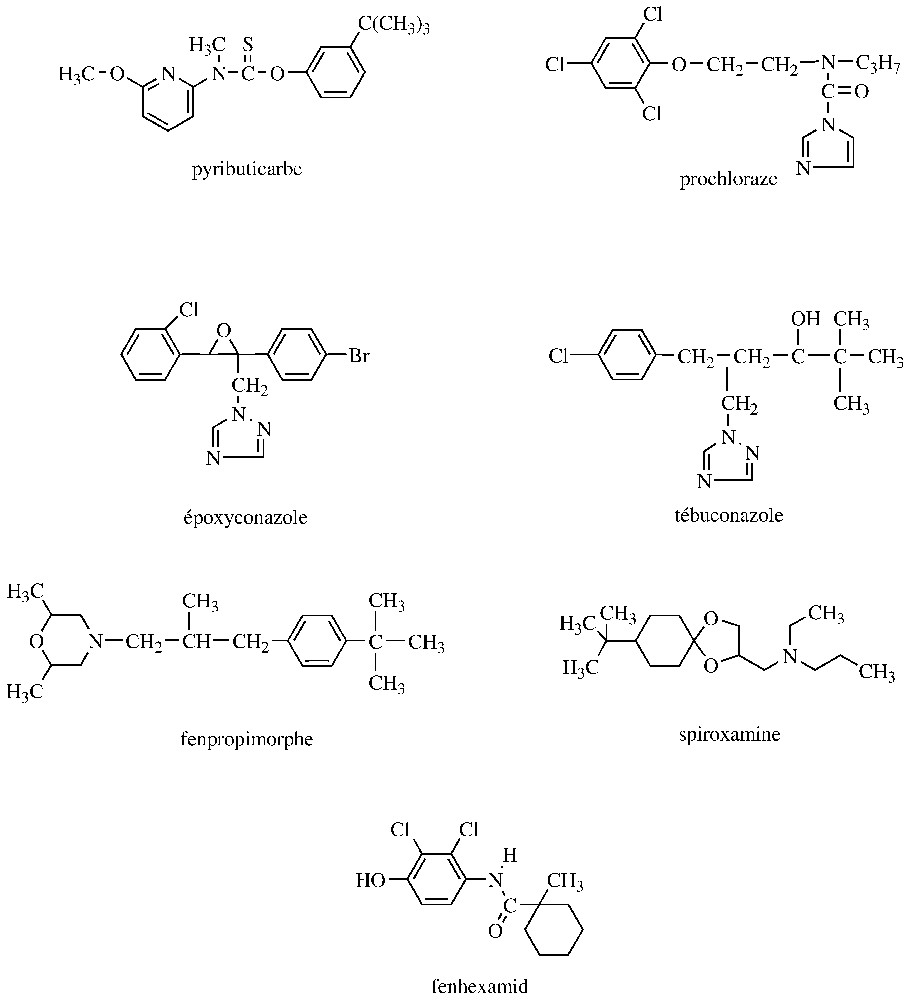
Structures d'inhibiteurs de la biosynthèse des stérols.
Les inhibiteurs de la 14α-déméthylation des stérols (synonyme : IDM) représentent le groupe le plus nombreux d'IBS utilisés en agriculture ; introduits il y a une trentaine d'années, ils représentent environ 25 % du marché mondial des fongicides (cette classe d'IBS est également très représentée en médecine). Ils comportent un hétérocycle azoté, qui peut être un imidazole (exemple : prochloraze), une pyrimidine (exemple : fénarimol) une pyridine (exemple : pyrifénox) ou un triazole (exemple : époxyconazole, fluzilazole, tébuconazole, tradiménol) (Fig. 2). Ces produits, qui sont pénétrants ou systémiques, ont en commun un large spectre d'activité et un bon effet curatif ; leur dose d'utilisation est comprise entre 100 et en grande culture et est inférieure à en viticulture [7]. La 14α-déméthylation implique une monooxygénase à cytochrome P450, qui catalyse trois oxydations successives du C-14 méthyle de l'éburicol, avant son élimination. Les IDM forment un complexe de type II avec le cytochrome P450, qui résulte de la liaison d'une paire d'électrons non liante d'un atome d'azote du fongicide avec le fer hémique. Outre ce ligand fer–IDM, il existe également des interactions avec le site de fixation du substrat sur l'apoprotéine. Étant donné que les enzymes à P450 sont ubiquistes et peuvent oxyder des molécules endogènes autres que les stérols et une grande variété de xénobiotiques, des effets secondaires des IDM sont attendus. Ainsi, des cas de phytotoxicité de certains IDM ont pu être corrélés avec une inhibition de la kaurène oxydase, une enzyme à P450 impliquée dans la synthèse des gibbérellines. Mais, basés sur cet effet, des analogues structuraux des IDM sont développés comme régulateurs de croissance (exemple : flurprimidol, paclobutrazole). Des inhibitions et/ou des inductions de cytochrome P450 impliquées dans le métabolisme de xénobiotiques ont également été signalées chez des invertébrés et vertébrés [18–20].
Un troisième groupe d'IBS est constitué de molécules comportant une fonction amine, qui est protonée en milieu aqueux à des pH biologiques. Cette amine se trouve généralement incluse dans un hétérocycle pouvant être une morpholine (exemple : fenpropimorphe, tridémorphe) ou une pipéridine (exemple : fenpropidine) ; la spiroxamine fait toutefois exception (Fig. 2). Ces fongicides présentent des activités voisines des IDM, avec cependant une spécificité plus marquée vis-à-vis des oı̈diums et des doses d'utilisation environ cinq fois supérieures à celles des IDM [7]. Ces amines sont susceptibles d'inhiber à la fois la Δ14-réductase et la Δ8→Δ7 isomérase. Ces deux enzymes vont initier une attaque électrophile par un proton H+ sur un carbone nucléophile du substrat, qui conduit à la formation de stérols à carbocations (en position 14 ou 8). Dans ces conditions, l'effet inhibiteur des amines précitées est probablement déterminé par leur analogie structurale avec ces intermédiaires stéroliques à haute énergie [18–20].
Enfin, depuis trois saisons, un nouveau type d'IBS est disponible contre Botrytis cinerea, l'agent de la pourriture grise et quelques autres champignons voisins (exemple : Monilinia, Sclerotinia). Il s'agit d'une hydroxyanilide, le fenhexamid (Fig. 2), qui inhibe la 3-céto-réductase, une des trois enzymes impliquées dans la C-4 déméthylation des stérols. Comme les IBS mentionnés précédemment, le fenhexamid affecte fortement l'élongation des hyphes mycéliens ; toutefois, cet hydroxyanilide agit essentiellement de manière préventive. La spécificité du fenhexamid semble être liée à des différences de détoxification et/ou de sensibilité de l'enzyme cible [21].
Dans le domaine agricole, ces IBS ont été relativement épargnés par les phénomènes de résistance. En fait, dans de nombreux cas, les réductions d'efficacité sont modérées et ne concernent pas toutes les matières actives d'une classe de mode d'action. Dans les cas des IDM, plusieurs mécanismes de résistance ont été identifiés, notamment une mutation ponctuelle du gène codant pour la 14α-déméthylase. Ainsi, chez les oı̈diums en position 136, un tyrosine (codon TAT) à la place d'une phénylalanine (codon TTT) induit une résistance au triadiménol et à quelques autres triazoles [22]. En revanche, chez Candida albicans, une forte résistance aux IDM à usage médical est conférée par la présence d'une histidine (codon TAT). Par ailleurs, il existe des cas où la résistance aux IDM résulte d'une moindre présence de ces molécules dans ces cellules fongiques. Ce mécanisme résulte d'une excrétion accrue, pouvant faire intervenir des transporteurs à ABC (pour ATP Binding Cassette), qui utilisent l'ATP comme source d'énergie. Ces systèmes peuvent parfois conférer une résistance à des fongicides différents et entraı̂ner une MDR (pour multidrug resistance) ; un tel phénomène a été reporté chez B. cinerea pour les IDM, des thiocarbamates et le fenhexamid ainsi que pour les dicarboximides et les anilinopyrimidines [23].
5 Les fongicides antimicrotubules
Les microtubules sont des constituants majeurs du cytosquelette et du fuseau achromatique. Toute substance susceptible d'interférer avec la formation et/ou le fonctionnement de ces microtubules bloque les divisions cellulaires et l'élongation des hyphes mycéliens. L'un des composants majeurs des microtubules est la tubuline, un hétérodimère constitué de deux sous-unités α et β. Les tous premiers fongicides agricoles polyvalents, systémiques et doués de propriétés curatives ont été les benzimidazoles (exemple : carbendazime) (Fig. 3). Ils se fixent sur la β-tubuline de nombreux Ascomycota et Basydiomicota, mais leur interaction est faible pour celles des Oomycota, des plantes ou des animaux. À noter, en revanche, que le nocodazole, une molécule voisine du carbendazime, présente une activité tumorale forte, liée à son interaction avec les β-tubuline de mammifères. L'usage agricole des benzimidazoles s'est trouvé fortement affecté par la sélection de souches résistantes chez de nombreux champignons phytopathogènes. Cette résistance acquise est liée à une moindre affinité de ces fongicides pour la β-tubuline et résulte de mutations dans les codons 198 ou 200. Ainsi, en position 198, chez les souches sensibles, le triplet GAG code pour un glutamate, alors que, chez les résistantes, il y a notamment les triplets GCG et GGG, qui codent respectivement pour l'alanine et la glycine. En position 200, les β-tubulines des souches sensibles et résistantes comportent respectivement une phénylalanine (codon TTC) et une tyrosine (codon TAC). Il convient aussi d'indiquer qu'à cette même position, les Oomycota et les plantes possèdent une méthionine, alors que les animaux renferment une tyrosine, ce qui peut en partie expliquer la sélectivité des benzimidazoles à usages agricoles [20]. Chez de nombreux champignons, les souches résistantes aux benzimidazoles comportant une β-tubuline modifiée en 198 présentent une sensibilité accrue aux phénylcarbamates. Ce phénomène, initialement observé avec des herbicides (exemple : chlorprophame), a été confirmé avec des fongicides dépourvus de phytotoxicité, comme le diéthofencarbe (Fig. 3). Cette résistance croisée négative entre deux groupes d'antimicrotubules a été exploitée comme stratégie anti-résistance, vis-à-vis principalement de B. cinerea, par l'intermédiaire d'une association carbendazime/diéthofencarbe. Cette approche a toutefois ses limites, car les souches présentant la mutation en 200 résistent simultanément aux benzimidazoles et aux phénylcarbamates [20]. Les benzimidazoles ont été introduits à la fin des années 1960, le diéthofencarbe est apparu vingt ans après et une nouvelle classe de fongicides susceptibles de se fixer sur la β-tubuline est sur le point d'être développée. Il s'agit d'une benzamide, la zoxamide, qui est principalement efficace sur des Oomycota et dont la structure est très proche d'un herbicide développé au début des années 1970, la propyzamide (Fig. 3). Vis-à-vis des mildious, la zoxamide agit préventivement à des doses de 125 à et elle est proposée en association avec un multi-site pour limiter le risque de résistance [24].
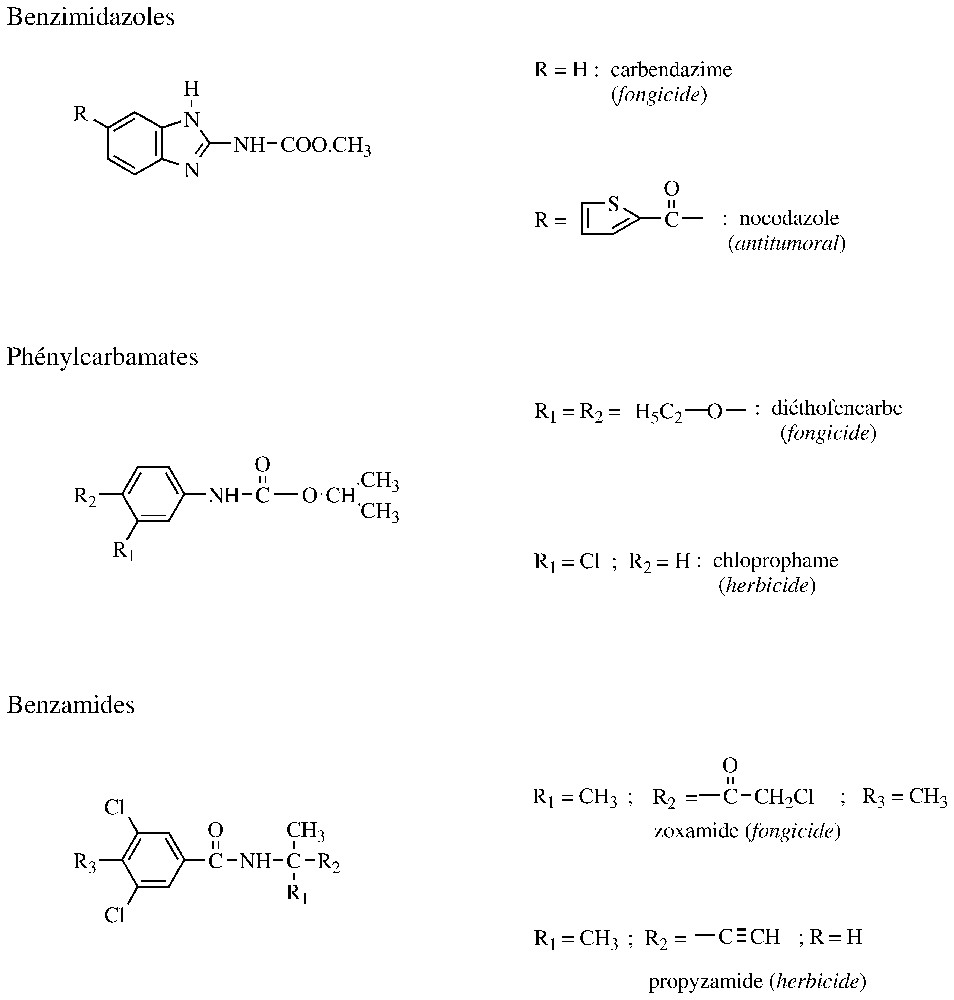
Structures d'antimicrotubules.
6 Inducteurs de résistance des plantes aux parasites
Lorsqu'une plante subit une attaque parasitaire, après une phase de reconnaissance impliquant souvent un éliciteur produit par le pathogène et un récepteur de l'hôte, elle réagit en mettant en place plusieurs barrières pour limiter la progression des agents pathogènes. Tout d'abord, une réaction d'hypersensibilité (HR) correspondant à une mort de la cellule hôte infectée peut s'observer. Puis, dans les cellules voisines du site d'infection, des molécules anti-microbiennes, comme des phytoaléxines ou des PR-protéines (pour Pathogenesis-Related) sont synthétisées. Par ailleurs, un renforcement des parois cellulaires est obtenu à la suite de dépôts de callose ou de lignine. L'ensemble de ces phénomènes contribue à la résistance locale de la plante hôte (LAR). Enfin, dans les organes non infectés, il est possible qu'il y ait une stimulation de production de PR-protéines ; ceci correspond à la résistance systémique acquise ou SAR. Tous ces processus impliquent l'activation de gènes, ainsi que la participation de médiateurs relais, comme l'acide jasmonique ou l'acide salicylique [14].
Depuis fort longtemps, des travaux ont été réalisés afin de mettre au point des composés susceptibles de stimuler les réactions de défense naturelle des plantes. Ainsi, de nombreuses molécules d'origine biologique (exemple : polysaccharides, lipides, protéines) ont été expérimentées et l'une des dernières en date est la laminarine, un glucane extrait d'une algue [14]. Même si, souvent, les niveaux d'efficacité pratique obtenus avec de telles substances sont modestes, celles-ci devraient cependant trouver leur place dans les systèmes de culture biologique. À côté de ces molécules naturelles, des produits organiques de synthèse ont été développés et le plus anciennement utilisé au champ (depuis environ deux décennies) est le probénazole (Fig. 4). Cette molécule, qui est un précurseur de la saccharine, constitue encore actuellement une des bases pour la lutte contre la pyriculariose du riz au Japon ; elle est également active contre une bactérie Xanthomonas oryzae. L'analyse des plantes traitées indique une production accrue de substances lipidiques anti-microtubiennes et la lignification des cellules du riz [20]. Le foséthyl-Al est également une autre molécule antifongique développée depuis une vingtaine d'années et dont l'activité résulte in vivo d'une activation des réactions de défense des plantes. Cette molécule et son principal métabolite, l'acide phosphonique (Fig. 4), sont surtout efficaces contre les Oomycota et présentent le particularité de migrer via le phloème et xylème (produits ambimobiles). En fait, il a été démontré que ces phosphonates provoquaient une carence phosphatée chez les champignons, entraı̂nant une augmentation de la production de substances fongiques à activité élicitrice chez les plantes hôtes [18,20]. Les développements les plus récents dans le domaine des molécules de synthèse à effets inducteurs concernent des analogues de l'acide salicylique. Les tous premiers composés ont été des dérivés de l'acide isonicotinique (exemple : INA), mais leur utilisation pratique n'a pas pu se faire en raison de leur phytotoxicité. En revanche, l'acibenzolar-S-méthyl (Fig. 4) est un benzothiadiazole qui présente de bonnes potentialités contre la pyriculariose du riz, ainsi que vis-à-vis de l'oı̈dium des céréales et de plusieurs mildious ; des activités antibactériennes et antivirales ont également été observées. Il a été démontré que l'acibenzolar-S-méthyl stimule la production de PR-protéines, probablement en se substituant à l'acide salicylique. Sur un plan pratique, cet inducteur de résistance, qui semble être ambimobile, s'utilise à des doses faibles (moins de ) mais doit être appliqué préventivement. Du fait de leur mode d'action, les analogues de l'acide salicylique semblent peu exposés aux phénomènes de résistance ; en revanche, leur développement peut être entravé par des irrégularités d'efficacité (notamment en cas de fortes infestations), ainsi que par des effets physiologiques défavorables chez les plantes [14,25,26].
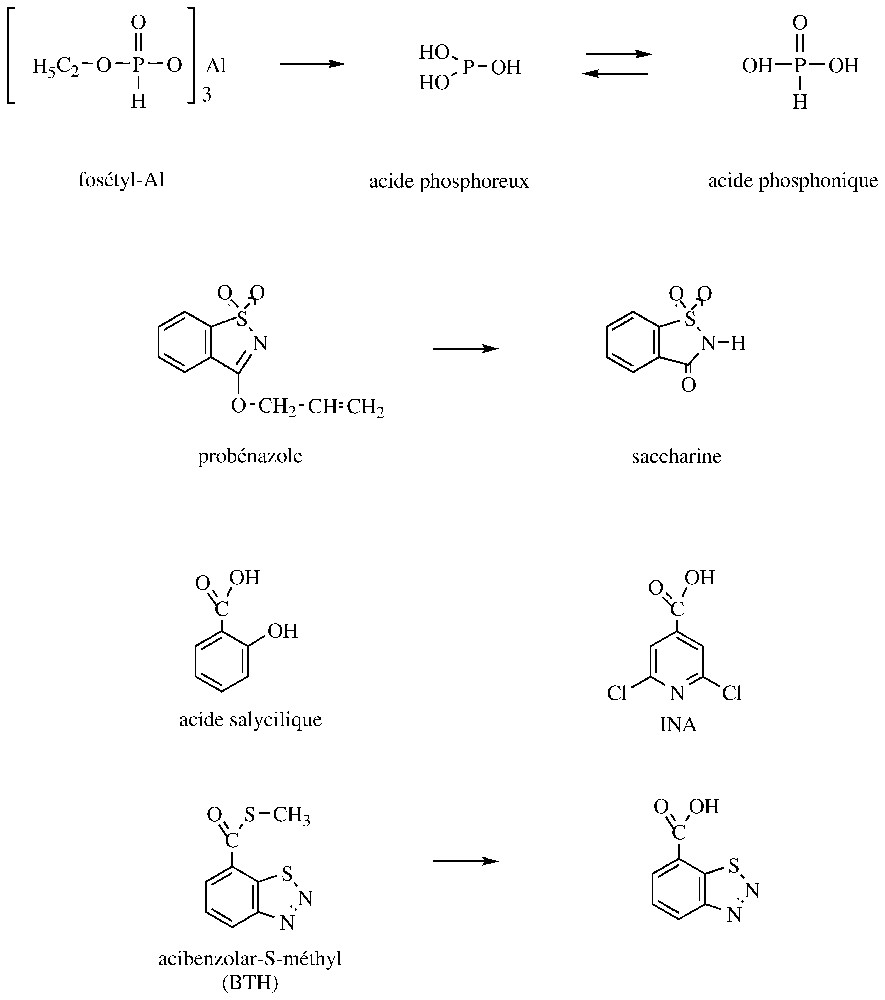
Structure de fongicides stimulant des réactions de défense des plantes.
7 Conclusion
Les fongicides constituent un des moyens de lutte contre les champignons phytopathogènes et doivent contribuer, au même titre que les méthodes prophylactiques, les moyens biologiques ou les variétés résistantes, à une protection intégrée des cultures. Pour que la lutte chimique puisse continuer à jouer un rôle important, il faut développer de nouvelles matières actives utilisables à faible dose, agissant curativement, possédant une bonne persistance d'action, peu exposées à la résistance et ne présentant pas de risques pour le manipulateur, le consommateur et l'environnement ; les firmes souhaitent en plus qu'elles soient polyvalentes. Pour atteindre ces objectifs, il est indispensable de trouver de nouvelles cibles ; la génomique fonctionnelle pourrait fournir des pistes. La diversification des structures chimiques, notamment par le biais de la chimie combinatoire ainsi que des systèmes de criblage à haute densité constituent des approches dont les retombées sont attendues dans la prochaine décennie. Des progrès doivent également être réalisés pour optimiser l'efficacité des traitements au champ et augmenter la biodisponibilité des matières actives [27].


