Abridged English version
The electrical capacitance and resistance of aerial organs of sunflower, pumpkin, and maize of different ages, grown in the laboratory, and of sorrel, bought at the market, was determined in a range of 34 frequencies, from 40 Hz to 100 kHz. Software was developed for scanning this range of frequencies and stocking measures into the PC, a 1 V signal being imposed by means of a LCZ meter. This system, in which the plant is modelled as a serial or parallel resistance/capacitor circuit, makes it possible to characterize different plant tissues. This characterization is made using a complex circuit impedance Z, which comprises a resistance and a reactance. In each system, these components also called respectively real and imaginary resistances are dependent on the alternative-current frequency and are functions of each other. The function brings out what is called the characteristic frequency (FC) corresponding the summit of the parable. Real () and imaginary () resistances were calculated using the following formulae:
- – real resistance: ;
- – imaginary resistance: , where is the measured plant resistance, ω is frequency of measure, and C is the measured plant capacitance.
For the measure, the vegetative organ (cotyledon, leaf or stem) is placed between two electrodes.
With the measurements obtained, comparisons were made between different species, between different organs of a same plant, between opposite organs of a same plant and between different physiological ages.
In all species tested, large differences were shown between bioimpedancy spectrometry curves (CSB) in the stem and the first leaf. However, CSB curves of the various dicotyledonous studied were similar, but these showed no resemblance to curves of the monocotyledon Maize. Comparing different impedance parameters of the various tested plant leaves, we note that the maize leaf had the highest capacitance (or electrical charge accumulation) and the highest resistance (if we except sorrel, which was not at the same physiological stage). First leaf capacitances of pumpkin, sunflower, maize and sorrel were respectively 2.58 nF (FC = 6200 Hz); 5.74 nF (FC = 800 Hz); 12.36 nF (FC = 80 Hz), and 18.00 nF (FC = 100 Hz). Comparing impedance-spectroscopy results in different aerial organs of a same species, we observed that resistance in stem is 1.8, 5.6 and 7.5 times higher than in leaves for maize, pumpkin and sunflower, respectively. Hypocotyl and leaf capacitances are nearly the same in pumpkin. This plant belongs to the Cucurbitaceae family, which is distinguished by a crawling stem. However, in maize and sunflower, which have upright stems, leaf capacitances were respectively 24.6 and 6.5 times higher than in hypocotyl/epicotyl. Comparing opposite organs of a same plant, we showed that in sunflower impedance parameters of opposite leaves are very close, whereas those of opposite cotyledons are very different.
First leaf resistance and capacitance values of Pumpkin at 14 days are lower than those of sunflower are at the same age. In these two species, for leaves as well as for cotyledons, the lowest capacitance values correspond to the highest resistance values. After 28 days, the sunflower first leaf does not give any typical CSB. Changes in the curve occur near the FC, beginning on day 21 with a big resistance reduction: from 16.70 to 2.38 kΩ. In the second dicotyledonous, pumpkin, curve changes begin also on day 21, but with a great resistance increase. In maize, we also observe an important impedance fall at this age, but the curve remains typical and continues so even on day 28. We note also that the highest FC corresponds to the smallest resistance and the changes in the curve begin at this moment. The smallest capacitance values were observed in pumpkin, the highest in maize.
This work could be exploited in biology as well as in agronomy and it would be useful to set up a databank for each cultivation as a function of different growth and developmental conditions.
1 Introduction
Chez les organismes vivants les paramètres électriques sont mesurés pour plusieurs raisons. Certains chercheurs veulent savoir les origines de ces phénomènes. D'autres veulent les exploiter à des fins pratiques pour diagnostiquer un état physiologique donné.
En effet, ces paramètres dépendent des courants hydro-ioniques lesquels sont fonction des structures, de l'état physiologique des organismes considérés et des conditions environnantes. Parmi les structures, il s'agit surtout des membranes cellulaires qui enveloppent le contenu cellulaire ou limitent des organites, tels que les chloroplastes ou les mitochondries, lieux de processus biochimiques intenses. Un échange ionique presque permanent s'opère entre l'intérieur et l'extérieur de ces organites, sur les membranes desquels il y a une forte accumulation d'ions et de charges électriques. C'est pour cette raison que les membranes sont considérées comme des condensateurs [1]. D'un point de vue chimique, les membranes cellulaires sont constituées en grande partie par des lipides et des protéines. Les résidus d'acides gras constituant les lipides sont apolaires et ont une faible constante diélectrique. Ils sont considérés comme de mauvais conducteurs. Les membranes ont, par conséquent, des résistances et des capacités électriques assez élevées [2].
Pour évaluer l'ordre de grandeur de ces deux paramètres, plusieurs schémas de mesure équivalents ont été proposés. Dans ces schémas, le passage du courant électrique continu à travers un système biologique, comme dans le cas des électrolytes, fait naître le phénomène de polarisation, c'est-à-dire la formation de charges électriques supplémentaires à cause de l'accumulation d'ions de signes opposés. Une nouvelle redistribution des charges électriques accompagne aussi leur accumulation. La quantité électrique accumulée dépend de la capacité statique et de la capacité de polarisation. Ce dernier phénomène rend difficile la mesure de la capacité, surtout lorsqu'on utilise un courant continu. Le courant alternatif, en revanche, élimine l'effet de polarisation. On l'utilise en introduisant aussi dans le schéma équivalent de mesure une deuxième résistance appelée impédance capacitive. Dans ces conditions et contrairement aux simples électrolytes, la conductance se trouve dépendante de la fréquence. Elle augmente jusqu'à une valeur maximale avec l'augmentation de la fréquence. Au-delà de cette fréquence, appelée fréquence caractéristique (FC), la conductance diminue. Lorsqu'on entreprend des mesures par contact et en basses fréquences, outre la polarisation des électrodes [3], on ne touche que les membranes externes. En hautes fréquences, ce sont les structures fortement enclavées dans les cellules de l'organisme testé qui sont concernées. Ainsi se sont développées les idées de mesures tomographiques afin d'évaluer, à l'instar des techniques du scanner, les propriétés électriques de différents compartiments. Pour ce faire, des systèmes multi-électrodes ont été développés [4]. De nombreuses mesures des propriétés électriques ont été faites en introduisant des électrodes à l'intérieur d'un organe, soit in situ, soit détaché de l'organisme [5–8].
Il est établi aujourd'hui que toute action mécanique (blessures ou excisions), thermique ou chimique que subit un organisme vivant l'excite et stimule chez lui un nouveau courant hydro-ionique de durée plus ou moins longue. Ceci entraîne des changements électrophysiologiques dans l'organisme testé [9,10].
Profitant des facilités qu'offrent les améliorations technologiques, nous nous sommes proposés de mesurer les impédances au niveau de certains organes de jeunes plantes grâce à l'utilisation d'électrodes autocollantes qui minimisent l'action mécanique. Nous avons choisi d'étudier et de comparer les caractéristiques électriques de divers organes aériens de deux dicotylédones et d'une monocotylédone.
2 Matériel et méthodes
2.1 Matériel biologique
Les plantes qui ont fait l'objet de cette étude sont le potiron (Cucurbita maxima L.), le tournesol (Helianthus annus L.), le maïs (Zea mays L.), cultivés en salle de culture, et l'oseille (Rumex sp.), achetée sur le marché.
2.2 Conditions de culture
Dans la salle de culture, la photopériode est de 12 h/12 h, l'intensité lumineuse de 10 000 lx, l'humidité relative de 50 à 60 % et la température moyenne jour/nuit de 22 °C/15 °C.
Après rinçage massif des graines à l'eau du robinet et imbibition dans l'eau pendant 1 h, ces graines sont mises à germer dans une bassine de faible profondeur entre deux couches de papier filtre mouillées et recouvertes par une plaque de verre. Après trois jours, la plaque et le papier filtre supérieur sont enlevés pour laisser les plantes prendre un port droit.
2.3 Culture en hydroponie (aquiculture)
Huit jours après le semis, les plants en bon état et de taille semblable sont repiqués dans des pots pourvus de couvercles percés de six trous, dont un central servant à l'aération, les cinq autres trous étant destinés à maintenir les plantes. Seules les racines sont plongées dans la solution nutritive.
La solution nutritive choisie est celle de KNOP. Sa constitution, légèrement modifiée, est la suivante (g l−1) : KNO3 (0,134) ; KH2PO4 (0,143) ; MgSO4 (0,286) ; KCl (0,071) ; Ca(NO3)2 (0,286) ; H2BO3 (0,005) ; MnSO4 (0,001) ; ZnSO4 (0,001) ; CuSO4 (0,001) ; Na2EDTA (0,019) et FeSO4⋅7 H2O (0,014).
2.4 Mesure de l'impédance
2.4.1 Appareillage, obtention et traitement des résultats
La plante est modélisée comme une résistance en série ou en parallèle avec un condensateur (Fig. 1). Ce modèle, appelé simple, donne des informations sur les changements que peut subir un essai comprenant un témoin et différents traitements, et ce par les variations des valeurs des éléments constituant le schéma ; en revanche, le modèle appelé double, comprenant une capacité supplémentaire en série, caractérise des tissus morts et ceux ayant subi des dommages mineurs [11,12].
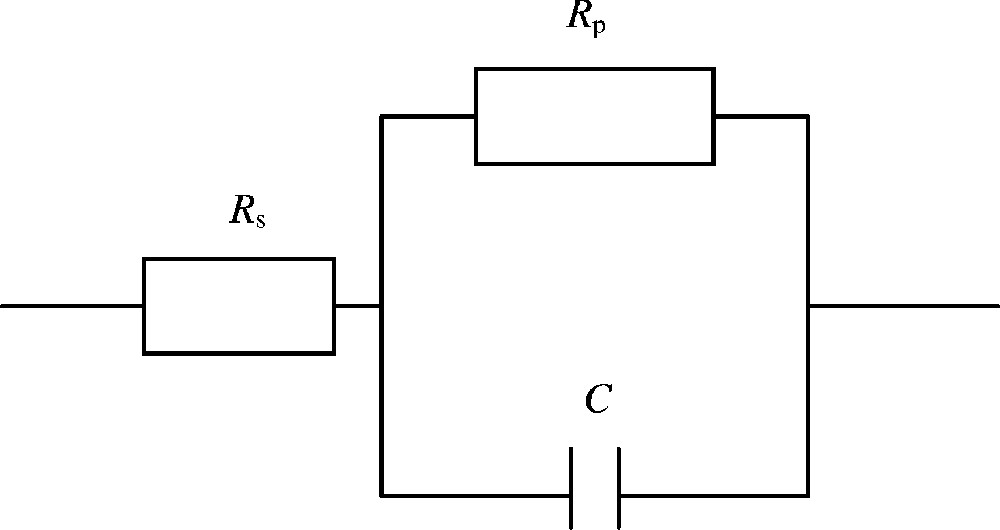
Schéma électrique équivalent à celui de la plante. représente la résistance série de la plante, sa résistance parallèle et C sa capacité.
Le système proposé comporte une injection électrique. La caractérisation de la zone ciblée se fait à l'aide de l'impédance complexe Z du circuit, qui comporte une résistance et une réactance. Ces composantes respectivement appelées aussi résistance réelle et résistance imaginaire dépendent de la fréquence du courant alternatif et sont fonction l'une de l'autre.
La fonction fait ressortir ce que l'on appelle une fréquence caractéristique (FC) marquant le sommet d'une parabole. Les résistances, réelle () et imaginaire (), sont calculées par les formules suivantes :
- • résistance réelle : ;
- • résistance imaginaire : .
En effet, l'impédance équivalente du circuit de la Fig. 1 est :
Pour les faibles fréquences (), est négligeable devant ; par conséquent ), où est résistance mesurée de la plante, C la capacité mesurée de la plante et ω la fréquence de mesure.
L'appareil de mesure est un LCZ meter 2345. Il est calibré par l'utilisation de la correction du circuit open/short pour éliminer l'impédance de polarisation de l'interface des électrodes. La capacité et la résistance sont mesurées dans une gamme de fréquences de 40 Hz à 100 kHz (34 fréquences). Les mesures sont saisies automatiquement sur un PC relié à l'appareil de mesure par une interface GBIP (IEEE 488), que nous avons programmé (un logiciel de commande et de traitement est développé pour cette étude) pour balayer la gamme de fréquence lorsqu'on injecte un signal électrique d'amplitude 1 V généré par le LCZ meter. Pour capter le signal électrique émis par la plante, nous avons utilisé des électrodes autocollantes utilisées en électrocardiologie et jetables après leur première utilisation. Nous les avons découpées dans des électrodes de marque Schiller Ag. L'endroit servant à la connexion avec le LCZ meter est laissé intact. L'électrode ainsi obtenue ressemble à une râpe à fromage de 1 cm2 de surface. La manche sert à la connexion par l'intermédiaire de fils livrés avec le LCZ meter. Pour une feuille de graminée, par exemple, l'électrode est placée parallèlement à la nervure centrale. La manche et les fils de connexion vont vers le sommet de la feuille. La surface des premières feuilles de toutes les plantes testées et supérieure à 1 cm2. Ces feuilles ne présentent pas, à l'œil nu, de signes de vieillesse, qui se caractérisent, comme on le sait, par un desséchement.
2.4.2 Mesures
Le jour de l'imbibition des graines est considéré comme le premier jour de la vie de nos plants. Les mesures sont faites sur les plantes entières, âgées de 14 j, ou toutes les semaines à partir de cet âge lorsqu'on veut suivre l'évolution des paramètres électriques en fonction de l'âge. L'organe végétal (cotylédon, feuille ou tige) est placé entre les deux électrodes. Pour la feuille, par exemple, une électrode est placée sur la face supérieure et la deuxième au même endroit, mais sur la face inférieure. La différence de dimension entre les organes opposés chez une même plante est connue [13]. Nous avons opté pour la désignation « Grand, G » ou « Petit, P » pour en faire la différence.
3 Résultats
Nous avons vérifié la reproductibilité des mesures en utilisant des résistances et des capacités connues. Les résultats exposés ci-dessous représentent la moyenne des mesures faites sur trois plantes.
Ces résultats nous permettent de procéder à des comparaisons électrospectrométriques entre les espèces testées, entre les organes d'une même plante, entre les organes opposés d'une même plante et entre les différents âges des différentes espèces.
3.1 Comparaisons électrospectrométriques entre les espèces testées
Les mesures sont réalisées sur la tige et la première feuille chez le tournesol, le potiron et le maïs.
Les résultats des mesures sont présentés sur les Figs. 2–4 sous forme de courbes spectrométriques. Sur ces courbes, chaque point est calculé en fonction de la fréquence de mesure, de la résistance parallèle () et de la capacité parallèle (C) mesurées. Les paramètres électriques mesurés, exprimés sous forme de courbes et caractérisant les tissus, font ressortir la grande différence qui existe entre la feuille et la tige et ce, indépendamment de l'espèce testée. De plus, une nette différence existe aussi entre les courbes spectrométriques de bioimpédance (CSB) des dicotylédones, d'une part (Figs. 2 et 3), et celles de l'espèce monocotylédone, de l'autre (Fig. 4).
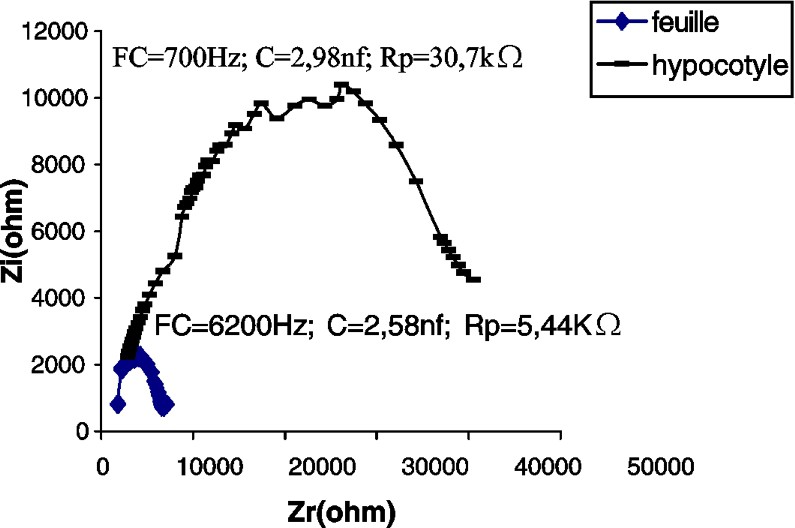
Impédance de l'hypocotyle et de la première feuille d'un plant de potiron âgé de 14 j. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
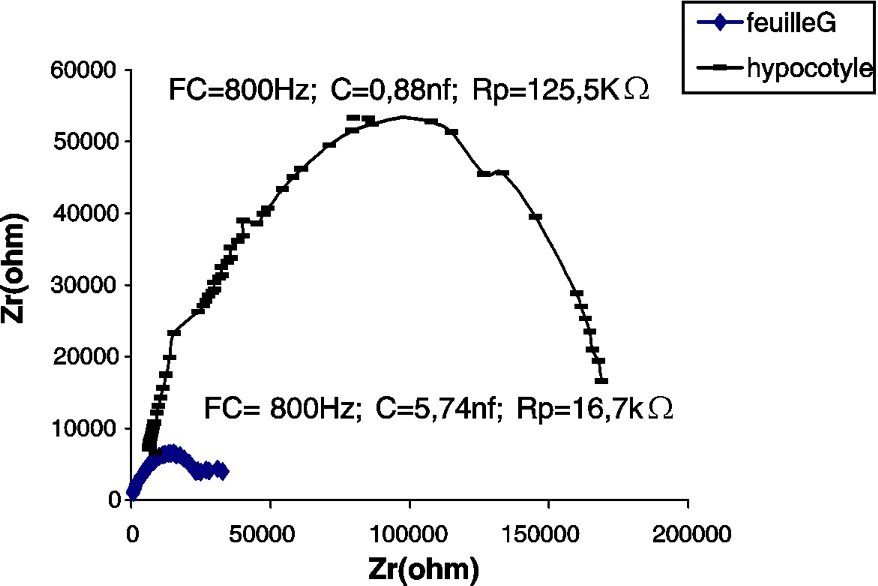
Impédance de l'hypocotyle et de la première feuille (G) d'un plant de tournesol âgé de 14 j. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
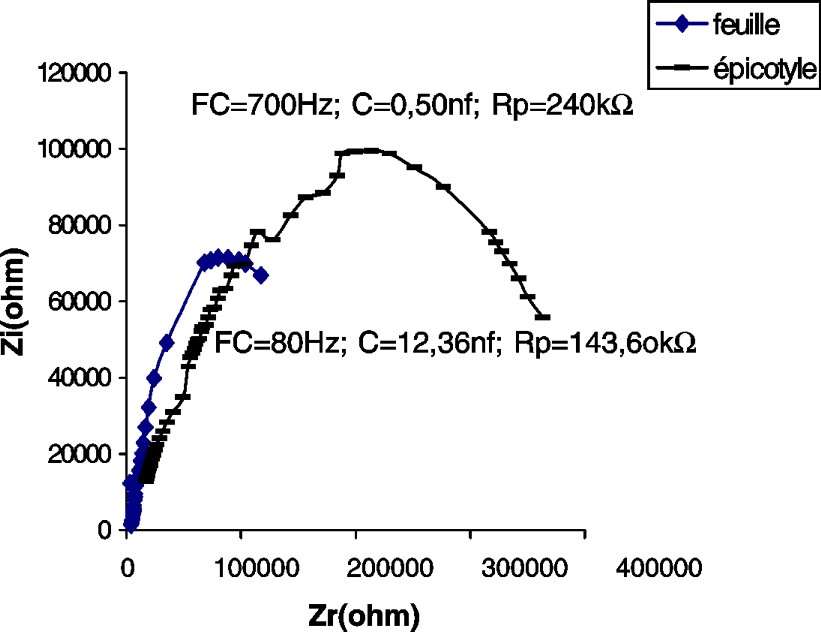
Impédance de l'épicotyle et de la première feuille d'un plant de maïs âgé de 14 j. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
Les CSB de la tige du potiron (Fig. 2) et du maïs (Fig. 4), par comparaison à celle du tournesol (Fig. 3), accusent une certaine irrégularité aux environs de la fréquence caractéristique (sommet de la courbe). Nous pensons que cette irrégularité est due au facteur « âge », étudié plus loin.
En comparant les paramètres des impédances des feuilles des différentes espèces testées, nous constatons que la feuille de maïs accuse la plus grande capacité (ou accumulation de charges électriques) et la plus grande résistance (Figs. 2–4).
Le tournesol et le potiron sont des plantes en C3, chez qui la fixation du gaz carbonique (CO2) aboutit à la formation de l'acide phosphoglycérique. Le maïs est, quant à lui, une plante en C4, chez qui cette première étape de fixation de CO2 aboutit à la formation d'acides dicarboxyliques (oxaloacétique, malique, aspartique). Les données de spectroscopie d'impédance obtenues sur la feuille de maïs nous ont incités à effectuer la même mesure sur une plante se distinguant par une grande teneur en acides, en l'occurrence l'oseille.
Le Tableau 1 montre que la plus grande condensation de charges électriques se trouve dans les feuilles d'oseille, la résistance électrique des feuilles de cette plante étant intermédiaire entre celle du maïs, d'une part, et celles du potiron et du tournesol, d'autre part.
Impédance de la tige (T) et de la première feuille (F) des plants de tournesol, de potiron, de maïs et d'oseille. Tournesol, potiron et maïs sont âgés de 14 j. L'âge de l'oseille n'est pas connu (voir texte). : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle
| FC (Hz) | C (nF) | (kΩ) | (Ω) | (Ω) | (Ω) | (Ω) | ||||
| T | F | T | F | T | F | T | F | T | F | |
| Tournesol | 800 | 800 | 0,88 | 5,74 | 125,50 | 16,70 | 100 000 | 550 000 | 15 000 | 6647 |
| Potiron | 700 | 6200 | 2,98 | 2,58 | 30,70 | 5,44 | 22 000 | 11 000 | 4000 | 2250 |
| Maïs | 700 | 80 | 0,50 | 12,36 | 240,00 | 143,60 | 210 000 | 100 000 | 80 000 | 71 000 |
| Oseille | 100 | 18,00 | 49,40 |
3.2 Comparaisons électrospectrométriques entre les organes aériens d'une même espèce
Les rôles des différents organes d'une plante étant différents, leur anatomie et leur physiologie doivent l'être aussi. Ceci se reflète sur les valeurs de l'impédance de ces organes (Figs. 2–4).
Dans nos expériences, la résistance de la tige est de 7,5–5,6 et est 1,8 fois plus grande que chez les feuilles du tournesol, du potiron et du maïs, respectivement (Tableau 1).
Les capacités de l'hypocotyle et de la feuille, chez le potiron, sont à peu près les mêmes. Cette plante appartient à la famille des Cucurbitacées qui se distinguent par une tige rampante. En revanche, chez le maïs et le tournesol, qui ont un port droit, les capacités sont respectivement 24,6 et 6,5 fois plus grandes dans les feuilles que dans l'hypocotyle et l'épicotyle.
3.3 Comparaisons électrospectrométriques entre les organes opposés d'une même plante
Morphologiquement, au cours des premiers stades de croissance, le tournesol se distingue par deux cotylédons opposés, se transformant en feuilles photosynthétisantes, et une première paire de « vraies » feuilles, également opposées. Le potiron possède, quant à lui, une paire de cotylédons photosynthétisants et une vraie feuille. Les paramètres de l'impédance de ces organes sont reportés sur le Tableau 2.
Capacité et résistance des organes opposés chez le tournesol et le potiron (plants âgés de 14 j). G, grand ; P, petit. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle
| C (nF) | (kΩ) | |||||||
| cotylédon | feuille | cotylédon | feuille | |||||
| G | P | G | P | G | P | G | P | |
| Tournesol | 4,53 | 1,87 | 5,74 | 5,20 | 6,76 | 23,70 | 16,70 | 19,00 |
| Potiron | 7,37 | 8,42 | 2,58 | 2,58 | 6,28 | 3,50 | 5,44 | 5,44 |
Chez le tournesol, les paramètres de l'impédance des feuilles opposées se rapprochent, alors que ceux des cotylédons sont très éloignés. Ainsi, le rapport de capacité du grand cotylédon au plus petit est de 2,42. Pour les feuilles, ce rapport est de 1,10. Pour la résistance (les rapports du plus petit au plus grand), ces rapports sont de l'ordre de 3,50 et de 1,14, respectivement pour les cotylédons et la feuille.
Les données du Tableau 2 nous renseignent aussi sur le sens de l'évolution des grandeurs que peuvent avoir les paramètres de l'impédance des organes opposés : aux plus petites valeurs de capacité d'un organe donné correspondent les plus grandes valeurs de résistance.
La capacité des cotylédons du potiron est plus élevée que celle du tournesol, mais, dans ce cas, c'est le plus petit cotylédon qui montre la plus grande capacité.
La capacité et la résistance de la première feuille du potiron âgé de 14 j sont en deçà de celles du tournesol du même âge.
Ainsi, comparées horizontalement ou verticalement, les données du Tableau 2 montrent une différence aussi bien entre les organes opposés d'une même plante qu'entre les organes correspondants des deux plantes comparées. Ceci laisse penser que les paramètres de l'impédance sont liés à la spécificité du matériel testé. Or, la spécificité biologique est imposée par le programme génétique qui se déroule dans le temps, entraînant des changements de structure et de métabolisme qui peuvent influencer à leur tour les valeurs de l'impédance.
3.4 Comparaisons électrospectrométriques en fonction de l'âge
Le jour de semailles, les graines sont mises à germer en nombre suffisant. Pour préparer les plantes aux analyses, le semis est conduit tel qu'il est décrit aux § 2.2 et 2.3. Au 14e jour, on prend trois pots de culture désignés par les lettres A, B, C et on procède aux mesures sur trois plantes. La moyenne de ces trois mesures (en fait, trois courbes spectrométriques) constitue celle retenue pour l'âge de 14 j. On recommence l'opération au 21e jour, mais sur des nouvelles plantes des mêmes pots A, B et C. Cette opération est refaite chaque semaine (mesure de cinq semaines pour le potiron et le tournesol).
La feuille est un organe commun et constitue le lieu de phénomènes physiologiques intensifs, tels que la photosynthèse, la transpiration, etc.
Les Figs. 5–7 montrent les impédances des trois plantes pendant la première période de croissance (14–42 jours). L'élément le plus remarquable est le renversement de la courbe de spectrométrie de la feuille du plant de tournesol âgé de 28 j. Les perturbations de cette courbe, aux environs de la fréquence caractéristique, commencent déjà à l'âge de 21 j, avec une forte chute de la résistance : de 16,70 à 2,38 kΩ (Tableau 3). Chez la deuxième dicotylédone, le potiron, les perturbations de la courbe commencent aussi à l'âge de 21 j, mais cette fois avec une forte augmentation de la résistance. Chez le maïs, on observe aussi une importante chute de l'impédance au 21e jour, mais la courbe demeure typique et continue à l'être, même au 28e jour. Nous remarquons aussi qu'à la plus forte fréquence caractéristique correspond la plus petite résistance ; c'est à ce moment-là que commencent les perturbations de la courbe. Les plus petites valeurs de capacité sont observées chez le potiron, les plus grandes chez le maïs.
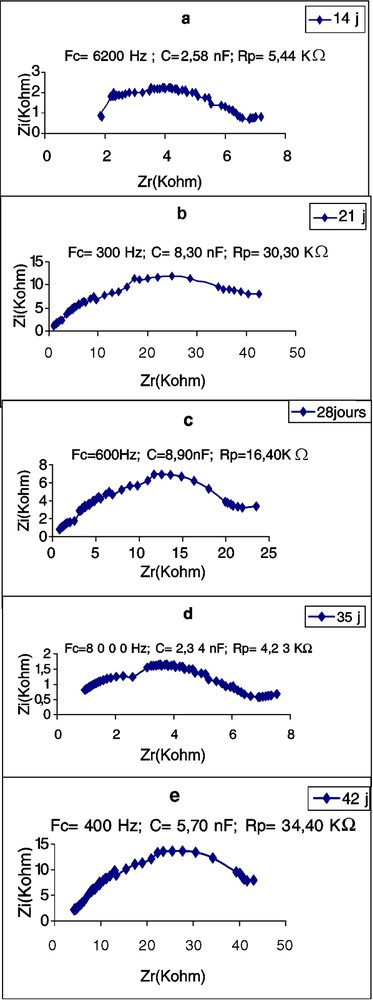
Évolution de l'impédance de la première feuille de Potiron en fonction de l'âge. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
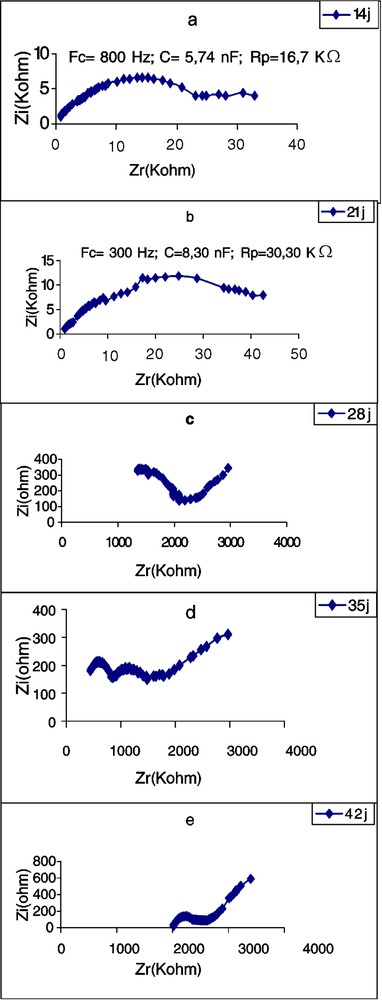
Évolution de l'impédance de la première feuille d'un plant de tournesol en fonction de l'âge. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
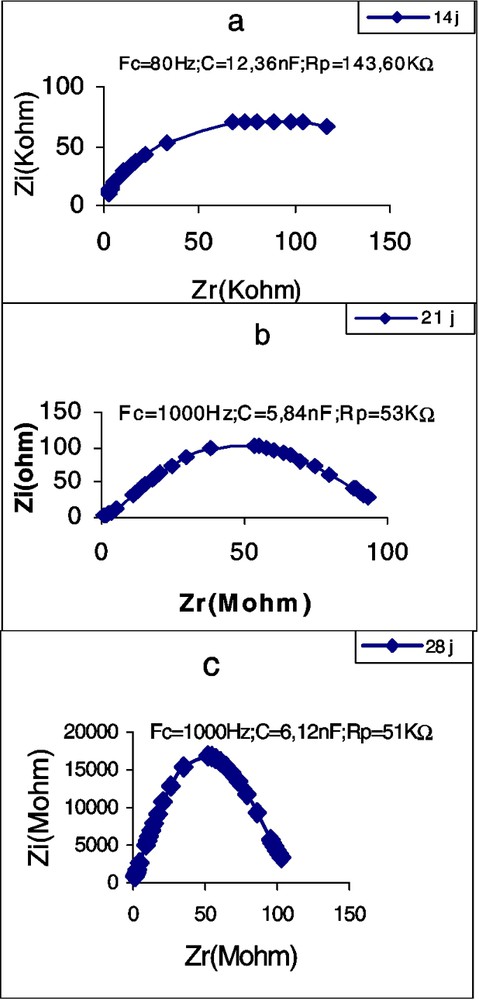
Évolution de l'impédance de la première feuille de maïs en fonction de l'âge. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle.
Évolution, en fonction de l'âge, des paramètres de l'impédance de la première feuille de plants de potiron, de tournesol et de maïs. : partie imaginaire ; : partie réelle ; FC : fréquence caractéristique ; : résistance parallèle ; C : capacité parallèle
| Age (j) | Tournesol | Potiron | Maïs | ||||||
| FC (Hz) | C (nF) | (kΩ) | FC (Hz) | C (nF) | (kΩ) | FC (Hz) | C (nF) | (kΩ) | |
| 14 | 800 | 5,74 | 16,70 | 6200 | 2,58 | 5,44 | 80 | 12,36 | 143,60 |
| 21 | 4500 | 5,90 | 2,38 | 300 | 8,30 | 30,30 | 1000 | 5,84 | 53,00 |
| 28 | 600 | 8,90 | 16,40 | 1000 | 6,12 | 51,00 | |||
| 35 | 8000 | 2,34 | 4,23 | ||||||
| 42 | 400 | 5,70 | 34,40 |
4 Discussion
Tout échantillon soumis au test n'est pas homogène. Outre la spécificité structurelle et métabolique des espèces testées, le tissu sur lequel sont appliquées les électrodes est constitué de cellules de différentes spécialités, ce qui explique la grande différence entre les courbes de spectrométrie de bioimpédance (CSB) de la tige et de la feuille et ce, indépendamment de l'espèce considérée. Nos mesures ont montré une différence entre les CSB des plantes dicotylédones et celle de la monocotylédone. Ces résultats montrent qu'il existe une relation évidente entre les paramètres électriques mesurés et la spécificité – dans le sens structure et métabolisme – de l'espèce testée, comme l'avait déjà mentionné Blinks [14]. En effet, les plantes en C4 se distinguent par une forte synthèse d'acides dicarboxyliques, qui présentent deux constantes de dissociation. En plus de cette distinction métabolique, les plantes en C4 sont pourvues d'un nombre de plasmodesmes beaucoup plus important que les plantes en C3 [15]. Ces structures, outre la communication entre cellules voisines, servent aussi au transport des acides entre les tissus photosynthétisant chez les plantes en C4, ce qui pourrait aussi influencer les paramètres de l'impédance, ici plus importants que chez les plantes en C3.
Nous avons observé une augmentation dans la résistance électrique de la tige par rapport à celle des feuilles. Cette augmentation peut être due au fait que l'hypocotyle et l'épicotyle servant comme organes de support et de conduction des différentes sèves doivent avoir un métabolisme moins intense que celui des autres organes testés, où l'hydrolyse de substances de réserves, la respiration et la photosynthèse sont plus importantes. De plus, la tige tend à une lignification, tout ceci concourant à l'augmentation de sa résistance électrique.
Nos mesures nous ont permis de constater des différences entre les capacités et les résistances électriques des organes opposés (feuilles ou cotylédons), qui se ressemblent sur le plan morphologique. Ceci implique qu'on doit considérer avec prudence les données avancées concernant un organe dont on sait qu'il a son opposé sur la même plante, ou que, lorsqu'on veut analyser une feuille trifoliolée, l'analyse de chaque foliole devient nécessaire. L'inhibition d'un organe par son opposé et le caractère hormonal que peut avoir cette inhibition ont été relatés [13]. Cette inhibition, comme dans le domaine des phénomènes de corrélation, peut être aussi de caractère trophique, structurel et spécifique. Son étude approfondie et systématique consistant en ablations et analyses biochimiques est rendue nécessaire eu égard à nos données.
Les CSB de la feuille sont influencées par l'âge. Ceci peut être dû au fait que – dans le temps – les feuilles subissent des changements quantitatifs et qualitatifs modulés par des facteurs exogènes et endogènes. En effet, les stades de développement entraînent des changements dans le métabolisme et la structure et doivent, par conséquent, influencer les valeurs de l'impédance. La fréquence caractéristique, telle que nous l'avons vue dans ce travail, est spécifique pour chaque période et pour chaque espèce testée. L'idéal serait de déterminer l'âge pour lequel la fréquence caractéristique (avec capacité et résistance) servirait d'indice pour décrire un état physiologique donné.
5 Conclusion
Notre méthode de mesure de l'impédance d'espèces végétales largement cultivées s'est montrée prometteuse. Elle confirme la différence qui doit exister entre les organes d'une même plante comme celle qui existe entre les espèces. La méthode pourra, par conséquent, être considérée comme fiable dès lors que la méthode de captage du signal électrique aura été améliorée. En effet, la façon de poser les électrodes autocollantes pourrait être plus ou moins traumatisante et dépend du manipulateur. L'intervention de ce dernier sur la plante pour prendre des mesures in vivo doit être réduite au minimum, eu égard à la labilité des organites cellulaires.
Le diagnostic effectué sur un semis pour s'informer sur son état physiologique – ou pathologique – doit être rapide, peu onéreux et fiable.
Nous attirons l'attention plus particulièrement sur la rapidité avec laquelle l'analyse doit être menée, car la physiologie change au cours de la journée. Notre première étude, avec la méthode utilisée, met en quelque sorte en lumière le danger que peut présenter un travail précipité. La différence d'impédance entre deux organes opposés et apparemment identiques suggère la nécessité de l'approfondissement et de la systématisation des recherches dans ce domaine de diagnostic foliaire, afin de mieux comprendre certains problèmes théoriques et d'essayer de trouver des solutions aux problèmes pratiques.
Acknowledgments
Ce travail a été financé par le Programme d'appui à la recherche scientifique (PARS Agro 106) du ministère de l'Enseignement supérieur du Maroc. Nous remercions Mme B. Chlyah, qui a bien voulu relire le présent manuscrit.


