Abridged English version
1 Introduction
Lithium therapy in humans was shown to be very successful to cure psychiatric diseases and especially bipolar disorders. Such a treatment often provokes undesirable side effects. Moreover, long-term treatment may result in insipid diabetes, thyroid hyperplasia, brain damages and premature births. The frequency of adverse effects of lithium therapy results from the proximity of efficient plasma concentrations (0.4–0.8 mM) with the toxic ones. Moreover, frequency is increased in case of renal failure, dehydration, and changes in the hydro-mineral balance or interactions with other drugs.
The present work aimed at analysing the effect of a subchronic exposure to low doses of lithium in male and female Wistar rats. For that purpose, they were given lithium carbonate, mixed with the food at concentrations of either 2000 or 4000 mg/kg food, for different periods up to one month. The effects on growth and on kidney, thyroid and gonads functions were analysed.
2 Materials and methods
Two hundred and eighty-eight (males and females) Wistar rats were divided in three groups: (C) were controls, (Li1) were animals given food containing 2000 mg Li2CO3/kg, (Li2) were animals that were given food containing 4000 mg Li2CO3/kg. The weight of each animal and its food consumption per cage were measured daily. Serum samples and testes were frozen at −20 °C until use.
Serum lithium concentration was measured by flame spectrometry. Hormone concentrations were measured by competitive RIA assays. Kidney function was evaluated by measuring serum creatinine concentration (kit Merk®).
3 Results
3.1 Body growth, food consumption and serum lithium concentration
A growth arrest and a dose-dependent decrease in body weight in both male and female animals were observed. In Li2 group, the treatment was stopped at day 14 because of a high mortality rate.
Throughout the first two weeks of experiment, food consumption was found to decrease in a dose- and time-dependent manner as compared to controls. As calculated from the ingested food quantity, during the first week, the respective amounts of ingested lithium carbonate in the Li1 group were 170 mg/male rat, then 116, 120 and 136 mg/male rat during the following weeks, resulting in a time-dependent increase of serum lithium concentration. Similar changes were found in female rats.
In the Li1 group, serum lithium concentrations during the first two weeks (0.44 to 0.62 mmol l−1) were similar to that used for the treatment of bipolar disorder in human. However, during the third and the fourth weeks, the concentrations exceeded the toxicity threshold (1.02 to 1.34 mmol l−1).
In the Li2 group, amount of ingested lithium carbonate resulted in high concentrations of serum lithium in male and female rats (1.45 and 1.29 mmol l−1 at day 14, respectively).
3.2 Serum creatinine concentration
A significant increase of serum creatinine concentration was found in Li1 group at day 7 for serum lithium concentrations ranging from 0.66 to 0.75 mmol l−1 and at day 14 for serum lithium concentrations ranging from 0.62 to 0.66 mmol l−1. However, while lithium concentration reached 1.4 mmol l−1 at day 28, creatinine concentration did not increase further.
3.3 Serum thyroid hormones
Serum levels of FT4 and FT3 were found to be decreased in a dose-dependent manner in both male and female lithium-treated rats. The FT4/FT3 ratio was almost similar in male and female control animals. Moreover, this ratio was significantly increased in animals of the Li2 group at day 7 and 14, for serum lithium concentrations ranging from 0.66 to 1.45 mmol l−1.
In the Li1 group, this ratio was only increased in males at day 21 and 28 (serum lithium concentrations
3.4 Circulating sex hormones
As compared to controls, testosterone level was decreased by more than 50% at day 7 and 14 in Li2 male rats (serum lithium concentrations
3.5 Testis histology
As compared to controls, strong abnormalities appeared in Li1-treated animals, at day 28. Histological features of spermatogenesis were profoundly disturbed. Spermatozoa were less numerous and most of them were deprived of flagella.
3.6 Estrous cycle
Most of the control animals were found to be in estrus or post-estrus phases while Li1-treated animals were mostly in post-estrus at days 7 and 14 and in diestrus at days 21 and 28. Similarly, at day 14, Li2-treated animals were mostly in post-estrus or diestrus.
4 Discussion
Lithium carbonate given as a food additive induced, under our experimental conditions, an arrest of body growth and a dose-dependent decrease of food consumption, but conversely, a time-dependent increase of serum lithium concentrations. In such animals, diarrhoea, polyuria, and polydipsia were observed. These disorders are also frequently observed in human patients submitted to lithium therapy for more than one year. A significant increase in serum creatinine was found for a serum lithium concentration corresponding to a therapeutic concentration in human. This renal failure in very probably the reason of the time-dependent increase in lithium serum concentration that we observed in treated rats.
As described in humans, lithium also induced a significant decrease of FT3 and FT4 levels in rats. The mechanism underlying the lithium effects are still under investigations but it was shown that 2 mM lithium reduced iodide uptake, iodine organification and de novo hormone synthesis. Moreover, it was found that Li+ can substitute to Na+ in the Na+/I− cotransporter, which can decrease the affinity of the transporter for iodide and/or decrease the iodide kinetic uptake in thyroid cells.
The increase in the FT4/FT3 ratio that we found, mainly due to a decrease of FT3, could be due, either to a lithium-related inhibition of the
While serum testosterone levels were significantly reduced in Li-treated rats, resulting in an arrest of spermatogenesis after one-month exposure, we observed in females an increase in blood estradiol levels, not previously reported. This increase is probably related to the perturbation of the estrus cycle, since the treated females were predominantly in the diestrus stage. In spite of a relatively high estradiol concentration, treated rats completely stopped cycle, confirming previous results reported in mice. Recently, it was reported that lithium induced a decrease in the number of uterine estrogen receptors. A high number of these receptors is also present in cell nuclei of hypothalamus-preoptic area and in gonadotrophic cells of the anterior lobe of the pituitary gland. This suggests that a decrease of the number of estrogen receptors induced by lithium in hypothalamus-pituitary gland axis could explain the perturbations of the estrus cycle we observed.
To conclude, our results show that serum lithium concentrations about 0.6 mmol l−1 can induce in rat, after two weeks, a renal failure, secondarily leading to an increase in the serum lithium concentration. Moreover, a hypothyroidic syndrome was observed for serum lithium concentrations above 0.75 mmol l−1. Lastly, increased serum estradiol concentration related to perturbations of the estrus cycle was shown when serum lithium concentrations reached 1 mmol l−1. Taken together, these results show that lithium can rapidly induce toxic effects in the rat at concentrations used for the treatment of bipolar disorders in human.
1 Introduction
Le lithium (Li) est un métal alcalin présent dans l'écorce terrestre (
Ses usages industriels sont multiples. Il est utilisé, en particulier, dans la fabrication des céramiques, des alliages (afin d'augmenter leur dureté), de la vitrocéramique, des écrans de télévision, des films couleurs pour augmenter leur sensibilité, des piles et batteries. Il est également utilisé pour la désinfection des piscines [1].
En médecine, il a été prescrit de très longue date dans le traitement de nombreuses affections : diabète, maladies infectieuses, syndromes prémenstruels, alcoolisme, toxicomanie, troubles des conduites alimentaires, anxiété, troubles obsessionnels et phobiques, dépressions récurrentes. Depuis plus de 50 ans et encore actuellement, il représente le traitement de choix des troubles bipolaires. Il a également un effet favorable dans le traitement des dépressions résistant aux antidépresseurs, de l'agressivité chronique, des surexcitabilités et des schizophrénies dysthymiques [4,5].
Lors de traitements prolongés, de nombreux effets secondaires ont été rapportés, tels qu'anorexie, nausée, tremblement des mains, diarrhée, faiblesse musculaire, confusion mentale, délire, hallucinations, convulsions, voire même coma [6–9]. Diverses observations ont montré qu'il peut induire un diabète insipide néphrogénique [10,11], une insuffisance rénale [12,13] des goitres [14,15], des désordres neurologiques [1,9], et augmenter les risques de naissance prématurée [16].
Ceci est dû au fait que les concentrations sériques de Li préconisées en thérapeutique (0,4– 0,8 mmol l−1) sont très proches des concentrations toxiques (
Compte tenu de l'efficacité indiscutable du lithium dans le traitement des troubles bipolaires et la prévention de rechutes [18–20], il est important de bien évaluer les concentrations induisant des effets cytotoxiques secondaires.
L'objectif de ce travail est d'analyser, chez des rats blancs de souche Wistar mâles et femelles en croissance, les effets d'une exposition subchronique de un mois au carbonate de lithium (Li2CO3) mélangé à l'alimentation aux concentrations de 2000 ou 4000 mg kg−1 de nourriture.
La croissance corporelle, les consommations journalières de nourriture et de lithium ainsi que la lithémie ont été mesurées. La fonction rénale, les fonctions endocrines de la thyroïde, des testicules et des ovaires ont été analysées par le dosage des taux sériques de créatinine, des hormones thyroïdiennes libres (FT3 et FT4) et des hormones sexuelles (testostérone et œstradiol). L'étude histologique des testicules et cytologique des frottis vaginaux a été réalisée afin d'évaluer les conséquences des variations hormonales observées.
2 Matériels et méthodes
2.1 Animaux
Deux cent quatre-vingt-huit rats mâles et femelles de souche Wistar, sexuellement matures, d'un poids corporel voisin de 100 g, ont été groupés par 12 dans des cages placées dans une animalerie ventilée maintenue entre 22° et 25 °C, de taux hygrométrique stable, munie d'un système réglant les périodes d'obscurité (10 h) et de lumière (14 h). Les animaux ont eu accès ad libitum à la nourriture (granulés à 14% de protéines, Sico, Sfax, Tunisie) et à l'eau.
2.2 Protocole expérimental
Les animaux ont été repartis pour chaque sexe en trois groupes : rats témoins (C) recevant une alimentation normale, rats traités recevant une alimentation additionnée de Li2CO3 à la concentration de 2000 mg kg−1 (Li1) ou 4000 mg kg−1 (Li2). Le traitement a été poursuivi pendant quatre semaines pour les groupes (C) et (Li1) et seulement deux semaines pour le groupe (Li2), du fait d'une importante mortalité due au traitement.
Si on tient compte des poids corporels des rats et de la quantité de nourritures qu'ils ingèrent chaque jour, on peut estimer que les quantités de carbonates de lithium ingérées par jour et par kg PC sont respectivement, chez les groupes Li1 et Li2, de 212 mg (5,738 mmol Li) et de 323 mg (8,742 mmol Li) chez les mâles, et de l'ordre de 190 mg (5,142 mmol Li) et 289 mg (7,822 mmol Li) chez les femelles.
Les animaux ont été pesés chaque matin, afin d'en déduire la courbe de croissance. La quantité de nourriture absorbée chaque jour a été mesurée afin d'estimer les quantités de Li2CO3 ingérées.
2.3 Prélèvement des échantillons
Le sacrifice des animaux a toujours eu lieu le matin par décapitation rapide pour limiter l'effet du stress. Le sang artério-veineux a été recueilli sans anticoagulant, puis centrifugé et le sérum collecté, stocké à −20 °C pour le dosage ultérieur des concentrations hormonales. Les testicules, prostate ont été prélevés, débarrassés de leur tissus adipeux et pesés. Les organes destinés à l'étude histologique, ont été placés dans un fixateur alcoolique (liquide de Bouin).
2.4 Dosage de la concentration sérique de lithium
La lithémie a été mesurée par spectrométrie d'émission de flamme (PerkinElmer AAnalyst 400).
2.5 Étude de la fonction rénale
Elle a été évaluée par le dosage de la créatininémie (kit Merck).
2.6 Dosages hormonaux
Les concentrations sériques des hormones thyroïdiennes libres – thyroxine (FT4) et triiodothyronine (FT3) – et des hormones sexuelles – testostérone et oestradiol sériques – ont été évaluées par des dosages radio-immunologique (RIA) par compétition (Immunoassay kits, Immunotech®, Marseille, France).
2.7 Étude histologique des testicules
L'étude histologique a été réalisée, selon les techniques classiques, après fixation dans le liquide fixateur de Bouin (48 h), inclusion en paraffine et coloration à l'hématoxyline–éosine.
2.8 Statistiques
Les résultats sont présentés sous forme de moyenne ± écart type. Les comparaisons intergroupes des témoins et des traités sont réalisées par le test « t » de Student. La corrélation entre la créatininémie et la lithémie est évaluée statistiquement par le test «
3 Résultats
3.1 Effet du traitement sur la croissance corporelle, la consommation de nourriture et la lithémie
La Fig. 1 montre que les deux concentrations de Li2CO3 utilisées (2000 mg et 4000 mg par kilogramme d'aliments, soit 212 mg (5,738 mmol Li) et 323 mg (8,742 mmol Li)/kg PC/j chez les mâles, et 190 mg (5,142 mmol Li) et 289 mg (7,822 mmol Li)/kg PC/j chez les femelles) entraînent, chez les rats mâles et femelles, non seulement un arrêt de la croissance corporelle, mais aussi une perte de poids dose-dépendante. Le traitement par la dose Li2 a été arrêté au 14e jour de traitement, car il a entraîné un taux de mortalité important.
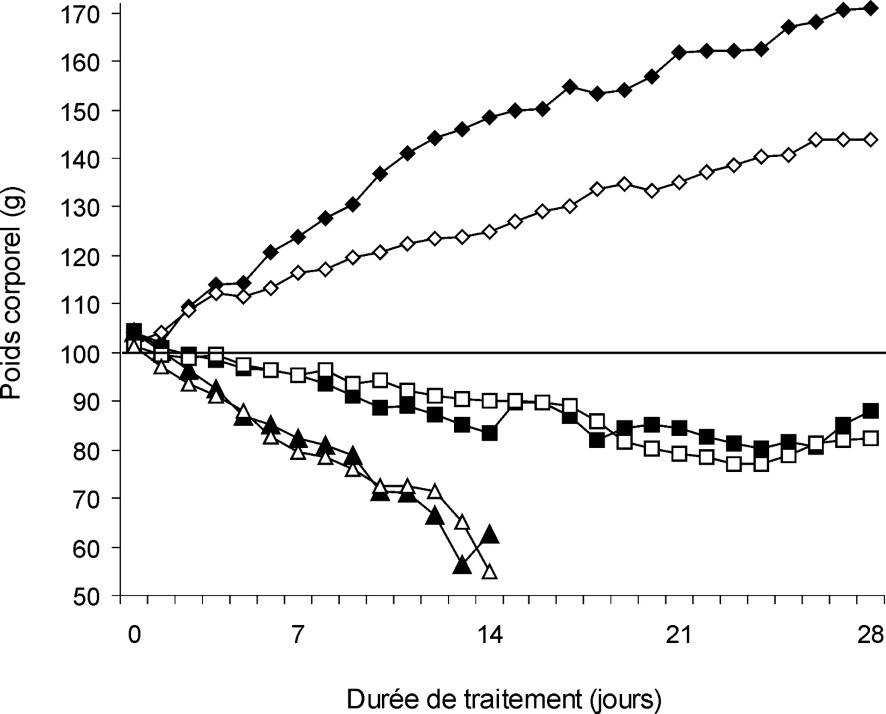
Évolution du poids corporel des rats mâles (marques pleines) et femelles (marques vides) témoins (losanges) ou consommant une nourriture supplémentée avec 2000 mg (carrés) ou 4000 mg (triangles) de carbonate de lithium par kilogramme d'aliments.
Le Tableau 1 montre que la consommation de nourriture augmente chez les témoins, alors qu'elle diminue en fonction de la dose de Li2CO3 chez les rats traités, mais également en fonction du temps pendant les deux premières semaines. Compte tenu de la quantité de nourriture consommée, les rats mâles traités par Li1 ont absorbé 170 mg de Li2CO3 au cours de la première semaine, puis 116, 120 et 126 mg au cours des semaines suivantes, ce qui a généré une augmentation temps-dépendante de la concentration en lithium dans le sang (Tableau 2). Le même type d'évolution a été observé chez les rats femelles. Comme le montre le Tableau 2, les valeurs de lithémie chez les rats mâles et femelles pendant les deux premières semaines (0,44–0,62 mmol l−1) correspondent à des concentrations utilisées en thérapeutique chez l'homme, mais atteignent des valeurs considérées comme toxiques au cours des troisième et quatrième semaines de traitement (1,02–1,34 mmol l−1).
Évolution hebdomadaire du poids corporel des rats témoins (C) ou traités à raison de 2000 mg (Li1) et 4000 mg (Li2) de carbonate de lithium par kilogramme d'aliments. Analyse, en fonction de la quantité de nourriture consommée, de la quantité moyenne de carbonate de lithium réellement ingérée par rat
| Mâles | Femelles | ||||||
| C | Li1 | Li2 | C | Li1 | Li2 | ||
| 1–7 j | Poids final – Poids initial (g) | 19,59 | −8,90 | −21,75 | 14,33 | −6,25 | −21,84 |
| Nourriture consommée (g) | 96,99 | 85,00 | 49,18 | 96,95 | 75,00 | 42,97 | |
| Li2CO3 ingéré (mg)/rat | 0 | 170,00 | 196,72 | 0 | 150,00 | 171,88 | |
| 7–14 j | Poids final – Poids initial (g) | 24,75 | −12,23 | −19,91 | 8,67 | −5,25 | −24,66 |
| Nourriture consommée (g) | 105,4 | 58,00 | 42,21 | 101,65 | 57,00 | 37,59 | |
| Li2CO3 ingéré (mg)/rat | 0 | 116,00 | 168,84 | 0 | 114,00 | 150,36 | |
| 14–21 j | Poids final – Poids initial (g) | 13,27 | 1,01 | 10,00 | −10,75 | ||
| Nourriture consommée (g) | 125,1 | 60,00 | 119,95 | 49,00 | |||
| Li2CO3 ingéré (mg)/rat | 0 | 120,00 | 0 | 98,00 | |||
| 21–28 j | Poids final – Poids initial (g) | 9,34 | 3,72 | 9,00 | 3,08 | ||
| Nourriture consommée (g) | 159,47 | 63,00 | 125,00 | 56,00 | |||
| Li2CO3 ingéré (mg)/rat | 0 | 126,00 | 0 | 112,00 |
Évolution hebdomadaire de la lithémie (moyenne ± ET) chez des rats témoins ou traités à raison de 2000 mg (Li1) et 4000 mg (Li2) de carbonate de lithium par kilogramme d'aliments
| 7 j | 14 j | 21 j | 28 j | |
| Témoins | 0,03 ± 0,01 | 0,05 ± 0,01 | 0,05 ± 0,01 | 0,04 ± 0,01 |
| Li1 (males) | 0,51 ± 0,08 | 0,66 ± 0,08 | 1,27 ± 0,22 | 1,34 ± 0,18 |
| Li1 (femelles) | 0,44 ± 0,07 | 0,62 ± 0,06 | 1,02 ± 0,16 | 1,24 ± 0,22 |
| Li2 (males) | 0,75 ± 0,09 | 1,45 ± 0,15 | ||
| Li2 (femelles) | 0,66 ± 0,10 | 1,29 ± 0,25 |
Chez les rats Li2, les quantités de Li2CO3 absorbées ont généré respectivement chez les mâles et les femelles une lithémie de 1,45 et 1,29 mmol l−1 au 14e jour de traitement.
3.2 Effets du lithium sur le taux de créatinine dans le sang
La Fig. 2a montre que le traitement Li2 induit une augmentation significative de la créatininémie au septième jour de traitement chez les rats mâles et femelles ayant des lithémies de 0,66–0,75 mmol l−1. Une augmentation de la créatininémie apparaît également chez les rats Li1 présentant des lithémies de 0,62–0,66 mmol l−1 au 14e jour de traitement. Cependant, l'augmentation de la créatininémie ne s'amplifie pas en fonction du temps de traitement, et ceci bien que la lithémie atteigne des concentrations de 1,4 mmol l−1 en fin de traitement. Ainsi, les courbes de corrélation entre la créatininémie et la lithémie pour la dose (Li1), prouvent bien que la créatininémie n'est pas corrélée à la lithémie (

(a) Évolution de la créatininémie chez des rats mâles et femelles témoins (T) ou traités par le carbonate de lithium à raison de 2000 mg (Li1) ou 4000 mg (Li2) par kilogramme d'aliments. Les valeurs correspondent à la moyenne de cinq déterminations ± écart type. * p<0,05, ** p<0,01. (b) Courbes de corrélation entre la créatininémie et la lithémie chez les rats (Li1), mâles et femelles, après 7, 14, 21 et 28 j de traitement.
3.3 Effets du lithium sur le taux des hormones thyroïdiennes libres : thyroxine (FT4) et triiodothyronine (FT3)
La détermination des taux sériques de FT4 chez les rats mâles et femelles montre que le lithium induit, par rapport aux témoins, une baisse dose-dépendante qui se maintient au cours du traitement. Les taux sériques de FT3 sont également diminués de manière dose-dépendante par le Li2CO3 chez les rats mâles et femelles (Tableau 3).
Variations relatives des taux sériques de thyroxine (FT4) et triiodothyronine (FT3) libres chez les rats traités par le carbonate de lithium à raison de 2000 mg (Li1) ou 4000 mg (Li2) par kg de nourriture, par rapport aux taux des témoins (C) dont les valeurs ont été ramenées à 100
| Mâles | Femelles | ||||||
| C | Li1 | Li2 | C | Li1 | Li2 | ||
| 7 j | T4 | 100 ± 7 | 74 ± 17 | 62 ± 6 | 100 ± 14 | 92 ± 19 | 68 ± 3 |
| T3 | 100 ± 9 | 62 ± 2 | 39 ± 3⁎⁎ | 100 ± 12 | 91 ± 23 | 61 ± 11 | |
| 14 j | T4 | 100 ± 9 | 73 ± 13 | 59 ± 5 | 100 ± 12 | 56 ± 27 | 56 ± 7 |
| T3 | 100 ± 1 | 70 ± 6 | 51 ± 11 | 100 ± 27 | 62 ± 12 | 27 ± 5⁎⁎ | |
| 21 j | T4 | 100 ± 6 | 81 ± 9 | 100 ± 9 | 70 ± 7 | ||
| T3 | 100 ± 6 | 65 ± 1⁎ | 100 ± 12 | 62 ± 9 | |||
| 28 j | T4 | 100 ± 8 | 70 ± 24 | 100 ± 6 | 84 ± 8 | ||
| T3 | 100 ± 7 | 39 ± 3⁎⁎ | 100 ± 20 | 99 ± 21 |
⁎
⁎⁎
De plus, le Tableau 4 montre que le rapport des taux sériques FT4/FT3 est du même ordre de grandeur chez les mâles (3,61) et les femelles (3,36) témoins. La dose Li2 induit une augmentation significative de ce rapport aux 7e et 14e jours, pour des lithémies variant de 0,66 à 1,45 mmol l−1. La dose Li1 induit également une augmentation de ce rapport, mais uniquement chez les rats mâles et après un certain délai, c'est-à-dire après le 21e jour de traitement (lithémie
Rapports des taux sériques de FT4/FT3 chez des rats mâles et femelles (C) ou nourris avec des granulés additionnés de carbonate de lithium à la concentration de 2000 mg/kg (Li1) ou 4000 mg/kg (Li2)
| Mâles | Femelles | |||||
| C | Li1 | Li2 | C | Li1 | Li2 | |
| 7 j | 3,15 ± 0,21 | 3,75 ± 0,76 | 4,97 ± 0,47⁎⁎ | 3,65 ± 0,46 | 3,76 ± 0,42 | 4,14 ± 1,00⁎ |
| 14 j | 3,90 ± 0,40 | 4,06 ± 0,22 | 4,56 ± 0,24⁎⁎ | 3,43 ± 0,83 | 3,00 ± 1,10 | 6,90 ± 1,43⁎⁎ |
| 21 j | 4,31 ± 0,50 | 5,52 ± 0,51⁎⁎ | 3,26 ± 0,51 | 3,68 ± 0,49 | ||
| 28 j | 3,08 ± 0,39 | 5,25 ± 1,37⁎⁎ | 3,12 ± 0,49 | 2,67 ± 0,27 | ||
| Moyenne des témoins | 3,61 ± 0,60 | 3,36 ± 0,23 |
⁎
⁎⁎
3.4 Effets du lithium sur le taux sérique des hormones sexuelles : testostérone et oestradiol
Chez les rats mâles, le dosage de la testostérone sérique (Tableau 5) montre que la dose Li2 induit une inhibition significative de cette hormone dès le 7e jour de traitement (lithémie : 0,75 mmol l−1). En revanche, l'inhibition induite par la plus faible dose (Li1) n'apparaît significative qu'après un certain délai, c'est à dire après le 21e jour de traitement (lithémie
Évolution du taux de testostérone sérique (ng ml−1) chez des rats mâles témoins (C) ou traités pendant 28 j au carbonate de lithium à raison de 2000 mg (Li1) ou 4000 mg (Li2) par kilogramme de nourriture
| 7 j | 14 j | 21 j | 28 j | |
| C | 1,23 ± 0,33 | 1,40 ± 0,37 | 5,07 ± 0,68 | 1,96 ± 0,32 |
| Li1 | 0,89 ± 0,36 | 1,14 ± 0,40 | 1,52 ± 0,54⁎⁎ | 0,84 ± 0,32⁎ |
| Li2 | 0,55 ± 0,10⁎ | 0,53 ± 0,09⁎ |
⁎
⁎⁎
Chez les rats femelles (Tableau 6), les taux sériques d'œstradiol ont respectivement augmenté d'un facteur 1,5 au 21e et 1,9 au 28e jour chez les rats traités avec Li1. Une augmentation d'un facteur 2 a été observée au 14e jour de traitement avec Li2. Cette augmentation de l'oestradiol apparaît donc pour des lithémies supérieures à 1 mM.
Évolution du taux d'oestradiol sérique (pg ml−1) chez des rates témoins (C) et traitées par le carbonate de lithium à raison de 2000 mg (Li1) ou 4000 mg (Li2) par kilogramme de nourriture
| 14 j | 21 j | 28 j | |
| C | 19,53 ± 0,49 | 27,69 ± 1,02 | 18,82 ± 1,23 |
| Li1 | 25,85 ± 2,35 | 42,63 ± 6,61⁎ | 35,92 ± 4,74⁎⁎ |
| Li2 | 38,51 ± 1,65⁎⁎ |
⁎
⁎⁎
3.5 Étude histologique des testicules
Comme le montrent les coupes histologiques, les testicules témoins (Fig. 3A) sont constitués de tubes séminifères serrés, avec des espaces interstitiels étroits. Au niveau de l'épithélium des tubes séminifères, on observe les différents stades de la spermatogenèse, qui s'y déroulent de façon centripète, avec de nombreuses spermatogonies en périphérie à proximité de la membrane basale, des spermatocytes I et II, des spermatides et des spermatozoïdes matures, dont les flagelles remplissent la quasi-totalité de la lumière.
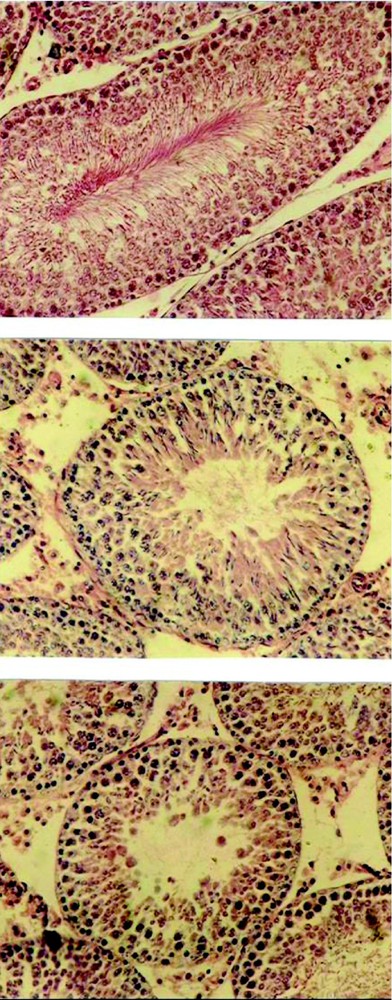
Structure histologique testicules de rats témoins (A) ou traités par Li1 pendant 28 j (B, C), montrant des tubes séminifères témoins dont la lumière est remplie de spermatozoïdes (A) et des tubes séminifères altérés par le traitement avec des spermatozoïdes sans flagelles (B) ou dépourvus de spermatozoïdes (C). Coloration : hématoxyline–éosine (×200).
Chez les rats traités pendant 28 j avec la dose Li1 (Fig. 3B, C) les différents stades de la spermatogenèse apparaissent fortement altérés. Parmi les perturbations observées, on note la présence d'un grand nombre de tubes séminifères avec des spermatozoïdes sans flagelles (B) ou une absence totale des spermatozoïdes (C).
3.6 Analyse du cycle oestral sur frottis vaginaux
L'étude cytologique des frottis vaginaux permet de différencier les quatre stades du cycle vaginal : prœstrus (nombreuses cellules épithéliales), œstrus (présence de cellules kératinisées dépourvues de noyaux) correspondant à la période ovulatoire, post-œstrus (apparition de leucocytes et de cellules phagocytaires et disparition des cellules kératinisées), di-œstrus.
Le Tableau 7 montre que dans les lots témoins, une grande majorité de rates étaient aux stades œstrus ou post-œstrus. Les rates traitées avec Li1 étaient en majorité au stade post-œstrus aux 7e et 14e jours et au stade di-œstrus aux 21e et 28e jours. Au 14e jour de traitement avec Li2, on observe que les rates étaient aux stades post-œstrus et di-œstrus.
Variations du cycle oestral chez les rates témoins (C) et traitées par Li1 et Li2. Les valeurs correspondent au nombre de rates en pro-œstrus (Pr), œstrus (O), post-œstrus (Po) et di-œstrus (Di) après 7, 14, 21 et 28 jours de traitement
| 7 j | 14 j | 21 j | 28 j | |||||||||||||
| Pr | O | Po | Di | Pr | O | Po | Di | Pr | O | Po | Di | Pr | O | Po | Di | |
| C | 1 | 7 | 5 | 10 | 2 | 7 | 4 | 1 | 8 | 1 | ||||||
| Li1 | 2 | 11 | 1 | 3 | 4 | 6 | 2 | 1 | 12 | 2 | 10 | |||||
| Li2 | 1 | 7 | 2 | 5 | 7 | 15 |
4 Discussion
Le but de ce travail est de compléter notre connaissance sur les concentrations seuil de lithium pouvant entraîner des effets cytotoxiques secondaires. Dans ce cadre, des rats blancs de souche Wistar ont été alimentés pendant un mois avec une nourriture supplémentée en Li2CO3, aux concentrations de 2000 mg (Li1) et 4000 mg (Li2) par kilogramme de nourriture
Nos résultats montrent que les doses Li1 et Li2 de Li2CO3 administrées par voie orale entraînent chez des rats matures une perte d'appétit (peut-être due au goût et à la forte alcalinité du Li2CO3) et une chute importante du poids corporel de caractère dose-dépendant, aussi bien chez les mâles que chez les femelles.
La dose Li2 a induit au 14e jour de traitement une lithémie de 1,29–1,45 mmol l−1, qui s'est accompagnée d'un taux de mortalité important. Ceci pourrait être le résultat de la déshydratation, associée aux phénomènes de polyurie, polydipsie et diarrhée qui ont été observés dans nos conditions expérimentales et qui ont été déjà observés par d'autres auteurs [5].
Pour la dose Li1, nos résultats suggèrent qu'une certaine adaptation s'installe après la première semaine de traitement. En effet, la quantité hebdomadaire de nourriture ingérée ne diminue plus et reste stable pendant les trois dernières semaines de traitement et le poids se stabilise. Nous avons cependant observé, pendant cette période, une augmentation de la lithémie, de 0,6 à 1,3 mmol l−1 et l'apparition de diarrhées et de polyurie, accompagnées d'une augmentation de la quantité d'eau de boisson consommée (polydipsie) (non présenté). Le syndrome de polyurie–polydipsie a également été observé chez des patients prenant du lithium depuis plus d'un an [21]. Une augmentation significative de la créatininémie a été détectée pour des lithémies de 0,6 mmol l−1, montrant que ces faibles concentrations de lithium, utilisées en thérapeutique chez l'homme, sont susceptibles d'induire une insuffisance rénale.
Cette insuffisance rénale est certainement à l'origine de l'augmentation temps-dépendante de la lithémie que nous avons observée chez les rats traités.
Notre étude a par ailleurs démontré que le Li2CO3 induisait une diminution dose-dépendante des taux sériques des hormones thyroïdiennes triodothyronine (FT3] et thyroxine (FT4). Il est bien connu que les risques de développer une hypothyroïdie sont augmentés chez les patients recevant un traitement au lithium [22–25] ; cependant, le mécanisme d'action du lithium est encore mal connu. Une diminution du diamètre des follicules thyroïdiens, de la taille des cellules folliculaire et des gouttelettes de colloïde a été observée chez des rats traités par le carbonate de lithium [26]. Urabe et al. [27] ont par ailleurs montré que l'incorporation d'iode, les étapes d'organification de l'iode et la synthèse de novo des hormones thyroïdiennes étaient inhibées par le lithium (2 mM) dans des follicules thyroïdiens en cultures primaires.
Un facteur important dans la régulation de la quantité d'hormone est la disponibilité en iode. Le transport de l'iode dans le thyréocyte dépend d'un transporteur symport Na+/I−, dont l'activité est électrogénique et Na+-dépendante [28]. Or, il a été démontré que le cation Li+ peut se substituer au Na+ et ainsi diminuer la constante d'affinité du transporteur pour l'anion I− [29], et donc l'iodation de la thyroglobuline.
Nos résultats montrent que le lithium modifie l'équilibre FT3–FT4. En effet, une augmentation du rapport FT4/FT3 a été mise en évidence, qui semble en rapport avec un défaut de conversion de FT4 en FT3. Cet effet pourrait être en relation avec l'insuffisance rénale que nous avons constatée chez les rats traités. En effet, il a été montré que l'insuffisance rénale chronique s'accompagne de troubles endocriniens, en particulier caractérisés par une diminution des concentrations sériques de T4 et T3 et d'un défaut de conversion de T4 en T3 [30]. Terao et al. [31] ont observé, chez des patients traités pendant huit semaines avec du lithium (taux sériques de 0,79 mmol l−1), une augmentation des niveaux de T4 et de TSH et aucune modification de T3. Ces auteurs suggèrent que le lithium pourrait inhiber la conversion périphérique de T4 libre en T3 en bloquant les processus de désiodation par la
Divers travaux suggérant que le lithium pouvait inhiber la stéroïdogenèse [32,33], Nous avons donc recherché les effets du lithium sur les organes sexuels mâles et femelles et plus particulièrement sur la production des hormones stéroïdes : la testostérone synthétisée par les cellules de Leydig du testicule et l'oestradiol produit par les cellules de la granulosa dans l'ovaire. Nos résultats montrent que des rats traités pendant un mois avec du Li2CO3, administré par voie orale aux doses de 2000 mg et 4000 mg par kilogramme de nourriture, présentent une diminution dose-dépendante des taux sériques de testostérone chez les mâles et, inversement, une augmentation des taux d'oestradiol chez les femelles. La testostérone favorise, entre autres, la croissance et le fonctionnement de l'épididyme, de la prostate et des vésicules séminales. En relation avec la diminution du taux de testostérone, nous avons observé une atrophie de la prostate et des vésicules séminales (non présenté). L'examen histologique des testicules des rats traités pendant un mois avec la plus faible dose a mis en évidence une atrophie de la plupart des tubes séminifères et un arrêt de la spermatogenèse. Thakur et al. [33] rapportent des résultats similaires chez des rats traités avec des doses de lithium de 1100 mg par kilogramme de nourriture. De plus, il a observé une vacuolisation du cytoplasme des cellules de Sertoli et un arrêt des sécrétions dans les vésicules séminales et la prostate. Les cellules de Sertoli, sous l'action combinée de la FSH et de la testostérone, sécrètent diverses protéines, qui commandent la différenciation et la production des spermatozoïdes. L'effet du lithium sur le taux de testostérone et sur les cellules de Sertoli peut donc expliquer, du moins en partie, l'arrêt de la spermatogenèse.
L'augmentation dose-dépendante du taux d'oestradiol induite par des lithémies supérieures à 1 mM est un résultat original, qui n'a pas à notre connaissance été rapporté dans la littérature.
Baptista et al. [34], analysant les fluctuations des hormones au cours du cycle menstruel chez des jeunes femmes traitées avec 900 mg/jour de Li2CO3, n'ont pas observé de modification des hormones suivantes : 17-1 oestradiol, progestérone, LH, FSH, thyroxine. Seule l'hormone thyréotrope (TSH) est apparue augmentée.
Chez les animaux, l'oestradiol déclenche l'œstrus, caractérisé par des modifications de la muqueuse vaginale, et assure le maintien des caractères sexuels secondaires. Banerji et al. [35] ont observé que des injections aiguës de lithium chez des souris en prœstrus supprimaient le pic de LH, qui doit normalement survenir en fin de prœstrus, et qu'une administration chronique de lithium entraînait une interruption du cycle sexuel, qui restait bloqué au stade diœstrus. Notre travail montre qu'après un mois de traitement par le lithium, la majorité des rates était bloquée en phase diœstrus, et ceci bien que les taux d'estradiol soient élevés.
Une étude récente a montré que le lithium provoquait une diminution de la densité des récepteurs des estrogènes au niveau de l'utérus [36]. Un grand nombre de récepteurs à l'oestradiol sont également présents dans les aires hypothalamiques préoptiques antérieures et dans des cellules gonadotropes de l'hypophyse antérieure [37]. Ceci suggère qu'une diminution du nombre des récepteurs des oestrogènes, induite par le lithium au niveau de l'axe hypothalamo-hypophysaire, pourrait être à l'origine de perturbations du contrôle neuro-endocrinien du cycle oestral chez les animaux traités.
En conclusion, nos résultats montrent que des lithémies de 0,6 mmol l−1 sont susceptibles d'induire chez le rat, au cours des 15 premiers jours de traitement, une insuffisance rénale entraînant secondairement une augmentation de la lithémie. L'apparition d'une hypothyroïdie et une baisse de la testostérone ont été observées pour des lithémies supérieures à 0,75 mmol l−1. Une augmentation des concentrations sériques d'estradiol et des perturbations du cycle oestral ont été observées pour des lithémies de l'ordre de 1 mmol l−1. Ces résultats mettent en évidence le fait que la toxicité du lithium se manifeste rapidement chez le rat dans une gamme de concentrations couramment utilisées en thérapeutique humaine, qui est cependant susceptible de générer des effets secondaires, essentiellement sur le long terme [5].



Vous devez vous connecter pour continuer.
S'authentifier