Abridged English version
In this study, the authors present for the first time an inventory of harmful algae, which is responsible for blooms appearing in coastal waters of the Annaba bay (Algeria). Phytoplankton samples and some hydrological data have been collected during year 2002 every 15 days, in three stations located along a south–north-oriented radial.
Micro-algae were examined with light and scanning electron microscopes (SEM JEOL, JSM-840A of the Common Service of Electronic Microscopy of the Life Sciences Laboratories of the National Museum of Natural History, in Paris, France).
The qualitative and quantitative surveys show that 11 taxa of dinoflagellates were identified as toxic or bloom forming. Between them, two harmful species were found on the Annaba coastline: Alexandrium catenella and Gymnodinium catenatum, which proliferated; seven other toxic Dinophyceae were discovered: Dinophysis caudata, D. fortii, D. rapa, D. rotundata, D. tripos, Lingulodinium polyedrum, and Protoperidinium crassipes, but they never generated blooms; two non-toxic species, Prorocentrum triestinum and Scrippsiella trochoidea, produced blooms.
Alexandrium catenella and Lingulodinium polyedrum are found, for the first time, in the Annaba bay's waters and in Algeria.
In spring, all identified taxa were listed, whereas in summer L. polyedrum is absent. In autumn, five species are present, namely: D. rapa, G. catenatum, L. polyedrum, P. crassipes, and P. triestinum, whereas only D. fortii and P. crassipes are recorded in winter.
In 2002, the 11 listed taxa appeared practically in the three stations, excepted D. caudata in station 1, D. fortii and L. polyedrum in station 2, and A. catenella in station 3.
Efflorescences appeared the most in station 1 with G. catenatum (
Another blooming occurred in station 2, with A. catenella, whereas station 3, for its own, never produced a notorious phytoplankton proliferation.
1 Introduction
Les blooms de micro-algues n'ont cessé de croître au cours de ces dernières décennies dans les régions tempérées et tropicales. Leurs manifestations peuvent être nocives pour la faune marine ainsi que pour la santé humaine. Les espèces responsables appartiennent aux Chlorophycées, Chrysophycées, Cryptophycées, Dinophycées, Euglénophycées, Prymnesiophycées et Prasinophycées [1]. À la suite de la recrudescence de ces phénomènes en Australie, aux États-Unis, en Europe et au Japon, et aux conséquences qu'ils entraînent, notamment pour l'aquaculture et le tourisme, plusieurs programmes de recherche et de surveillance ont été mis en œuvre dans ce domaine [2].
À l'échelle mondiale, de nombreux travaux ont été menés sur les blooms à phytoplancton toxique, entre autres sur ceux à dinoflagellés (= Dinophycées) [3–9].
Sur la côte méditerranéenne sud-occidentale, plusieurs études ont été réalisées sur le phytoplancton marin toxique, en particulier au Maroc [10–13] et en Tunisie [14]. En revanche, seules quelques données ponctuelles existent pour le littoral algérien, dont le phytoplancton marin demeure à ce jour peu connu. Les travaux disponibles concernent les baies d'Alger et d'Annaba [15,16], mais aucun inventaire exhaustif n'a été réalisé à ce jour.
La présente étude décrit, pour la première fois, les espèces phytoplanctoniques toxiques et celles impliquées dans des efflorescences se manifestant parfois dans les eaux côtières de la baie d'Annaba. Des mesures des sels nutritifs et un suivi de quelques paramètres hydrologiques ont été réalisés afin de tenter d'appréhender les conditions écologiques favorables à ces microorganismes.
2 Matériels et méthodes
La récolte des échantillons et les mesures des paramètres physicochimiques ont été effectuées durant l'année 2002 tous les 15 jours, en trois points distribués le long d'une radiale orientée sud–nord, avec un gradient bathymétrique (3,5 m, 7 m et 28 m), et en suivant l'axe de fertilisation (Oued Seybouse), au sud, et les entrées des eaux du large (cap de Garde), au nord (Fig. 1).
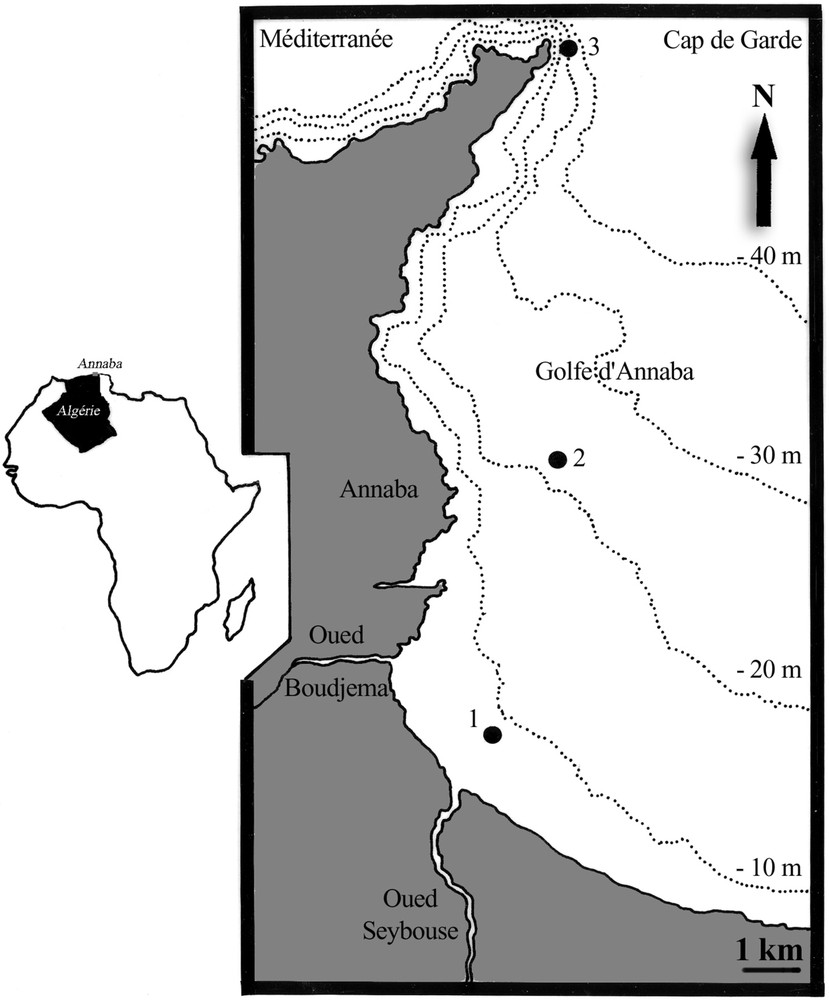
Situation géographique des stations échantillonnées dans la baie d'Annaba (Algérie).
La température et la salinité sont mesurées in situ à l'aide d'un thermosalinomètre de type Kent EIL 5005. Les sels nutritifs dissous (ammonium (
La chlorophylle a a été dosée selon le protocole décrit par [17], les concentrations étant calculées suivant les équations usuelles [18].
Pour le phytoplancton, des traits horizontaux ont été réalisés à −50 cm de la surface, à l'aide d'un filet à plancton de 20 μm de vide de maille. Les échantillons ont été immédiatement fixés à l'aide de formaldéhyde neutralisé (concentration
Les identifications et les descriptions des espèces sont basées sur les caractères définis par différents auteurs [19–24].
Un microscope Wild M20, équipé d'une chambre claire, a été utilisé pour les observations et l'exécution des dessins.
Les espèces examinées au microscope électronique à balayage (MEB) ont été isolées à la micropipette, lavées à l'eau distillée et traitées à l'eau oxygénée durant 24 à 72 h (pour éliminer les salissures). Elles ont ensuite été déshydratées et montées sur les porte-objets selon le protocole défini par Couté [25].
Les observations et les prises de vues ont été réalisées sur le MEB Jeol JSM-840A du service commun de microscopie électronique des laboratoires des sciences de la Vie du Muséum national d'histoire naturelle, à Paris.
3 Résultats
3.1 Physicochimie et biomasse chlorophyllienne
L'analyse des résultats des mesures des paramètres physico-chimiques et de la biomasse chlorophyllienne (Tableau 1) révèle l'existence d'un gradient spatial de température, de salinité et de concentration des sels nutritifs et de la chlorophylle a, de la côte vers le large. La température fluctue entre 14 °C en hiver et 25,8 °C en été entre les stations 1 et 3. La salinité varie dans la station 1 entre 35,1 PSU en hiver et 37,5 PSU en été ; elle est comparable à celle des eaux du large, dont la moyenne annuelle est de 37,4 PSU.
Valeurs des paramètres physicochimiques mesurés en 2002 dans les trois stations (1, 2, 3) échantillonnées dans la baie d'Annaba
| Température (°C) | Salinité (PSU) | Ammonium ( |
Nitrates ( |
Phosphates ( |
Chlorophylle a (μg L−1) | |||||||||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| J | 16 | 14,4 | 14,8 | 37,4 | 37,8 | 37,5 | 32,7 | 0,6 | 0 | 3,8 | 0,61 | 1,15 | 2,11 | 0,02 | 0 | − | − | − |
| F | 16,8 | 18 | 14,6 | 37,2 | 37,9 | 37,6 | 272,8 | 0,06 | 0 | 13,95 | 0,22 | 0,13 | 1,99 | 0 | 0 | 7,21 | 0,8 | 0,26 |
| M | 17,3 | 17 | 15,3 | 37,2 | 37,3 | 37,5 | 64,5 | 37,06 | 1,86 | 9,24 | 0,22 | 0,06 | 3,03 | 0,68 | 0 | 10,94 | 0,8 | 0,26 |
| A | 17,4 | 16,5 | 16,2 | 36,9 | 37,4 | 37,4 | 87,9 | 1,16 | 0,71 | 37,36 | 0,16 | 0,06 | 1,92 | 0,05 | 0 | 7,21 | 3,47 | 0,25 |
| M | 20,9 | 20 | 18,5 | 37 | 37,4 | 37,2 | 21,6 | 4,26 | 0,56 | 1,45 | 0,09 | 0,06 | 1,06 | 1,2 | 0,03 | 10,68 | 5,6 | 3,2 |
| J | 21,6 | 20,8 | 19,4 | 36,9 | 37,3 | 37,2 | 5,06 | 23,46 | 0 | 0,87 | 2,02 | 0,11 | 2,12 | 4 | 0 | 23,5 | 32,84 | 1,06 |
| J | 25,8 | 24,8 | 24,6 | 36,8 | 36,9 | 37,1 | 26,01 | 16,7 | 0 | 5 | 1,72 | 0,03 | 5,96 | 5,64 | 0 | 39,51 | 28,3 | 6,4 |
| A | 25,8 | 25,5 | 25,3 | 37,5 | 38,1 | 37,9 | 28,9 | 0,21 | 0 | 4,47 | 0,41 | 0,11 | 1,65 | 0,48 | 0 | 11,74 | 9,61 | 1,87 |
| S | 25,4 | 25,4 | 25 | 37,2 | 37,5 | 37,6 | 29,3 | 1,11 | 0 | 2,1 | 0,70 | 0,03 | 1 | 0,56 | 0 | 1,6 | 11,74 | 0,22 |
| O | 22,2 | 21,9 | 21,8 | 35,9 | 37,1 | 37,4 | 55,5 | 3,76 | 0,16 | 13,4 | 1,53 | 0,06 | 2,36 | 1,16 | 0 | 7,21 | 1,6 | 0,20 |
| N | 16,8 | 16,4 | 16,5 | 36,4 | 37,2 | 37,2 | 210 | 43,6 | 1,66 | 29,37 | 10,53 | 0,83 | 0,82 | 0 | 0,18 | 1,33 | 1,33 | 0,80 |
| D | 14,6 | 14,1 | 14,8 | 35,1 | 37,1 | 37,1 | 211,8 | 6,9 | 0,81 | 58,36 | 4,28 | 1,2 | 0,46 | 0,02 | 0 | 14,95 | 3,2 | 0,23 |
Les teneurs élevées en sels nutritifs et en chlorophylle a traduisent une eutrophisation, qui s'accentue en période estivale. On constate, en outre, 1'établissement d'un gradient décroissant sud–nord, plus marqué pour l'ion ammonium, dont les teneurs sont très élevées (de 5,06 à 272,82 μmol L−1 à la station 1, et de 0 à 1,86 μmol L−1 à la station 3), retrouvant les valeurs d'oligotrophie enregistrées en Méditerranée nord-occidentale [26].
La plus forte concentration en chlorophylle a est notée au cours du mois de juillet (Tableau 1), atteignant des valeurs très élevées à la station 1 (39,51 μg L−1), mais avec des teneurs inférieures à 2 μg L−1 à la station 3.
D'après la classification des niveaux trophiques des milieux aquatiques [27], la baie d'Annaba peut être considérée comme eutrophe (teneur en chlorophylle a se situant entre 5 et 20 μg L−1). La concentration de la chlorophylle a moyenne enregistrée en 2002 est de 6,60 μg L−1.
3.2 Inventaire et description des Dinophycées
L'inventaire des peuplements de Dinophycées toxiques et/ou responsables de blooms mené durant l'année 2002 dans la baie d'Annaba a permis de recenser 11 taxons (Tableau 2) : Alexandrium catenella, Dinophysis caudata, D. fortii, D. rapa, D. rotundata, D. tripos, Gymnodinium catenatum, Lyngulodinium polyedrum et Protoperidinium crassipes sont considérés comme toxiques, tandis que Prorocentrum triestinum et Scrippsiella trochoidea, qui ont été associés à des blooms, ne sont pas nuisibles.
Présence des différentes espèces de Dinophycées provoquant des blooms et/ou toxiques dans les trois stations échantillonnées (1, 2, 3) durant l'année 2002 dans la baie d'Annaba
| Espèces | J | F | M | A | M | J | J | A | S | O | N | D | ||||||||||||||||||||||||
| 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 2 | 3 | |
| Alexandrium catenella | + | + | + | + | + | |||||||||||||||||||||||||||||||
| Dinophysis caudata | + | + | + | + | + | + | + | |||||||||||||||||||||||||||||
| Dinophysis fortii | + | + | + | + | ||||||||||||||||||||||||||||||||
| Dinophysis rapa | + | + | + | + | + | |||||||||||||||||||||||||||||||
| Dinophysis rotundata | + | + | + | + | + | + | + | |||||||||||||||||||||||||||||
| Dinophysis tripos | + | + | ||||||||||||||||||||||||||||||||||
| Gymnodinium catenatum | + | + | + | + | + | + | + | + | + | + | + | + | + | |||||||||||||||||||||||
| Lingulodinium polyedrum | + | + | + | + | + | |||||||||||||||||||||||||||||||
| Prorocentrum triestinum | + | + | + | + | + | + | + | + | + | + | + | + | + | + | + | |||||||||||||||||||||
| Protoperidinium crassipes | + | + | + | + | + | + | + | + | ||||||||||||||||||||||||||||
| Scrippsiella trochoidea | + | + | + | + | + | + | + | + | + | + | + | + | + | + |
Alexandrium catenella (Whedon et Kofoid) Balech (Fig. 2 a et b)

Alexandrium catenella : (a) chaîne de quatre cellules, (b) complexe apical (flèche blanche : foramen ; flèche noire : pore apical de liaison). Fig. 3. Dinophysis caudata, vue latérale. Fig. 5. Dinophysis rapa, vue apicale. Fig. 7. Dinophysis tripos, vue latérale. Fig. 9. Lingulodinium polyedrum : (a) vue ventrale ; (b) tabulation apicale ; (c) détail du pôle antérieur (flèche blanche : plaque 4′).
(= Gonyaulax catenella Whedon et Kofoid )
(= Protogonyaulax catenella (Whedon et Kofoid) Taylor)
Cellules en chaîne par deux, quatre ou huit, de forme globuleuse ; épithèque hémisphérique, hypothèque légèrement concave, cingulum descendant, non croisé, sulcus bordé par de larges ailettes (Fig. 2a), thèque lisse, avec des pores espacés. Un large complexe poral apical (APC) de forme triangulaire (côté : 7,6 μm, base : 4,6 μm) est composé d'un pore apical (Po), qui est en contact direct avec la plaque 1' et abrite un foramen, et d'un pore de liaison antérieur (aap : attachment anterior pore), de forme ellipsoïdale (dimensions : 1–1,6 μm) (Fig. 2b) ; on relève l'absence de pore ventral.
Dimensions : longueur 25–30 μm ; largeur 30–35 μm.
Tabulation : Po, 4′, 6″, 6c, 8s, 5‴, 2⁗.
C'est la première fois que cette espèce est trouvée en Algérie. Dans la baie d'Annaba, elle a provoqué un bloom au mois de mars à une température de 17 °C, dans la station 2, avec une densité de
Alexandrium catenella est connu dans la littérature pour synthétiser de puissantes toxines, des gonyautoxines (GTX1/5, dcGTX2, dcGTX3, C1 et C2, des traces de C3 et C4, la neosaxitoxine (neoSTX) et la saxitoxine (STX) [28,29]).
Dinophysis caudata Saville–Kent (Fig. 3)
Cellule allongée, fortement aplatie latéralement, équipée d'une longue projection hypothécale ventrale. Thèque épaisse couverte de pores entourés d'aréoles. Épithèque très réduite, masquée par la collerette cingulaire antérieure ; hypothèque étroite au niveau du cingulum.
Cingulum très antérieur bordé de deux collerettes tronconiques, l'antérieure supportée par des rayons et la postérieure étroite dorsalement, s'élargissant ventralement. Sulcus bordé de deux ailettes plus ou moins réticulées, la droite nettement plus développée que l'autre.
Dimensions : longueur 130 μm, largeur 60 μm.
Commune dans les eaux néritiques de la baie d'Annaba ; sa présence est notée à partir du mois de mai jusqu'en juillet.
C'est une espèce connue pour produire de l'acide okadaïque, impliqué dans les intoxications de type IDFM (intoxication diarrhéique par fruits de mer), et des pectenotoxines (PTX-2) [30,31]
Dinophysis fortii Pavillard (Fig. 4)

Dinophysis fortii, vue latérale. Fig. 6. Dinophysis rotundata, vue latérale. Fig. 8. Gymnodinium catenatum, chaîne de quatre cellules.
(= Dinophysis laevis Pouchet ; Dinophysis ovum Schütt sensu Martin)
Cellule de forme subovale, avec l'extrémité postérieure arrondie. L'ailette sulcale gauche est bien développée et plus longue que celle de droite, triangulaire. La collerette cingulaire antérieure est plus large que la collerette cingulaire postérieure. Hypothèque ornementée d'aréoles, chaque aréole contenant un pore.
Dimensions : longueur 62 μm, largeur 50 μm.
Rencontrée dans les eaux néritiques de la baie d'Annaba en période hivernale, entre novembre et janvier à la station 1.
Selon divers auteurs [32,33], il s'agit d'une espèce qui vit dans les eaux froides, mais aussi dans les zones subtropicales et tropicales. Elle est présente dans les eaux côtières de l'Atlantique oriental et en Méditerranée, de l'été jusqu'à l'hiver [24].
Plusieurs études toxicologiques ont conclu que Dinophysis fortii était responsable de la production de l'acide okadaïque, de la dinophysistoxine-1 (DTX1) et de la pectenotoxine-2 (PTX2), impliquées dans les intoxications de type IDFM (intoxication diarrhéique par fruits de mer) [34–36].
Dinophysis rapa (Stein) Abé (Fig. 5)
(= Phalacroma rapa Stein)
Corps trapézoïdal en vue latérale, avec un bord postéro-ventral étendu et concave. Épithèque très réduite et aplatie, mais qui dépasse la collerette antérieure, relativement étroite, avec de nombreux rayons. L'aileron sulcal gauche, avec trois rayons, dont le R3, est le plus long et recouvre tout le bord ventral. Thèque épaisse ornementée par de grosses aréoles (3–4 μm de diamètre), dont certaines avec un pore.
Dimensions : longueur 75–80 μm, largeur 65–75 μm.
Certains auteurs [37,38], évoquent la possibilité que Dinophysis mitra soit une variété de D. rapa.
Très fréquente durant la période printanière et estivale dans la baie d'Annaba, aux stations 2 et 3.
Espèce connue pour produire de l'acide okadaïque [34].
Dinophysis rotundata Claparède et Lachmann (Fig. 6)
(= Phalacroma rotundatum Kofoid et Michener)
(= Dinophysis whittingae Balech)
Cellule comprimée latéralement, épithèque et hypothèque de forme arrondie en vue latérale ; épithèque en partie masquée par la collerette cingulaire antérieure ; hypothèque sans ornementation. Cingulum antérieur bordé de deux collerettes subhorizontales, généralement lisses.
L'ailette sulcale gauche est plus large que la droite et s'étend sur plus de la moitié de la longueur de l'hypothèque ; elle est munie de trois forts rayons, R1 et R2 étant plus proches que R2 et R3. Thèque à nombreux pores.
Dimensions : longueur 52 μm, largeur 50 μm.
Très peu abondante sur les côtes d'Annaba, cette espèce a été détectée de mai à août aux stations 2 et 3.
Espèce commune en eaux froides et océaniques, présente en abondance dans la Manche, en Atlantique et, de façon occasionnelle, en Méditerranée [38].
Des études toxicologiques ont révélé que Dinophysis rotundata était responsable de la production de la dinophysistoxine-1 (DTX1) [34].
Dinophysis tripos Gourret (Fig. 7)
Cellule comprimée latéralement, pourvue de deux appendices postérieurs, l'un ventral et long (46 μm), l'autre dorsal et beaucoup plus court (16 μm). Thèque épaisse avec des pores (12/10 μm2) entourés d'aréoles. Cingulum très antérieur, bordé de deux collerettes largement évasées, l'antérieure étant supportée par des rayons.
Sulcus bordé de deux ailerons, le droit plus court, et celui de gauche plus long, avec trois rayons accompagnés de nervures au niveau de l'extrémité du R3.
Dimensions : longueur 116,5 μm, largeur 83,5 μm.
Espèce thermophile, très fréquente en juin aux stations 2 et 3.
Des analyses de toxines chez Dinophysis tripos ont montré, sur une population japonaise, qu'il était responsable de la production de la dinophysistoxine-1 (DTX1) [34].
Gymnodinium catenatum Graham (Fig. 8)
Cellules en chaîne comportant jusqu'à 32 individus. Cellule globuleuse, épithèque subconique, hypothèque hémisphérique. Cingulum descendant ; sulcus s'étendant de l'antapex à l'apex.
Dimensions : longueur 20 μm, largeur 15 μm.
Présence de nombreux chloroplastes.
Espèce très fréquente pendant les périodes printanière et estivale ; elle a provoqué un bloom à la fin du mois de juin aux stations 1 et 2, avec une densité de
Lingulodinium polyedrum (Stein) Dodge (Fig. 9 a, b et c)
(= Gonyaulax polyedra Stein)
La cellule présente un aspect globuleux, grossièrement pentagonal (Fig. 9a), avec une vue apicale presque circulaire ; elle possède des plaques thécales épaisses (tabulation épithécale : Po, 4′, 2a, 6″ ; Fig. 9b) à bord très prononcé ; elle comporte de grosses aréoles, avec un pore central. Le cingulum est descendant et croisé. La plaque 4′ (Fig. 9c) est très petite et située sur le côté droit du pore apical, particularité de cette espèce par rapport aux espèces voisines du genre Gonyaulax. Le sulcus est droit, élargi dans la partie postérieure. C'est une espèce connue pour former des kystes portant éventuellement des épines.
Dimensions : longueur 42,5 μm, largeur 40,8 μm.
Le développement de L. polyedrum sur les côtes algériennes a été observé entre mars et septembre aux stations 1 et 3. Cette espèce est présente en Méditerranée tout au long de l'année, avec une fréquence moindre en hiver. Elle est occasionnelle en Atlantique [24].
Ce taxon est déjà recensé comme responsable d'eaux rouges et est associé à des ichtyotoxines [39].
Prorocentrum triestinum Schiller (Fig. 10 a et b)

Prorocentrum triestinum : (a) vue d'un individu ; (b) deux cellules avec trichocystes. Fig. 11. Protoperidinum crassipes : (a) vue ventrale ; (b) tabulation apicale ; (c) vue dorsale. Fig. 12. Scrippsiella trochoidea : vue ventrale.
(= Prorocentrum redfeldii Bursa, P. pyrenoideum Bursa)
Cellule de forme lancéolée, en vue latérale, avec une thèque asymétrique ; elle a un bord convexe et bombé, arrondi dans sa partie antérieure, avec un aiguillon de 3 à 5 μm de longueur, pointu du côté postérieur (Fig. 10a). La thèque est plate et lisse ; pores à trichocystes (Fig. 10b) peu nombreux disposés régulièrement sur la périphérie.
Dimensions : longueur 24 μm, largeur 10 μm.
Espèce la plus petite du genre, dont la forme et les dimensions facilitent l'identification [40].
Espèce planctonique, plus néritique qu'océanique.
Dans la baie d'Annaba, elle est rencontrée pratiquement toute l'année, surtout dans la station 1, avec un bloom en juin et septembre et des densités respectives de
Protoperidinum crassipes (Kofoid) Balech (Fig. 11 a, b et c)
Contour cellulaire en forme de toupie, aspect ventral subcarré et vue apicale circulaire ; corne antapicale droite forte, la gauche étant plus courte, toutes les deux étant munies d'une épine solide. Cingulum descendant ; paroi réticulée avec plusieurs pores dispersés au hasard (Fig. 11 a et c), Plaque 1′ en position méta ; tabulation épithécale : 4′, 3a, 7″ (Fig. 11b).
Dimensions : longueur 88,5 μm, largeur 83,5 μm.
Taxon détecté durant toutes les saisons aux stations 1 et 2.
Il est connu pour produire une nouvelle phycotoxine (AZP Azaspiracid Poisonning), qui génère les symptômes d'une intoxication par IDFM (intoxication diarrhéique par fruits de mer) [41]
Scrippsiella trochoidea (Stein) Loeblich III (Fig. 12)
Cellule de forme subpiriforme ou sublosangique, peu ou pas comprimée dorso-ventralement. Plaques lisses avec quelques pores. Épithèque subconique, hypothèque subhémisphérique. Cingulum assez large (3 à 4 μm), légèrement descendant. Tabulation : 4′, 3a, 7″, 6c, 5‴, 6⁗. Présence de chloroplastes.
Dimensions : longueur 24,5 μm, largeur 22 μm.
Espèce cosmopolite, connue des eaux néritiques et estuariennes. Dans la baie d'Annaba, elle est présente pendant l'hiver, le printemps et l'été dans l'ensemble des stations ; elle a constitué des blooms en mai, juin et juillet dans la station 1, avec une densité maximale de
Espèce non toxique.
4 Discussion et conclusion
L'étude qualitative et quantitative des peuplements de Dinophycées menée durant l'année 2002 dans la baie d'Annaba a permis de constater des floraisons presque permanentes, surtout dans les stations côtières, en particulier la station 1, soumise à une grande influence continentale, ce qui explique son caractère eutrophe. En effet, on y a noté des teneurs en éléments nutritifs extrêmement élevées (moyenne annuelle pour l'ammonium : 86,3 μmol L−1, nitrates : 14,9 μmol L−1, phosphates : 2,04 μmol L−1), et de la chlorophylle a avec 11,3 μg L−1, ces apports terrigènes masquant ainsi les variations saisonnières. La station 3, pour sa part, se caractérise par une eau oligotrophe, les concentrations moyennes y étant respectivement de 0,48 μmol L−1 pour l'ammonium, 0,3 μmol L−1 pour les nitrates et 0,01 μmol L−1 pour les phosphates, ce qui favorise le développement des formes thécales, comme : Dinophysis, Diplopsalis, Gonyaulax, Prorocentrum, Protoperidinium, et un accroissement des Ceratium.
Ces analyses ont abouti également au recensement de 11 espèces de Dinophycées, soit impliquées dans des blooms, soit toxiques, soit les deux à la fois.
Plusieurs fleurs d'eau de dinoflagellés ont ainsi été observées durant l'année 2002, dont les plus importantes pendant la période printanière. Les espèces concernées étaient : Alexandrium catenella, Gymnodinium catenatum, Prorocentrum triestinum et Scripsiella trochoidea. Parmi celles-ci, seuls Alexandrium catenella et Gymnodinium catenatum sont considérées comme toxiques.
Le bloom à G. catenatum est apparu en juin dans toute la baie, avec une densité maximale de
C'est en 1987 que G. catenatum a été identifié comme responsable de la production des toxines paralysantes sur les côtes méditerranéennes du Sud de l'Espagne [52]. On a enregistré l'existence régulière de cette espèce sur les côtes espagnoles depuis la mise en place du programme de surveillance du phytoplancton toxique, en 1997 [53]. Des constatations analogues ont aussi été faites sur les côtes marocaines (Méditerranée sud-occidentale) [14,54].
Sur les côtes algériennes, la présence de G. catenatum dans les eaux des baies d'Alger et de Bou-Ismail a été signalée en 2004 [16], avec des densités variant entre 440 et 3200 cellules L−1. Cependant, cette concentration reste très faible par rapport au bloom observé dans la baie d'Annaba (
L'espèce Alexandrium catenella est signalée pour la première fois dans les eaux algériennes. Connu pour être toxique, ce taxon a provoqué un bloom dans la baie d'Annaba en mars, à la station 2 seulement, avec une densité de
Alexandrium catenella est connu pour synthétiser de puissantes toxines, des gonyautoxines (GTX1/5, dcGTX2, dcGTX3, C1 et C2, des traces de C3 et C4, la neosaxitoxine (neoSTX) et la saxitoxine (STX) [36,37].
Par ailleurs, il faut signaler que sept espèces de dinoflagellés toxiques trouvées dans la baie d'Annaba, à savoir Dinophysis caudata, D. fortii, D. rapa, D. rotundata, D. tripos, Lingulodinium polyedrum et Protoperidinium crassipes, n'ont jamais contribué de manière significative aux blooms phytoplanctoniques.
Pour Lingulodinium polyedrum, il s'agit de la première signalisation de cette espèce toxique dans la baie d'Annaba. Elle a été observée dans les échantillons qualitatifs, en un nombre très réduit, en période printanière et automnale, à des températures de 18 et 20 °C. Il semble que la température joue un rôle essentiel dans le déclenchement du processus des efflorescences de L. polyedrum, un bloom s'étant produit durant la période estivale à des températures de 17 à 18 °C sur le littoral de Doukkala (Atlantique marocain) [16] et sur la côte atlantique dans la baie de Setubal (Portugal) [61]. En mer Adriatique (Croatie), des efflorescences ont aussi été observées, de juin à septembre [62]. Des travaux postérieurs ont démontré que des températures supérieures à 20 °C favorisaient le déclenchement ou le maintien des efflorescences de L. polyedrum [63–65]. Ce taxon est déjà recensé comme responsable d'eaux rouges et est associé à des ichtyotoxines et à la mortalité de jeunes huîtres [63–66]. Il a été à l'origine d'une anoxie du milieu qui a causé la mortalité de poissons dans la baie de Kastela en 1980, en Croatie [67].
Plus tard, en 1990, il a été rapporté la présence de saxitoxine dans des échantillons d'eau lors d'un bloom à L. polyedrum [68]. Plus récemment, on a pu déterminer la toxine comme une yessotoxine [69,70].
Les espèces du genre Dinophysis ont été décelées à partir d'avril, mais leur abondance est bien marquée en période printanière, en particulier en mai pour D. caudata et D. fortii, puis en juin et juillet pour D. tripos et D. rapa. La plupart des études mentionnent des valeurs très faibles, limitées à quelques cellules par litre en période hivernale, et augmentant à quelques dizaines, puis jusqu'à quelques milliers par litre, pour la période estivale [71]. Des concentrations cellulaires supérieures à 106 cellules L−1 ont été récemment signalées dans différentes régions du monde [50,72,73]. Plusieurs études toxicologiques [74–76] ont conclu que Dinophysis caudata, D. fortii, D. rapa et D. rotundata étaient responsables de la production de l'acide okadaïque, de la dinophysistoxine-1 (DTX1) et de la pectenotoxine-2 (PTX2), impliquées dans des intoxications diarrhéiques par fruits de mer (IDFM).
Plus récemment, plusieurs travaux [77–81] ont montré qu'il existait une relation entre la mixotrophie et la présence de cellules de très petite taille (picophytoplancton) sur la surface des vacuoles, à l'intérieur des cellules de Dinophysis acuminata et D. fortii. Ceci a conduit [79] à émettre l'hypothèse selon laquelle les Dinophysis spp. pourraient être non toxiques à l'origine, et le deviendraient après ingestion du picophytoplancton toxique.
Protoperidinium crassipes, qui apparaît très souvent dans les eaux de la baie d'Annaba, est connu pour être impliqué dans la production d'une nouvelle phycotoxine, l'azaspiracid (AZs), qui a causé de sévères intoxications chez l'homme depuis 1995 [82]. C'est en 2003 qu'a été confirmée la responsabilité de P. crassipes dans la production de cette phycotoxine [83].
Parmi les 11 taxons de dinoflagellés identifiés, deux espèces, Alexandrium catenella et Gymnodinium catenatum, sont responsables d'efflorescences et sont connues pour être toxiques. Sept espèces, à savoir Dinophysis caudata, D. fortii, D. rapa, D. rotundata, D. tripos, Lyngulodinium polyedrum et Protoperidinium crassipes, sont considérées comme toxiques, mais n'ont jamais contribué à des floraisons phytoplanctoniques. Deux espèces, Prorocentrum triestinum et Scrippsiella trochoidea, ont été associées à des blooms, mais elles ne sont pas connues comme toxiques.
Il faut ajouter qu'Alexandrium catenella et Lyngulodinium polyedrum sont signalés ici pour la première fois sur les côtes algériennes.
Du point de vue écologique, les peuplements de Dinophycées et, plus généralement, les peuplements phytoplanctoniques semblent évoluer dans un système à faible inertie, fluctuant selon la prépondérance des flux terrestres ou des intrusions d'eaux marines. Le faible hydrodynamisme local ne paraît pas assurer un brassage des eaux suffisant pour faire face à cette eutrophisation et à son impact sur le fonctionnement écologique du secteur étudié, entre autres, l'apparition de blooms phytoplanctoniques, toxiques ou non.
La collecte de moules sauvages et l'activité conchylicole (mytiliculture et ramassage de la palourde) dans le lac El-Mella, situé au voisinage de la région, au moment des efflorescences d'espèces micro-algales potentiellement toxiques sont susceptibles d'affecter la santé humaine, en particulier celle des consommateurs de ces animaux filtreurs. La prolifération de ces dinoflagellés nuisibles peut aussi, par voie de conséquence, avoir un impact socio-économique négatif sur la commercialisation de ces bivalves comestibles.


