Abridged version
The green birdmouth wrasse Gomphosus caeruleus is present all year round on the coral reefs of Reunion Island in the Indian Ocean (Fig. 1A–B). A group of G. caeruleus individuals was followed on one of these reefs to study the reproductive mode and mating system of this species, and determine the influence of social behaviors and environmental factors on reproduction. Observations were performed by snorkeling over 13 months. No fish were captured because the study was performed within the boundaries of the Reunion Island marine protected area (Fig. 1B). Water turbidity was usually quite high, often preventing clear observation of egg release and of rapid reproductive events, lasting no more than a few seconds. Thus, we analyzed reproduction using spawning rushes as proxy. These we define as a quick rush to the surface of a male accompanied by one or multiple females, but not necessarily leading to the expulsion of gametes (Fig. 2D–F, Video S1). During this study, males, by their constant movements within the site, defined three territories (Fig. 1C–F) that differed in size, coral assemblages, and reproductive success–the smallest territory (T1, Fig. 1C–D) was the most successful in terms of females and spawning rush numbers.
Our observations revealed that G. caeruleus is similar to many Labridae in exhibiting protogynous hermaphroditism and probably diandry (Fig. 2). This is similar to its sister species Gomphosus varius. Females were between 6 and 15 cm long, and were recognizable by a rounded caudal fin lobe, a tubiform snout with a brown to red line on the upper side, and a white neck (Fig. 2 C). Males were always larger than females, from 15 to 20 cm long, they were uniformly dark blue to teal, even on the tubiform snout, and the caudal fin was lunate with thin filaments extending posteriorly at the dorsal and ventral edges (Fig. 2F). Several juveniles smaller than 3 cm were observed on site, and displayed a brown to red–brown color anteriorly and lime green posteriorly, with a white neck similar to that of females (Fig. 2A). Multiple observations included individuals presenting morphological characteristics in size, shape, and colors, intermediate between the juveniles and mature females (Fig. 2B), and between mature females and males (Fig. 2D–E). This supports the hypothesis of protogynous hermaphroditism. Protogynous hermaphroditism of G. caeruleus should be validated by histological examination of the gonads of intermediate individuals.
By analyzing the number of males and females present on site, and their territory, social behavior, and courtship (Fig. S2, Video S1), we could demonstrate that the group mating system is dominated by a haremic organization on a single-territory, alternating with short periods of lek-like mating without aggressiveness between males. This is atypical for a lek-like mating system in fish. Few aggressive behavior events were however observed from males toward females, which could actually be primary males. We noticed that females chose the site of reproduction by positioning themselves on specific corals (Fig. 3A, Fig. S2C). Females were also the drivers of the transition from the haremic to the lek-like mating system. Males chose when to reproduce, which females to reproduce with, and likely initiated the transition from the lek-like to the haremic mating system. Short periods of lek-like mating were associated with variations in population density (linked with an increased number of females fitting a “hotspot” model) and/or seasonal changes between the winter solstice and the spring equinox. Seasonality of switching between reproductive systems should be confirmed over several years.
Reproductive events followed a daily cycle and occurred exclusively from mid-morning to early afternoon. Statistical analyses of the number of spawning rushes observed per day revealed that the reproduction of G. caeruleus is similar to that of other reef fish species in being influenced by the lunar cycle with peak of reproductive activity before the full moon. Both the number of females present on site and the observed number of spawning rushes were significantly higher during the waxing gibbous phase compared to other lunar phases (Fig. 4A–B). The number of observed spawning rushes was positively and linearly correlated with the number of females present on site (Fig. 4C), but the average number of spawning rushes per female remained higher during waxing gibbous lunar phases (Fig. 4D). The moon cycle could provide a temporal reference for reproductive aggregates, stimulate oogenesis, and/or maximize larval recruitment, similarly to other fish species. Histological study of ovaries and study of larval recruitment are required to test these hypotheses.
Our observations in G. caeruleus broaden our knowledge of the reproduction of reef species in the Labridae, providing a better understanding of the diversity and evolution of reproductive behaviors within closely related fish species.
1 Introduction
Les Labridae composent une famille d’acanthomorphes présentant l’un des plus larges éventails de particularités liées à la reproduction. Cette diversité inclut notamment le dimorphisme et le dichromatisme sexuels, la gonochorie et l’hermaphrodisme successif protogyne ou protandre, la monogamie facultative et l’existence de harems, la diandrie, les possibilités d’hybridation [1–5]. Cependant, la connaissance de leurs comportements reproducteurs est encore largement incomplète. À ce jour, 70 genres et 504 espèces sont connues [6], mais la diversité taxonomique de la famille fait débat. Notamment, une récente étude phylogénétique conclut que les Scaridae devraient être considérés comme une sous-famille (Scarinae) des Labridae, puisque les résultats moléculaires présentent les Scaridae comme un groupe monophylétique inclus dans le groupe des Labridae [7]. Les Labridae comporteraient alors 80 genres et 603 espèces. Toutefois, ces conclusions ne sont pas en accord avec les phylogénies basées sur des critères morphologiques [6,8–10].
D’un point de vue écologique, la grande diversité d’habitats et de comportements observée chez les espèces de Labridae étudiées en détail suggère que chaque espèce pourrait avoir adapté sa stratégie reproductrice aux caractéristiques de l’environnement qu’elle occupe. La disponibilité de la nourriture, la densité des individus, celle des prédateurs, le ratio mâles/femelles, la durée du développement larvaire et la prédation sur les larves ainsi que les courants de marées sont quelques-uns des facteurs pouvant influencer le comportement reproducteur d’une espèce pour s’adapter à un environnement.
Le genre Gomphosus appartient à cette famille et comporte deux espèces : G. varius Lacépède, 1801 et G. caeruleus Lacépède, 1801. G. varius est présent dans l’océan Pacifique ouest et centre et à l’est de l’océan Indien, tandis que G. caeruleus est présent en mer Rouge et dans l’océan Indien. Les deux espèces se rencontrent dans la zone de suture des deux océans (mer d’Andaman et ouest de l’Indonésie) [11]. Bernardi et al. [12] suggèrent l’inclusion du genre Gomphosus dans le genre Thalassoma, les deux espèces du premier formant un clade inclus dans un groupe monophylétique plus large comprenant toutes les espèces du second. Toutefois, Parenti et Randall [6] estiment que ces auteurs ne concluent pas pour autant que le genre Gomphosus est invalide. Les deux espèces du genre Gomphosus sont étroitement apparentées [12]. Il existe chez l’une et l’autre un dimorphisme sexuel et un dichromatisme permanent, ainsi qu’une livrée spécifique du juvénile. Le mode de reproduction n’est, à notre connaissance, pas documenté chez G. caeruleus, et il ne l’est chez G. varius qu’à travers les observations de Colin & Bell [13] et celles de changement de sexe et de réversibilité de ces changements en captivité [14]. L’étude des comportements reproducteurs chez G. caeruleus apporterait donc de nouvelles connaissances sur la reproduction des labres oiseaux et plus généralement des Labridae et des espèces récifales, et permettrait d’appréhender la diversité et l’évolution des comportements de reproduction au sein d’espèces proches.
Le labre-oiseau G. caeruleus est présent toute l’année sur les récifs coralliens de l’île de la Réunion (océan Indien). Un groupe d’une quarantaine d’individus a pu être suivi dans l’un de ces récifs pendant dix mois, avec pour objectif d’observer et de décrire le comportement reproducteur de l’espèce sur ce site et de tester les hypothèses suivantes :
- • G. caeruleus, comme de nombreux autres Labridae, est une espèce hermaphrodite protogyne ;
- • la reproduction de G. caeruleus, comme celle d’autres espèces récifales, est influencée par des facteurs environnementaux, et ;
- • G. caeruleus développe des comportements sociaux conduisant à une stratégie de reproduction similaire à celles observées chez d’autres espèces de Labridae.
2 Matériel et méthodes
Les observations ont eu lieu dans la dépression d’arrière-récif de L’Ermitage, dans l’île de La Réunion (21°07'S, 55°32’E) (Fig. 1A–C). Cette île volcanique de l’archipel des Mascareignes est géologiquement jeune (environ 2 Ma [15,16]). Ses formations coralliennes datent d’environ 8500 ans [17] et sont de type frangeant. Le récif de L’Ermitage, situé sur la côte ouest de l’île, fait moins de 8 km de linéaire côtier, sa largeur maximale est de 500 m et sa profondeur maximale inférieure à 2 m à marée haute. L’ensemble du récif de L’Ermitage se situe dans le périmètre d’une aire marine protégée (AMP) nommée « réserve naturelle marine de La Réunion » (Fig. 1B). Les observations ont été faites sur un site placé en zone de protection de niveau 2A (zone de protection renforcée) proche de l’agglomération de La Saline les Bains (21°05’ 31,9” S, 55° 13’ 54,9”E).

Le site d’étude à la Réunion. A. Situation de l’île de la Réunion dans l’Ouest de l’océan Indien. Image satellite Géoportail. B. Localisation des récifs coralliens de la Réunion (pointillé rouge), du récif frangeant de L’Ermitage (pointillé vert) et du périmètre de la réserve naturelle marine (ligne bleue). C. Vue aérienne de l’ensemble de massifs territorialisé par le groupe étudié, et répartition des territoires T1, T2 et T3. Photo prise par Stella Dubernet-Kélonia. D. Représentation schématique de la répartition des territoires, des surfaces occupées par les espèces coralliennes et des types de substrat : petits points : zone à dominante sablo-détritique, lignes continues : zone à dominante d’Acropora muricata, larges points : zone à dominante de Porites cylindrica, lignes discontinues : plateau de coraux nécrosés arasés. La surface délimitée par des pointillés est celle de la zone foyer de T1, celle qui est délimitée par des tirets est celle où ont eu lieu le plus grand nombre d’ascensions durant la seconde série d’observations. E. Zone foyer de T1, délimitée par trois gros massifs de Porites lutea, vue du massif au-dessus duquel a eu lieu le plus grand nombre d’ascensions. F. Zone de reproduction de T2, exclusivement peuplée de Porites cylindrica. Masquer
Le site d’étude à la Réunion. A. Situation de l’île de la Réunion dans l’Ouest de l’océan Indien. Image satellite Géoportail. B. Localisation des récifs coralliens de la Réunion (pointillé rouge), du récif frangeant de L’Ermitage (pointillé vert) et du périmètre ... Lire la suite
Après des observations préliminaires d’accouplements en septembre 2012 sur le site, deux séries d’observations distinctes ont eu lieu. La première, centrée sur les individus, la territorialité, les comportements reproducteurs et la cyclicité de la reproduction, s’est déroulée entre le 27 octobre 2012 et le 30 janvier 2013, à raison de deux passages par semaine en moyenne sur le site. Elle a donné lieu à 31 jours de suivi (dont 26 en matinée et cinq l’après-midi) et à 91 heures d’observation. La seconde, destinée à étudier la saisonnalité de la reproduction et d’éventuelles variations dans la stratégie reproductrice adoptée, a duré du 10 avril 2013 au 1er décembre 2013, à raison d’un passage par semaine en moyenne sur le site. Elle a totalisé 38 jours de suivi (tous en matinée) et 86 heures d’observation. Toutes les observations ont été faites en randonnée palmée par le deuxième auteur (PB) et généralement accompagné par un second observateur entraîné. La grande majorité d’entre elles a eu lieu entre 9 h et 14 h pendant les deux périodes. Les informations détaillées concernant les dates, les horaires, les marées, les phases de lune et les observations ponctuelles liées à la reproduction sont rapportées dans le matériel supplémentaire (Tableau S1). Les horaires des marées utilisés ont été prédits par le SHOM (service hydrographique et océanographique de la Marine. Tide prediction website : http://www.shom.fr, France) pour la station la plus proche à la Pointe des Galets, qui peut néanmoins avoir un décalage d’onde d’environ cinq à vingt minutes avec le récif de L’Ermitage.
La profondeur moyenne du site d’observation est d’environ 1,20 mètre. Cinq mâles (Fig. 2F) et une vingtaine de femelles (Fig. 2C) ont été observés sur l’ensemble du site durant le premier suivi. Les observations se déroulant en zone de protection renforcée dans le périmètre d’une AMP, aucun spécimen n’a été prélevé et aucun individu n’a été capturé ni marqué. Les mâles ont été différenciés in situ grâce à diverses caractéristiques individuelles telles que des amputations partielles des rayons extérieurs de la nageoire caudale (Fig. 2F, Fig. S1A), des blessures sur le pédoncule caudal (Fig. S1B), la présence ou l’absence d’un liseré noir sur tout ou partie des nageoires dorsale et/ou anale (Fig. S1C) et, occasionnellement, des écailles manquantes sur les flancs (Fig. S1D).

Hermaphrodisme protogyne chez le labre oiseau Gomphosus caeruleus. A. Individu au stade juvénile. B. Individu intermédiaire entre le stade juvénile et la phase initiale femelle. C. Individu en phase initiale femelle. D. Individu en début de stade intermédiaire entre phase initiale femelle et phase terminale mâle. E. Individu en fin de stade intermédiaire entre phase initiale femelle et phase terminale mâle. F. Individu en phase terminale mâle. L’échelle sur chaque photographie indique 1 cm.
Des notes ont été prises in situ sur des ardoises sous-marines concernant les individus, le nombre d’accouplements, les déplacements d’individus à l’intérieur des territoires et entre eux et les autres comportements remarquables tels que des agressions entre individus ou des nages conjointes. Des photos prises avec un objectif 60 mm Macro monté sur un boîtier Canon EOS 7D ont permis de confirmer l’identité de chaque mâle par ses caractéristiques externes et, grâce à leurs métadonnées, de relever l’heure précise des accouplements ainsi que la durée des épisodes de reproduction. Des captures vidéo faites avec un Canon PowerShot G15 ont aussi permis de préciser le déroulement des comportements trop rapides pour l’œil. Cependant, l’eau étant constamment plus ou moins turbide sur le site du fait d’un courant de dérive littorale présent quelle que soit la phase de la marée, il n’a pas toujours été possible de distinguer les accouplements s’achevant par une émission de gamètes des simulacres restés improductifs (pseudospawning). Le terme d’« ascension » est donc employé dans cet article pour décrire un acte de reproduction conduisant ou non à une émission de gamètes (matériel supplémentaire, vidéo S1).
Les différences statistiques entre phases lunaires ont été analysées avec le test non-paramétrique de Mann–Whitney, l’influence du mâle dominant sur le nombre d’ascensions par journée par le test de Kruskal–Wallis, et les coefficients de corrélation par la méthode de Pearson appliquée avec un modèle linéaire de régression. Toutes les analyses statistiques ont été réalisées avec le logiciel R v.3,1.2.
3 Résultats
3.1 Caractéristiques morphologiques des individus observés
L’examen des caractéristiques observables in situ des différents morphes rencontrés et des individus en transition entre eux est requis pour tester l’hypothèse d’un hermaphrodisme protogyne chez G. caeruleus. Sur le site d’étude, 18 mâles et plus de 20 femelles ont pu être observés et photographiés au cours des deux séries d’observation, ainsi que des individus aux livrées intermédiaires entre les phénotypes macroscopiques du juvénile et de la femelle (trois individus) et de la femelle et du mâle (trois individus). De nombreux autres mâles, femelles et individus aux livrées intermédiaires ont été observés et photographiés sur l’ensemble du récif de L’Ermitage entre 2009 et 2016. L’ensemble de ces photographies a été analysé pour préciser les descriptions suivantes. Ces descriptions s’attachent aux principaux caractères déterminant l’évolution des patrons de couleur chez les intermédiaires. Toutes les observations suggèrent un hermaphrodisme successif de type protogyne.
Les femelles labre-oiseau observées mesuraient généralement entre 6 et 15 cm. Leur corps était gris bleuté à brun rouge sur le front et la nuque ainsi que sur les flancs depuis l’arrière des nageoires pectorales jusqu’à la queue (Fig. 2C). La gorge était blanche, et l’abdomen était blanc à jaunâtre. Les écailles, bordées de brun foncé en partie postérieure, formaient des séries de taches sur les flancs. La tête était bicolore, avec le tiers supérieur de la couleur dominante du corps, et les deux tiers inférieurs blancs. Les deux parties étaient séparées par une marque brune à rouge formant un V, qui ornait le museau de la partie antérieure des yeux à la lèvre supérieure. La membrane de la nageoire dorsale était gris brunâtre, avec une bande marginale brun foncé à liseré translucide, et portait une marque noire à liseré rouge orangé entre les quatre premiers rayons. La membrane de la nageoire anale avait une base grisâtre suivie d’une bande jaune striée de brun par les rayons, avec une large bande marginale brun foncé à liseré translucide. La nageoire caudale était brun foncé à noirâtre avec, une bande bleu violacé en partie distale et un liseré translucide plus ou moins large selon l’âge des individus. Elle était arrondie chez les plus petits individus, et tronquée chez les individus plus âgés.
Les mâles étaient uniformément bleu foncé à bleu vert, avec parfois le museau et le pédoncule caudal plus clairs (Fig. 2F). Ils étaient aussi toujours plus grands que les femelles (Fig. 3D) et pouvaient mesurer de 15 à 20 cm. Les nageoires dorsale et anale étaient turquoise translucide, avec une base plus foncée partiellement couverte d’écailles. Les rayons de la nageoire caudale étaient eux aussi turquoise alors que les rayons extérieurs dessinaient une fourche bleu foncé, dont les pointes s’achevaient en filaments chez les individus les plus grands. Les plus jeunes mâles avaient des nageoires impaires jaunes à vert pâle, les nageoires dorsale et/ou anale présentant souvent un fin liseré noir (Fig. S1C).

La reproduction du labre oiseau Gomphosus caeruleus. A. Cinq femelles se regroupent au-dessus d’un massif peu élevé de Porites cylindrica durant un épisode de reproduction. La position oblique des femelles nos 3 et 4 indique au mâle leur disponibilité à l’accouplement. B. Aucun changement manifeste de livrée n’a été observé durant les épisodes de reproduction dans les deux sexes, mais la marque en V sur le museau de certaines femelles devenait alors rouge vif (vs brune à brun rouge). C. Un mâle se présente devant une femelle en position oblique tête en bas, l’angle par rapport à l’horizontale étant d’environ 70°, les nageoires impaires déployées. Ce comportement était parfois développé en préliminaire de la cour proprement dite, mais n’était pas constant. D. Début d’une ascension. Le mâle est placé au-dessus de la femelle, dont le museau précède de peu le sien. E. Apex d’une ascension. Mâle et femelle virent chacun de leur côté, l’émission des gamètes se produisant durant cette manœuvre. F. Émission de gamètes. L’étoile indique la présence d’ovocytes. L’échelle sur chaque photographie indique 5 cm. Masquer
La reproduction du labre oiseau Gomphosus caeruleus. A. Cinq femelles se regroupent au-dessus d’un massif peu élevé de Porites cylindrica durant un épisode de reproduction. La position oblique des femelles nos 3 et 4 indique au mâle leur disponibilité à l’accouplement. ... Lire la suite
La taille des juvéniles était généralement inférieure à 3 cm. La partie antérieure du corps était brune au-dessus d’une ligne horizontale passant par l’œil, et blanche en dessous, alors que la partie postérieure du corps était vert lime (Fig. 2A). Toutes les nageoires étaient translucides, mais la dorsale portait, comme celle des femelles, une tache noire à bord supérieur rouge entre ses quatre premiers rayons. Le museau était pointu, mais pas tubiforme comme celui des adultes, et une marque noire à brun foncé en forme de V était discernable au-dessus de la bouche. Des points et tirets blancs se trouvaient au-dessus des yeux et dans l’axe médian de la nuque.
Outre des juvéniles, certains individus possédant des caractères morphologiques externes intermédiaires entre le juvénile et la femelle (Fig. 2B) et entre la femelle et le mâle (Fig. 2D–E) ont été observés sur le site de l’étude.
Les individus intermédiaires de petite taille (Fig. 3B), de 3 à 6 cm environ, possédaient des caractères présents chez les juvéniles (Fig. 3A) et chez les femelles (Fig. 3C) en proportion variable selon leur taille, les plus grands ayant l’aspect d’une très jeune femelle. La transition s’opérait ainsi : la partie supérieure de la tête devenait grisâtre et cette couleur progressait vers la région caudale au détriment du vert lime, les tirets blancs sur la tête disparaissaient au profit de taches brunes et un nombre croissant d’écailles dans la partie brune du dos portait une bordure postérieure foncée. Le museau s’allongeait peu à peu et la marque noire à brun foncé en forme de V sur celui-ci passait au brun rouge chez les plus grands. Les nageoires dorsale et anale étaient grisées à l’emplacement des motifs présents sur celles des femelles.
Certains individus intermédiaires de plus grande taille (Fig. 2D–E), de 12 à 15 cm, présentaient quant à eux des caractères présents chez les femelles (Fig. 2C) et chez les mâles (Fig. 2F). Certains spécimens étaient devenus uniformément gris bleu foncé mais avaient toujours la bordure postérieure des écailles caractéristique des femelles, cette bordure étant devenue bleu foncé, et comme elles, une marque brun rouge en V sur le museau, qui devenait grisâtre et de moins en moins discernable. De surcroît, les nageoires impaires portaient le même patron de couleur, bien qu’estompé, que celui des femelles, à l’exception de la marque présente entre les quatre premiers rayons (Fig. 2D). Chez des individus intermédiaires de plus grande taille (Fig. 2E), la coloration était vert sombre, alors que les nageoires impaires devenaient jaune clair à verdâtre, tout en conservant des traces résiduelles des couleurs des mêmes nageoires chez les femelles. L’accroissement de taille des individus progressant vers le morphe mâle suggère que le changement sexuel s’opère depuis la femelle vers le mâle, et non depuis le mâle vers la femelle.
Nos observations permettent donc de soutenir l’hypothèse d’un hermaphrodisme successif protogyne chez G. caeruleus, mais seul un examen histologique des gonades chez plusieurs individus aux différentes livrées pourra la confirmer définitivement.
3.2 Utilisation des territoires
3.2.1 Description des territoires
Au début de la première série d’observations, cinq mâles étaient présents et trois d’entre eux délimitaient par leur présence et leurs comportements trois territoires contigus (T1, T2 et T3) sur l’aire de reproduction (Fig. 1C–D). Les deux autres mâles étaient non territoriaux, mais passaient régulièrement sur les trois territoires pour s’y nourrir. La distinction entre mâles territoriaux et non territoriaux a été faite en considérant conjointement les types de déplacement des mâles, leur temps de présence et la continuité de cette présence sur chaque territoire, leurs types d’interaction avec les femelles ainsi que leur activité reproductrice ou son absence.
Le territoire T1 (Fig. 1C–E), situé à environ 10 m du rivage, s’étendait parallèlement à la plage sur un axe sud-est–nord-ouest, sur environ 50 m de long et 13 m de large. Sa surface était d’environ 650 m2. Il a été délimité par le parcours, toujours identique et fait alternativement dans un sens et dans l’autre, du mâle dominant. Ce mâle ne patrouillait pas, mais suivait l’agencement de certains massifs de scléractiniaires, Porites cylindrica (Poritidae), de 30 à 65 cm de hauteur, occupés par les femelles durant les épisodes de reproduction (Fig. 2A). Le territoire était entouré par une population dense d’autres scléractiniaires, Acropora muricata (Acroporidae), d’une hauteur moyenne de 80 cm. Les deux autres territoires n’étaient pas aussi nettement définis, faute de parcours stéréotypé chez les mâles dominants, et étaient nettement plus étendus. Le territoire T2 (Fig. 1C–D), d’environ 2100 m2, était occupé majoritairement par la population d’A. muricata qui bordait T1 et par deux étendues de massifs de P. cylindrica dans sa partie nord-ouest (Fig. 1F). Le territoire T3 (Fig. 1C–D), d’environ 1500 m2, était une zone majoritairement sablo-détritique proche du rivage, incluant une frange de massifs dispersés d’A. muricata bordant un petit plateau de coraux nécrosés. T1 et T2 sont séparés de T3 sur la plus grande partie de leurs frontières par une bande sablo-détritique qui était empruntée par les mâles pour leurs allers-retours d’un territoire à l’autre.
Les trois territoires n’existaient comme tels qu’à l’occasion des épisodes de reproduction. Mâles et femelles y apparaissaient et en disparaissaient régulièrement lors de ces épisodes, à l’exception d’un petit nombre de femelles qui semblaient résidentes. Les mâles étaient généralement présents avant l’arrivée des autres femelles et pouvaient arriver sur leur territoire une à deux heures avant de s’y reproduire. En dehors de cette aire de reproduction les mâles étaient solitaires ou nageaient par paires, et les femelles, rarement isolées, étaient le plus souvent en petits groupes de deux ou trois individus.
3.2.2 Usage des territoires par les mâles
Au début de la première période d’observation, chaque territoire était occupé par un mâle différent, défini comme dominant par son temps de présence, son type de circulation et ses interactions avec les femelles. Aucun des mâles ne patrouillait aux frontières de son territoire. On a constaté, 22 jours plus tard, qu’un unique mâle, le mâle dominant sur T2, était devenu sexuellement actif et dominant sur les trois territoires. Il sera remplacé 44 jours plus tard, le 31 décembre 2012, par un des mâles non territoriaux présents au début de la série d’observation, qui conservera la domination sur les trois territoires. Le mâle dominant sur le territoire unifié l’arpentait de façon aléatoire et ne patrouillait pas non plus, mais il passait une large majorité de son temps sur T1 pour se nourrir ou se reproduire.
Quelle que soit la stratégie de reproduction adoptée, l’aire de reproduction restait neutre tant qu’un mâle dominant n’y était pas sexuellement actif, ainsi que durant ses pauses au cours d’un épisode de reproduction. Durant ces périodes, des mâles, y compris le mâle dominant, ont pu être observés nageant et se nourrissant pacifiquement ensemble, souvent par paire (Fig. S2A). Ce comportement de recherche de nourriture à deux a été fréquemment observé ailleurs dans le même récif chez des mâles étrangers au groupe concerné par l’étude, et n’a donc pas de rapport spécifique avec le regroupement lié à la reproduction. Nous avons pu observer par deux fois pendant ces périodes un mâle terminal et un individu en transition entre phases initiale et terminale nageant ensemble (Fig. S2B), l’un des mâles développant par moments un comportement de cour vis-à-vis de l’individu intermédiaire. Les mâles inactifs disparaissaient toujours peu de temps avant que le mâle dominant ne redevînt sexuellement actif, sans que l’on puisse observer d’interactions agressives avec lui. Les rares cas de présence sur le site de mâles étrangers pendant une phase active d’un épisode de reproduction n’ont conduit qu’à de courtes poursuites de la part du mâle dominant.
Une des caractéristiques du groupe observé est une agressivité quasi inexistante entre les mâles sur l’ensemble des observations. Cependant, les mâles présentaient régulièrement des blessures, le plus souvent superficielles, de même nature et situées en partie postérieure du corps (amputation des pointes de la nageoire caudale, entailles sur le pédoncule caudal [Fig. S1A–B]), ce qui suggère qu’elles pourraient avoir été infligées dans le cadre de poursuites liées à des rivalités territoriales. Des pertes d’écailles sur les flancs et la tête ont aussi été constatées (Fig. S1D). Nous avons, en outre, observé quelques interruptions soudaines d’activité de mâles dominant T1 pour des départs fulgurants en trajectoire rectiligne vers un point éloigné de T2, sans qu’il soit possible d’identifier la cause de ce comportement, du fait de la vitesse du mâle. Ce comportement, qui n’apparaissait pas comme une réaction de fuite (startle response [18]), puisqu’aucun danger immédiat ne semblait menacer ces mâles, paraissait manifestement agressif. Néanmoins, aucun mâle n’a été observé en train de combattre un rival.
3.2.3 Usage des territoires par les femelles
Pendant les épisodes de reproduction du début de la première série d’observations, alors qu’un mâle diffèrent dominait chaque territoire, les femelles visibles sur T1 stationnaient, seules ou en groupe, sur neuf massifs de P. cylindrica isolés les uns des autres (Fig. 3A), alors que d’autres massifs voisins de la même espèce et de taille similaire n’étaient jamais occupés. Les mâles nageaient au-dessus des massifs, y compris les plus hauts A. muricata, alors que les femelles restaient à proximité des massifs les plus bas et nageaient à quelques centimètres du substrat à l’occasion de leurs rares passages d’un massif de P. cylindrica à l’autre. En fin de première série d’observation, lorsqu’un unique mâle dominait les trois territoires, les femelles n’avaient plus de massif privilégié et circulaient fréquemment d’un massif de P. cylindrica à l’autre. Pendant les épisodes de reproduction, ces massifs ont toujours été préférés aux A. muricata, y compris sur T2, où ces derniers sont majoritaires. Il n’y avait que sur T3, présentant la plus faible activité reproductrice et où P. cylindrica n’est représenté que par de petites colonies au ras du substrat, que les ascensions se produisaient à partir des bords de massifs d’A. muricata.
Le nombre de femelles présentes quand un mâle était sexuellement actif sur T1 était très variable et allait de trois à vingt. Les femelles étaient habituellement peu nombreuses, mais tendaient à se rassembler en périodes de lune gibbeuse et à la pleine lune. Le nombre de femelles présentes en phase de lune gibbeuse croissante est significativement plus important qu’au cours des phases de dernier et premier quartier (p = 0,018 et p = 0,025 respectivement, Mann–Whitney) (Fig. 4A), avec une augmentation du nombre moyen de femelles sur site passant de 3,8 en phases de quartiers à 9,4 en phase gibbeuse croissante. Il semblerait donc qu’un faible nombre de femelles résidaient sur les territoires, alors que les autres paraissaient venir d’un périmètre assez étendu autour du site. Deux d’entre elles paraissaient résider sur T1, trois sur T2 et deux sur T3, du fait de leur présence fréquente sur ces territoires en dehors des épisodes de reproduction.
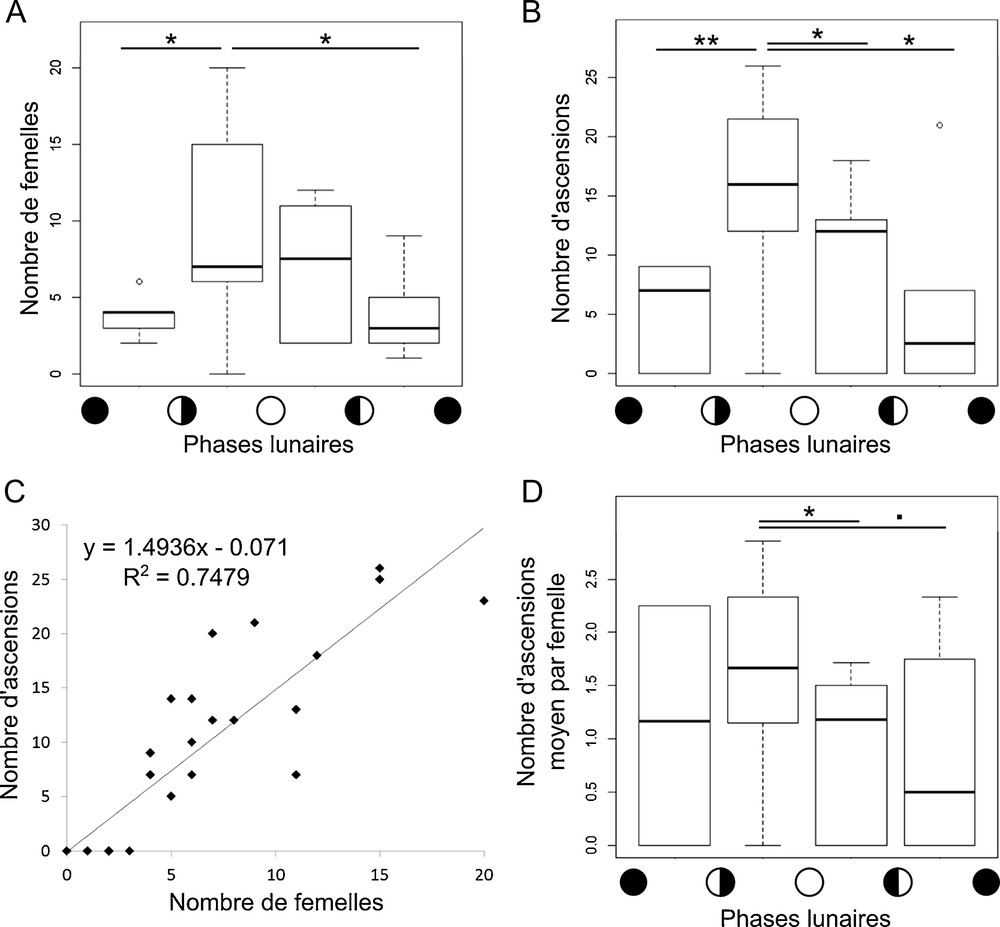
Variations de l’activité reproductrice du labre oiseau Gomphosus caeruleus selon la phase lunaire sur le territoire T1. A. Nombre de femelles présentes sur le territoire T1 selon la phase lunaire. B. Nombre d’ascensions observées sur T1 selon la phase lunaire. C. Corrélation entre le nombre d’ascensions et le nombre de femelles sur T1. D) Nombre d’ascensions moyen par femelle sur T1 selon la phase lunaire. «. », 0,1 > p > 0,05, « * », 0,05 > p > 0,01, « ** », 0,01 > p > 0,001.
Les jours où aucune observation d’ascension n’a eu lieu malgré la présence d’un mâle, les femelles étaient au maximum trois (Tableau S1). Le nombre de femelles par massif était lui aussi changeant, d’une à cinq en général, mais il pouvait aller jusqu’à douze pendant des épisodes de reproduction de forte intensité (Fig. S2C). Contrairement aux mâles, les femelles n’ont jamais été observées en train de se nourrir pendant les épisodes de reproduction. Il n’y avait pas de relation de dominance discernable entre elles, quelle que soit leur taille, et il n’a jamais été observé d’interactions agressives entre femelles. Les blessures visibles étaient par ailleurs très rares chez elles et restaient toujours bénignes.
3.2.4 Utilisation des territoires pour la reproduction
Le mâle résidant sur T3 pendant les épisodes de reproduction était le plus petit des mâles présents, quelle que soit l’évolution de la dominance sur T1 et T2 et la période d’observation. Il semblait inhibé par les mâles dominant successivement T1 pendant la période où les trois territoires étaient effectifs, et par le mâle dominant tout le site ensuite. Sa subordination est aussi avérée par la durée exceptionnelle de sa participation aux regroupements destinés à la reproduction, comparée à celle des autres mâles : ceci a été observé du 27 octobre 2012 au 15 juin 2013, soit pendant plus de huit mois. À l’exception d’une tentative d’interférence (streak spawning, [19]) infructueuse sur son propre territoire, ce mâle n’a jamais été observé sexuellement actif et n’a jamais manifesté d’opposition envers les mâles dominants qui venaient régulièrement s’accoupler sur le sien. Le caractère territorial de T3 et la dominance du mâle présent pendant les épisodes de reproduction sont, de ce fait, particuliers : ce territoire, occupé par un mâle subordonné, n’était un territoire de reproduction que du point de vue des femelles présentes pendant les épisodes d’activité reproductrice, et la dominance de ce mâle n’était observable que du fait de sa présence régulière, de ses interactions sociales et de quelques rares comportements de cour avec les femelles.
Pendant toute la première série d’observations, le nombre de femelles et d’accouplements sur T1 a été supérieur à ceux de T2 et T3, bien que T1 soit le territoire le moins étendu. À la limite nord-ouest de T1, une zone d’environ 30 m2 (soit environ 5 % du territoire, Fig. 1C–D) délimitée par trois gros massifs de Porites lutea (Poritidae) (Fig. 1E) constituait un foyer de concentration de l’activité reproductrice lors des épisodes du début de la première série d’observation, et l’un de ces massifs, le plus proche du rivage, concentrait lui-même l’essentiel de cette activité (Fig. S2C). La densité de femelles et le nombre des accouplements y étaient nettement supérieurs. C’était aussi là que commençaient généralement les épisodes de reproduction sur T1 et que les femelles venues d’autres endroits du territoire se regroupaient lors des épisodes de forte intensité. Durant la seconde phase de la première série d’observations et la domination d’un seul mâle sur les trois territoires, la densité de l’activité reproductrice y a nettement augmenté. À l’inverse, T2 a connu une baisse sensible du nombre des accouplements, et T3 a été le plus souvent complètement désaffecté. La zone foyer de T1 est alors devenue progressivement la zone centrale des épisodes de reproduction, et la densité de femelles ainsi que la fréquence des ascensions diminuaient avec l’éloignement de ce foyer. Sur l’ensemble du suivi, onze matinées n’ont donné lieu à aucune observation d’accouplement.
3.3 Interactions entre mâles et femelles
3.3.1 Les comportements de reproduction
Parmi les épisodes de reproduction observés sur T1, nous avons pu distinguer trois niveaux d’intensité caractérisés par des comportements distincts et par des différences dans la fréquence des ascensions. Aucune variation notable dans le patron de couleurs des deux sexes n’a été observée à l’occasion d’un quelconque comportement lié à la reproduction, quel que soit le niveau d’intensité des épisodes, mais le bleu des plus grands mâles paraissait alors plus intense, et la ligne bordeaux foncé qui relie les yeux au bout de la lèvre supérieure des femelles devenait parfois rouge vif (Fig. 3B).
- • durant les épisodes de faible intensité, survenant quand les femelles étaient en petit nombre (de 2 à 4), le mâle ne semblait pas disposé à la reproduction et circulait de façon aléatoire pour se nourrir. Les femelles quittaient alors leur massif respectif quand le mâle passait près d’elles et suivaient sa trajectoire sur de courtes distances en restant au niveau du substrat. Au cours de ce trajet elles se maintenaient par moments en position oblique (approximativement à 45° par rapport à l’horizontale), nageoires déployées, et parfois hochant la tête de haut en bas, pour signaler leur disposition à l’accouplement. Cette position oblique du corps avec les nageoires déployées est un comportement de reproduction connu chez les femelles de Labridae (par exemple, [20]). Bien qu’il soit arrivé que la réceptivité des femelles suscite une ascension, elles étaient le plus souvent ignorées par le mâle et rejoignaient ensuite rapidement leur massif. Les ascensions consécutives à l’incitation de femelles pouvaient être espacées d’une demi-heure à une heure, ce rythme conduisant à un faible nombre d’accouplements ;
- • durant les épisodes d’intensité moyenne, le mâle visitait rapidement et continuellement chacun des massifs peuplés de femelles. Il commençait par rester un instant en position stationnaire inactive au-dessus de chaque massif (matériel supplémentaire, vidéo S1). Il lui arrivait aussi de se présenter devant une femelle ou de nager avec elle en position oblique tête en bas, l’angle par rapport à l’horizontale étant d’environ 70°, les nageoires impaires déployées (pointing, [21], Fig. 3C). Après un certain nombre de passages en position stationnaire inactive, le mâle commençait à décrire des cercles au-dessus d’une femelle, puis se maintenait en position stationnaire plus près d’elle et agitait sa nageoire caudale de telle sorte que sa membrane dessine des « S », tout en battant très rapidement des nageoires pectorales (matériel supplémentaire, vidéo S1). Ce mouvement des nageoires pectorales pouvait être accompagné d’un tremblement de l’ensemble du corps (quivering, par ex. [21,22] qui peut aussi être observé notamment chez l’espèce sœur G. varius [13]). Cette invitation pressante à l’accouplement pouvait se répéter à l’occasion de deux ou trois passages successifs, parfois davantage, avant que la femelle n’y réagisse. Au troisième passage il arrivait que le mâle, plus agité, décrive un ou deux cercles plus rapides et de faible rayon tout en battant des nageoires pectorales au-dessus de la femelle, qui faisait alors les mêmes cercles quelques centimètres sous lui. Une ascension succédait toujours immédiatement à ce comportement. Le mâle actif simulait parfois, sur les femelles présentes et peu ou pas encore réceptives, des attaques en les poursuivant sur quelques mètres et en les contraignant à se cacher dans les massifs d’A. muricata. Ces femelles en sortaient rapidement, se joignaient à nouveau à leur groupe et finissaient par participer à des ascensions ;
- • les épisodes de forte intensité, qui n’ont été observés que dans la zone foyer de T1, survenaient généralement au cours d’un épisode d’intensité moyenne, et étaient caractérisés par une soudaine agitation du mâle et des femelles. Durant la période de domination d’un mâle par territoire, les femelles, qui habituellement attendaient les passages du mâle, se mettaient alors à passer rapidement d’un massif à l’autre en groupe, en s’arrêtant souvent en position oblique, toutes nageoires déployées, pour l’attirer. Durant la période de domination d’un unique mâle, les femelles circulaient rapidement avec le mâle et l’entraînaient parfois vers le massif de leur choix, avec ou sans succès. Durant les épisodes de forte intensité, le mâle faisait de fulgurantes montées et descentes dans la colonne d’eau. Ces « sauts de signalement » (signal sprung [23], signal jump [24], ou looping [22]) constituent un signal, connu chez de nombreuses espèces. Il est destiné à attirer les femelles sur de longues distances en leur indiquant la présence et la localisation du mâle territorial [25], ainsi qu’à stimuler de façon plus pressante les femelles présentes. Après ce signal, les femelles devenaient en quelques instants plus nombreuses, et toutes étaient réceptives. Ces sauts n’ont été observés que pendant les épisodes de forte intensité, que les mâles déclenchaient parfois. Les ascensions devenaient alors très nombreuses. On pouvait en observer de deux en deux secondes à trois en moins d’une minute avec la même femelle, et successivement trois en huit secondes (matériel supplémentaire, vidéo S1) à une par minute avec des femelles différentes. Les ascensions survenaient aussi plus rapidement, un seul passage du mâle avec un rituel d’invitation à peine esquissé était en général suffisant pour que la femelle accepte l’accouplement. Il arrivait aussi qu’un grand individu dont la livrée était celle d’une femelle se maintienne en position stationnaire au-dessus d’autres femelles et agite ses pectorales en tremblant de tout le corps, nageoires impaires déployées, imitant ainsi la cour du mâle. Ce comportement provoquait parfois une ascension avec une autre femelle. Les seules observations d’ascensions groupant plus d’une femelle ont été faites au cours de tels épisodes. Un autre aspect notable du degré d’excitation du groupe était une nage rapide du mâle dessinant des zigzags de trois à quatre segments d’environ 1,5 m chacun au niveau du substrat. Ces épisodes de forte intensité pouvaient durer de quelques minutes à plus d’une heure. Nos observations n’ont pas permis de déterminer la raison, ni de leur déclenchement, ni de leur arrêt. Nous avons néanmoins observé que les épisodes de forte agitation du mâle semblaient concomitants à un renforcement du courant de vidange régulièrement présent sur le site, qui pouvait entraîner des accélérations fréquentes, soudaines et puissantes des masses d’eau. Toutes les accélérations notables du courant n’ont cependant pas entraîné un épisode de forte intensité, même si chacune semblait provoquer un comportement agité chez les mâles.
Les épisodes de reproduction s’annonçaient par l’apparition soudaine des femelles, qui étaient alors assez rapidement réceptives à la cour du mâle. Elles survenaient généralement toutes en même temps, ou progressivement dans un laps de temps de l’ordre de dix minutes. Quand une femelle était prête à s’accoupler, elle venait se placer sous le mâle stationnaire et le couple s’élevait ensuite très vite vers la surface (matériel supplémentaire, vidéo S1). La trajectoire paraissait plus ou moins oblique selon la phase de marée et s’achevait à 10 cm ou moins de la surface, mais elle n’était jamais verticale du fait de la très faible profondeur du site (les ascensions de G. varius observées par [13] avaient une hauteur de 2 à 4 mètres). Pendant l’ascension, le mâle était placé au-dessus de la femelle, dont le museau précédait de peu le sien (Fig. 3D). L’arrière du corps ou le pédoncule caudal de la femelle se trouvaient souvent entre ses nageoires pelviennes. Mâle et femelle étaient toujours très proches, mais ne se touchaient pas nécessairement. Au sommet de l’ascension, le couple était au contact par les flancs. Le mâle et la femelle se séparaient alors en virant brusquement chacun de leur côté pour redescendre vers le substrat (Fig. 3E). La séparation avait lieu à proximité immédiate de la surface en même temps que la libération des gamètes, qui étaient émis de façon plus ou moins synchrone selon les cas. L’expulsion de la grappe d’œufs, qui n’était pas toujours visible, commençait chez la femelle juste avant la boucle qui clôturait l’ascension et s’achevait juste après (Fig. 3F). Le couple redescendait ensuite verticalement aussi vite qu’il était monté (matériel supplémentaire, vidéo S1). La durée de l’ascension était de l’ordre d’une seconde. Le même couple pouvait faire plusieurs ascensions successives, puis le mâle partait courtiser d’autres femelles sur un autre massif. Il arrivait aussi qu’une femelle stimulée se place sous le mâle stationnaire, puis redescende sans qu’il y ait eu d’ascension du couple, l’insistance du mâle pouvant convaincre la femelle après plusieurs tentatives avortées (matériel supplémentaire, vidéo S1). Contrairement à ce qui a été observé chez G. varius [13], aucun comportement de parade après les accouplements n’a été observé sur le site, en dehors de rares et rapides passages d’un mâle au-dessus d’une femelle qui venait de participer à une ascension.
Ces épisodes d’ascension étaient le plus souvent entrecoupés de pauses du mâle, pendant lesquelles il se nourrissait et ignorait les femelles.
La fin d’un épisode de reproduction se signalait par la disparition rapide des femelles non résidentes. Les épisodes de reproduction pouvaient durer d’une dizaine de minutes à plus de deux heures, sachant que les pauses des mâles pouvaient être fréquentes et durer de quelques minutes à plus d’une heure. Ils ont tous eu lieu en fin de matinée, en se poursuivant parfois en tout début d’après-midi. Le site est resté inactif malgré la présence de femelles, et parfois de mâles, durant les cinq après-midis d’observation consacrées à contrôler l’absence de reproduction en dehors des tranches horaires habituellement constatées. Les épisodes de reproduction pourraient donc suivre un rythme circadien. Au total, 308 ascensions ont été observées pendant la première série d’observations pour une durée cumulée des épisodes de reproduction de 22 heures et 35 minutes, s’étalant sur environ trois mois. En dehors de deux attaques infructueuses de carangues bleues Caranx melampygus (Carangidae) sur des femelles au niveau du substrat, aucune tentative de prédation sur les gamètes, les couples ou les individus n’a été observée pendant les deux séries d’observation.
Parallèlement aux variations du nombre de femelles observées sur le site selon la phase lunaire, nous avons observé une augmentation significative du nombre d’ascensions en phase gibbeuse croissante par rapport aux autres phases lunaires (p = 0,008, p = 0,021, p = 0,016 pour les phases de premier quartier, gibbeuse décroissante et de dernier quartier respectivement, Mann–Whitney) (Fig. 4B), qui peut s’expliquer par la corrélation positive entre le nombre de femelles et le nombre d’ascensions observées (r2 = 0,74 et p = 6e-09, test de corrélation de Pearson) (Fig. 4C). Ceci est en adéquation avec nos observations témoignant de la participation probable de toutes les femelles à des ascensions. De plus, les données recueillies ne permettent pas de montrer une influence du mâle dominant sur le nombre d’ascensions par journée d’observation (p = 0,7154, Kruskal–Wallis). Le nombre d’ascensions par femelle et par journée d’observation tend à être lui aussi supérieur en phase de lune gibbeuse croissante par rapport à la lune gibbeuse décroissante et au dernier quartier (p = 0,043 et p = 0,095 respectivement, Mann–Whitney) (Fig. 4D), suggérant que la période de lune gibbeuse croissante est une période de forte activité reproductrice pour cette espèce à cet endroit.
La seconde série d’observation, du 10 avril 2013 au 1er décembre 2013, a eu pour but d’étudier la saisonnalité de la reproduction de G. caeruleus à partir de la fin de l’été austral. Nous avons observé que G. caeruleus n’a pas cessé de se reproduire durant cette période. Ces observations suggèrent donc que l’espèce se reproduit tout au long de l’année, malgré l’interruption de nos observations entre le 30 janvier et le 10 avril 2013. Plusieurs observations anecdotiques d’accouplements faites en fin de matinée sur le même site, en février et décembre 2013, et en avril, mai et novembre 2015, suggèrent en outre que cette aire de reproduction est pérenne, et que la zone foyer de T1 reste la plus attractive.
3.3.2 Autres types d’interactions
En dehors des épisodes de reproduction, quatre principaux types d’interaction entre mâles et femelles ont été observés sur les territoires. Les trois premiers types d’interaction ne paraissaient pas agressifs et semblaient destinés au renforcement d’un lien social avec les quelques femelles apparemment résidentes. Le quatrième type témoignait, quant à lui, d’une agressivité manifeste.
- • le mâle passait au-dessus d’un massif occupé par une femelle, descendait vers elle et déployait ses nageoires impaires sans stationner au-dessus d’elle, le corps penché sur le côté. Les nageoires dorsale et anale pouvaient être plus ou moins déployées, mais la nageoire caudale l’était toujours au maximum. Le mâle pouvait aussi se contenter de ralentir en passant, le corps penché sur le côté et nageoires déployées (Fig. S2D–E) ;
- • le mâle se cambrait sans cesser de nager en passant au-dessus d’une femelle, le museau et le pédoncule caudal redressés de telle sorte que le dos devînt presque rectiligne, avec ou sans déploiement des nageoires impaires (Fig. S2F–G) ;
- • le mâle voyait une femelle sur un massif et faisait une ou deux descentes décrivant un demi-cercle dans sa direction, le corps penché sur le côté et toutes les nageoires déployées, avant de reprendre sa nage ;
- • le mâle chargeait soudain une femelle, qui se réfugiait entre les branches d’un massif d’A. muricata. Il passait alors jusqu’à une vingtaine de secondes à tourner très rapidement autour du massif et à charger continuellement entre ses branches en y pénétrant profondément. Ces épisodes étaient violents et concernaient des femelles de toute taille. Par deux fois, une agression de ce type menée par deux mâles en même temps sur la même femelle a été observée. Ce type d’interaction pouvait survenir en dehors ou pendant un épisode de reproduction.
3.4 Stratégies de reproduction et alternance
Durant la première période d’observation, la stratégie reproductrice adoptée par ce groupe d’individus a changé. Elle est passée d’une situation où le site était divisé en territoires dominés par des mâles différents, ce qui évoque une stratégie de reproduction de type lek-like, à une situation où un seul mâle dominait l’ensemble du site, ce qui évoque une stratégie de reproduction de type harémique. Durant toute la seconde série d’observations et contrairement à ce qui avait été observé au cours de la première, T3 ne jouait plus aucun rôle, et les enjeux reproducteurs se concentraient uniquement sur T1 et T2. Cette désaffection de T3 pourrait être en relation avec la diminution du nombre de femelles observée en 2013 par rapport à 2012.
L’organisation de type harémique était conservée au profit d’un nouveau mâle lors de la reprise des observations, le 10 avril 2013. Ce mâle est resté dominant sur l’ensemble des territoires pendant plus de quatre mois, jusqu’au 24 août, ce qui suggère un taux de renouvellement faible des mâles actifs dès le début de la saison sèche (mai à octobre). Durant cette période, le nombre moyen des femelles présentes sur T1 était inférieur à ce qu’il était pendant la phase harémique de la première série d’observation (cinq et presque neuf, respectivement). Ce faible taux de renouvellement des mâles et ce faible nombre de femelles sur site suggère que la reproduction de G. caeruleus au cours de l’hiver austral est maintenue, mais réduite.
Cette stratégie de type harémique perdura plus de cinq mois, jusqu’au 21 septembre, date à partir de laquelle une stratégie de type lek-like fut à nouveau observée durant trois semaines, après une longue période de transition. La phase de transition commença le 26 juin, soit peu après le solstice d’hiver. Elle était caractérisée par des changements de comportements chez les femelles, dont certaines résistaient aux tentatives des mâles pour les amener vers la zone foyer de T1 et tentaient de les attirer vers les territoires de leur choix. Entre le solstice d’hiver et l’équinoxe de printemps austral, le 22 septembre, la fréquentation du site lors des épisodes de reproduction augmentait progressivement, et l’on pouvait observer une moyenne de six femelles ainsi que cinq nouveaux mâles réguliers. Les comportements des mâles commencèrent à manifester un délitement de l’organisation de type harémique le 28 août, et le 4 septembre marqua l’apogée de cette désorganisation : quatre mâles et onze femelles se trouvaient sur T1 et T2, les mâles s’accouplant indifféremment sur les deux territoires sans combat entre eux. Les premiers « sauts de signalement » (signal jumps) et le premier épisode de forte intensité depuis le début de la seconde période d’observation furent aussi observés ce jour-là. De surcroît, nous avons observé, pour la première fois, des ascensions réunissant un mâle et deux à quatre femelles, les femelles surnuméraires étant probablement des mâles primaires tentant d’interférer (streakers) (matériel supplémentaire, vidéo S1), et le seul comportement évoquant un affrontement rituel pendant l’ensemble des observations : en l’espace de quelques secondes, deux mâles se placèrent face à face et firent trois voltes, chacun sur sa droite, pour se faire à nouveau face de façon synchrone, les pointes des museaux étant séparées par quelques centimètres, sans chercher à mordre. Cette journée particulière montre que le système des comportements liés à la reproduction chez G. caeruleus n’a probablement pas été complètement développé par la population observée sur ce site à la Réunion. Le 21 septembre, une stratégie de reproduction de type lek-like était stabilisée et caractérisée par un mâle dominant se reproduisant sur T1 pendant qu’un autre mâle dominant se reproduisait sur T2, sans qu’aucun d’eux ne cherche à pénétrer sur le territoire de l’autre. Cette organisation, qui incluait cependant une alternance de la dominance sur T1 et T2 par ces deux mâles, resta inchangée jusqu’au 13 octobre.
À partir du 13 octobre, soit après trois semaines de stratégie de type lek-like, nous avons observé un retour progressif à une organisation de type harémique. La transition était caractérisée par la dominance alternée de deux mâles actifs sur T1, celui qui stationnait sur T2 n’étant pas actif. La stratégie de type harémique fut complètement stabilisée le 2 novembre au profit de l’un de ces deux mâles, et elle fut maintenue jusqu’à la fin des observations, le 1er décembre 2013.
4 Discussion
Notre étude montre que:
- • Gomphosus caeruleus est vraisemblablement une espèce hermaphrodite protogyne diandrique ;
- • la stratégie de reproduction du groupe étudié est dominée par une organisation harémique, mais inclut de courtes périodes de stratégie lek-like ;
- • la particularité de la population étudiée est que la stratégie lek-like n’implique pas de comportements agressifs entre les mâles ;
- • des agressions sévères ont été observées envers certaines femelles, probablement des mâles primaires ;
- • les femelles choisissent le site de reproduction et initient le passage de la stratégie harémique à la stratégie lek-like, tandis que les mâles décident de l’accouplement, choisissent les femelles et initient probablement le passage de la stratégie lek-like à la stratégie harémique ;
- • la stratégie lek-like semble être liée aux variations de la densité de peuplement (augmentation du nombre de femelles, modèle du « hotspot ») et/ou à des changements de saisons ;
- • les accouplements suivent un rythme nycthéméral (du milieu de la matinée jusqu’en début d’après-midi) et sont plus abondants en phase lunaire gibbeuse croissante.
4.1 Mode de reproduction
À notre connaissance, le mode de reproduction de G. caeruleus reste jusqu’à présent non documenté. Notre suivi a permis d’observer régulièrement chez G. caeruleus des individus présentant des caractéristiques progressant de la morphologie et de la livrée des juvéniles à celles des femelles, aucun d’entre eux n’évoluant vers les caractéristiques des mâles, et des individus présentant des caractéristiques progressant de la morphologie et de la livrée des femelles vers celles des mâles. Ces caractéristiques étaient le plus souvent liées à des différences de taille intermédiaires entre les moyennes de taille des juvéniles et des femelles, et entre celle des femelles et celle des mâles. Ces observations ont été confirmées par l’examen de nombreuses photos montrant que ces transitions sont graduelles et répétées à l’identique chez tous les individus concernés. Ces données suggèrent un hermaphrodisme successif de type protogyne chez cette espèce, les femelles représentant une phase initiale et les mâles une phase terminale. Cet hermaphrodisme protogyne peut identiquement être supposé chez l’espèce-sœur G. varius si l’on se réfère aux observations de changements de sexe et de réversibilité de ces changements qui ont été faites en captivité à l’aquarium de Nouméa [14].
La diandrie est par ailleurs fréquente chez les Labridae et les Scaridae [26], et trois types d’observations suggèrent que l’hermaphrodisme protogyne chez G. caeruleus pourrait aussi être diandrique. Ces observations portent sur :
- • la violence réelle et parfois collective développée par les mâles contre certaines femelles, qui pourraient donc être des mâles primaires ;
- • la présence probable de ces mâles primaires lors des ascensions groupant plusieurs individus arborant la livrée des femelles et tentant donc d’interférer ;
- • les comportements de cour caractéristiques du mâle terminal développés par un individu portant la livrée des femelles au-dessus d’autres femelles.
Ce comportement est documenté chez une autre espèce de labre : chez Halichoeres poecilopterus, les mâles primaires peuvent développer les comportements sexuels des mâles terminaux dans des interactions avec des individus conspécifiques de plus petite taille qu’eux, quel que soit leur sexe [26]. Nous avons par ailleurs observé que des ascensions succédaient parfois à cette cour, sans qu’il soit possible de voir si une émission de gamètes avait lieu à leur apex. Certains individus en transition de la phase initiale à la phase terminale pourraient donc eux aussi être des mâles primaires, sans qu’il soit possible de les distinguer des femelles changeant de sexe. Cependant, l’hermaphrodisme successif et l’éventuelle diandrie chez cette espèce restent à démontrer à travers un examen histotologique des gonades.
4.2 Facteurs environnementaux influençant la reproduction
Colin et Bell [13] observent que les accouplements chez G. varius commencent environ une heure après le lever du soleil et durent jusque peu avant son coucher, alors que, dans le groupe observé de G. caeruleus, les accouplements se déroulent uniquement du milieu de la matinée au début de l’après-midi, ce qui est aussi observé par exemple chez l’espèce proche Thalassoma bifasciatum [19]. Colin et Bell [13] notent aussi que G. varius se reproduit invariablement après la marée haute, alors que les accouplements observés chez G. caeruleus ont eu lieu quelle que soit la phase de la marée (Tableau S1). Ces différences nettes entre les périodes journalières de reproduction chez G. varius et G. caeruleus peuvent être spécifiques à chaque espèce ou peuvent aussi être spécifiques à la population présente sur le site d’étude, étant donné le courant toujours sortant que l’on y trouve [27].
Nos données démontrent que les ascensions, et donc probablement les évènements reproductifs, étaient plus abondants durant les phases lunaires gibbeuses croissantes. L’effet du cycle lunaire sur la reproduction des poissons récifaux est bien connu de par son influence sur les cycles oogénétiques et sur les périodes de ponte [28–31], qui, dans certains cas, ont été mises en relation avec le succès du recrutement des larves selon la phase lunaire [32,33]. Nos données suggèrent que la reproduction chez G. caeruleus pourrait aussi être influencée par la phase lunaire, qui offrirait un repère temporel pour des agrégats reproducteurs, stimulerait la maturation d’ovocytes, et maximiserait le succès du recrutement. Un suivi histologique des ovaires et du recrutement au cours d’un cycle lunaire est nécessaire pour confirmer ou invalider ces différentes hypothèses.
Au cours de plus de dix mois d’observation, nous avons pu constater que la stratégie de reproduction la plus durable était harémique. Cependant, en septembre–octobre 2013, nous avons observé une période de retour à une stratégie où le site était divisé en territoires dominés par des mâles différents, stratégie similaire à celle qui avait été observée en octobre–novembre 2012. Cette transition pourrait être influencée par l’alternance de l’été et de l’hiver austraux, mais un suivi sur une durée plus longue serait nécessaire pour confirmer cette hypothèse. Le changement de comportement des femelles, immédiatement postérieur au solstice d’hiver, et le retour à une stratégie impliquant plusieurs mâles dominant chacun un territoire la veille de l’équinoxe de printemps suggèrent, de surcroît, l’influence des variations saisonnières de la photopériode sur la reproduction de cette espèce.
4.3 Les stratégies reproductrices : alternance des stratégies lek-like et harémique
4.3.1 Une stratégie reproductrice lek-like sans combats entre les mâles
Une aire de parade sans combats. Chez l’espèce sœur G. varius, Colin et Bell [13] écrivent que la stratégie reproductrice paraît être lek-like, mais que leurs données sont insuffisantes pour acquérir une certitude sur ce point. Le lek, usuellement traduit par « aire de parade », est un système de reproduction connu chez certains mammifères, reptiles, amphibiens, oiseaux ou insectes, consistant en un rassemblement temporaire de mâles concurrents sur des territoires proches destinés uniquement à la reproduction. L’expression lek-like [21], appliquée aux poissons, vient du fait que seuls certains aspects de la stratégie de lek sont développés par certaines espèces. Chez les poissons, le nombre et la configuration des territoires ne sont pas des critères discriminants, puisqu’il en a été dénombré 23 à distribution plus ou moins concentrique sur l’un des sites étudiés par Moyer et Yogo [21] chez H. melanochir, et cinq à distribution linéaire discontinue chez Cheilinus undulatus [34]. Les deux configurations spatiales particulières que nous avons observées (trois territoires de reproduction contigus, dont le troisième est occupé par un mâle sexuellement inactif, puis deux territoires) peuvent donc être considérées comme des formulations originales de la stratégie lek-like chez les Labridae, puisque cette stratégie est basée sur la compétition en vue d’une sélection et que son efficacité suppose le plus grand nombre possible de compétiteurs.
Gladstone [35] synthétise les caractéristiques communes aux comportements de type lek-like dans certaines familles (Acanthuridae, Callionymidae, Labridae, Pomacentridae, Scaridae, Synodontidae) telles qu’elles ont été établies par ses prédécesseurs [21,25,36,37] :
- • une migration vers un territoire spécifiquement destiné à la reproduction ;
- • une fidélité des acteurs au site à travers le temps ;
- • un dimorphisme et un dichromatisme sexuels ;
- • des succès reproducteurs variables selon les mâles ;
- • une période d’activité sexuelle limitée dans la journée ;
- • des agressions ritualisées entre les mâles, et ;
- • des soins parentaux, quand il y en a, dispensés exclusivement par le mâle.
Les cinq premiers critères ont été réunis par Gomphosus caeruleus sur le site d’observation, et le septième ne peut pas l’être, puisque les œufs sont pélagiques. C’est donc l’absence du sixième critère, concernant les agressions ritualisées entre mâles, qui rend le système lek-like de G. caeruleus atypique. L’absence d’affrontements manifestes durant les épisodes de reproduction est en effet remarquable étant donné la contiguïté des territoires, qui aurait dû provoquer des combats rituels à leurs frontières, et l’existence d’un territoire central au succès reproducteur plus important, qui aurait dû engendrer une rivalité et des combats réels entre les mâles. Ce rapport inverse entre la taille du territoire et le nombre de femelles ainsi que son influence sur le nombre d’accouplements et l’agressivité des mâles ont déjà été observés chez un autre labridé, Halichoeres melanochir [21]. Chez G. varius, Colin et Bell [13] notent que les agressions entre mâles sont communes durant les périodes de reproduction. Nos observations des comportements reproducteurs de G. caeruleus montrent au contraire une surprenante tolérance du mâle dominant un territoire vis-à-vis des autres mâles, y compris avec un prédécesseur ou un futur successeur et lors d’interactions communes avec des femelles, ainsi qu’une agressivité très modérée durant les épisodes de reproduction. Deux données sont cependant notables : les mâles qui deviendront dominants sur T1 étaient toujours vus en compagnie du mâle sexuellement actif avant son éviction, et les mâles ayant perdu la dominance n’étaient que rarement et pour très peu de temps présents sur le site immédiatement après, période pendant laquelle ils entretenaient des relations apparemment pacifiques avec le nouveau mâle dominant. Le fait que les autres mâles disparaissaient toujours quelques instants avant que le mâle dominant ne redevienne sexuellement actif, sans interaction agressive avec lui, représente un autre aspect de l’originalité du système lek-like mis en place par G. caeruleus sur ce site. Colin [34] observe aussi chez un autre Labridae, le Napoléon Cheilinus undulatus, un système lek-like sans agressivité réelle entre les mâles et il réfère cette particularité à une hiérarchie stable. Toutefois, dans le cas de C. undulatus, cette hiérarchie concerne des mâles de tailles différentes présents sur les mêmes sites d’agrégation, ce qui peut expliquer la stabilité de la hiérarchie, et ces sites ne sont pas limitrophes comme le sont les territoires du groupe de G. caeruleus observé, ce qui exclut des rivalités territoriales directes.
Comme Clavijo [38] le suggère au sujet du perroquet royal Scarus vetula (Scaridae), l’hypothèse de combats pour la domination du territoire ayant lieu au lever du soleil ne peut pas être exclue. Cette hypothèse, appliquée au groupe observé, expliquerait les blessures identiques et récurrentes de certains mâles qui auraient tenté de conquérir un territoire avant un épisode de reproduction. Elle expliquerait aussi le fait que le mâle présent sur T3, dont la subordination est restée inchangée au cours des deux séries d’observations et qui n’a jamais été observé tentant de dominer un autre territoire, ait pu fréquenter le site pendant plus de huit mois et n’ait jamais été blessé. L’hypothèse que les blessures observées aient été infligées par des individus d’une autre espèce n’est cependant pas exclue.
Cause possible de la tolérance des mâles entre eux. La cause de cette tolérance des mâles entre eux (identique dans les deux types de stratégie) pourrait venir d’un système de comportements étranger au regroupement lié à la reproduction. Nous avons observé une tendance récurrente des mâles dominants à nager et à se nourrir par paires sur le site, y compris pendant les pauses des épisodes de reproduction. D’autres mâles faisaient de même ailleurs dans le même récif, en dehors de toute activité reproductrice. Ce comportement pourrait être le signe d’un système d’interactions sociales permanent entre mâles, inattendu chez une espèce où ils sont le plus souvent solitaires. Ce comportement de recherche de nourriture par paires est connu pour susciter, dans un cadre expérimental au moins, des hiérarchies entre « meneurs » (leaders) et « suiveurs » (followers) [39–42]. Cette hiérarchie est fondée sur le fait que, les deux individus étant au repos et en sécurité, le comportement de recherche de nourriture de l’un, qui implique un risque de prédation, entraîne l’autre à faire de même [40]. Ces hiérarchies peuvent être la conséquence de différences de tempérament entre les individus (« audace », boldness, ou à l’inverse, « timidité », shyness, ces deux traits de tempérament étant respectivement considérés comme la propension à prendre ou à éviter des risques [41]). D’autres études ont montré que ces rôles étaient interchangeables en fonction notamment des besoins énergétiques propres à chaque individu, et que cette réversibilité des rôles permettait à l’un et l’autre individu de gagner ou de perdre temporairement de l’influence sur son partenaire [42]. La relation entre commandement (leadership) et dominance n’est ni bien comprise, ni systématique : elle est avérée chez certaines espèces (par ex. [43,44]) et n’existe pas dans d’autres [45]. Cependant, ces données permettent de supposer que l’absence d’agressivité réelle des mâles dominants vis-à-vis des autres mâles chez G. caeruleus sur le site de reproduction étudié peut être la conséquence d’interactions sociales régulières à l’occasion de la recherche commune de nourriture. Ces interactions manifesteraient une tendance des individus à la coopération et une accoutumance à la réversibilité pacifique des statuts sociaux. Ward et Hart [46] montrent en effet que la « familiarité » (familiarity) acquise à travers de telles interactions réduit l’agressivité intraspécifique.
Agressivité envers les femelles. Contrairement à leurs interactions pacifiques entre eux, les mâles témoignaient d’une agressivité réelle vis-à-vis de certaines femelles. Cette agressivité prenait deux formes différentes. La première, très violente, correspond au type d’interaction 4 présenté dans les résultats, ce type d’agression pouvant être mené par deux mâles simultanément ; la seconde, beaucoup moins violente, consistait en charges plus ou moins simulées contre des femelles insuffisamment réceptives lors des épisodes de reproduction. À supposer l’espèce hermaphrodite protogyne et diandrique et comme nous l’avons suggéré, certains des individus agressés dans le cadre du type d’interaction 4 pourraient être en réalité des mâles primaires. La tolérance des mâles terminaux entre eux est en effet susceptible de cesser quand il s’agit d’un mâle primaire, concurrent difficilement identifiable dans la compétition pour le succès reproducteur. Par ailleurs, aucun individu en phase initiale n’a été observé quittant le territoire quand le mâle dominant redevenait sexuellement actif, comme le faisaient les autres mâles terminaux. Cela suggère que les mâles primaires, s’il y en avait, pouvaient y rester dans un objectif de compétition sexuelle « déloyale » (streaking), ce qui expliquerait l’agressivité spectaculaire des mâles terminaux à leur égard. Les observations de mâles terminaux nageant avec un individu en transition entre phases initiale et terminale, et celle d’un de ces mâles développant par moments un comportement de cour vis-à-vis de l’individu intermédiaire, concerneraient donc probablement des femelles changeant de sexe. Il paraît peu probable que cette agressivité ait été liée à un contrôle social du changement de sexe, dans la mesure notamment où les plus petites femelles pouvaient être agressées de la même manière que les plus grandes, seules susceptibles de changer de sexe dans un court laps de temps. Cela semble donc exclure aussi l’hypothèse qu’il s’agissait de femelles réticentes à l’accouplement du fait de la possibilité prochaine d’un changement de sexe, comme cela a été observé chez Halichoeres melanochir [21], puisque ces auteurs ne mentionnent cette agressivité qu’envers les femelles approchant la taille des mâles.
4.3.2 Une stratégie harémique au territoire réduit
Le passage d’une stratégie de type lek-like à une stratégie de type harémique a profondément remanié la structure territoriale de l’aire de reproduction. La surface susceptible d’être considérée comme territoriale du fait du regroupement des femelles à l’occasion des épisodes de reproduction a drastiquement diminué durant les phases harémiques. Elle s’est concentrée autour de la zone foyer de T1, en intégrant quelques mètres carrés de T2 sur la zone frontalière, bien que les mâles harémiques aient continué à arpenter l’ensemble des deux territoires, et parfois T3, avant ces épisodes ou pendant leurs pauses. Les usages territoriaux de T1 par les femelles ont eux aussi changé : les femelles qui stationnaient auprès de massifs toujours identiques en attendant le mâle en situation lek-like circulaient de façon apparemment aléatoire et sollicitaient activement les mâles en situation harémique. Le seul point commun entre les deux structures territoriales était la permanence de la zone foyer de T1, qui restait le lieu du plus grand nombre d’ascensions, et donc de la principale activité reproductrice. Du point de vue de l’évolution du nombre des territoires, il faut noter que le retour à la stratégie lek-like en septembre–octobre 2013 n’a concerné que deux territoires (T1 et T2) au lieu des trois observés en octobre–novembre 2012.
4.4 Le contrôle de la reproduction
4.4.1 Rôle des femelles
Il est probable que la densité relativement élevée des femelles sur toute la zone aux abords du créneau horaire de reproduction ait été ce qui motivait le regroupement des mâles. Si les femelles ne choisissent pas les mâles présents sur les territoires, il se pourrait donc qu’elles choisissent le site de reproduction, comme Shibuno et al. [20] le suggèrent pour la girelle arc-en-ciel Halichoeres marginatus (Labridae), et comme le démontre Warner [47] pour la girelle à tête bleue Thalassoma bifasciatum (Labridae). Il se pourrait aussi que certaines femelles se soient rassemblées en amont du segment de la dépression d’arrière-récif concerné, Warner [48] ayant montré que T. bifasciatum pouvait parcourir plus de 1,5 km pour rejoindre un site de reproduction. La pérennité du site d’étude comme aire de reproduction tient donc vraisemblablement à la fidélité des femelles envers lui. Des études ont en effet montré que les femelles revenaient sur le même territoire et ne s’accouplaient qu’avec le mâle dominant, quelles que soient ses qualités (par exemple, [47,49]).
4.4.2 Rôle des mâles
Chez l’unique autre espèce du genre, G. varius, Colin et Bell [13] notent que ce sont les mâles qui se positionnent sur un massif, et que les femelles viennent les y retrouver quand elles sont prêtes à s’accoupler. Chez G. varius, les femelles choisissent donc le mâle avec lequel elles vont se reproduire et le moment de la reproduction. L’inverse a été observé à la Réunion chez G. caeruleus : ce sont toujours les mâles, que les femelles soient mobiles ou pas selon le type de stratégie de reproduction adopté, qui décidaient de l’accouplement et du choix de la femelle. De plus, si les femelles n’étaient pas réceptives à sa cour, le mâle devenait insistant et provoquait l’ascension. L’insistance des mâles peut être à l’origine des ascensions multiples observées pour certaines femelles, notamment lors d’épisodes de forte intensité. Ces ascensions multiples suggèrent qu’un certain nombre d’ascensions improductives (pseudo-spawning) était nécessaire pour stimuler l’expulsion d’ovocytes par la femelle. Les femelles d’autres espèces de Labridae telles que H. marginatus [20], Cheilinus undulatus [34] et T. bifasciatum [50] ne pondent en effet qu’une fois par jour, rarement deux pour la troisième espèce. Quant aux mâles T. bifasciatum, les plus grands d’entre eux peuvent émettre des gamètes plus de 40 fois par jour [19]. Par conséquent, chez G. caeruleus sur ce site d’étude, il semblerait que les femelles ne choisissent pas les mâles, mais que ce soit les mâles qui déterminent l’opportunité, le nombre et le rythme des accouplements, qu’ils soient féconds ou non.
Les raisons de la succession apparemment pacifique des mâles dominant T1 restent obscures. Dans leur étude sur H. melanochir, Moyer et Yogo [21] observent la disparition inexpliquée du premier mâle dominant sur le territoire central environ un mois après le début de la saison de reproduction, et son remplacement par un nouveau mâle. Ils notent que le mâle disparu n’était pas celui qui obtenait le plus grand succès reproducteur, et que les combats pour ce territoire ont alors été continus et violents entre six mâles. Concernant G. caeruleus sur le site d’observation, l’hypothèse de variations dans le succès reproducteur pour expliquer la disparition du premier mâle et son remplacement par un second plus performant ne peut pas être soutenue, puisque les données recueillies ne mettent pas en évidence une influence du mâle sur le nombre d’ascensions par journée d’observation. Néanmoins, il est possible que le nombre d’accouplements puisse dépendre davantage de la possession du territoire que des qualités reproductrices du mâle, qui sont susceptibles d’évoluer en fonction du territoire, comme cela a été démontré pour une autre espèce de la même famille, le spotty Notolabrus celidotus (sous le synonyme Pseudolabrus celidotus) [49].
4.4.3 Causes possibles de l’alternance des stratégies
La stratégie de type lek-like observée au début de l’étude n’a duré que 22 jours, et a été suivie par plus de huit mois de stratégie de type harémique, à l’issue desquels la stratégie de type lek-like a progressivement été rétablie et finalement stabilisée pendant une nouvelle période de 22 jours, puis remplacée par un retour à l’organisation harémique. Pendant les périodes de transition, mâles et femelles semblaient avoir des intérêts divergents quant au choix de la stratégie adoptée.
La problématique de la reproduction touche différemment les deux sexes, qui ont rarement les même intérêts évolutifs dans ce domaine [51–53]. Du point de vue des critères éco-éthologiques relatifs aux avantages matériels, cette problématique est liée pour chacun au rapport entre coûts et bénéfices liés à la recherche du plus grand succès reproducteur, ou fitness. Dans le cadre de la polygynie, le problème est schématiquement, pour les mâles, celui de la rentabilité d’une monopolisation de plusieurs femelles, autrement dit celui du coût en temps et en énergie de la défense de la ressource (femelles et/ou nourriture, [54]). Pour les femelles, l’enjeu est de trouver un mâle de bonne qualité à moindre coût. La constitution d’une aire de parade (lek) semble pouvoir satisfaire les deux sexes du point de vue considéré. Nos observations à partir du 26 juin et du changement de comportement des femelles présentes sur le site, qui paraissent alors chacune décider de leur territoire dans l’aire de reproduction, semblent indiquer que ce sont elles qui provoquent le passage d’une stratégie de type harémique à une stratégie de type lek-like. En revanche, si l’on considère les efforts des mâles pour maintenir une stratégie harémique pendant la période de reproduction, on peut conjecturer que ce sont les relations de dominance entre eux qui décident du changement inverse.
L’intérêt pour un mâle d’installer une structure harémique quelques heures par jour sur un territoire de lek est vraisemblablement la monopolisation de toutes les femelles sans les coûts élevés de la défense d’un territoire permanent, d’autant que, chez G. caeruleus sur le site d’étude, le coût lié à la défense contre les intrusions de mâles concurrents pendant les épisodes de reproduction semble extrêmement réduit. L’intérêt pour les femelles de susciter une stratégie lek-like sur le territoire d’un mâle harémique est plus ambigu pour ce qui concerne le groupe observé à la Réunion. Trois hypothèses principales, non exclusives [55], tentent de rendre compte des causes de la stratégie « lek » : « préférence des femelles » [56], « hotshot » [57] et « hotspot » [58]. L’hypothèse de la « préférence des femelles » stipule que les femelles gagnent à s’accoupler en leks plutôt que de rechercher des partenaires isolés du fait d’une meilleure protection contre les prédateurs, d’une réduction du coût de la recherche des mâles et d’une possibilité d’évaluer les meilleurs mâles. L’hypothèse de la préférence des femelles ne s’applique pas à la stratégie lek-like de G. caeruleus sur ce site, dans la mesure où le risque de prédation était minimal, et où les femelles ne choisissaient pas les mâles. L’hypothèse du « hotshot » est basée sur l’intérêt des femelles pour un (ou plusieurs) mâle(s) particulièrement attirant(s) (« hotshot male »). Elle prédit que la présence de ces femelles attire à leur tour des mâles moins attirants venus pour tenter de parasiter le succès du ou des premiers et adoptant des comportements de mâles subordonnés. L’hypothèse du « hotshot » ne s’applique pas non plus ici, car les femelles ne choisissaient pas les mâles. L’hypothèse du « hotspot » établit que les mâles se regroupent dans les lieux où la probabilité de rencontrer de nombreuses femelles est la plus grande. Cette dernière hypothèse semble pouvoir être applicable à la population étudiée dans cet article, dans la mesure où sept femelles apparemment résidentes se trouvaient sur le site et un certain nombre d’autres dans les environs.
Toutefois, cela n’explique ni la saisonnalité apparente ni la brève durée des phases lek-like dans le groupe étudié. Ces caractéristiques pourraient dépendre de variations de densité dans cette population. Nous avons, en effet, observé une nette augmentation du nombre de femelles sur le site entre le 28 août 2013 et le 14 septembre 2013, soit à la fin de la période de transition entre la stratégie harémique et la stratégie lek-like, en même temps qu’une augmentation du nombre des mâles. Il se pourrait donc que ce qui motive l’alternance des stratégies soit lié à la densité des individus présents dans l’aire de reproduction, quel que soit leur sexe. Donaldson [59] observe en effet, d’une part, une diversité interspécifique et intraspécifique dans les stratégies de reproduction adoptées par plus de vingt espèces de labres et, d’autre part, un rapport densité-dépendant entre les variations de ces stratégies. Il constate que les comportements lek-like et de reproduction en groupes sont liés à une densité plus forte de mâles et de femelles sur le site, et que les comportements harémiques et de reproduction en couples sont adoptés quand cette densité faiblit (voir aussi [31,60,61]). Clavijo [38] observe en outre que dans les deux stratégies (harémique et lek-like) adoptées par le perroquet périco Scarus vetula sur deux sites différents à Porto-Rico, le lek est saisonnier et de courte durée. Nos observations montrent que les deux périodes de 22 jours pendant lesquelles la stratégie lek-like a été privilégiée se situaient au début de l’été austral. Il est donc probable que les variations de densité dans la population étudiée et l’alternance des stratégies soient en rapport avec les variations saisonnières. Cela expliquerait les changements dans l’attitude des femelles à partir du solstice d’hiver et le délitement final de la structure harémique à l’approche de l’équinoxe de printemps. Bien que l’activité reproductrice du groupe soit annuelle, elle pourrait connaître, comme chez d’autres espèces, des pics de reproduction en début de saison chaude.
5 Conclusions
Les présentes observations permettent de conclure que les individus de l’espèce Gomphosus caeruleus présentent des transitions entre morphes qui suggèrent un hermaphrodisme protogyne, et que la probable présence de mâles primaires suggère qu’il est diandrique. Par ailleurs, elles attestent que l’espèce a un comportement reproducteur de type territorial et que les comportements distincts des deux sexes, couplés avec des facteurs externes tels que le cycle lunaire et probablement le cycle saisonnier, influencent la localisation, la fréquence et l’intensité des épisodes reproductifs. Nos observations ont aussi permis de témoigner de stratégies de reproduction lek-like et harémique originales n’impliquant pas d’agressivité entre les mâles, et de confirmer que deux stratégies de reproduction différentes peuvent être utilisées par la même espèce sur le même site, ces choix stratégiques étant réversibles. Ces observations doivent être validées par des analyses gonadiques histologiques et être confrontées aux résultats d’études sur le comportement de reproduction de cette espèce sur des durées plus longues et dans d’autres parties de sa distribution. Elles enrichissent toutefois notre connaissance, relativement limitée, sur la diversité des comportements reproducteurs connus chez les Labridae et les espèces récifales.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Remerciements
Nous tenons à exprimer nos plus vifs remerciements à J. E. Randall (Bishop Museum, Honolulu, Hawaï, États-Unis) pour les informations transmises au sujet de la documentation sur G. caeruleus dans la littérature, R. Troadec, LGSR (laboratoire GéoSciences Réunion) de l’université de la Réunion, pour les informations sur la courantologie de la dépression d’arrière-récif de L’Ermitage, E. Meunier, vétérinaire aquacole (VétoFish, France), pour son aide dans la confirmation, après cicatrisation, de l’identité de mâles blessés. Nous remercions aussi C. Jean et S. Dubernet (observatoire des tortues marines de la Réunion, Kélonia) pour les photographies aériennes des territoires, L. Massé (RNMR, réserve naturelle marine de la Réunion, Saint-Denis de la Réunion), pour son aide dans la détermination des coraux, et tout particulièrement E. Morcel (Les Sentinelles du Récif, RNMR, la Réunion) pour son assistance régulière sur le terrain. Nous remercions aussi un rapporteur anonyme pour ses commentaires, qui nous ont permis d’améliorer le manuscrit original. Ce projet n’a pas reçu de financements spécifiques de la part d’agences publiques, commerciales, ou d’organisations non gouvernementales.


