1. STING, une protéine centrale de la réponse immunitaire associée aux acides nucléiques cytosoliques
Le système immunitaire inné constitue la première ligne de défense contre les pathogènes. L’une des voies centrales de détection des pathogènes repose sur la reconnaissance de leur contenu en acides nucléiques par des récepteurs intracellulaires. Un large panel de récepteurs impliqués dans le déclenchement de la réponse immunitaire innée a été décrit [1]. Leur interaction avec les acides nucléiques pathologiques mène à l’activation de voies de signalisation qui induisent la production de cytokines inflammatoires. Cette réponse inflammatoire permet de mobiliser les cellules effectrices du système immunitaire adaptatif et constitue donc une étape cruciale dans le déclenchement, le maintien et la coordination de la réponse immunitaire.
Récemment, une voie centrale de détection des acides nucléiques cytosoliques a été décrite (Figure 1). Cette voie reposant sur le récepteur cGAS (cGAMP synthase) et la protéine adaptatrice STING (Stimulator of Interferon Genes), a été initialement identifiée dans les cellules immunes comme étant activée par l’ADN double brin cytosolique, au cours des infections virales ou bactériennes [2]. Le récepteur cGAS est capable de reconnaitre différents types d’acides nucléiques cytosoliques, tels que l’ADN double brin (dsDNA), simple brin (ssDNA) ou encore les hybrides ADN:ARN [3, 4, 5]. La liaison de cGAS aux acides nucléiques cytosoliques induit son activation et sa capacité à synthétiser le 2′3′-cGAMP, un dinucléotide cyclique, à partir d’ATP et de GTP [6]. Ce messager secondaire lie la protéine adaptatrice STING, promouvant l’assemblage d’une plateforme de signalisation où STING sert de site d’ancrage aux différents partenaires nécessaires à l’induction de la réponse inflammatoire. Ces partenaires comprennent notamment la kinase TBK1 (TANK binding kinase 1) et les facteurs de transcriptions IRF3 (interferon regulatory factor 3) et/ou NF-κB (nuclear factor κB) [7, 8].
L’activation de l’axe de signalisation reposant sur cGAS et STING se caractérise par une production d’interférons de type I, ainsi que d’autres cytokines et chimiokines pro-inflammatoires. L’activation de cette voie de signalisation est particulièrement importante dans la réponse aux pathogènes car la production d’interférons de type I mène à l’établissement d’un état antiviral caractérisé par l’expression de gènes de réponse aux interférons.
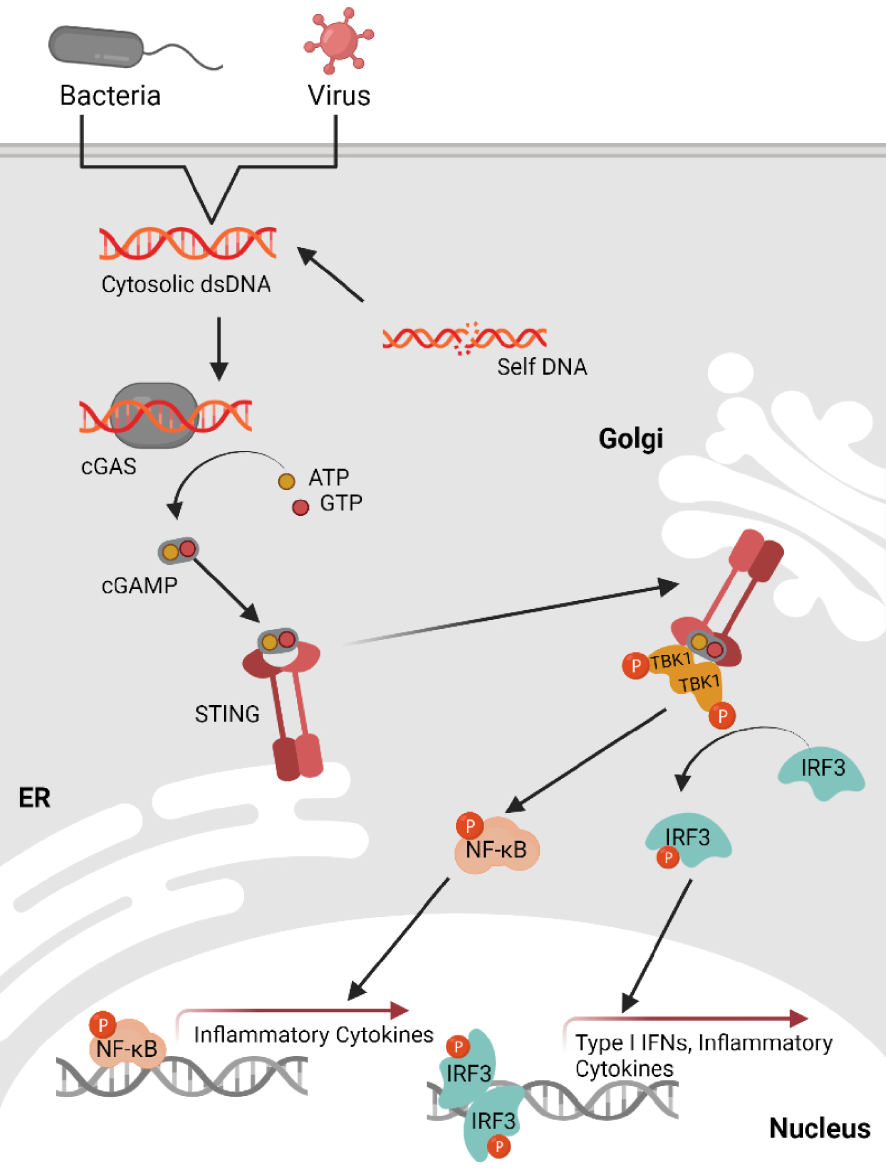
Vue globale de la détection de l'ADN cytosolique via la voie cGAS-STING. La présence d'ADN double brin dans le cytosol peut résulter d'une infection bactérienne ou virale ou d’ADN endogène après un stress cellulaire. La protéine cGAS se lie à l'ADN, ce qui conduit à son activation et à la synthèse du second messager 2,3′-cGAMP à partir d’ATP et de GTP. Le cGAMP se lie à STING, une protéine résidante du réticulum endoplasmique (ER), et cette liaison déclenchera la translocation de STING vers le Golgi. Sur le Golgi, STING se lie et active la kinase TBK1 (par autophosphorylation) ainsi que le facteur de transcription NF-κB via IKK. TBK1 phosphoryle ensuite IRF3 qui après une dimérisation va transloquer dans le noyau pour induire la transcription des IFN de type I et de plusieurs chimiokines inflammatoires. NF-κB quant à lui induit la transcription de cytokines inflammatoires. Créée avec Biorender.
Des travaux récents suggèrent que les protéines cGAS et STING, par-delà leur fonction canonique dans l’immunité innée, sont également impliquées dans divers processus cellulaires tels que l’induction et le maintien de la sénescence ou la régulation de la prolifération cellulaire [9, 10, 11].
2. STING dans le métabolisme des acides gras : un rôle inattendu
En 2022, nos travaux ont permis de mettre à jour un rôle central de STING dans l'homéostasie énergétique et glucidique via la régulation du métabolisme du tissu adipeux [12] (Figure 2). En utilisant un modèle murin délété de STING [13], cette étude dévoile que la protéine STING inhibe l’enzyme FADS2 (Fatty acid desaturase 2) qui est essentielle à la désaturation des acides gras polyinsaturés (AGPI). De ce fait, l'ablation ou la dégradation de STING suite à son activation mènent à une augmentation de l'activité enzymatique de FADS2, conduisant à l'accumulation de dérivés d'AGPI, ces derniers étant connus pour moduler les gènes de la thermogénèse. En conséquence, les dépôts adipeux blancs des animaux n’exprimant pas STING sont métaboliquement plus actifs, brûlant de l'énergie via la thermogenèse adaptative, ce qui se traduit par un brunissement des dépôts adipeux blancs. De plus, nous avons montré que les AGPI sont également capables de lier et d’inhiber STING. La modulation de la production des AGPI régule ainsi les réponses antivirales tout en contribuant à résoudre l'inflammation associée à STING. Finalement, cette étude a aussi révélé que les agonistes de STING sont capables de lier et de moduler l’activité enzymatique de FADS2. Ainsi, ces travaux démontrent l’existence d’une boucle régulatrice négative entre STING et FADS2, ouvrant de nombreuses questions quant à leur rôle respectif dans les pathologies humaines présentant une composante inflammatoire chronique associée à l’activation de STING [14].
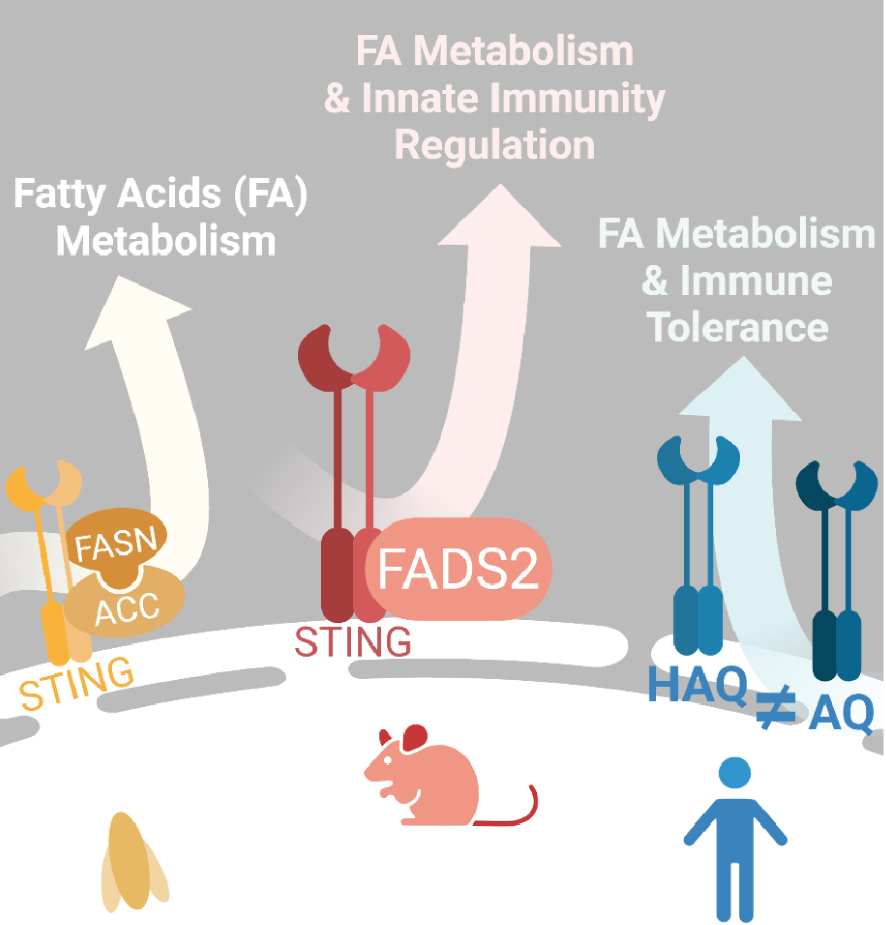
STING joue un rôle dans le métabolisme des lipides. En 2022 des données convergentes ont montré que STING régule le métabolisme des lipides. Chez la drosophile, STING forme un complexe multiprotéique avec deux enzymes impliquées dans la synthèse des acides gras à longue chaîne (FASN et ACC). Chez la souris, STING régule l'activité de la désaturase FADS2 modulant ainsi la synthèse d'acide gras polyinsaturé à longue chaîne. La production de ces espèces lipidiques va à son tour moduler l'activité de STING et réduire son activation en présence de son agoniste cGAMP. Enfin dans les populations humaines, plusieurs allèles existent et étaient déjà connus pour être plus ou moins capables d'induire une réponse IFN. L'étude des allèles AQ et HAQ a montré qu'ils diffèrent également dans la modulation du métabolisme des lipides, HAQ favorisant plus le stockage des graisses que AQ. Créé avec Biorender.
De façon intéressante, des allèles de STING non compétents pour l’induction de réponses interférons ont été documentés dans les populations humaines. Il s’agit notamment de l’allèle de STING HAQ portant les substitutions R71H, I229A et R292Q [15]. L’analyse des haplotypes de STING a révélé une forte prévalence de l’allèle HAQ dans les populations d’Asie de l’Est, par rapport aux populations d’Afrique subsaharienne, qui présentent au contraire une forte prévalence d’un allèle AQ (G230A, R293Q) compétent pour la reconnaissance de cGAMP, et l’induction des réponses interférons [16]. Les auteurs proposent que ces allèles de STING (HAQ et AQ) auraient subi une sélection naturelle lors de la migration hors d'Afrique il y a 50,000~70,000 ans [16]. L’utilisation de modèles murins exprimant les allèles de STING humains HAQ ou AQ a permis de montrer que les souris AQ stockent moins de lipides que les souris HAQ, tout en présentant une amélioration de l’oxydation des acides gras. De plus, le tissu adipeux blanc viscéral des souris HAQ est infiltré par des lymphocytes T régulateurs et des macrophages anti-inflammatoires, contrairement à celui des souris AQ. Ainsi, l’haplotype HAQ favorise le stockage des graisses, tandis que l’haplotype AQ favorise la tolérance immunitaire. Comme l'allèle HAQ offre une meilleure capacité de stockage de l'énergie que l'allèle AQ, les auteurs concluent que cette capacité de stockage de l'énergie pourrait avoir été critique pendant la période glaciaire pour la survie des premiers humains [17]. L’étude menée par Vila et al. a permis de montrer que l’allèle HAQ de STING présente une interaction forte avec FASD2 [12], ce qui est en accord avec la description d’un rôle prépondérant de cet allèle dans le métabolisme des acides gras [16]. Ainsi, l’étude de l'évolution des haplotypes de STING suggère que la fonction de STING dans la modulation du métabolisme des acides gras a pu être critique lors de la migration humaine hors d'Afrique.
Des travaux menés chez la drosophile [18] confirment le lien ancien et étroit entre STING et métabolisme des acides gras. En effet, les auteurs ont montré que l’orthologue de STING chez la drosophile interagit avec des enzymes impliquées dans la biosynthèse des acides gras à longue chaîne tels que l'acétyl-CoA carboxylase (ACC) et l’acides gras synthétase (FASN) au sein d’un complexe multiprotéique. Les drosophiles dans lesquelles la protéine STING a été délétée présentent une diminution du stockage des lipides et une diminution de l'expression des gènes en lien avec le métabolisme lipidique. Ainsi, la suppression de la protéine STING rend la drosophile plus sensible à la privation de nourriture et au stress oxydatif. Ces résultats montrent des modifications profondes du métabolisme des acides gras en l’absence de STING, étayant l’hypothèse d’un rôle conservé de STING dans la régulation du métabolisme des lipides.
Enfin, les allèles FADS (FADS1, FADS2 et FADS3) se sont avérés être sous sélection chez les Inuits groenlandais, probablement en raison d'un régime alimentaire riche en AGPI [19]. Ces résultats confirmant la sélection génétique de FADS parmi les populations [20] suggèrent que ces gènes jouent un rôle important dans l'adaptation humaine à des régimes alimentaires particuliers. Ainsi, l'étude de la co-évolution des allèles STING et FADS pourrait apporter un nouvel éclairage sur leur rôle synergique dans l'inflammation et les fonctions métaboliques.
3. STING, une protéine du métabolisme des lipides au service de l'immunité innée ?
Bien que le rôle de STING dans les mécanismes de défense de l'hôte contre les pathogènes n’est plus à démontrer, ces découvertes récentes sur le lien entre STING et métabolisme des acides gras démontrent que cette protéine a des fonctions importantes au-delà de la détection des acides nucléiques cytosoliques. L'analyse évolutive du rôle de STING suggère que ces fonctions de modulation du métabolisme des lipides sont anciennes, largement conservées et constituent peut-être la fonction primordiale de STING.
De plus, les voies métaboliques qui interagissent avec STING, telles que celles menant à la production des AGPI, sont également impliquées dans le contrôle des réponses inflammatoires indépendantes de STING. En effet, si les AGPI peuvent inhiber directement STING [12], ils peuvent aussi être transformés en médiateurs lipidiques (oxilipines) qui possèdent, entre autres, des propriétés immunomodulatrices [21]. Ainsi, on peut émettre l'hypothèse que les allèles de STING, exprimés dans des organismes dépourvus de voie de signalisation interféron, pourraient contrôler des réponses inflammatoires en régulant la génération de ces métabolites immunomodulateurs.
Enfin, ces études récentes [12, 16, 18] mettent en évidence un lien étroit entre immunité innée et métabolisme lipidique, ouvrant la voie à la recherche du rôle des altérations métaboliques dans les pathologies humaines associées à l'activation aberrante de STING [22]. Parmi les pathologies où le rôle de l’activation de la voie cGAS-STING a été documenté, figurent les cancers. Récemment la présence des composants de cette voie dans les tumeurs a été décrite comme un élément essentiel dans la définition de leur immunogénicité [23, 24]. L’implication de la régulation métabolique dépendant de STING dans ce contexte reste à être étudiée.
Conflits d’intérêts
Les auteurs n'ont aucun conflit d'intérêts à déclarer.




 CC-BY 4.0
CC-BY 4.0