1. Introduction
Les sols sont la base de 16 des 24 services écosystémiques répertoriés dans le Millennium Ecosystem Assessment (MEA, 2005). Ces services peuvent être reliés à trois fonctions majeures du sol : la gestion des flux d’eau, le cycle des nutriments et le stockage du carbone avec effet sur le climat, et le soutien à la production primaire, qui dépend largement des deux fonctions précédentes (Kibblewhite et al., 2007). Les caractéristiques physiques du sol déterminent le service de protection contre l’érosion, l’infiltration et la rétention d’eau à divers potentiels dans les espaces poreux et le transfert des eaux de pluie vers les aquifères (Lavelle and Spain, 2001). Le recyclage de la matière organique se fait par deux processus complémentaires, la minéralisation et l’humification. La minéralisation, réalisée à plus de 90 % par les microorganismes du sol, libère sous des formes minérales assimilables une partie des nutriments contenus dans la matière organique en décomposition, comme nitrates, ammonium, phosphates ou sulfates par exemple, et les rend disponibles pour la plante et les organismes vivants du sol. La complexité des processus biologiques et la diversité des organismes impliqués dans ce processus permettent une synchronisation entre le flux de nutriments libérés et leur utilisation par les plantes, un mécanisme de conservation essentiel comparé au taux médiocre d’utilisation des engrais chimiques, qui ne dépasse souvent pas 50 % pour l’azote, par exemple (Fixen et al., 2015). La part de matière organique non minéralisée est préservée dans le sol par deux systèmes de protection chimiques et physiques complémentaires. La protection chimique est assurée par l’accumulation de composés récalcitrants, des macromolécules riches en composés aromatiques plus difficiles à dégrader que les glucides, dont les molécules sont plus petites, comme la cellulose ou les protéines. Une autre partie de la protection est de nature physique : les particules de matière organique, micro-fragmentées en grande partie par l’action des invertébrés, sont associées à des particules minérales dans des agrégats compacts du sol et ainsi protégées des attaques des microorganismes qui n’y ont plus accès physiquement (Chevallier, 2011). Ils abritent aussi une proportion importante de la biodiversité planétaire (Orgiazzi et al., 2016; FAO et al., 2020; Anthony et al., 2023), plus de la moitié probablement.
On sait que les méthodes de gestion des sols affectent profondément la production de ces services, avec des externalités positives ou négatives selon les pratiques (Gairola et al., 2024). L’adoption de méthodes agricoles intensives combinant l’utilisation exclusive d’engrais chimiques de synthèse, le travail mécanique du sol et la lutte chimique contre les adventices et les ravageurs des cultures a considérablement réduit la fourniture de services écosystémiques des sols au seul bénéfice de la production. L’augmentation mondiale spectaculaire de 250 % en 40 ans de la production alimentaire, accompagnée d’une baisse de son prix à 40 % du niveau initial, s’est accompagnée de la dégradation d’au moins 1/3 des sols de la planète (MEA, 2005), du déstockage de 133 Gt de carbone équivalent à 15 ans d’émissions anthropiques (Sanderman et al., 2017) et d’une diminution généralisée de la diversité, avec par exemple une diminution de la densité des macroinvertébrés de plus de 60 % dans les cultures annuelles des régions tempérées (Lavelle, Mathieu et al., 2022). Ajoutons à ce constat qu’au-delà de l’an 2000, l’épuisement progressif des sols a progressivement effacé les bénéfices observés, et qu’en 2020, le prix des denrées alimentaires est revenu à sa valeur de 1960 (MEA, 2005; FAO, 2025).
L’économie agricole a jusqu’à présent peu pris en compte les externalités environnementales et sociales. Le seul élément comptable du fonctionnement d’une exploitation est le plus souvent la production, payée à un prix fluctuant par le marché national ou international. Dans ces conditions, les dommages environnementaux liés aux pratiques agressives ne sont pas pénalisés et le soin apporté par les producteurs, qui utilisent des pratiques douces, au maintien d’une bonne qualité environnementale n’est pas compensé.
L’idée d’une telle compensation est pourtant répandue et même inscrite dans les constitutions de divers pays (Engel et al., 2008; FAO, 2011; Salzman et al., 2018). Sa mise en œuvre pratique se limite à quelques situations expérimentales, si l’on exclut les nombreux projets visant à rémunérer la protection de zones où est généré l’approvisionnement en eau de nombreuses villes ou le stockage de carbone.
Un obstacle majeur à la mise en œuvre de politiques ciblées est la mesure même des services. Les systèmes de paiement, par exemple pour le stockage du carbone, sont complexes et nécessitent un niveau d’expertise qui rend les coûts de transaction élevés. Seuls quelques agriculteurs aisés ou de grandes entreprises agroalimentaires peuvent les mettre en œuvre et les petits producteurs, qui gèrent généralement leurs terres de manière plus respectueuse, ne sont pas bénéficiaires de ces subventions. Cependant, nous savons que de telles politiques, même mises en œuvre avec un faible niveau de subvention, ont des effets surprenants (Schomers et al., 2015).
Fortement connectés à tous les éléments microbiens et fauniques de cette biodiversité, les macroinvertébrés forment une communauté abondante partout et d’une grande diversité. Définis simplement par le fait qu’ils sont visibles à l’œil nu, ils se répartissent en 15 grandes unités taxonomiques, entre familles et ordres (Tableau 1). Ils regroupent des insectes sociaux, fourmis et termites), un grand nombre d’insectes non sociaux, Coléoptères, Diptères, Dermaptères, des Myriapodes, Chilopodes, Diplopodes, plusieurs groupes d’Arachnides, les vers de terre et les Gastropodes terrestres et un petit nombre d’invertébrés plus rares. Ces groupes se trouvent partout, à l’exception des termites confinés aux régions intertropicales, avec des fréquences qui varient de 9 à 71 % selon les groupes. Les espèces, genres et même familles, diffèrent cependant beaucoup d’un site à un autre, même si les fonctions assumées sont comparables à l’intérieur d’un même groupe. Des unités plus rares se rencontrent localement : des Arachnides particuliers (Solifuges, Palpigrades, Uropyges), les très primitifs Onychophores des forêts tropicales humides et les Planaires géantes, les Nématodes Mermithidae parasites des Orthoptères dont une phase du cycle passe par le sol, les pseudo-sociaux Embioptères, les larves de cigales et les courtilières dotées de puissantes pattes antérieures fouisseuses. La diversité et l’abondance de ces habitants des sols n’échappent pas à l’agriculteur qui, quelle que soit la région, les reconnaît et les nomme.
Biologie générale et fréquence des taxons de macroinvertébrés du sol dans 3 682 sites de la base de données Macrofauna (Lavelle, Mathieu et al., 2022)
| Common english name | Taxonomic classification | Taxonomic level | Main habitat | Feeding habits | Respiration | % frequency in DB |
|---|---|---|---|---|---|---|
| Earthworms | Crassi clitellata | Order | Litter and soil | Detritivores, geophagous | Skin | 70.7 |
| Beetles | Coleoptera | Order | Litter Rhizosphere | Predators, detritivores, fungivores | Trachea | 65.4 |
| Ants | Formicidae | Family | Soil and litter | Predators granivores, fungivores | Trachea | 53.3 |
| Spiders | Araneae | Order | Litter and soil | Predators | Trachea | 49 |
| Centipede | Chilopoda | Order | Leaf and woody litter | Predators | Trachea | 35.8 |
| Milipede | Diplopoda | Order | Leaf and woody litter | Detritivores | Trachea | 33.4 |
| Fly larvae | Diptera | Order | Litter and soil | Predators, detritivores, fungivores | Trachea | 27.2 |
| Termites | Termitoidea | Epifamily | Soil, decaying logs | Detritivores, herbivores, wood feeders | Trachea | 26.6 |
| Woodlouse | Isopoda | Order | Litter | Saprophagous | Gills | 19.5 |
| Stink bugs | Homoptera Hemiptera | Order | Litter | Phytophagous | Trachea | 19.3 |
| Snails and slugs | Pulmonata | Order | Litter | Herbivorous, saprophagous | Lung | 18.2 |
| Cockroaches | Blattaria | Order | Litter | Detritivores | Trachea | 13.8 |
| Cricket | Grylloidea | Super family | Litter | Detritivores | Trachea | 12.7 |
| Caterpilar | Lepidoptera | Order | Litter | Detritivorous | Trachea | 12.1 |
| Earwings | Dermaptera | Order | Litter | Predators, saprophagous | Trachea | 8.9 |
| Others | Cicadoidea, Opilionidae, Scorpions, Pseudoscorpions… | 15.2 |
Dans cette revue, nous expliquons le rôle essentiel des macroinvertébrés dans le fonctionnement écologique du sol. Nous résumons ensuite un ensemble de données de terrain démontrant le lien étroit entre ces communautés et les services écosystémiques liés au sol. Nous présentons enfin une méthode simple et peu coûteuse permettant de synthétiser l’état de leurs communautés en un indicateur numérique unique. Nous proposons de mettre cet indicateur à la disposition des agriculteurs afin qu’ils puissent l’utiliser comme marqueur des externalités environnementales de leurs pratiques, et bénéficier d’éventuelles subventions reconnaissant les bénéfices environnementaux découlant de leur travail.
L’ensemble de ces invertébrés recouvre une gamme très large de modes alimentaires, de choix d’habitat, de capacités à se déplacer dans le sol, de modes de respiration qui en fait naturellement de très bons témoins des conditions de vie qu’offre ce milieu.
2. Vivre dans le sol
Pour comprendre l’importance des peuplements de macroinvertébrés, il est important de prendre en compte les conditions particulières du sol comme milieu de vie. Vivre dans le sol, c’est affronter deux contraintes très fortes, le caractère compact difficilement pénétrable de ce milieu, et la nature des ressources alimentaires disponibles (Lavelle and Spain, 2001).
2.1. Se déplacer dans un environnement compact
Les sols sont certes des milieux poreux, et la porosité peut atteindre des valeurs élevées, jusqu’à 50 % par exemple dans des sols de forêt amazonienne peuplés d’une faune active, mais elle diminue rapidement en profondeur et l’installation de pâturages peut la faire descendre jusqu’à moins de 20 % dès les premiers centimètres du sol (Barros et al., 2001). Cette porosité est cependant composée d’une proportion de micropores inaccessibles même aux microorganismes du sol, et la faible connectivité des pores habitables limite de fait l’espace utilisable et les mouvements dans la matrice du sol. Dans un tel contexte, deux stratégies adaptatives se définissent : se déplacer en creusant et accéder de ce fait aux ressources alimentaires disponibles, ou entrer en dormance quand les ressources disponibles sont épuisées au contact de l’organisme, et attendre que des conditions favorables permettent une reprise de l’activité. La première stratégie est celle des organismes fouisseurs, les ingénieurs de l’écosystème du sol, vers de terre, termites et fourmis principalement, qui se déplacent et aménagent le sol en creusant galeries et macropores. Pour les autres organismes incapables de creuser, l’option est d’utiliser les espaces poreux créés par les ingénieurs. C’est le cas par exemple de la mésofaune des Acariens et Collemboles, dont la taille varie entre 0,1 et 2 mm, qui profitent des espaces poreux créés par les vers de terre ou par les racines (Loranger et al., 1998). Pour les microorganismes incapables de se déplacer vers de nouvelles sources de nourriture une fois que celle qui était a leur contact s’est épuisée, l’option est la dormance, jusqu’à ce que la bioturbation leur donne de nouvelles opportunités de reprendre leur activité et d’entrer en contact avec de nouvelles ressources alimentaires. On mesure ainsi que, dans le sol, jusqu’à 75 % des bactéries sont inactives (Couradeau et al., 2019), et le temps de turnover de la biomasse bactérienne se compte en mois et même en années, quand le temps de génération peut être de moins d’une heure dans les conditions optimales du laboratoire (Lavelle and Spain, 2001).
2.2. Une alimentation de mauvaise qualité ou imprévisible
La deuxième contrainte importante du sol a trait à la qualité et à la disponibilité des ressources alimentaires. On peut distinguer grossièrement deux grands types de ressources : (1) la nécromasse végétale, animale et microbienne, et (2) les ressources solubles, médiateurs énergétiques produits par les organismes ingénieurs (Lavelle, Spain, et al., 2016).
(1) La nécromasse végétale est un ensemble divers de feuilles, tiges et branches et racines. Bien que cet ensemble recouvre une très grande diversité de compositions et de structures, deux caractéristiques générales rendent sa digestion problématique pour la plupart des organismes. La première est la composition globale en divers éléments qui impose des limitations stœchiométriques à l’utilisation de ces ressources (Yu et al., 2025). On observe fréquemment que la forte valeur du rapport carbone sur nutriments, par exemple du carbone à l’azote, oblige l’organisme utilisateur à trouver une source complémentaire d’azote, ou à mettre en œuvre des mécanismes physiologiques d’élimination du carbone excédentaire quand la simple élimination par la respiration aérobie ne suffit pas (Swift et al., 1979). Cette contrainte est bien connue des agriculteurs qui enfouissent les pailles à un rapport C:N élevé, avec pour conséquence l’immobilisation de l’azote disponible dans le sol et une compétition temporaire entre la plante et la microflore qui décompose la paille.
À cette limitation s’en ajoute une autre : l’inclusion de l’azote des cellules végétales dans des complexes tanins-protéines que très peu d’organismes peuvent digérer. Ces tanins, dont la fonction est de limiter l’herbivorie, étaient contenus dans des vacuoles dont le contenu se libère à la mort de la plante. On estime que plus de 80 % de l’azote des feuilles ou des racines mortes est bloqué sous cette forme (Toutain 1987). Une autre limitation de nature chimique est la présence de lignine, un composé naturellement peu digestible.
Une dernière contrainte limite l’usage de ces ressources : la résistance mécanique des composés aux processus de comminution et fragmentation nécessaires à l’ensemencement des champignons qui effectueront les premières étapes de la décomposition.
La nécromasse animale qui représente une proportion assez faible des ressources oppose moins de limitations.
La nécromasse microbienne, objet d’une abondante littérature récente (Liang et al., 2019; Sokol et al., 2022), se distingue par des marqueurs chimiques permettant son identification et sa quantification. Cependant, un doute subsiste : ces marqueurs sont-ils exclusifs à la nécromasse ou caractérisent-ils également la biomasse vivante et/ou les métabolites microbiens, comme les polysaccharides du mucilage et les enzymes ?
La nécromasse fragmentée et transformée, quelle que soit son origine, associée aux éléments minéraux des agrégats du sol, constitue la matière organique du sol, une ressource abondante mais dont l’utilisation est rendue difficile par une distribution très dispersée à l’échelle des microorganismes, ou par sa faible concentration dans le sol pour les invertébrés qui s’en nourrissent. À ces inconvénients s’ajoutent sa localisation dans les agrégats, qui offre une protection physique, et sa qualité chimique appauvrie en éléments facilement assimilables lors des différentes étapes de sa transformation.
(2) Ressources solubles. L’autre ressource majeure pour les organismes du sol est représentée par les produits en grande partie solubles sécrétés par les racines (exsudats racinaires), les vers de terre (mucus intestinal) ou les termites (salive). Ces composés, regroupés sous le terme de médiateurs énergétiques (Lavelle, Spain, et al., 2016), sont utilisés par les organismes d’ingénierie des sols, racines et macroinvertébrés, pour stimuler l’activité des microorganismes du sol par des effets d’amorçage (Lavelle and Spain, 2001). Les microorganismes, une fois sortis de la dormance dans laquelle ils peuvent être immergés pendant des mois, voire des années, digèrent les composés que ni les racines ni les invertébrés ne peuvent assimiler, dans un système de digestion mutualiste (Lavelle, Lattaud et al., 1994). Ces ressources de très haute valeur énergétique et digestibilité sont abondantes. Jusqu’à 20 % des produits de la photosynthèse sont injectés dans le sol à l’extrémité des racines, tandis que les vers de terre ajoutent au sol ingéré entre 5 et 18 % d’un mucus intestinal composé de glycoprotéines de faible poids moléculaire (Martin et al., 1987). L’inconvénient de ces ressources est l’extrême localisation, à la fois dans le temps et dans l’espace, de leur production qui en fait des ressources sporadiques (ibid.).
2.3. Le sol auto-organisé
Les peuplements du sol se divisent ainsi grossièrement entre les microorganismes incapables de se déplacer dans l’univers compact du sol, ce qui les oblige à de longues périodes de dormance, et les invertébrés et les racines, organismes ingénieurs capables de se déplacer dans les couches de litière et dans le sol minéral, et même pour certains d’effectuer de la bioturbation, mais avec un équipement enzymatique insuffisant pour digérer la plupart des ressources disponibles (Lavelle, Lattaud et al., 1994; Lattaud et al., 1998). L’association et la complémentarité de ces deux groupes sont à la base du fonctionnement du sol comme système auto-organisé dans lequel les macroinvertébrés occupent une place stratégique (Figures 1 and 2, Lavelle, Spain, et al., 2016).
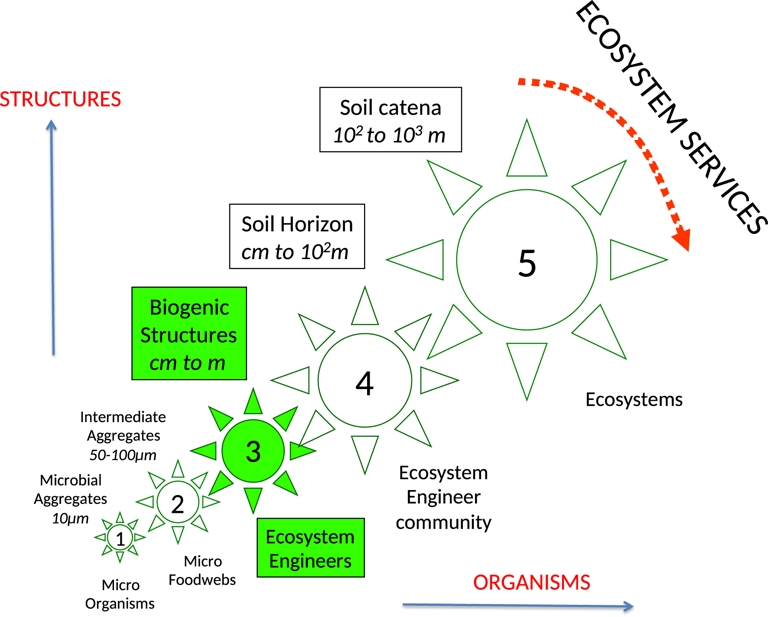
Le sol, système auto-organisé d’entités biologiques. Des organismes de tailles croissantes, des microorganismes aux micro-invertébrés prédateurs, aux ingénieurs écosystémiques et aux écosystèmes (axe horizontal) créent des structures de différentes tailles (axe vertical) et organisent le sol à différentes échelles imbriquées de l’échelle 1 (agrégats microbiens habités par des communautés microbiennes) à 5 (paysage vu comme une mosaïque de différents écosystèmes). La plupart des services écosystémiques basés dans le sol sont perçus et fournis à l’échelle du paysage (5).
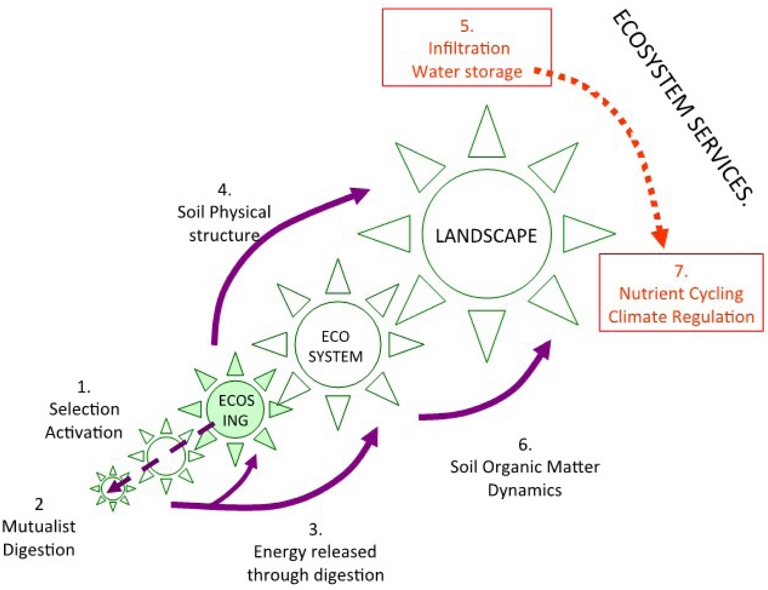
Interactions entre unités auto-organisées du sol à travers les échelles spatiales et temporelles et fourniture de services écosystémiques. Il convient de noter que des échelles supplémentaires, telles que le biome et la biosphère peuvent être ajoutées lorsque les services écosystémiques sont considérés à l’échelle mondiale. Les ingénieurs écosystémiques sélectionnent et activent les communautés microbiennes dans leurs domaines fonctionnels (1). Un système de digestion mutualiste (2) libère de l’énergie (3) utilisée par les ingénieurs écosystémiques pour construire des structures biogéniques et organiser la structure physique du sol (4) avec des effets sur les services hydriques (infiltration et stockage) (5). La combinaison des processus de minéralisation pendant le processus de digestion et la séquestration des composés organiques dans les structures biogéniques affectent la dynamique de la matière organique du sol (6) et donc le cycle des nutriments et la régulation du climat (7).
3. Les macroinvertébrés comme indicateurs
Le rôle des macroinvertébrés et les caractères de leurs peuplements en font ainsi des indicateurs naturels à fort potentiel. Le fait que tous les grands groupes, à l’exception des termites, soient présents partout même si avec des espèces, genres et familles différents, reconnus par la plupart des travailleurs du sol, facilitera la collecte de données par un grand nombre de personnes. Les outils pratiques pour l’analyse quantitative des peuplements et l’élaboration d’indicateurs numériques sont disponibles.
Il existe deux façons de les utiliser comme indicateurs : au niveau des espèces, avec des espèces indicatrices, ou au niveau des populations, avec des indicateurs synthétiques.
3.1. Espèces indicatrices
Un sol en bonne santé peut abriter jusqu’à plusieurs centaines d’espèces de macroinvertébrés. Les fourmis, les coléoptères et les arachnides sont généralement les groupes les plus riches en espèces, mais les vers de terre et les termites peuvent également être des indicateurs intéressants (Lobry de Bruyn, 1999; Sanabria, Dubs et al., 2016; Duran-Bautista et al., 2020; Dufrêne and Legendre, 1997). L’utilisation de l’indicateur IndVal, qui mesure le pouvoir indicatif des espèces pour un attribut écosystémique donné, permet d’identifier des espèces indicatrices (Dufrêne and Legendre, 1997). Plusieurs études ont testé avec succès cette méthode, ouvrant la voie à des utilisations intéressantes des données de peuplement. Par exemple, dans un ensemble de 75 parcelles réparties sur 5 types d’utilisation des sols des plaines orientales colombiennes, 91 espèces de fourmis ont été collectées à l’aide de la méthode de tri manuel ISO/TSBF (Anderson and Ingram, 1993; ISO, 2011). Parmi elles, 52 ont été trouvées dans les pâturages améliorés, 45 dans les savanes semi-naturelles, 39 et 38 respectivement dans les plantations d’hévéas et de palmiers à huile, et 20 dans les cultures annuelles (Sanabria, Lavelle et al., 2014). Les pâturages améliorés présentèrent le plus grand nombre d’espèces exclusives, présentes uniquement dans ce système d’utilisation des terres (11), suivies par les plantations de caoutchouc (10) et la savane semi-naturelle (9). Dans les mêmes parcelles, la mesure d’un ensemble complet de variables physiques et chimiques du sol, des communautés de macroinvertébrés, de l’accumulation de carbone dans les sols et la végétation et des émissions de gaz a effet de serre (GES) a permis d’élaborer des indicateurs synthétiques de services écosystémiques (SE) basés sur le sol (Lavelle, N. Rodríguez et al., 2014). Quinze espèces ont montré une valeur indicatrice significative : cinq comme indicatrices de la biodiversité générale (communautés de macroinvertébrés du sol), cinq de la morphologie des macroagrégats, un indicateur indirect de l’infiltration et du stockage de l’eau dans le sol, une indicatrice des services hydrologiques (liés négativement à la compaction du sol), trois de l’apport en éléments nutritifs du sol (basé sur les propriétés chimiques générales du sol) et une indicatrice de l’effet de régulation du climat, évalué par la concentration de carbone dans le sol, la biomasse végétale et les émissions de GES. Il est intéressant de noter que, dans ce cas, aucune espèce ne semblait indiquer plus d’un SE.
Une autre étude similaire sur les termites de 38 fermes, situées dans des régions déboisées d’Amazonie, dans le département colombien de Caqueta et l’État brésilien de Para, montre des résultats intéressants. Quarante-huit espèces ont été collectées au total, 12 en Colombie et 45 au Pérou. Neuf espèces étaient communes aux deux régions. Onze espèces présentaient un pouvoir indicatif significatif. Deux espèces en Colombie étaient indicatrices de la fertilité chimique et de la morphologie des agrégats du sol. Au Pérou, neuf espèces avaient un pouvoir indicatif significatif : deux pour les fonctions hydrologiques liées aux propriétés physiques du sol, une pour la morphologie des agrégats du sol et six pour la biodiversité du sol telle que mesurée par les communautés de macroinvertébrés. Quatre espèces étaient indicatrices de plus d’un proxy de SE.
Les ateliers participatifs menés avec les agriculteurs ont montré une certaine connaissance des espèces rencontrées et de leur relation avec les services écosystémiques du sol, les fonctions hydrologiques, la fertilité chimique et la diversité des populations de macroinvertébrés (Duran, 2020). Les agriculteurs péruviens ont pu reconnaître quatre des sept espèces présentées et indiquer sept relations avec les SE du sol, dont cinq correspondaient à des effets significatifs reconnus par la méthode IndVal. En Colombie, les sept espèces présentées étaient connues des agriculteurs et trois d’entre elles étaient associées à la fertilité chimique, tandis que la méthode IndVal n’a pas permis de confirmer l’importance de ces relations.
3.2. Indicateurs synthétiques des peuplements de macroinvertébrés
D’autres études de terrain non publiées ont logiquement montré que la capacité des agriculteurs à reconnaître les invertébrés du sol s’améliore lorsqu’ils considèrent des groupes taxonomiques plus larges, comme les familles et les ordres. Dans des travaux ultérieurs, nous avons testé l’hypothèse selon laquelle les compositions des communautés évaluées à des niveaux taxonomiques tels que l’ordre, permettraient de prédire les SE associés à de larges échelles géographiques. Si cette hypothèse était vérifiée, elle montrerait une bonne correspondance entre les connaissances scientifiques et celles des agriculteurs.
Une méthode de tri manuel simple et peu coûteuse a été proposée il y a près de 40 ans et popularisée dans le programme Tropical Soil Biology and Fertility (Anderson and Ingram, 1993). Elle fut ensuite adoptée comme standard par l’ISO (2011). L’échantillon de base est un bloc de 25 cm de côté, étendu jusqu’à une profondeur de 30 cm. Le bloc est extrait avec un cadre métallique, si cette facilité existe, et séparé au fur et à mesure en ses différentes couches : la litière en surface et le sol entre 0-10, 10-20 et 20-30 cm respectivement. Le nombre de répétitions conseillé est de cinq, espacées de 30 m, si le terrain le permet, pour éviter l’autocorrélation des données. Une étude portant sur des échantillonnages réalisés en France montre même qu’à partir de trois répétitions, la définition est suffisante (Ruiz et al., 2032).
Cette méthode simple et peu coûteuse a été adoptée massivement. Aujourd’hui, la base de données Macrofauna qui regroupe ces données compte plus de 10 000 sites échantillonnés, distribués entre plus de 60 pays, recouvrant l’ensemble des biomes et écosystèmes terrestres à l’exception des déserts, froids ou chauds (Mathieu et al., 2022).
Une analyse en composantes principales (ACP) d’une version intermédiaire de la base de données, avec 3 690 sites, donne les résultats généraux suivants (Figure 3). Le peuplement « moyen » échantillonné dans tous ces sites comprend 712 individus par m2 appartenant à cinq ordres différents. Le premier facteur de l’ACP ordonne les peuplements en fonction de l’abondance de tous les groupes, avec un effet majeur des insectes sociaux et des invertébrés de la litière. Des tests spécifiques montrent des effets significatifs de tous les paramètres environnementaux testés, la couverture végétale (11 % de la variance totale expliquée), latitude (8,6 %), altitude (5,2 %), texture du sol (3,2 %) ou température (2,3 %) (Lavelle, Mathieu et al., 2022).
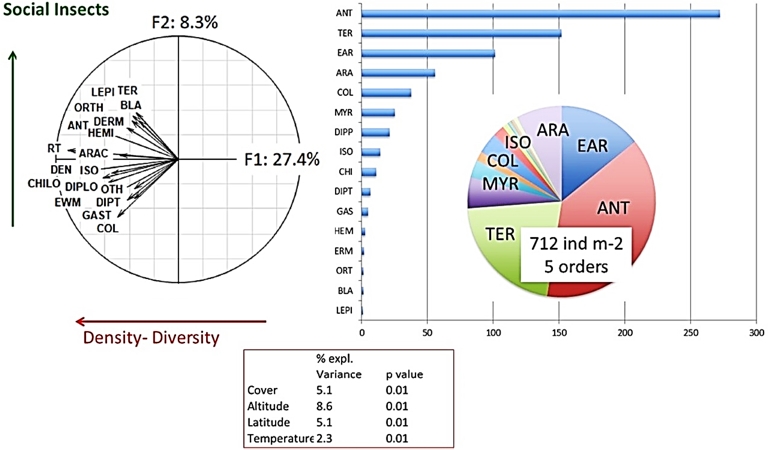
Projection (à gauche) des densités de groupes de macroinvertébrés et autres paramètres des peuplements dans un plan défini par les facteurs 1 et 2 (F1 et F2) d’une analyse en composantes principales des données de communauté de macroinvertébrés de la base de données Macrofauna. ANT, fourmis ; ARAC, Arachnida ; BLA, Blattaria ; CHILO, Chilopoda ; COL, Coleoptera ; DEN, densité totale par mètre carré ; DERM, Dermaptera ; DIP, larves de diptères ; DIPLO, Diplopoda ; EWM, vers de terre ; GAST, Gastropoda ; HEMI, Homoptera Hemiptera ; ISO, Isopoda ; MYR, Myriapoda ; ORTH, Orthoptera ; OTH, autre ; RT, richesse taxonomique (nombre d’ordres trouvés dans l’échantillonnage) ; TER, termites ; et (à droite) densité moyenne globale des différents groupes et richesse spécifique. Cadre inférieur : Pourcentage de variance expliquée par différents facteurs environnementaux (d’après Lavelle, Mathieu et al., 2022).
Les données d’abondance des groupes de macrofaune dans les différents types d’usage du sol en un site donné peuvent être synthétisées en un indicateur calculé à partir des paramètres produit par une ACP : les % de variance expliquée par les deux premiers axes, corrélations des variables (les densités des différents groupes taxonomiques) avec les axes factoriels et coordonnées des points le long de ces axes. Cet indicateur est calibré pour varier de 0,1 à 1,0 suivant que le peuplement est plus ou moins abondant et divers (Velasquez, Lavelle and Andrade, 2007). Il est apparu très sensible aux types de couverture et d’utilisation du sol, comme le montre l’exemple de l’étude réalisée dans les Llanos Orientales de Colombie (Lavelle, N. Rodríguez et al., 2014).Dans ce site, l’indicateur eut les valeurs les plus élevées dans des pâturages qui associaient la graminée africaine Brachiaria humidicola avec la légumineuse Centrosema. Bien qu’ayant une moyenne supérieure, la différence avec la savane naturelle et la plantation de palmiers à huile ne fut pas significative, à la différence de la plantation d’Hévéa, et surtout des cultures transitoires de riz, soja et maïs qui montrent la moyenne la plus faible, 0,28 contre 0,74 dans le pâturage amélioré (Figure 4).
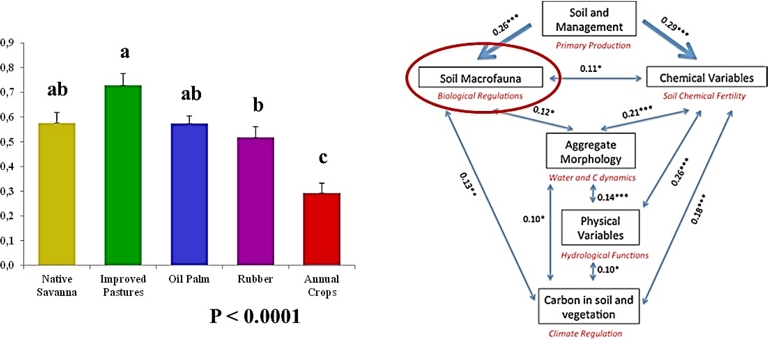
Indicateurs de macrofaune dans différents types d’utilisation du sol dans l’Orénoquie Colombienne (à gauche) et coefficient de corrélation matricielle (Rv) entre les tableaux de données pour les différents indicateurs de services écosystémiques, et valeurs p associées (*p < 0,05 ; **p < 0,01 ; ***p < 0,001) (à droite).
Dans ce site, la mesure exhaustive des paramètres chimiques et physiques du sol, du C accumulé dans le sol et la végétation et émis sous forme de gaz à effet de serre, a permis de construire des indicateurs synthétiques, avec la même méthodologie utilisée pour la macrofaune. Les corrélations matricielles entre les tableaux de données ainsi constitués sont toutes significatives au seuil de 0.01. Ce résultat et d’autres similaires obtenus dans d’autres sites (Lavelle, Dolédec et al., 2016; Galindo et al., 2022; L. Rodríguez et al., 2021; Velasquez and Lavelle, 2019), confirment d’une part le comportement en groupe des services écosystémiques qui varient tous dans la même direction (Raudsepp-Hearne et al., 2010). Ils suggèrent d’autre part d’utiliser l’indicateur de macrofaune comme proxy de tous les autres, avec l’avantage de pouvoir être évalué à un faible coût, par les opérateurs locaux du terrain.
3.3. Élaboration d'un indicateur global de la macrofaune
Les nombreuses analyses en composantes principales comparant les peuplements de macroinvertébrés dans différents types d’usage d’un même sol montrent toujours le même patron : l’axe 1 de l’ACP, qui compare les sites, les classe systématiquement en fonction de l’abondance de tous les groupes et de la richesse taxonomique (Hurtado et al., 2024).L’axe 2 sépare les sites où dominent les insectes sociaux. Un indicateur global a été créé à partir des 3 690 sites compilés dans la base de données Macrofauna. Cet indicateur a été appliqué aux peuplements échantillonnés dans une dizaine de régions aux caractéristiques contrastées : sites partiellement déforestés de l’Amazonie ; agroécosystèmes et vestiges forestiers andins de la Colombie ; plantations de thé et systèmes associés en Chine ; ou forêts de France (ibid.). Les valeurs ainsi calculées ont été comparées à celles obtenues en appliquant la même méthode aux jeux de données locaux. Des corrélations très significatives entre les deux jeux d’indicateurs soutiennent ainsi l’utilisation d’une formule unique pour évaluer un peuplement de macrofaune quel que soit le site. On peut ainsi évaluer la qualité du peuplement de macrofaune avec la formule :
| \begin {eqnarray*} \text {I macrofauna} = 0.014* \mathop {(}19.2*\mathrm {EWM} + 17.5*\mathrm {ANT} +\, 20.9*\mathrm {TER} + 9.8*\mathrm {BLA} + 20.4*\mathrm {COL} +\,17.5*\mathrm {ARAC} + 20.1*\mathrm {DIPLO} +\,21.8*\mathrm {CHILO} + 13.5*\mathrm {HEMI} +\,8.9*\mathrm {DERMA} + 15.5*\mathrm {LEPI} +\,16.7*\mathrm {GAST} + 21.9*\mathrm {OTR} +\,31.8*\mathrm {DEN} + 31.8*\mathrm {RT} \mathop {)}+0.1, \end {eqnarray*} |
L’indicateur montre de grandes variations, entre les types de couverture végétale et à l’intérieur de ces groupes (Figure 5). Les environnements tropicaux montrent les valeurs les plus élevées, entre 0,61 ± 0,16 et 0,55 ± 0,12 dans les forêts naturelles et les savanes respectivement, et 0,51 ± 0,19, 0,49 ± 0,15 et 0,48 ± 0,14) dans les cultures arborées, les pâturages et les cultures non arborées, respectivement. Les sols tempérés ont les valeurs les plus élevées dans les prairies (0,38 ± 0,14) et les forêts (0,35 ± 0,14), et des valeurs plus faibles dans les buissons et les forêts sèches (0,31 ± 0,14) et les cultures annuelles (0,31 ± 0,13). Cependant, au-delà de ces différences significatives entre les moyennes, la variabilité au sein des groupes est très élevée car les conditions locales et les options de gestion ont des impacts importants.
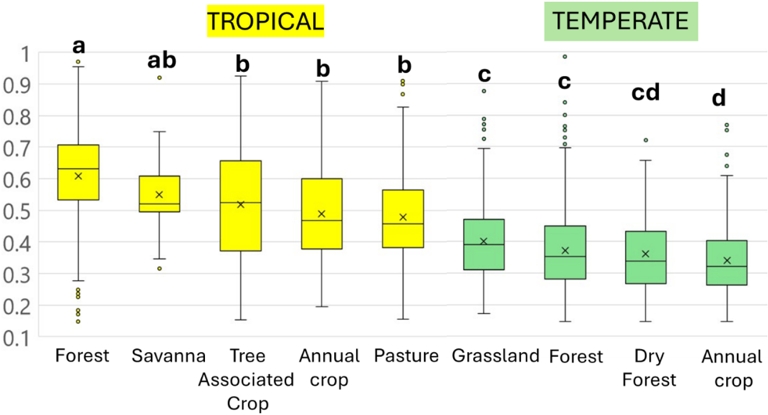
Variations de l’indicateur global des peuplements de macroinvertébrés du sol dans les régions tropicales et tempérées, en fonction de la couverture végétale (source Base de données Macrofauna, https://datadryad.org/downloads/file_stream/1355027). Les blocs surmontés d’une lettre différente sont différents au seuil de p<0.05.
4. Conclusion
Les peuplements de macroinvertébrés sont au cœur des processus du sol pour leur interaction globalement mutualiste avec la microflore et leurs puissants effets d’ingénierie physique, biochimique et d’ingénierie des communautés (Lavelle, Spain, et al., 2016). Ils présentent la particularité d’être divisés en 15 groupes principaux, présents partout à l’exception des termites, et qui exercent des fonctions similaires même s’ils sont représentés par des familles, genres et espèces parfois très éloignés taxonomiquement.
Le nombre relativement limité de ces unités taxonomiques fait que la plupart des opérateurs du terrain les reconnaissent et peuvent les nommer. Des travaux préliminaires non encore publiés confirment cette connaissance, dans les régions amazoniennes où la recherche a été menée.
Dans tous les sites où le lien entre cet indicateur et les indicateurs de services écosystémiques du sol a été mesuré, des corrélations très élevées ont été notées (Velasquez and Lavelle, 2019). L’indicateur proposé est ainsi un outil de premier ordre à la disposition de populations éloignées des laboratoires qui pourront en les utilisant avoir une évaluation de la qualité agroécologique de leur terrain. Ils pourront surtout comparer des parcelles soumises à des pratiques diverses et mesurer le cas échéant les progrès réalisés. Des politiques de paiement des services écosystémiques pourront s’appuyer sur cet outil, avec l’avantage considérable de permettre à tous les producteurs, mais surtout aux petits producteurs, de valoriser les externalités positives de pratiques respectueuses des sols et de leur biodiversité.
Pour atteindre cet objectif, quelques étapes sont indispensables. Produire un guide pratique et rendre l’outil plus facile en automatisant les calculs avec une application pour smartphone facilitera le travail de l’opérateur. Une formation proposée par les institutions d’aide technique permettra le cas échéant de délivrer un diplôme attestant une maitrise correcte de l’outil. Du côté des politiques publiques, des connaissances complémentaires sont nécessaires pour calibrer les progrès mesurés avec l’indicateur et évaluer des propriétés telles que l’augmentation de l’infiltration et le stockage de l’eau ou le stockage de carbone dans les sols.
Déclaration d’intérêts
L’auteur ne travaille pas, ne conseille pas, ne possède pas de parts, ne reçoit pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’a déclaré aucune autre affiliation que son organisme de recherche.




 CC-BY 4.0
CC-BY 4.0