1 Introduction
La mesure des excès énantiomériques est devenue une nécessité dans de nombreux domaines d’activité, en particulier dans l’industrie pharmaceutique et agrochimique, où elle est généralement effectuée par chromatographie chirale, souvent couplée à la spectrométrie de masse. Le souci d’une identification indiscutable des énantiomères et d’une détermination fiable de leurs concentrations respectives a conduit de nombreux chercheurs à utiliser la résonance magnétique nucléaire pour obtenir à la fois l’attribution de la stéréochimie et la mesure de l’excès énantiomérique [1,2]. La RMN en milieu non chiral ne distinguant pas deux énantiomères d’une même molécule [3], une réaction préalable avec un réactif énantiopur (ou agent dérivant chiral) conduit à deux diastéréoisomères, qui peuvent alors être quantifiés. Nous avons décrit récemment un nouveau réactif dérivant chiral, la chlorocobalt(III) tétraméthylchiroporphyrine (Fig. 1), qui s’est avéré d’une grande commodité dans la mesure des excès énantiomériques d’amines aliphatiques et d’aziridines [4]. Dans cet article, nous décrivons son application à l’analyse chirale des esters méthyliques d’acides aminés.
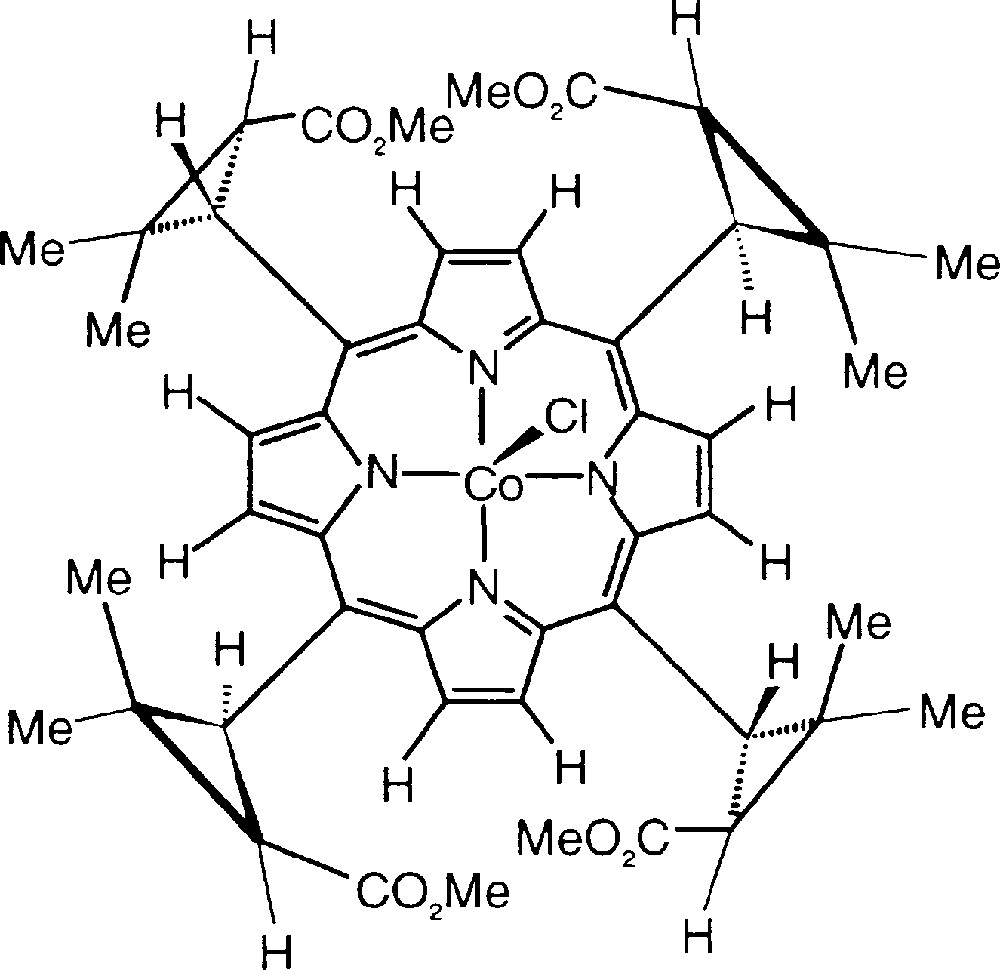
Structure du réactif dérivant chiral CoCl(TMCP).
2 Principe de la méthode
Une transformation préalable de la fonction acide carboxylique en ester méthylique rend l’acide aminé soluble dans les solvants organiques. Puis on complexe l’amino ester L* sur le centre Co(III) pour former un bis-adduit cationique hexacoordonné [Co(L*)2(TMCP)]+Cl– (Fig. 2). Enfin, le spectre de RMN 1H du bis-adduit est enregistré. L’attribution des signaux est très simple : du fait du courant de cycle de la porphyrine, les protons de l’amino ester fixé sur le cobalt résonnent à haut champ dans une région spectrale vierge de tout autre signal entre 0 et –6 ppm.
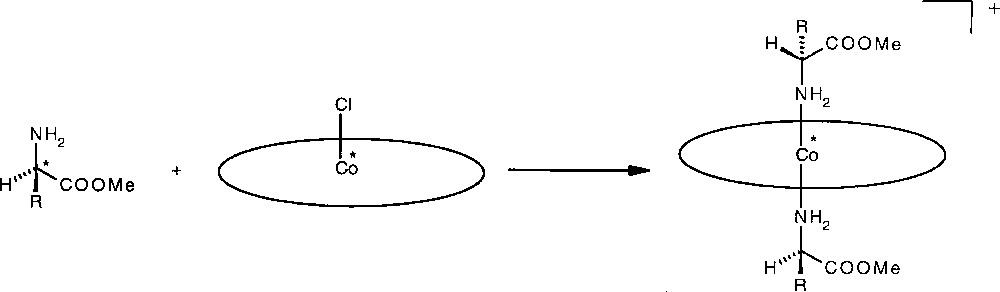
Complexation des esters méthyliques d’acides aminés avec le réactif dérivant CoCl(TMCP). Les astérisques symbolisent la chiralité de l’hôte TMCP et celle du ligand amino ester.
Diverses sources d’erreur potentielle ont été envisagées. Nous avons d’abord vérifié que l’estérification préalable ne modifie pas le rapport de concentrations des énantiomères. De même, nous avons estimé que la dimérisation des amino esters en dicétopipérazines est négligeable dans les conditions utilisées pour l’analyse. En effet, il a été observé que la formation de dimères à partir du produit pur s’effectue très lentement (environ 3% en 6 h à 80 °C pour l’ester méthylique de l’alanine [5]); elle est donc indécelable dans les conditions de la mesure (quelques minutes en solution diluée à 25 °C). La mise en œuvre de la méthode est facile puisque la dérivation se fait in situ dans le tube de RMN, de façon immédiate et quantitative à température ambiante, comme dans le cas des amines et aziridines étudié précédemment [4].
3 Résultats et discussion
La Fig. 3 représente la partie à haut champ des spectres obtenus pour les deux configurations de l’ester méthylique de l’acide aspartique, ainsi que pour le mélange racémique. On remarque que les signaux correspondant aux protons de l’acide aminé, notés Ha, Hb, Hc, Hd et He, se situent à des déplacements chimiques différents selon sa configuration absolue. Le spectre du mélange racémique présente tous les signaux obtenus pour l’espèce (R) dans l’adduit [Co(R)(R)(TMCP)]+ et tous ceux obtenus pour l’espèce (S) dans l’adduit [Co(S)(S)(TMCP)]+, plus des signaux nouveaux. Ceux-ci sont clairement détectés vers –1,3 ppm, et correspondent au proton Hd du ligand de configuration (R) de l’espèce mixte [Co(R)(S)(TMCP)]+. À la différence des résonances des autres protons de l’espèce mixte, ce signal de Hd est bien résolu de ceux des deux homoadduits. Par simple intégration des signaux obtenus, il est possible de déterminer la composition énantiomérique d’acides aminés dans des mélanges inconnus.
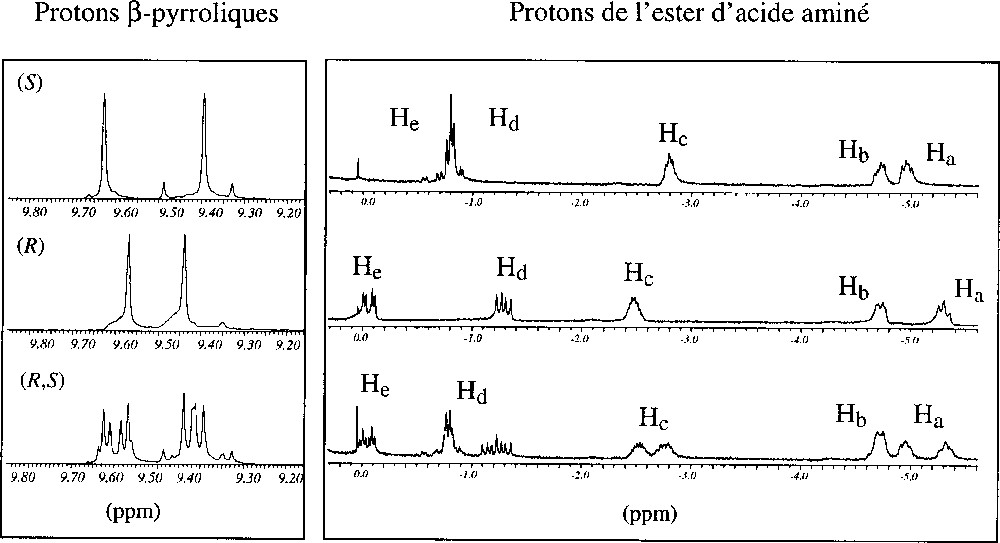
De haut en bas : spectres de RMN 1H (200 MHz) des adduits des diesters méthyliques de l’acide aspartique (S), (R) et (R,S). Les faibles signaux à 9,3 et 9,5 ppm sont dus à de la base libre H2(TMCP) résiduelle.
De plus, on constate que la complexation de l’ester d’acide aminé exerce une influence sur les signaux du réactif dérivant. Les protons β-pyrroliques, qui se présentent sous la forme de deux doublets de doublets pour CoCl(TMCP), résonnent sous la forme de deux singulets pour les bis-adduits. Ces deux singulets correspondent aux deux groupes inéquivalents de pyrroles opposés. Cette simplicité résulte de l’environnement octaédrique, dans lequel un processus de rotation des amino esters autour des liaisons Co–N, rapide à l’échelle de temps de la RMN, engendre une symétrie effective D2. L’écart entre ces deux singulets varie selon la configuration absolue du ligand fixé. Nous avons remarqué que pour toute la série des acides aminés étudiés, l’écart entre les deux singulets, pour un acide aminé de configuration (R), est toujours très inférieur à celui obtenu pour un acide aminé de configuration (S).
Nous avons étudié la plupart des amino esters biogéniques sous leurs deux configurations [6], ainsi que quelques amino esters non biogéniques. Grâce aux spectres de corrélation à deux dimensions COSY (Correlation SpectroscopY) et TOCSY (TOtal Correlation SpectroscopY), nous avons pu attribuer tous les signaux observés, et obtenir ainsi une « empreinte digitale » spectrale pour chaque amino ester. Un exemple de spectre de corrélation COSY est présenté sur la Fig. 4. L’ensemble de ces analyses forme une base de données qui nous permet d’analyser et de quantifier des mélanges inconnus d’acides aminés. Un extrait de cette base est donné dans le tableau 1.
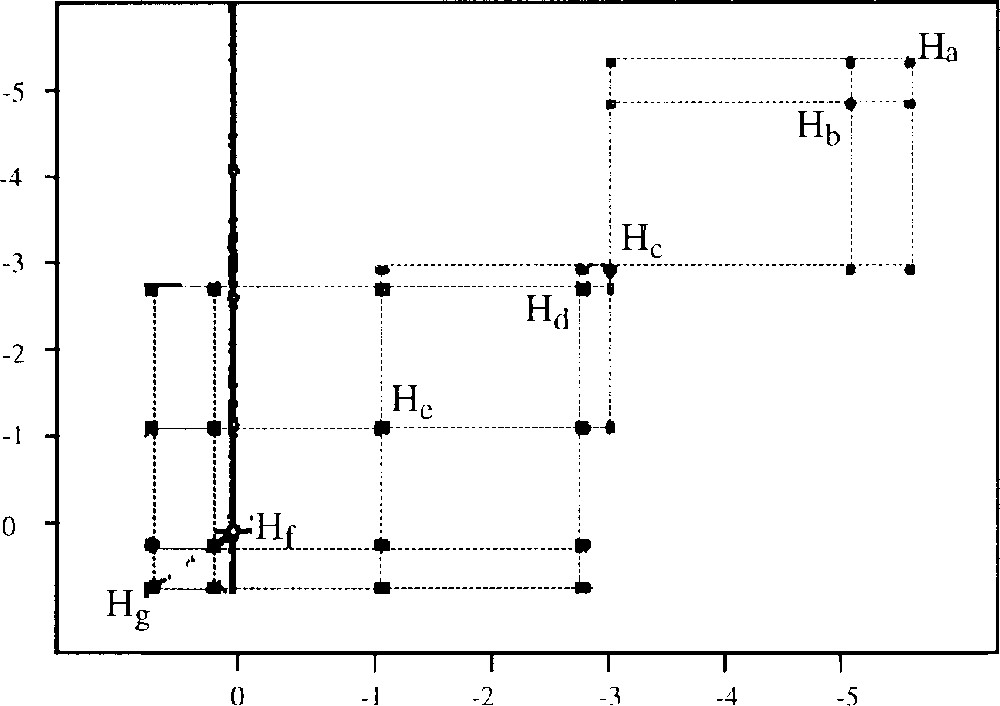
Spectre de RMN 1H COSY (400 MHz) à deux dimensions de l’adduit du diester méthylique de l’acide (S)-glutamique. La ligne verticale à 0 ppm est due à une trace de graisse.
Déplacements chimiques des protons des esters méthyliques de l’acide aspartique et de l’acide glutamique (S) et (R) dans leurs bis-adduits avec CoCl(TMCP).
| Acide aspartique | Acide glutamique | |||
| (R) | (S) | (R) | (S) | |
| Ha | –5,28 (t) | –4,95 (m) | –5,81 (dd) | –5,48 (m) |
| Hb | –4,72 (m) | –4,72 (m) | –5,23 (dd) | –4,97 (m) |
| Hc | –2,48 (m) | –2,79 (t) | –3,39 (m) | –2,93 (m) |
| Hd | –1,28 (q) | –0,79 (m) | –3,24 (m) | –2,79 (m) |
| He | –0,05 (dd) | –0,79 (m) | –1,26 (m) | –1,16 (m) |
| Hf | +0,05 (m) | +0,17 (m) | ||
| Hg | +0,79 (m) | +0,80 (m) | ||
| OMe1 | +2,73 (s) | +2,59 (s) | +2,63 (s) | +2,57 (s) |
| OMe2 | +2,82 (s) | +2,83 (s) | +3,40 (s) | +3,33 (s) |
4 Partie expérimentale
4.1 Réactifs
Les solvants et les produits chimiques sont utilisés sans purification préalable, sauf pour le pyrrole qui est passé sur une colonne d’alumine. Le (1R)-cis-hémicaronaldéhyde (biocartol) est fourni par la société Aventis CropScience. Les acides aminés et certains de leurs esters méthyliques proviennent de Sigma-Aldrich.
4.2 Synthèse du réactif dérivant
La synthèse de la porphyrine base libre TMCPH2 à partir du (1R)-cis-hémicaronaldéhyde (biocartol) et celle du complexe CoCl(TMCP) ont été effectuées selon des méthodes mises au point dans notre laboratoire et décrites dans de précédents articles [7–9].
4.3 Estérification des acides aminés
L’α-acide aminé (1 mmol) et le méthanol (3 ml) sont placés dans un ballon de 10 ml. On ajoute sous agitation du chlorotriméthylsilane (5 mmol) et le milieu réactionnel est agité à température ambiante pendant 20 h selon un procédé de la littérature [10]. Nous avons vérifié que cette estérification s’effectue sans racémisation ni résolution cinétique notable. Le solvant est alors évaporé pour donner l’α-ester méthylique sous forme de chlorhydrate. Celui-ci est neutralisé avec une solution titrée de NaOH, puis l’amino ester obtenu est extrait à l’aide de dichlorométhane et cristallisé.
4.4 Procédure générale de complexation des amino esters par le réactif dérivant
À une solution de 3.3 mg (3 μmol) de CoCl(TMCP) dans CDCl3 est ajouté 6 μmol de (R)- ou de (S)-ester méthylique de l’acide aminé. La couleur du milieu réactionnel passe du rouge au vert. Ce changement de couleur est caractéristique de la formation d’un complexe de cobalt hexacoordonné contenant des ligands azotés en position axiale.
4.5 Spectroscopie de résonance magnétique nucléaire
Les analyses des solutions résultant de l’addition des amino esters sur l’agent dérivant sont effectuées à température ambiante pour des concentrations de 3·10–3 M de CoCl(TMCP) dans CDCl3. Les spectres ont été enregistrés sur des spectromètres Bruker Avance 400 et Avance 500. Les déplacements chimiques sont rapportés au TMS. Dans tous les cas, les paramètres d’acquisition sont identiques, avec 64 accumulations sur des fenêtres spectrales de 20 ppm.
5 Conclusion
Nous avons développé l’utilisation d’ un nouveau réactif analytique chiral, la chlorocobalt(III) tétraméthylchiroporphyrine CoCl(TMCP), pour la détermination par RMN de la composition énantiomérique d’amino esters. Cet agent dérivant présente plusieurs caractéristiques nouvelles, qui se révèlent avantageuses pour la commodité et l’exactitude de l’analyse. Sous l’effet du courant de cycle de la porphyrine, les résonances des espèces à analyser sont déplacées à haut champ dans une zone vierge. L’attribution de structure et de configuration peut donc être faite sans ambiguïté. Grâce à l’inertie cinétique du cobalt(III), le système métal–ligand se trouve en régime d’échange lent à l’échelle de temps de la RMN. Les intensités des signaux considérés reflètent donc réellement les concentrations des espèces individuelles, à la différence des réactifs paramagnétiques, qui fournissent le reflet d’un ensemble d’espèces en équilibre dynamique. À l’exposé de ces avantages, il faut ajouter celui d’un défaut : la modeste sensibilité de détection, intrinsèque à la RMN. Si cette sensibilité se révélait suffisante, ou pouvait être accrue, la méthode pourrait être appliquée à l’analyse des acides aminés présents dans des météorites carbonées et, éventuellement, dans des échantillons de sol martien.
Remerciements
Ce travail a été financé par le Centre national de la recherche scientifique, le Commissariat à l’énergie atomique et le Centre national d’études spatiales. Nous remercions Pierre-Alain Bayle, Isabelle Santarella, Nathalie Gon et Colette Lebrun pour leur aide.



