1 Introduction
Nous avons récemment publié la synthèse de 2-alkylidène-benzo[1,3]dioxin-4-ones [1, 2], une famille d’hétérocycles de structure originale. Au cours de ce travail, nous avons découvert que l’hydrolyse ménagée de la 2-méthylidène-benzo[1,3]dioxin-4-one conduit à un composé d’addition (Fig. 1).
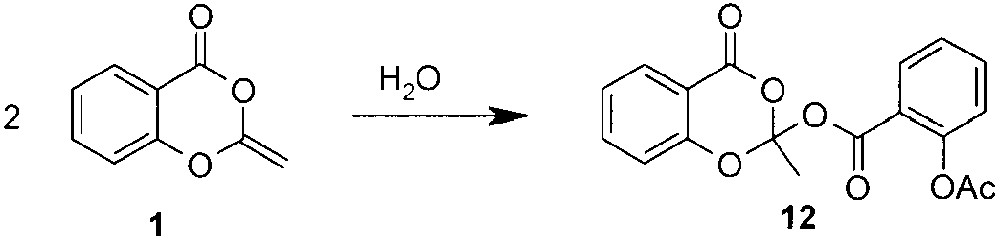
Hydrolyse ménagée de la 2-méthylidène-benzo[1,3]dioxin-4-one.
La formation de l’orthoester peut s’expliquer par l’addition, dans un premier temps, d’une molécule d’eau sur la double liaison exocyclique, suivie d’un réarrangement en acide acétyloxybenzoïque, lequel s’additionne, dans un deuxième temps, sur une deuxième molécule de benzodioxinone (Fig. 2).
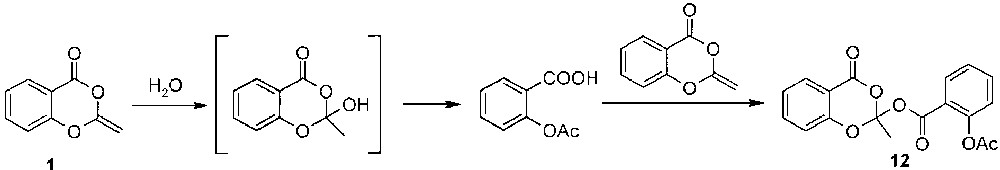
Mécanisme proposé de l’hydrolyse de 1.
Afin de confirmer cette hypothèse, nous avons étudié l’addition d’acides carboxyliques sur quelques alkylidène-benzo[1,3]dioxin-4-ones.
2 Résultats et discussion
Nous avons effectué l’addition de divers acides carboxyliques sur des 2-alkylidène-benzo[1,3]dioxin-4-ones, dont la préparation a été décrite antérieurement [1, 2], à température ambiante ou au reflux (Fig. 3).

Addition d’acides carboxyliques sur quelques 2-alkylidène-benzodioxinones.
L’ensemble de nos résultats ainsi que les conditions opératoires sont rassemblés dans le Tableau 1.
Orthoesters synthétisés
L’avancement des réactions a été suivi par chromatographie sur couche mince. Dans tous les cas, nous avons observé la formation de l’orthoester attendu. Tous les produits ont été purifiés par recristallisation dans le minimum d’acétate d’éthyle, à l’exception du composé 11, qui a été isolé par distillation, et des composés 16 et 17, qui ont été purifiés par flash chromatographie sur colonne de silice.
Les produits isolés sont en bon accord avec les RMN 1H et 13C ainsi qu’avec les spectres IR. Le signal le plus caractéristique est celui du carbone de la fonction orthoester. Ce signal, qui se situe vers 113 ppm, est caractéristique du carbone sp3 des orthoesters obtenus. Cette structure est aussi confirmée par la spectroscopie infrarouge, puisque dans tous les cas la bande anhydride, caractéristique des produits ouverts [3], est absente (Fig. 4).
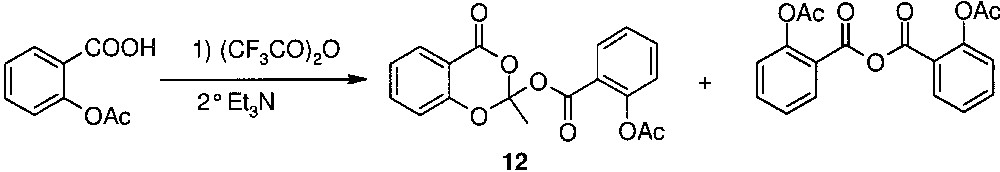
Préparation de 12 selon Falborg et al. [3].
Tous les orthoesters décrits dans ce mémoire sont originaux, à l’exception du composé 12. Il faut cependant noter que ce composé a été obtenu selon une méthode [3] à l’intérêt synthétique limité, car elle ne permet d’obtenir que des orthoesters correspondant à la réaction entre deux molécules du dérivé benzoïque de départ (Fig. 4).
À notre connaissance, il n’existe que trois publications décrivant l’addition d’acides carboxyliques sur un acétal de cétène cyclique. Deux indiquent l’addition de l’acide acétique sur un acétal de cétène dihalogénée [4, 5] ; la troisième décrit l’addition d’acides sur des acétals de cétènes cycliques, mais conduit uniquement aux diesters correspondants [6] (Fig. 5).
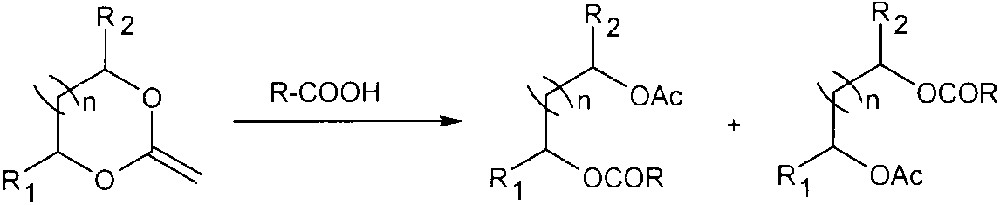
Synthèse de diesters par addition d’acides carboxyliques sur des acétals de cétènes.
Toutefois, les auteurs n’ont jamais mentionné la présence d’orthoesters. Il est probable que les conditions opératoires choisies et la méthode de purification retenue (la chromatographie sur colonne de silice) conduisent aux diesters par ouverture du cycle, après addition de l’acide carboxylique sur la double liaison exocyclique.
Cette hypothèse semble confirmée dans le cas de l’orthoester 16, que nous n’avons pu purifier par recristallisation, mais uniquement par chromatographie sur silice ; le rendement en orthoester chute à 8%, alors que ce dérivé était très largement majoritaire avant purification. De plus, les produits d’ouverture sont indécelables par CCM dans le brut de réaction, alors qu’ils sont très largement majoritaires après passage sur colonne de silice.
3 Conclusion
Cette étude confirme l’hypothèse selon laquelle il est possible de synthétiser des orthoesters originaux par addition d’acides carboxyliques sur des acétals de cétènes substitués. De plus, la méthode que nous proposons ici est d’une portée beaucoup plus générale que celles précédemment décrites, puisqu’il est permis de combiner une large variété d’acides carboxyliques et de benzodioxinones.
4 Partie expérimentale
4.1 Généralités
Les spectres RMN 1H et 13C ont été enregistrés sur un appareil Bruker AC 250 à 250 MHz. Les spectres infrarouge ont été réalisés sur un spectromètre Perkin Elmer FT-IR Paragon 1000.
4.2 Mode opératoire général
Sous atmosphère d’argon, une solution de 6 mmol de 2-alkylidène-benzo[1,3]dioxin-4-one et 6 mmol d’acide carboxylique dans 5 ml d’acétate d’éthyle est agitée à température ambiante (ou 60 °C) pendant 18–40 h (voir Tableau 1). Après élimination des produits légers sous pression réduite, l’orthoester attendu est recristallisé (sauf mention spéciale) dans le minimum d’acétate d’éthyle.
4.2.1 Acétate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 4
F = 84 °C.
RMN 1H (CDCl3) δ (ppm) : 1,84 (s, 3H, CH3) ; 2,14 (s, 3H, CH3) ; 6,99 (d, 1H, 3J = 8,2 Hz) ; 7,16 (dd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz) ; 7,55 (dd, 1H, 3J = 8,2 Hz, 3J = 7,6 Hz) ; 7,91 (d, 1H, 3J = 7,6 Hz).
RMN 13C (CDCl3) δ (ppm) : 21,3 ; 23,9 ; 113,1 (Cq sp3) ; 116,0 ; 116,9 ; 123,9 ; 129,4 ; 136,8 ; 153,7 ; 158,4 ; 167,1.
IRFT (KBr) ν = 1768 ; 1745 cm–1.
Anal. calc. pour C11H10O5 : C, 59,46 ; H, 4,54 ; trouvé : C, 59,39 ; H, 4,58.
4.2.2 Acétoxy-acétate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 5
F = 90 °C.
RMN 1H (CDCl3) δ (ppm) : 2,03 (s, 3H, CH3) ; 2,24 (s, 3H, CH3) ; 4,28–4,35–4,40–4,47 (système AB, 2H, CH2) ; 7,07 (dd, 1H, 3J = 8,2 Hz, 4J = 0,6 Hz) ; 7,25 (ddd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz, 4J = 0,6 Hz) ; 7,64 (ddd, 1H, 3J = 8,2 Hz, 3J = 7,6 Hz, 4J = 1,8 Hz) ; 7,99 (dd, 1H, 3J = 7,6 Hz, 4J = 1,8 Hz).
RMN 13C (CDCl3) δ (ppm) : 20,2 ; 24,1 ; 60,3 ; 113,9 (Cq sp3) ; 116,8 ; 117,1 ; 124,2 ; 129,5 ; 137,0 ; 153,9 ; 158,2 ; 164,8 ; 170,1.
IRFT (KBr) ν = 1769 ; 1750 cm–1.
Anal. calc. pour C13H12O7 : C, 55,72 ; H, 4,32 ; trouvé : C, 54,88 ; H, 4,45.
4.2.3 2-Acétylamino-benzoate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 6
F = 146 °C.
RMN 1H (CDCl3) δ (ppm) : 2,22 (s, 3H, CH3) ; 2,35 (s, 3H, CH3) ; 6,89–6,95 (m, 1H) ; 7,09–7,13 (m, 1H) ; 7,16–7,24 (m, 1H) ; 7,43–7,52 (m, 1H) ; 7,58–7,67 (m, 2H) ; 7,99 (d, 1H, 3J = 7,8 Hz) ; 8,63 (d, 1H, 3J = 7,8 Hz) ; 10,30 (s, 1H, échangeable à l’eau lourde).
RMN 13C (CDCl3) δ (ppm) : 24,2 ; 25,5 ; 112,9 ; 113,4 (Cq sp3) ; 116,9 ; 117,1 ; 120,4 ; 122,5 ; 124,2 ; 129,5 ; 130,8 ; 135,6 ; 137,1 ; 142,2 ; 153,6 ; 158,1 ; 164,7 ; 169,1.
IRFT (KBr) ν = 3327 ; 1750 ; 1709 ; 1697 cm–1.
Anal. calc. pour C18H15NO6 : C, 63,34 ; H, 4,43 ; N, 4,10 ; trouvé : C, 63,41 ; H, 4,39 ; N, 3,99.
4.2.4 2-Acétyl-benzoate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 7
F = 104 °C.
RMN 1H (CDCl3) δ (ppm) : 2,28 (s, 3H, CH3) ; 2,36 (s, 3H, CH3) ; 6,99 (d, 1H, 3J = 8,5 Hz) ; 7,16 (dd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz) ; 7,30–7,40 (m, 4H) ; 7,56 (dd, 1H, 3J = 8,5 Hz, 3J = 7,6 Hz) ; 7,88 (d, 1H, 3J = 7,6 Hz).
RMN 13C (CDCl3) δ (ppm) : 23,7 ; 29,1 ; 113,2 (Cq sp3) ; 117,0 ; 117,1 ; 124,1 ; 127,0 ; 128,8 ; 129,4 ; 129,5 ; 130,6 ; 132,2 ; 137,0 ; 141,5 ; 153,7 ; 158,4 ; 163,8 ; 201,4.
IRFT (KBr) ν = 1761 ; 1746 ; 1694 cm–1.
Anal. calc. pour C18H14O6 : C, 66,26 ; H, 4,32 ; trouvé : C, 66,23 ; H, 4,39.
4.2.5 (1H-Indol-3-yl)-acétate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 8
F = 121 °C.
RMN 1H (CDCl3) δ (ppm) : 2,27 (s, 3H, CH3) ; 3,55 (s, 2H, CH2) ; 6,87–7,43 (m, 8H) ; 7,77 (d, 1H, 3J = 7,4 Hz) ; 8,23 (s, 1H, échangeable à l’eau lourde).
RMN 13C (CDCl3) δ (ppm) : 24,0 ; 31,9 ; 106,7 ; 111,4 ; 113,0 (Cq sp3) ; 116,4 ; 116,7 ; 118,4 ; 119,7 ; 122,1 ; 123,4 ; 123,8 ; 127,7 ; 129,0 ; 136,0 ; 136,5 ; 153,4 ; 158,9 ; 168,4.
IRFT (KBr) ν = 3352 ; 1759 ; 1746 ; 1736 ; 1617 cm–1.
Anal. calc. pour C19H15NO5 : C, 67,65 ; H, 4,48 ; N, 4,15 ; trouvé : C, 67,78 ; H, 4,39 ; N, 4,21.
4.2.6 2-Oxo-propionate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 9
F = 94 °C.
RMN 1H (CDCl3) δ (ppm) : 2,19 (s, 3H, CH3) ; 2,21 (s, 3H, CH3) ; 6,95 (d, 1H, 3J = 8,2 Hz) ; 7,16 (dd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz) ; 7,56 (ddd, 1H, 3J = 7,6 Hz, 3J = 8,2 Hz, 4J = 1,2 Hz) ; 7,88 (dd, 1H, 3J = 7,6 Hz, 4J = 1,2 Hz).
RMN 13C (CDCl3) δ (ppm) : 24,2 ; 26,7 ; 113,0 (Cq sp3) ; 117,3 ; 117,4 ; 124,8 ; 129,9 ; 137,6 ; 153,7 ; 157,1 ; 158,0 ; 190,3.
IRFT (KBr) ν = 1773 ; 1757 ; 1735 ; 1694 cm–1.
Anal. calc. pour C12H10O6 : C, 57,60 H, 4,03 ; trouvé : C, 57,74 ; H, 4,11.
4.2.7 Phényl-acétate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 10
F = 89 °C.
RMN 1H (CDCl3) δ (ppm) : 2,17 (s, 3H, CH3) ; 3,39 (s, 2H, CH2) ; 6,89–6,93 (m, 2H) ; 7,08–7,12 (m, 5H) ; 7,48 (ddd, 1H, 3J = 7,8 Hz, 3J = 7,7 Hz, 4J = 1,3 Hz) ; 7,84 (dd, 1H, 3J = 7,8, 4J = 1,5 Hz).
RMN 13C (CDCl3) δ (ppm) : 23,9 ; 41,7 ; 113,2 (Cq sp3) ; 116,3 ; 116,8 ; 123,9 ; 127,2 ; 128,5 ; 128,8 ; 129,4 ; 132,7 ; 136,7 ; 153,5 ; 158,3 ; 167,6.
IRFT (KBr) ν = 1760 ; 1616 cm–1.
Anal. calc. pour C17H14O5 : C, 68,45 ; H, 4,73 ; trouvé : C, 68,32 ; H, 4,66.
4.2.8 2,2-Diméthyl-propionate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 11
Eb0.5 mm = 150 °C
RMN 1H (CDCl3) δ (ppm) : 0,91 (s, 9H, 3CH3) ; 2,20 (s, 3H, CH3) ; 7,05 (d, 1H, 3J = 7,9 Hz) ; 7,20 (dd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz) ; 7,60 (dd, 1H, 3J = 7,6 Hz, 3J = 7,9 Hz) ; 7,98 (d, 1H, 3J = 7,6 Hz).
RMN 13C (CDCl3) δ (ppm) : 23,9 ; 26,9 ; 39,4 ; 113,7 (Cq sp3) ; 116,3 ; 117,0 ; 124,1 ; 129,2 ; 136,6 ; 153,7 ; 158,7 ; 174,4.
IRFT (film) ν = 1756 ; 1616 cm–1.
Anal. calc. pour C14H16O5 : C, 63,63 ; H, 6,10 ; trouvé : C, 63,75 ; H, 6,14.
4.2.9 2-Acétoxy-benzoate de 2-méthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 12
F = 120 °C.
RMN 1H (CDCl3) δ (ppm) : 2,35 (s, 3H) ; 2,37 (s, 3H) ; 6,98–7,22 (m, 4H) ; 7,42–7,63 (m, 2H) ; 7,7 (dd, 1H, 3J = 7,8 Hz, 4J = 1,6 Hz) ; 7,98 (dd, 1H, 3J = 7,8 Hz, 4J = 1,6 Hz).
RMN 13C (CDCl3) δ (ppm) : 20,9 ; 24,0 ; 113,0 (Cq sp) ; 116,8 ; 117,0 ; 122,1 ; 123,9 ; 124,1 ; 126,0 ; 129,4 ; 131,7 ; 134,7 ; 137,0 ; 150,8 ; 153,5 ; 158,3 ; 160,5 ; 169,5.
IRFT (KBr) ν = 1770 ; 1744 ; 1617 ; 1604 cm–1.
Anal. calc. pour C18H14O7 : C, 63,16 ; H, 4,12 ; trouvé : C, 62,45 ; H, 4,18.
4.2.10 2-Acétoxy-benzoate de 2-éthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 13
F = 94°C
RMN 1H (CDCl3) δ (ppm) : 1,22 (t, 3H, 3J = 7,5 Hz); 2,36 (s, 3H) ; 2,67 (q, 1H, 3J = 7,5 Hz) ; 2,68 (q, 1H, 3J = 7,5 Hz) ; 7,04 (dd, 1H, 3J = 8,2 Hz, 4J = 1,1 Hz) ; 7,11 (dd, 1H, 3J = 8,2 Hz, 4J = 0,9 Hz) ; 7,12–7,26 (m, 2H) ; 7,53 (ddd, 1H, 3J = 6,9 Hz, 3J = 7 Hz, 4J = 1,6 Hz) ; 7,61 (ddd, 1H, 3J = 8 Hz, 3J = 7,2 Hz, 4J = 1,7 Hz) ; 7,74 (dd, 1H, 3J = 7,9 Hz, 4J = 1,5 Hz) ; 8,02 (dd, 1H, 3J = 7,6 Hz, 4J = 1,3 Hz).
RMN 13C (CDCl3) δ (ppm) : 7,2 ; 20,9 ; 29,7 ; 113,1 (Cq sp3) ; 117 ; 118,7 ; 122,1 ; 124 ; 124,1 ; 126,1 ; 129,4 ; 131,7 ; 134,7 ; 137 ; 150,7 ; 153,8 ; 158,6 ; 160,4 ; 169,4.
IRFT (KBr) ν = 1769 ; 1747 ; 1612 ; 1609 cm–1.
Anal. calc. pour C19H16O7 : C, 64,04 ; H, 4,53 trouvé : C, 63,95 ; H, 4,49.
4.2.11 2-Acétylamino-benzoate de 2-éthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 14
F = 128 °C
RMN 1H (CDCl3) δ (ppm) : 1,24 (t, 3H, 3J = 7,4 Hz) ; 2,26 (s, 3H) ; 2,71 (q, 2H, 3J = 7,4 Hz) ; 6,97 (dd, 1H, 3J = 7,4 Hz, 3J = 7,6 Hz) ; 7,15 (d, 1H, 3J = 8,1 Hz) ; 7,24 (dd, 1H, 3J = 7,4 Hz, 3J = 7,6 Hz) ; 7,52 (ddd, 1H, 3J = 7,4 Hz, 3J = 7,6 Hz, 4J = 1,6 Hz) ; 7,57–7,74 (m, 2H) ; 8,02 (dd, 1H, 3J = 7,6 Hz, 4J = 1,7 Hz) ; 8,66 (d, 1H, 3J = 8,6 Hz) ; 10,7 (s élargi, 1H, échangeable à l’eau lourde).
RMN 13C (CDCl3) δ (ppm) : 7,3 ; 25,5 ; 29,9 ; 112,9 ; 113,5 (Cq sp3) ; 116,9 ; 118,9 ; 120,6 ; 122,7 ; 124,2 ; 129,6 ; 130,9 ; 135,7 ; 137,2 ; 142,2 ; 153,8 ; 159,6 ; 164,7 ; 169,3.
IRFT (KBr) ν = 3331 ; 1768 ; 1700 ; 1617 cm–1.
Anal. calc. pour C19H17NO6 : C, 64,22 ; H, 4,82 ; N, 3,94 ; trouvé : C, 64,33 ; H, 4,80 ; N, 3,99.
4.2.12 Acétate de 2-éthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 15
F = 58°C
RMN 1H (CDCl3) δ (ppm): 1,14 (t, 3H, 3J = 7,5 Hz) ; 1,9 (s, 3H); 2,54 (q, 1H, 3J = 7,5 Hz) ; 2,56 (q, 1H, 3J = 7,5 Hz) ; 7,07 (dd, 1H, 3J = 8,2 Hz, 4J = 0,8 Hz) ; 7,22 (ddd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz, 4J = 0,8 Hz) ; 7,63 (ddd, 1H, 3J = 8,2 Hz, 3J = 7,6 Hz, 4J = 1,7 Hz) ; 8,0 (dd, 1H, 3J = 7,6 Hz, 4J = 1,7 Hz).
RMN 13C (CDCl3) δ (ppm) : 7,3 ; 21,4 ; 29,6 ; 113,7 (Cq sp3) ; 116,9 ; 118,2 ; 123,8 ; 129,4 ; 136,8 ; 153,8 ; 162,9 ; 169,3.
IRFT (KBr) ν = 1756 ; 1616 cm–1.
Anal. calc. pour C12H12O5 : C, 61,01 ; H, 5,12 ; trouvé : C, 60,89 ; H, 5,19.
4.2.13 2-Acétylamino-benzoate de 2-méthoxyméthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 16
F = 122 °C ; colonne de silice : éluant CH2Cl2/AcOEt (8:2).
RMN 1H (CDCl3) δ (ppm) : 2,13 (s, 3H) ; 3,46 (s, 3H) ; 4,2 (s, 2H) ; 6,85 (ddd, 1H, 3J = 8,1 Hz, 3J = 7,5 Hz, 4J = 1,1 Hz) ; 7,06 (d, 1H, 3J = 8,2 Hz) ; 7,13 (ddd, 1H, 3J = 7,8 Hz, 3J = 7,6 Hz, 4J = 1,2 Hz) ; 7,39 (ddd, 1H, 3J = 7,8 Hz, 3J = 8 Hz, 4J = 1,5 Hz) ; 7,54 (ddd, 1H, 3J = 7,8 Hz, 3J = 7,6 Hz, 4J = 1,2 Hz) ; 7,65 (dd, 1H, 3J = 7,8 Hz, 4J = 1,8 Hz) ; 7,87 (dd, 1H, 3J = 7,8 Hz, 4J = 1,5 Hz) ; 8,6 (d, 1H, 3J = 8,5 Hz) ; 10,5 (s élargi, 1H, échangeable à l’eau lourde).
RMN 13C (CDCl3) δ (ppm) : 25,5 ; 60,3 ; 72,7 ; 112,8 ; 113,4 (Cq sp3) ; 115,7 ; 117 ; 120,5 ; 122,6 ; 124,4 ; 129,7 ; 131,2 ; 135,8 ; 137,3 ; 142,2 ; 153,6 ; 158,9 ; 164,5 ; 169,6.
IRFT (KBr) ν = 3339 ; 1774 ; 1701 ; 1618 cm–1.
Anal. calc pour C19H17NO7 : C, 61,45 ; H, 4,61 ; N, 3,77 ; trouvé : C, 61,41 ; H, 4,63 ; N, 3,81.
4.2.14 Acétate de 2-méthoxyméthyl-4-oxo-4H-benzo[1,3]dioxin-2-yl 17
F = 72°C ; colonne de silice : éluant CH2Cl2/AcOEt (8/2).
RMN 1H (CDCl3) δ (ppm) : 2,13 (s, 3H) ; 3,57 (s, 3H) ; 4,37 (s, 2H) ; 7,05 (dd, 1H, 3J = 8,1 Hz, 4J = 0,7 Hz) ; 7,20 (ddd, 1H, 3J = 7,6 Hz, 3J = 7,6 Hz, 4J = 0,7 Hz) ; 7,61 (ddd, 1H, 3J = 8,1 Hz, 3J = 7,6 Hz, 4J = 1,6 Hz) ; 8,15 (dd, 1H, 3J = 7,6 Hz, 4J = 1,6 Hz).
RMN 13C (CDCl3) : 21,6 ; 62,3 ; 73,1 ; 113,1 (Cq sp3) ; 116,4 ; 118,5 ; 124,2 ; 130,4 ; 136,2 ; 153,7 ; 164,6 ; 169,3.
IRFT (KBr) ν = 1772 ; 1704 ; 1607 cm–1.
Anal. calc. pour C12H12O6 : C, 57,14 ; H, 4,80 ; trouvé : C, 57,22 ; H, 4,89.
Remerciements
Ce travail a été soutenu financièrement par Rhodia-Chimie.


