1 Introduction
Le graphite est une structure d’accueil bidimensionnelle lamellaire, susceptible d’accueillir aussi bien des réactifs donneurs d’électrons qu’accepteurs d’électrons. Nous nous limiterons dans cet article aux composés d’intercalation du graphite avec les donneurs d’électrons et, parmi ceux-ci, nous n’étudierons que les matériaux purement inorganiques. En effet, les composés contenant des molécules organiques forment une famille à part entière, bien différente de celle étudiée ici.
2 Le graphite : une structure d’accueil pour l’intercalation
2.1 Structure, comportement amphotère du graphite
Le graphite est la structure d’accueil bidimensionnelle la plus simple, puisqu’elle ne contient qu’un seul type d’atome. La variété la plus stable, de structure hexagonale, est constituée d’un empilement de type AB de feuillets plans, dans lesquels les atomes de carbone, distants de 142 pm, forment entre eux des liaisons covalentes. L’hybridation sp2 de ces atomes de carbone disposés au sommet d’hexagones réguliers conduit à considérer les feuillets comme des macromolécules aromatiques, d’où leur appellation de « feuillets de graphène ».
Dans la direction perpendiculaire, des liaisons de Van der Waals maintiennent les feuillets régulièrement espacés. La distance qui sépare ces derniers, appelée distance interplanaire di, est relativement élevée, en raison des liaisons faibles échangées dans cette direction, puisqu’elle atteint 335 pm. La « lacune de Van der Waals » qui apparaît ainsi va permettre les réactions d’intercalation.
De par son caractère aromatique, le graphite présente un comportement amphotère. Chaque réaction d’intercalation s’accompagne d’un transfert électronique et s’apparente donc systématiquement à une réaction d’oxydoréduction. Mais ce caractère amphotère limite son caractère accepteur d’électrons (comme son caractère donneur, d’ailleurs). En effet, il apparaît comme une structure d’accueil moins oxydante que le fullerite, par exemple. En effet, cette autre variété allotropique cristallisée du carbone, de dimensionnalité nulle, montre un caractère accepteur d’électrons si marqué qu’il n’intervient quasiment que comme oxydant dans les réactions d’intercalation.
2.2 Termes énergétiques mis en jeu au cours de l’intercalation
Selon le « modèle ionique » [1], l’intercalation d’un donneur d’électrons M dans le graphite fait intervenir une série de termes énergétiques qui peuvent être brièvement décrits à partir de la Fig. 1.
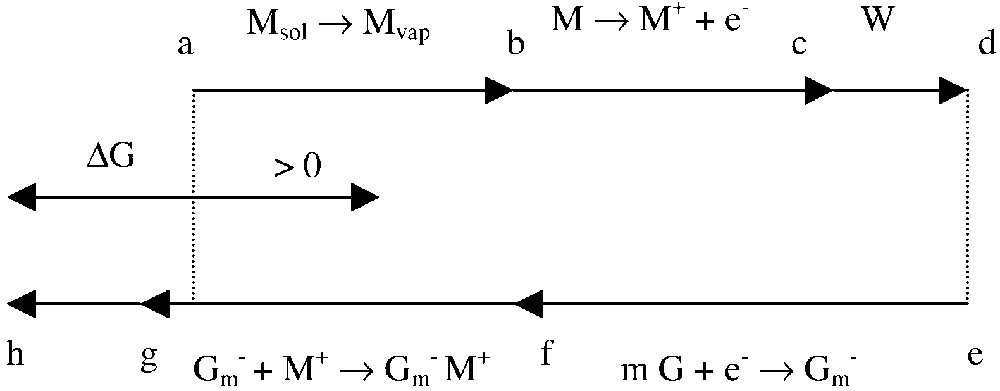
Bilan des termes énergétiques mis en jeu au cours de l’intercalation dans le graphite d’un métal M, dans le cadre du modèle ionique.
Le passage de (a) à (b) nécessite la vaporisation du métal, puis la transition de (b) à (c) met en jeu le potentiel d’ionisation du métal. Vient ensuite, entre (c) et (d), le travail d’écartement des feuillets. L’occupation de la lacune de Van der Waals pour un intercalat produit un accroissement plus ou moins important de la distance interplanaire : celle-ci passe d’une valeur initiale de 335 pm à une valeur di imposée par l’épaisseur de la couche intercalée. L’attraction entre feuillets de graphène étant due à des forces faibles, le travail d’écartement reste modéré. La décroissance rapide de l’attraction lorsque la distance interplanaire augmente rend possible l’intercalation de couches épaisses.
Ces trois termes sont positifs.
Le passage de (e) à (f) correspond à l’énergie libérée par la capture d’un électron par les feuillets de graphène. L’étape suivante correspond aux interactions de type électrostatique : d’une part, l’attraction coulombienne entre le cation positif et le feuillet de graphène chargé négativement et, d’autre part, la répulsion entre cations intercalés. Cette dernière contribution étant nettement plus faible que la précédente, le terme énergétique est globalement largement négatif. Enfin, le passage de (g) à (h) traduit l’énergie relative aux forces de Van der Waals qui se manifestent après intercalation.
La variation d’enthalpie libre pour l’ensemble des processus, ΔG, est négative.
2.3 Notion de stade
Le plus souvent, l’intercalat vient occuper toutes les lacunes de Van der Waals, ce qui conduit à un composé saturé de premier stade. Cependant, l’intercalat peut venir n’occuper qu’un intervalle sur 2, 3 ou plus. On définit alors le stade d’un composé par le nombre de feuillets de graphène compris entre deux feuillets intercalés successifs. La distance entre ces derniers, appelée période d’identité Ic, est reliée au stade s et à la distance interplanaire di par la relation suivante, les distances étant exprimées en picomètres :
Néanmoins, dans un composé de stade supérieur à 1, le modèle des feuillets plissés [2] exprime le fait que l’intercalat est également réparti dans chaque espace interfeuillet. Pour un composé de stade 3, par exemple, ce n’est pas une lacune de Van der Waals sur trois qui est occupée, les deux autres restant vides ; au contraire, l’intercalat occupe tous les espaces interfeuillets, sous forme de domaines (de l’ordre de la centaine de nanomètres) qui recouvrent un tiers seulement de la surface des feuillets adjacents. Les deux tiers restants correspondent à des domaines inoccupés. Le passage de la distance interplanaire des intervalles vides à la distance interplanaire des espaces occupés se fait par plissement des feuillets. En effet, la faible épaisseur des feuillets de la structure d’accueil autorise la répulsion électrostatique entre couches intercalées de même charge à travers ceux-ci, ce qui permet une répartition régulière des couches intercalées dans la matrice hôte.
2.4 Interactions structure d’accueil–intercalat
2.4.1 Organisation dans la direction de l’axe c et transfert de charge
La réaction d’intercalation d’une espèce donneuse d’électrons dans le graphite étant une réaction d’oxydoréduction, le feuillet intercalé porte globalement une charge positive, tandis que le feuillet de graphène est chargé négativement. Il en résulte une alternance dans la direction de l’axe c de couches positives (intercalat) et négatives (graphène). C’est le cas simple d’un feuillet intercalé constitué d’une couche monoatomique. Le feuillet intercalé peut également être polycouche : dans ce cas plus complexe, cette alternance de charges positives et négatives est conservée au sein du feuillet intercalé. C’est le cas par exemple du mercurographiture de potassium KHgC4, dont la séquence des couches dans la direction de l’axe c est la suivante :
2.4.2 Organisation des feuillets intercalés – commensurabilité et stœchiométrie
Lorsque les espèces intercalées n’exercent pas entre elles de liaisons fortes, elles occupent les puits de potentiel des feuillets adjacents. Ces derniers peuvent d’ailleurs glisser l’un par rapport à l’autre pour offrir des sites adaptés aux espèces intercalées. La maille de l’intercalat est alors commensurable avec celle des feuillets de graphène. Les paramètres du feuillet intercalé ai et bi sont reliés à ceux des feuillets de graphène aG et bG par les relations suivantes, où p, q, u et v sont des entiers relatifs :
La structure du composé d’intercalation ne pourra être décrite au moyen d’une maille unique que si la commensurabilité est vérifiée.
Lorsque la commensurabilité est établie, la formule chimique se déduit du rapport des surfaces des mailles de l’insérat et du feuillet de graphène en tenant compte du nombre d’atomes contenus dans chacune d’elles. Le rapport espèce intercalée/carbone est alors un entier ou une fraction d’entiers. Un cas simple est celui du composé de premier stade graphite–lithium, de formule LiC6. C’est une formule topochimique, puisqu’elle ne respecte pas la valence des éléments.
L’incommensurabilité est plus fréquente lorsque l’intercalat est constitué de feuillets polycouches possédant une forte cohésion interne. Les coefficients stœchiométriques de la formule chimique du composé d’intercalation sont alors quelconques.
3 Les composés binaires
Le graphite présentant un caractère accepteur modéré, seuls les éléments fortement réducteurs vont pouvoir réagir aisément avec celui-ci. C’est le cas des métaux alcalins, alcalinoterreux et de certains lanthanoïdes.
3.1 Alcalins lourds : césium, rubidium et potassium
Dès 1926, Fredenhagen et Cadenbach [3] décrivent la réaction entre le graphite et chacun des trois métaux alcalins lourds, potassium, rubidium et césium. C’est quelques années plus tard, en 1932, que Schleede et Wellmann [4] mettent en évidence la nature lamellaire de ces composés grâce à des études radiocristallographiques.
Les formules chimiques des différents stades sont déterminées par Rüdorff et Schulze [5] en 1954 et A. Hérold [6] en 1955, tandis que la structure complète du composé de premier stade, de formule KC8, est décrite pour la première fois en 1978 par Lagrange et al. [7]. Celle des binaires avec les deux autres métaux alcalins lourds, rubidium et césium, sont déterminées à la même période respectivement par Lagrange et al. [8] et Guérard et al. [9]. Les distances interplanaires valent respectivement 535, 562 et 592 pm. Les feuillets intercalés présentent une maille hexagonale de paramètre a égal à 492 pm, appelée maille « octale ».
Dans les trois cas, l’action de la vapeur ou du liquide sur le graphite conduit très facilement aux composés saturés de formule MC8.
3.2 Sodium
Le comportement du sodium est bien différent, puisqu’en effet il s’intercale difficilement, pour ne conduire qu’à des composés de stade élevé. C’est en 1958 qu’Asher [10] réussit à isoler une phase de huitième stade. Une vingtaine d’années plus tard, Métrot et al. [11] confirment ces résultats et obtiennent des binaires purs de stades 8, 7 et 6, présentant tous une distance interplanaire de 452 pm et répondant à la formule générale NaC8s (s étant le stade). En abaissant la température, ils obtiennent un mélange de graphite et de composés de stades 6, 5 et 4. Ceci indique que les difficultés rencontrées lors de l’intercalation du sodium sont essentiellement de nature thermodynamique : plus la température est basse, plus lente et moins complète est l’intercalation, mais plus riches en métal sont les composés formés.
3.3 Lithium
Ce métal alcalin, dont les propriétés physiques et chimiques diffèrent de celles des autres métaux de la première colonne, présente également un comportement qui se distingue très nettement de celui des alcalins lourds en ce qui concerne ses capacités d’intercalation dans le graphite. Néanmoins, comme ces derniers, et contrairement au sodium, il est capable de conduire à un composé binaire de premier stade dont la distance interplanaire vaut 370 pm [12, 13]. Toutefois, probablement en raison de la plus faible taille de ce métal, la quantité intercalée est supérieure de 33,3% dans le cas du lithium : le nombre d’atomes métalliques intercalés ramené à un atome de carbone est en effet de 1/6 pour le lithium. La maille bidimensionnelle hexagonale, dont le paramètre a est égal à 426 pm, est appelée maille « hexale ».
Ce composé LiC6 est largement utilisé aujourd’hui dans les électrodes négatives des accumulateurs à ions lithium.
Néanmoins, des composés binaires graphite–métal alcalin encore plus riches en métal intercalé ont été observés, soit en réalisant les synthèses sous forte pression [14, 15], soit en utilisant les méthodes de mécanosynthèse [16], dans le cas du lithium. Dans tous les cas, les composés binaires obtenus sont au mieux thermodynamiquement métastables.
3.4 Alcalinoterreux et lanthanoïdes
Tout comme ce qui se passe dans le cas du lithium, l’intercalation des métaux alcalinoterreux conduit à des composés de formule MC6. Cependant, la température de réaction est limitée par les risques de formation du carbure MC2. Dans les cas du strontium et du baryum, l’intercalation est totale, tandis qu’elle reste superficielle avec le calcium. Les distances interplanaires des composés de premier stade CaC6, SrC6 et BaC6 valent respectivement 455, 495 et 526 pm [17] et les feuillets intercalés possèdent une structure hexale.
Seuls quelques lanthanoïdes ont la capacité de réagir, de façon incomplète, avec le graphite pour conduire à des composés de type MC6 [18].
3.5 Éléments moins électropositifs
Comme le montre ce bref aperçu des composés binaires graphite–donneurs d’électrons, seuls les métaux alcalins lourds, et dans une moindre mesure le lithium, donnent facilement naissance à des composés binaires de premier stade. Le caractère électropositif, donc réducteur fort de l’élément considéré, sa faible température de fusion font partie des conditions requises pour l’intercalation. On comprendra donc facilement que les éléments de transition, bien que métalliques, ne soient pas de bons candidats à l’intercalation directe dans le graphite et que les métalloïdes le soient encore moins.
Les tentatives d’intercalation de tous les éléments incapables de s’intercaler seuls ont donc suscité de nombreux travaux. Deux voies de synthèse, indirecte et directe, ont été explorées. La première consiste à réaliser une réaction d’intercalation, suivie d’une réaction chimique in situ entre les feuillets de graphène. À titre d’exemple, l’intercalation du fer dans le graphite peut être obtenue en deux étapes : la première consiste à réaliser l’intercalation de cet élément sous une forme capable de réagir avec le graphite. Le chlorure de fer FeCl3 répond à cette exigence et conduit en présence de chlore à un composé de premier stade de type graphite–accepteur d’électrons [19]. Cette intercalation doit être suivie d’une réaction de réduction de l’halogénure intercalé entre les feuillets de graphène. Pour cela, un réducteur capable de s’intercaler seul dans le graphite est un bon candidat : ce peut être un métal alcalin et tout particulièrement le césium qui, grâce à sa forte tension de vapeur à des températures peu élevées, permet une réduction douce in situ, qui limite beaucoup la formation de clusters tridimensionnels [20]. La matrice graphitique contient alors des plages de fer bidimensionnel intercalé, mais également les autres produits de la réaction, en particulier le chlorure de césium, présent en quantité importante compte tenu de la stœchiométrie de la réaction :
Cette voie de synthèse ne peut donc conduire à des composés d’intercalation purs.
La synthèse directe nécessite un réactif capable de s’intercaler seul, qui va servir de vecteur au tiers-élément qui, lui, ne possède pas cette capacité. On obtient ainsi un composé ternaire graphite–réactif vecteur–tiers-élément. Cependant, un certain nombre de conditions sont requises et la co-intercalation des deux éléments ne reste possible que pour un nombre limité de couples.
4 Les composés ternaires
À l’heure actuelle, deux voies de synthèse principales ont été ouvertes pour l’obtention de composés ternaires. Dans les deux cas, le réactif vecteur est un élément qui s’intercale facilement dans le graphite : c’est un métal alcalin, le plus souvent un métal alcalin lourd, et dans certains cas le sodium. Ensuite, la méthode de synthèse va dépendre essentiellement de l’électronégativité de l’élément qui va lui être associé.
4.1 Tiers-élément fortement électronégatif (électronégativité supérieure à 2 dans l’échelle de Pauling)
Lorsqu’un élément très électronégatif est ajouté à un métal alcalin, le comportement de ce dernier est fortement modifié. Prenons le cas du potassium, qui a été largement étudié. L’action de potassium en excès (en phase vapeur ou liquide) sur un échantillon de graphite conduit au composé saturé de premier stade, de formule KC8, dans lequel tous les intervalles graphitiques sont occupés par une couche monoatomique de potassium. À titre d’exemple, choisissons d’associer au potassium l’élément soufre afin d’étudier le système graphite–potassium–soufre. L’action du potassium contenant une faible quantité de soufre conduit à un composé ternaire, dont les feuillets intercalés sont systématiquement polycouches, selon la séquence potassium–soufre–potassium. La formation de ces feuillets intercalés polycouches est directement liée à la différence d’électronégativité entre les deux éléments. La réaction est effectuée en immergeant un échantillon de pyrographite dans du potassium liquide contenant environ 1% atomique de soufre, à une température comprise entre 400 et 600 °C [21, 22]. Le milieu alcalin fondu, extrêmement réducteur, nécessite l’utilisation d’un réacteur en acier inoxydable parfaitement étanche. Cette étanchéité est assurée par un joint, lui-même en acier inoxydable, ou par une soudure à l’arc électrique sous argon. Compte tenu de la très grande réactivité chimique des métaux alcalins, le remplissage du réacteur et l’extraction de l’échantillon après réaction sont réalisés dans une boîte à gants à circulation d’argon purifié par tamis moléculaires et copeaux d’alliages Ti–Zr chauffés à 750 °C. Différentes phases ont été obtenues, dont certaines ont pu être isolées ; c’est le cas du composé KC3S0,25, dont la structure a pu être entièrement déterminée [23]. La distance interplanaire s’élève à 875 pm. La Fig. 2 permet de comparer ce composé ternaire avec le composé binaire KC8. Le feuillet intercalé est constitué d’une tricouche potassium–soufre–potassium, qui peut être considérée comme une tranche du composé ionique tridimensionnel K2S, de structure antifluorine.
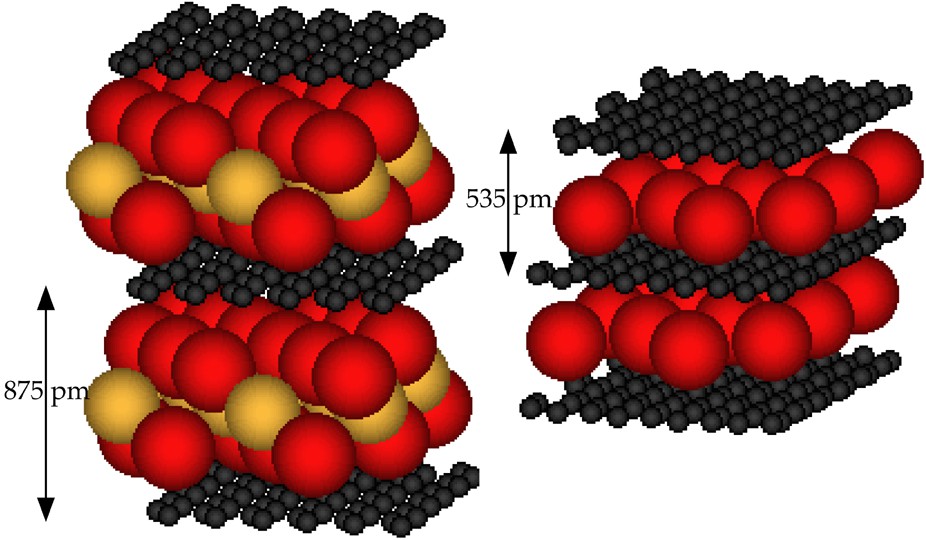
Comparaison du composé ternaire graphite–potassium–soufre KC3S0,25 et du composé binaire KC8 (les atomes de carbone sont représentés en noir, ceux de potassium en rouge et ceux de soufre en jaune).
Au sein de l’ensemble des éléments électronégatifs, le potassium a permis l’intercalation de tous les chalcogènes : oxygène, soufre, sélénium [24] et tellure [25], ainsi que du phosphore [26], qui appartient à la colonne 15.
La méthode de synthèse mise en œuvre (milieu potassium fondu contenant quelques pour-cent atomiques de tiers-élément) conduit systématiquement à un composé de premier stade, dont la distance interplanaire, parfaitement définie pour chacun d’eux, est comprise entre 850 et 910 pm. L’étude quantitative par diffraction des rayons X des réflexions 00l permet d’établir le profil de densité électronique expérimental que l’on compare à celui calculé à partir d’un modèle. Dans chacun des cas, les feuillets intercalés sont tricouches et globalement donneurs d’électrons vis-à-vis des feuillets de graphène, qui deviennent dans tous les cas des macroanions graphiture. À titre d’exemple, la Fig. 3 présente les profils de densité électronique expérimental et calculé relatifs au composé KC3Se0,15. Le transfert de charge est toujours plus élevé que dans les composés binaires. La quantité de potassium intercalé est d’ailleurs au minimum doublée par rapport à celle du binaire de premier stade de formule KC8, puisque le rapport C/tiers-élément est compris entre 3 et 4. Quant à la quantité de tiers-élément intercalé, elle varie de 0,07 (cas de l’oxygène) à 0,35 (cas du tellure) par atome de potassium. L’enrichissement en tiers-élément au cours de la réaction d’intercalation est impressionnant. Malgré la concentration élevée de potassium dans ces composés, ils sont beaucoup plus stables chimiquement vis-à-vis de l’air et de l’eau que les binaires graphite–métal alcalin. Cette stabilité chimique s’explique, selon toute vraisemblance, par une forte cohésion du feuillet intercalé, liée à son caractère iono-covalent. Celle-ci est confortée par un blocage cinétique de l’oxydation, créé par une couche d’oxyde puis d’hydroxyde au bord des feuillets.
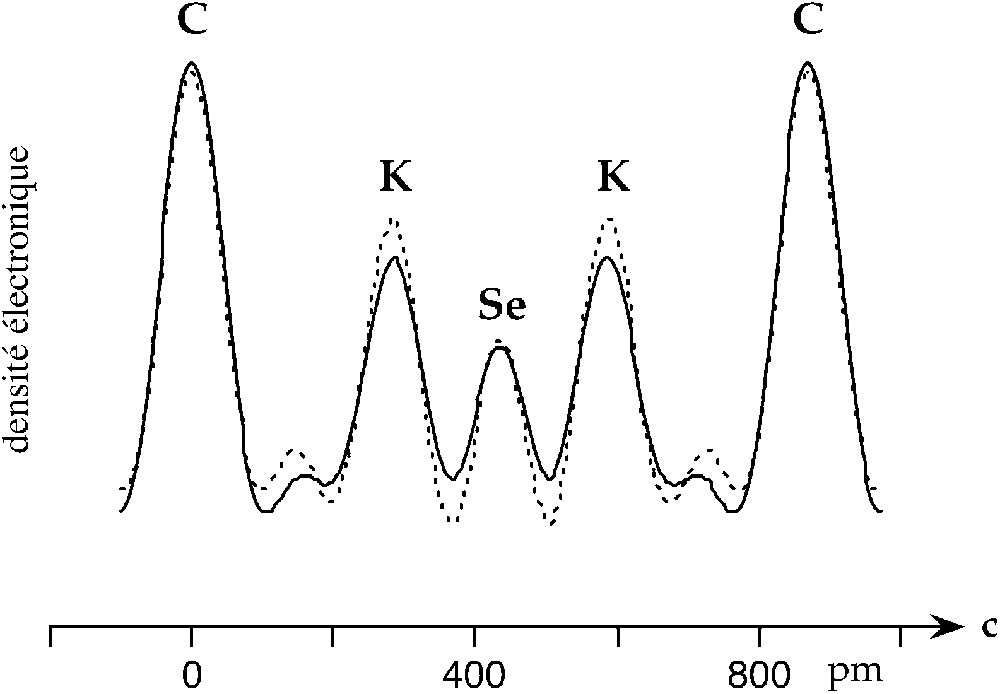
Profils de densité électronique selon l’axe c (expérimental : trait plein ; calculé : traits pointillés) du composé graphite–potassium–sélénium KC3Se0,15.
Les autres métaux alcalins lourds ont été uniquement associés à l’oxygène, ce qui a également conduit à l’obtention de composés ternaires du même type [27, 28].
Le cas du sodium est sensiblement différent, car il s’agit d’un élément qui s’intercale beaucoup plus difficilement que les autres alcalins. Malgré cela, il a conduit à un composé ternaire de stade 2 avec l’oxygène [29] et à une nouvelle famille de composés ternaires avec les halogènes [30].
Le composé graphite–sodium–oxygène obtenu à 450 °C par immersion d’un échantillon de graphite dans du sodium liquide contenant environ 1% atomique d’oxygène, de second stade, a pour formule chimique NaC6O0,5. Chaque feuillet intercalé est constitué d’une pentacouche dont l’empilement Na–O–Na–O–Na dérive directement de la structure du peroxyde de sodium tridimensionnel. En effet, comme dans le composé libre, les anions peroxyde O22– occupent les doubles sites octaédriques créés par l’empilement des cations Na+. Le feuillet intercalé contient cependant un excès de cations, de telle sorte que les plans de graphène deviennent des macroanions. La présence d’ions peroxyde a par ailleurs été confirmée par des études par XPS et UPS [31]. Ce composé possède une anisotropie de conductivité très élevée, puisqu’elle vaut 3,46 × 105 à température ambiante pour atteindre 9,96 × 105 à 4,2 K.
Les composés graphite–sodium–halogène, préparés avec le chlore, le brome ou l’iode, appartiennent tous au second ou au troisième stade [32]. Le fluor n’a pu être intercalé qu’en présence d’un autre halogène pour former un composé quaternaire. Les composés ternaires contiennent des feuillets intercalés tricouches répondant à la séquence Na–halogène–Na. Les mailles planes de l’intercalat peuvent être commensurables ou non avec celle du feuillet de graphène. Dans le composé graphite–sodium–chlore de formule NaC3sCl0,5 (où s représente le stade), le feuillet intercalé possède une maille hexagonale commensurable avec celle du graphène et tournée de ±30° par rapport à ses axes, de paramètre Par ailleurs, le feuillet intercalé n’est autre qu’une tranche de chlorure de sodium, découpée parallèlement au plan (111). Les composés graphite–sodium–iode présentent, quant à eux, plusieurs organisations bidimensionnelles, qui dépendent essentiellement de la teneur en iode.
La co-intercalation directe du lithium avec un élément fortement électronégatif n’a pu être réalisée jusqu’à présent.
4.2 Tiers-élément d’électronégativité moyenne (inférieure ou égale à 2)
La réaction est effectuée entre un échantillon de graphite et un large excès d’alliage liquide. Le tiers-élément doit donc être suffisamment miscible à l’état liquide avec le métal alcalin pour former un alliage de composition choisie. Celle-ci conditionne en effet l’obtention d’un composé ternaire. Lorsque la composition est riche en métal alcalin (supérieure ou égale à 80% atomique), seul le composé binaire graphite–métal alcalin est obtenu. À l’opposé, lorsque l’alliage est riche en tiers-élément (teneur supérieure à 80% atomique), aucune intercalation ne se produit. Il faut donc se placer dans un domaine de composition intermédiaire, dont les limites précises varient d’un système à l’autre, si l’on souhaite obtenir un composé ternaire. La température minimale de réaction est alors directement imposée par la température de fusion de l’alliage, obtenue à partir du liquidus du diagramme binaire métal alcalin–tiers-élément.
À titre d’exemple, la co-intercalation du mercure et du potassium a conduit à divers composés ternaires, appelés mercurographitures [33]. Le composé de premier stade, bien connu, de formule KHgC4, dont la distance interplanaire atteint 1016 pm, contient des feuillets intercalés tricouches de séquence K–Hg–K. Ce sandwich peut être considéré comme une tranche de l’amalgame libre de structure monoclinique KHg2, ce qui laisse penser que les liaisons au sein du feuillet intercalé possèdent un caractère partiellement métallique. Comme dans le cas des composés ternaires préparés par co-intercalation d’un métal alcalin et d’un élément très électronégatif, le métal alcalin se situe à proximité du feuillet de graphène et encadre l’élément le plus électronégatif. Le transfert de charge s’effectue globalement du feuillet intercalé vers les plans de graphène ; on obtient alors l’alternance de plans positifs et négatifs suivante : carbone (–) potassium (+) mercure (–) potassium (+) carbone (–). Les interactions entre le feuillet intercalé et le réseau carboné sont fortes : la maille de l’insérat est commensurable avec celle des feuillets de graphène et la structure du composé a été entièrement résolue [34].
Certains cas sont plus complexes, comme par exemple celui des ternaires graphite–potassium–thallium. Le composé de premier stade KTl1,5C4 possède des feuillets intercalés polycouches dans lesquels le plan central de thallium s’est scindé en trois, ce qui conduit en fait à une pentacouche K–Tl–Tl–Tl–K [35]. Ce feuillet, très épais, entraîne une distance interplanaire particulièrement élevée (1210 pm) et une forte cohésion interne, qui limite les interactions entre insérat et réseau hôte. En conséquence, les mailles planes du feuillet intercalé et du feuillet de graphène sont totalement incommensurables, les deux sous-réseaux bidimensionnels apparaissant sur le plan structural comme quasi indépendants.
D’autres éléments d’électronégativité moyenne ont été intercalés avec un métal alcalin lourd : il s’agit d’éléments de la colonne 15 (arsenic, antimoine et bismuth) [36]. Le phosphore se comporte un peu différemment : son électronégativité de 2,1 dans l’échelle de Pauling le place à la charnière des éléments qui s’intercalent sous forme d’alliage et des éléments très électronégatifs qui s’intercalent en milieu alcalin fondu. Un composé ternaire de premier stade a été obtenu dans les deux cas : d’une part, par réaction entre un liquide de composition K2P et un échantillon de pyrographite ; d’autre part, en immergeant un échantillon dans du potassium contenant 1% atomique de phosphore rouge [37]. Les feuillets intercalés sont tricouches selon un empilement potassium–phosphore–potassium.
La bonne connaissance des réactions de co-intercalation possibles avec les métaux alcalins lourds permet d’orienter les recherches avec les alcalins plus légers (lithium et sodium). Par ailleurs, la maîtrise du travail expérimental en milieu très réducteur à des températures déjà élevées et dans des conditions de grande pureté des éléments est favorable à une telle recherche. Enfin, le lithium entre dans la composition des accumulateurs à ions lithium par le biais du composé binaire de premier stade LiC6. La ternarisation conduit toujours à une augmentation de la teneur en métal et celle-ci pourrait être intéressante dans le cadre de l’amélioration des performances des électrodes de tels accumulateurs. Un certain nombre de tentatives de co-intercalation du lithium et d’éléments d’électronégativité moyenne ont été réalisées. Cependant, il existe un certain nombre de facteurs qui rendent difficiles cette co-intercalation.
4.3 Cas particulier du lithium
Le composé binaire de premier stade LiC6 possède la plus petite distance interplanaire parmi tous les composés d’intercalation (370 pm), ce qui a pour conséquences :
- • une liaison particulièrement forte avec les feuillets de graphène ;
- • un travail d’écartement des feuillets singulièrement faible ;
- • un fort écrantage des répulsions électrostatiques entre ions dans les couches intercalées.
La distance qui sépare deux atomes de lithium d’une couche intercalée à une autre n’est supérieure que d’environ 21% environ à la distance interatomique observée dans le lithium métallique (304 pm). Ces atomes pourraient donc échanger entre eux des liaisons de type métallique dans la direction c. La co-intercalation du lithium et d’un autre élément entraînerait une augmentation de la distance interplanaire et par conséquent la rupture des liaisons Li–Li à travers les plans de graphène. Par ailleurs, ces synthèses requièrent des températures souvent élevées, d’autant plus élevées d’ailleurs que les points de fusion des composés métal alcalin–tiers-élément sont plus hauts. Par exemple, dans le cas du système graphite–sodium–chlore, nombre de réactions ont dû être effectuées à 850 °C. À cette température, le graphite est largement attaqué ; il se forme de l’acétylure Na2C2, qui se dissout dans le bain liquide [38]. Cette attaque qui ne concerne, dans le cas du sodium, que la surface externe de l’échantillon de graphite, gêne, sans toutefois l’empêcher, la formation du composé d’intercalation. Au contraire, dans le cas du lithium, l’attaque, déjà sensible au-dessous de 500 °C, devient très rapide vers 600 °C et donne naissance à l’acétylure dans tout le volume de l’échantillon. Or la plupart des composés du lithium avec les éléments électronégatifs fondent à des températures plus élevées que celles des composés des autres alcalins. Leur co-intercalation semble donc irréalisable par le biais des méthodes utilisées dans le cas des autres alcalins. Les essais ont donc porté sur des éléments formant des alliages facilement fusibles comme l’argent, le magnésium, le cadmium, le mercure, le thallium, l’étain. Au cours de ces tentatives, aucun composé ternaire n’a pu être mis en évidence. L’obtention de ce type de composé semble donc peu probable, lorsqu’on associe le lithium à un élément incapable de s’intercaler seul. Les recherches ont donc été orientées vers la co-intercalation du lithium avec un élément lui aussi capable de s’intercaler seul, en commençant déjà par les alcalino-terreux. C’est ainsi que les composés obtenus en immergeant une plaquette de pyrographite dans un alliage lithium–calcium équi-atomique diffèrent profondément, par leur composition et leur structure, des composés d’intercalation ternaires connus jusqu’ici [39].
Le premier composé ternaire graphite–lithium–tiers-élément métallique a donc été obtenu en immergeant une plaquette de pyrographite (PGCCL) dans un alliage fondu lithium–calcium dans les proportions 1:1. La réaction est menée à 350 °C pendant une dizaine de jours. L’obtention de ce composé est conditionnée par une extrême pureté tant des réactifs que de l’atmosphère d’argon (boîte à gants et réacteur). Les études par diffraction des rayons X révèlent que ce composé appartient au premier stade et possède une distance interplanaire de 776 pm. Le feuillet intercalé est constitué d’un empilement pentacouche selon la séquence Li–Ca–Li–Ca–Li. Comme le montre la Fig. 4, cet empilement dérive directement de la structure cristalline du composé CaLi2 (maille hexagonale de type ThMn2 – phase de Laves). L’intercalat contient une très grande quantité de métal, qui provoque un transfert de charge extrêmement élevé vers les feuillets de graphène.
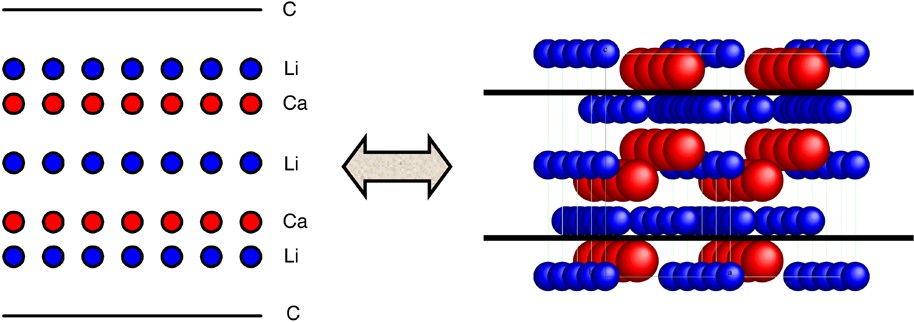
Comparaison de l’empilement pentacouche du feuillet intercalé du premier composé graphite–lithium–calcium synthétisé avec la structure du composé tridimensionnel CaLi2 (les atomes de lithium sont représentés en bleu, les atomes de calcium en rouge – l’axe c est vertical).
5 Conclusion
Ce bref aperçu sur la chimie d’intercalation des donneurs d’électrons dans le graphite met en lumière la richesse et la diversité des composés qui peuvent être préparés.
L’intercalation, considérée comme une voie de synthèse de choix dans le domaine de la chimie du solide, offre en effet de nombreuses combinaisons possibles en vue de préparer de nouveaux matériaux.
En ce qui concerne l’intercalation dans le graphite, si les métaux alcalins lourds ont joué un rôle prépondérant dans la découverte de plusieurs familles de composés binaires et ternaires, désormais bien connus, ils permettent aujourd’hui d’orienter les recherches relatives à la co-intercalation du lithium et du sodium avec d’autres réactifs, éléments ou radicaux, et ceci en vue de développer ces matériaux nouveaux et de mettre en évidence leurs propriétés tout à fait originales.



