1 Introduction
L'avantage de coupler une mesure d'électrochimie avec une mesure de résonance magnétique est d'obtenir simultanément les données électrochimiques (intensité, tension) et les données de RMN (déplacement du noyau observé, aire) lors de l'avancement de la réaction étudiée. On obtient ainsi le nombre d'électrons entrant ou sortant dans le système, l'énergie associée, l'état chimique du noyau et sa quantité en fonction du temps.
Nous étudions ici un matériau d'électrode négative pour batterie lithium. Les premières batteries de ce type comportaient une électrode négative en métal lithium, l'électrode positive étant un oxyde. Mais, lors des décharges, des dendrites de lithium croissent à la surface du métal, jusqu'à créer des courts-circuits. Une alternative est offerte par le remplacement du lithium métal par du graphite, méthode actuellement utilisée. En effet, le graphite possède la particularité de pouvoir absorber des ions positifs ou négatifs et former des composés dits d'intercalation [1]. En particulier, avec le lithium, il forme les composés bien définis : LiC36, LiC27, LiC18 (configuration plan LiC9), LiC12 jusqu'à LiC6, ce dernier stade correspondant à une capacité théorique de 372 mA h g–1 pour la batterie et ce, à une tension très proche de celle du lithium.
Les premières intercalations de lithium ont été réalisées par voie chimique [2] et étudiées, entre autres, par spectroscopie RMN, déplacement [3], temps de relaxation [4]. D'autres procédés sont utilisés pour produire des composés plus denses en lithium : la mécanosynthèse [5] et l'utilisation de hautes pressions [6].
Dans une batterie lithium-ion complète, lors de la charge, des électrons sont envoyés sur l'électrode en graphite ; via l'électrolyte lithié, Li+ s'insère alors entre les plans de graphène, avec un transfert de charge partiel sur le carbone [7]. Cette insertion par voie électrochimique est réversible et l'on peut observer tous les « stades » successifs du lithium proprement intercalé et désintercalé dans la structure hôte.
On tente actuellement d'utiliser des carbones durs, non graphitisables, désordonnés, à la place du graphite. Ils permettent de presque doubler [8] la capacité réversible de 372 mA h g–1, mais présentent deux défauts : une capacité irréversible plus élevée que celle du graphite et une hystérésis entre charge et décharge, qui induirait une chute de la tension utile de la batterie.
Des études RMN ex situ (réalisées en détruisant une batterie à une tension donnée) ont indiqué un statut nouveau, mais mal défini, pour ce lithium inséré [9,10]. Il a été dénommé pseudo-métallique à cause de son déplacement assez proche de celui du métal lithium. D'autres études ont aussi montré que le matériau récupéré variait beaucoup avec le mode de préparation de l'échantillon [11], d'où l'intérêt de réaliser directement l'étude RMN pendant au moins un cycle complet de charge et décharge, sur une seule et même batterie, sans la démonter.
2 Matériel et méthodes
Pour réaliser une mesure de résonance magnétique pendant une mesure électrochimique, il importe de perturber le moins possible les deux appareils. La première exigence est d'utiliser une cellule électrochimique contenant très peu de métal, ce qui détruirait le facteur de qualité de la bobine RMN. La seconde difficulté provient de l'effet d'antenne créé par les fils connectant le générateur de courant et la cellule, ceux-ci apportant des parasites HF qui perturbent le signal RMN. Il faut aussi éviter d'envoyer dans le montage électrochimique des tensions induites à la fréquence de travail du spectromètre.
2.1 RMN
La cellule d'étude (10 × 51 × 3 mm) est simplement positionnée dans la bobine statique de diamètre 10 mm du spectromètre ; les fils d'amenée du courant sont soudés aux collecteurs de cuivre. Un blindage soigné est réalisé jusqu'au générateur Mac Pile.
Les réglages sont : fréquence du 7Li : 139,97 MHz dans un champ de 8,46 T, séquence à une impulsion de 5 μs, 512 acquisitions séparées d'une seconde, 8 min par spectre donc. Comme on réalise un spectre toutes les deux heures, on considérera qu'un spectre représente un instantané dans l'évolution du lithium et non un mélange entre différents sites (moyenne temporelle).
2.2 Pile plastique
La cellule électrochimique est une demi-pile, carbone/lithium métal, où l'on mesure la différence de potentiel V entre l'électrode de carbone et le lithium. On étudie ainsi uniquement l'électrode de carbone. Dans cette configuration, la décharge correspond à l'intercalation du lithium. La technologie Bellcore [12] des piles Lion-ion plastique permet de réaliser des piles sans pression et presque sans métal. Le carbone est plastifié, la conduction entre les composants (collecteur de courant, anode, séparateur imbibé d'électrolyte LiPF6, cathode, collecteur de courant) est assurée par pressage avec des liants. Le tout est contenu dans un sac plastique faiblement métallisé ; les deux collecteurs de courants, grilles de cuivre, sortent de chaque côté.
2.3 Électrode
Le matériau étudié provient d'un tissu de fibres de viscose pyrolysé à 400, 700, puis 1000 °C pendant 15 min sous atmosphère inerte et fourni par Carbone Industrie (France). Un post-traitement a consisté à décomposer du propène à 900 °C pendant 10 min. Cela diminue considérablement la capacité irréversible [13]. Le volume de carbone dans l'électrode est de 10,72 mm3.
2.4 HRTEM
Une étude de microscopie électronique haute résolution HRTEM a permis d'observer le cœur des fibres ainsi que le dépôt de surface et a quantifié la taille et l'espacement des feuillets de graphène [14]. Il s'agit de carbone très désordonné, avec des feuillets courts (1 à 4 nm) et d'espacement d002 0,35 à 0,65 nm. Le dépôt de carbone en surface des fibres consiste en des feuillets un peu plus longs et mieux ordonnés, plus proches du graphite.
2.5 Électrochimie
Le générateur Mac Pile II [15] fonctionne en mode galvanostatique : il envoie un courant I constant, dans un sens pour l'insertion, puis dans l'autre pour la désinsertion et mesure continûment la tension. On règle I = 1,47 mA pour 20,7 mg de carbone afin d'intercaler 1 lithium dans LiC6 en 20 h (mode C/20). La capacité est traditionnellement mesurée par x dans LixC6; autrement dit, x = 1 correspond à Q = 372 mA h g–1. Le nombre n d'électrons (avec 1 électron pour 1 lithium) est donné par x = 72 n/ m, avec le nombre d'Avogadro et m la masse de carbone.
3 Résultats expérimentaux
Trois cycles complets ont été réalisés in situ, plus un pour mesurer le temps de relaxation T1. Sur la Fig. 1 (courbe électrochimique), on peut mesurer sur le premier cycle décharge/charge une capacité irréversible xirr = 0,5 et une capacité réversible xrév = 1,5. On remarque aussi que le champ magnétique vertical intense ne perturbe pas le fonctionnement de la cellule. On attendrait que la force de Laplace modifie le mouvement des ions lithium jusqu'à accélérer, ralentir ou bloquer l'insertion ou l'extraction. Dans ce milieu désordonné que constitue le carbone, la force de Laplace n'agit pas sur la composante verticale des vitesses et l'on peut supposer qu'aucun lithium n'est alors perdu : une cellule jumelle a été cyclée à l'extérieur de l'aimant et a donné la même courbe électrochimique.
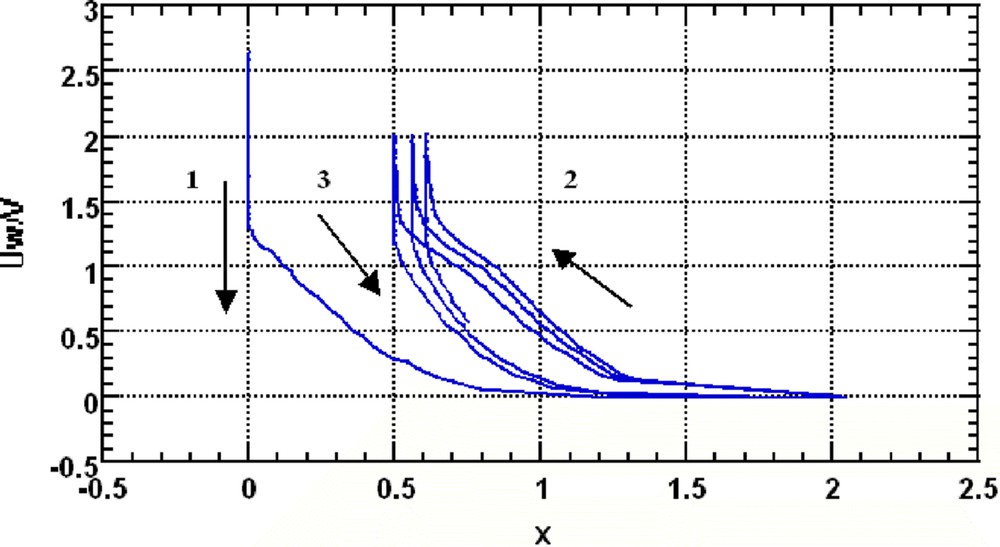
Courbe électrochimique : trois premiers cycles (tension V par rapport à Li+/Li en fonction de x dans LixC6), vitesse de cyclage C/20. 1 indique la première décharge, 2 la charge suivante, 3 la seconde décharge.
Sur la Fig. 2 sont présentés les spectres correspondant aux trois premiers cycles. On observe un pic intense et fin à –2 ppm par rapport à LiCl 1 M. Il correspond à l'électrolyte LiPF6 et au lithium formant la couche de passivation et perdu irréversiblement. On observe bien sûr le pic du métal à 263 ppm. Les pics que nous étudions sont situés entre 0 et 104 ppm, ils suivent l'insertion/désinsertion du lithium dans l'électrode. On constate que ce matériau ne se comporte pas comme le graphite. En effet, lors de l'insertion de lithium dans un graphite bien structuré, on doit observer les pics successifs caractérisant les stades successifs [16] : c'est-à-dire vers 0 à 15 ppm pour les stades élevés puis vers 43 ppm, et avec une intensité croissant avec le remplissage des stades II puis I. De plus, on devrait observer la structure quadripolaire qui caractérise la présence d'un gradient de champ électrique à symétrie axiale sur le site du lithium, comme pour le lithium intercalé.
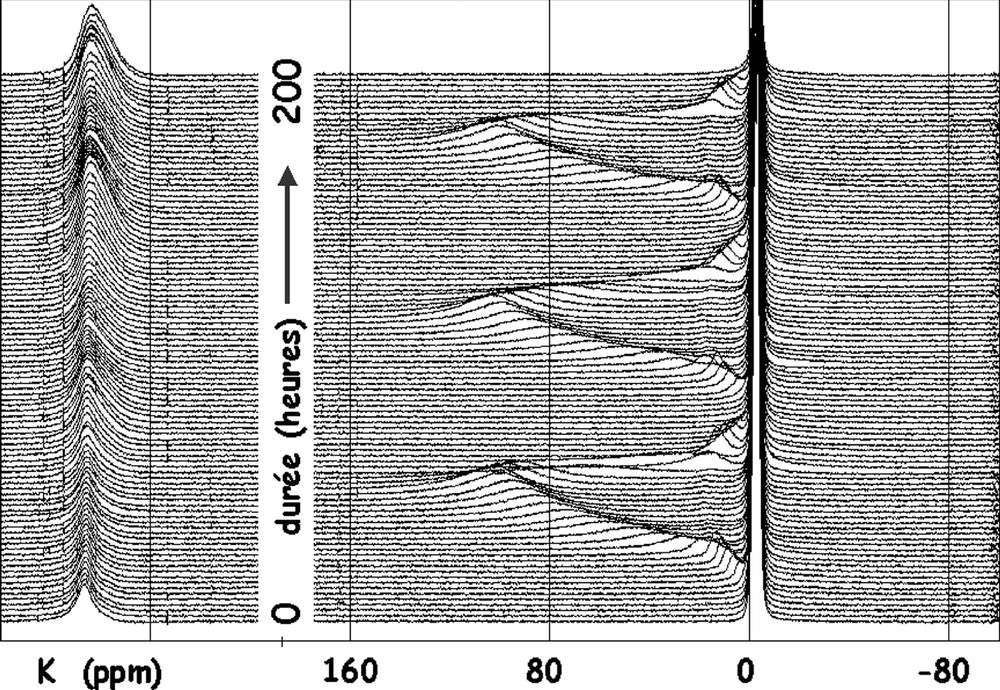
Spectres RMN 7Li statiques des trois premiers cycles ; le spectre initial est en bas.
On observe ici un pic dont le déplacement (0 à 104 ppm) est synchrone avec l'avancement de la réaction de réduction/oxydation du carbone. Il y a aussi un petit pic (0 à 18 ppm) confondu avec le précédent, que l'on peut observer, car il reste constant lorsque le premier évolue. Ce faible déplacement correspond à du lithium intercalé, mais la faible dimension des plans graphitiques et la dispersion de leurs espacements expliquent l'absence de gradient de champ électrique bien défini ; aucune structure quadripolaire n'est donc observée.
4 Déductions
En comparant la courbe tension/temps et la courbe déplacement/temps, on déduit immédiatement la chronologie des évènements : de 0 à 7 h, 74 % de la couche de passivation est formée [17], l'insertion débute ensuite avec 0,5 lithium en position intercalée à 18 h et se poursuit jusqu'à 39 h avec 1 lithium ; le statut de ce dernier est intéressant à connaître, car il correspond à la faculté d'insertion anormalement élevée de ce matériau.
4.1 Quantité de lithium
En intégrant le signal variable sur le domaine 5 à 200 ppm, on obtient l'aire correspondant au lithium total inséré. Si l'on compare (Fig. 3) la courbe x/temps et la courbe aire des pics variables/temps, on constate que l'aire RMN correspond bien au lithium échangé au cours des trois cycles présentés. La petite perte de lithium à chaque cycle est la même que celle indiquée par le Mac Pile. La RMN permet bien donc d'observer tout le lithium. En réalité, on n'a pas intégré sur tout le signal de lithium intercalé car une petite partie est cachée sous le pic à –2 ppm. Sur le deuxième cycle, par exemple, on peut mesurer une variation d'aire Δa = 40 unités arbitraires, correspondant à une variation Δx = 1,5, donc à une variation Δn = 2,6 × 1020 électrons.

Aire (unités arbitraires) du signal intégré de 5 à 200 ppm en vert ; x dans LixC6 en rouge, en fonction du temps.
En comptant un lithium inséré pour un électron envoyé sur le carbone, on peut calibrer la quantité de lithium à nLi = 6,5 × 1018 a. La quantité réelle de lithium est en réalité légèrement inférieure à cette valeur.
Sur la Fig. 4, l’aire de chaque pic (–2 ppm, 264 ppm et variable) en fonction du temps est indiquée.

Aires (mêmes unités arbitraires) : en vert, signal de 5 à 200 ppm ; en rouge, signal à 264 ppm ; en bleu, signal à 0 ppm ; en noir, aires cumulées, en fonction du temps.
Le pic à –2 ppm, il correspond au lithium de LiPF6 et des oxydes de lithium de la couche de passivation. Ce pic fin est élargi par l'inhomogénéité du champ magnétique B0 et on ne peut pas l'utiliser pour quantifier le lithium dans la couche de passivation. Toutefois, entre 0 et 10 h, on peut voir une légère augmentation. Ensuite, on s'aperçoit que l'aire n'est pas tout à fait constante ; cela provient du changement du facteur de qualité de la bobine RMN lorsque le lithium s'insère dans le carbone : on sait que LiC6 est déjà plus conducteur que le lithium métal. La sensibilité de la sonde RMN varie donc légèrement avec la quantité de lithium insérée au cours des cyclages.
4.2 Dendrites
En position métal, 264 ppm, l'aire augmente lors de l'extraction du lithium du carbone ; il s'agit de la formation de dendrites, que l'on peut ainsi quantifier. Le lithium du métal et des dendrites est consommé pour l'insertion dans le carbone, mais globalement la quantité de dendrites augmente. Entre l'instant 0 et l'instant 160 h, par exemple, on peut noter une croissance Δa = 25, soit Δn = 1,37 × 1020 Li, soit 0,228 mmol de Li, soit 1,58 mg de lithium métal, ce qui est considérable. Une image de microscopie électronique à balayage a été réalisée [18] sur des piles complètes, qui montre la formation de mousse et de dendrites lorsque l'on utilise une électrode en métal (Li ou Cu). Aucune dendrite n'est observée avec une électrode en graphite. En RMN nous observons le signal constant de la peau de lithium métal, superposé au signal variable des dendrites métalliques. Globalement, le signal RMN augmente ; cela correspond à la formation des dendrites.
4.3 Knight shift
L'originalité de la méthode d'analyse in situ est de conserver intact le carbone, sans transfert dans un rotor, ni dilution. Le signal du 7Li inséré n'est donc pas altéré, voir [11]. Le fait d'observer un seul pic, bien qu'il y ait de nombreux sites possibles pour le lithium, est compatible avec une moyenne d'espace telle qu'on l'observe pour des métaux ou alliages métalliques. Le déplacement important et continu peut être un Knight shift :
Connaissant le nombre N0 = 0,463 × 1020 d'électrons par mm3 dans le métal et le déplacement K0 = 264 ppm, on déduit par proportionnalité le nombre N d'électrons par unité de volume dans l'alliage.
4.4 Transfert de charge
Sur la Fig. 5, le déplacement en fonction de x (ou de n) est indiqué. Deux régimes apparaissent. De 0 à 18 ppm, le déplacement est bien proportionnel à x et parfaitement réversible, comme un phénomène d'intercalation. De 18 à 104 ppm, le déplacement n'est pas réversible : une hystérésis apparaît.

Déplacement relatif de fréquence K(ppm) en fonction de x pour le second cycle.
En comparant la quantité N d'électrons dans l'alliage à la quantité n d'électrons injectés sur le carbone, on peut estimer le transfert de charge f. Par exemple, pour la deuxième désinsertion, donc sur la deuxième courbe de charge, on a Δx = 1,4 – 0,85 = 0,55, donc Δn = 9,5 × 1019, soit 8,88 × 1018 électrons mm–3. À cela correspond ΔK = 18 ppm soit N = 3,175 × 1018 électrons mm–3, d'où f = (n – N)/n = 0,65.
Pour les grands déplacements, de 18 à 104 ppm, on peut mesurer un transfert de charge moyen f = 0,1 [17].
Ces résultats expérimentaux (Li+0,65 et Li+0,1) sont à comparer avec des simulations de lithium entre deux plans de coronènes (sept hexagones de carbone, donc feuillet de petite taille, comme nos systèmes). Lorsque l'on écarte les plans de coronènes, f varie de 0,67 à presque 0, avec une transition assez franche, indiquant que les deux seuls états du lithium sont Li+0,67 et Li+0 [19].
4.5 Temps de relaxation
La Fig. 6 montre les variations de T1 au cours d'un cycle insertion/extraction.

T1 en fonction de K pour le quatrième cycle. T1 métal est indiqué en rouge.
Pour les déplacements de 18 à 104 pm, T1 est proche de la valeur du métal, 140 ms, mais inférieur, ce qui indique un terme supplémentaire dans la relaxation. Comme il n'y a pas de couplage quadripolaire, on peut penser à un terme dipolaire. On peut évaluer ainsi ce terme : pour les déplacements de 0 à 18 ppm, dans le domaine de l'intercalation, on mesure environ 250 ms au lieu de 1,9 s dans le graphite ordonné, ce qui correspond à une contribution de vitesse de 3,47 s–1. Ce même terme, ajouté à la vitesse de relaxation du métal, conduit à 94 ms, valeur proche de celle mesurée. La contribution dipolaire, faible pour LiC6, LiC12, proviendrait ici de la modulation de l'interaction dipolaire par le mouvement de diffusion du lithium, beaucoup plus lent dans le carbone désordonné que dans le graphite.
4.6 Quasi-métal
Le statut du lithium inséré en grande quantité peut être déduit des observations précédentes. Il formerait des amas quasi métalliques Li+0,1 entre les petits plans désordonnés du carbone. Le lithium étant faiblement lié au carbone, son insertion est possible avec peu d'énergie, à bas potentiel ; toutefois, l'étape initiale d'intercalation est nécessaire et, sans post traitement, ces fibres de carbone ne sont pas un bon matériau d'électrode. Le T1, caractéristique d'un métal, indique une faible vitesse de diffusion.
5 Conclusion
Nous avons montré la faisabilité d'un couplage entre RMN 7Li et électrochimie. La présente étude a porté sur une électrode de batterie lithium-ion. Elle a permis de préciser la chronologie des réactions : formation de la couche de passivation, intercalation puis insertion du lithium. Elle a permis aussi de quantifier un effet indésirable : la formation de mousse et de dendrites de lithium sur l'électrode métallique. Par ailleurs, nous avons précisé le statut particulier du lithium, qui s'insère en grande quantité dans l'électrode composite en carbone : lithium quasi métallique Li+0,1 caractérisé par un pic continûment variable et par un temps de relaxation métallique.
Depuis cette étude, le matériau a été amélioré et fournit une capacité irréversible x = 0,18 (aussi bien que le graphite) et une capacité réversible x = 1,82. Le défaut qu'il présente encore pour son utilisation dans une pile complète est l'hystérésis (0,5 V) entre charge et décharge. La RMN montre que le problème réside dans l'évacuation du lithium quasi métallique.
Remerciements
Les auteurs remercient Stéphane Rodts et Jean-Paul Salvetat (CRMD Orléans) pour leur aide en instrumentation et en analyse, Mathieu Morcrette (LRCS Amiens) pour la fabrication de la cellule, ainsi que Dominique Massiot (CRMHT Orléans) pour l'usage gratuit du logiciel RMN [20].


