1 Introduction
Les hydrazonates phénylés 1 ont été utilisés avec succès dans la synthèse de nombreux hétérocycles comportant le motif [1–3]. Leurs homologues 2, dérivant de la tosylhydrazine, n’ont, à notre connaissance, fait l’objet que de peu de publications [4–7]. Pourtant, ces composés sont susceptibles de présenter une réactivité différente de celle des dérivés phénylés. En effet, la présence du groupe tosyle sur l’azote terminal en abaisse la nucléophilie et le remet en concurrence avec l’azote central. Ils pourraient, de ce fait, présenter deux centres réactifs en 1,2 ou 1,3 et constituer d’excellents substrats pour la synthèse d’hétérocycles azotés et phosphorés.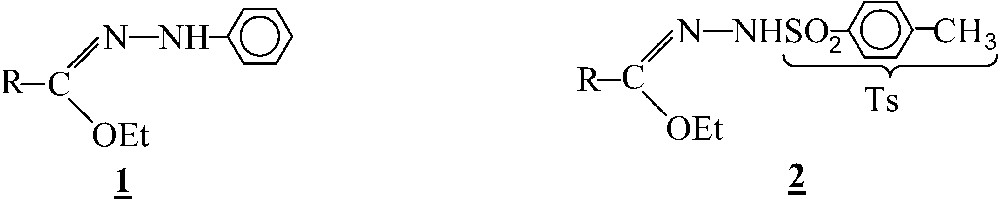
Nous montrons dans le présent travail que la réactivité des N1-tosylhydrazonates vis-à-vis du réactif de Lawesson, du cyanamide et des hydrazides conduit systématiquement à la formation d’hétérocycles à cinq chaînons, respectivement aux thiadiazaphospholines 3, aux C-aminotriazoles 4 et aux N-aminotriazoles tosylés 6.
2 Résultats et discussion
2.1 Action du réactif de Lawesson sur les N1-tosylhydrazonates
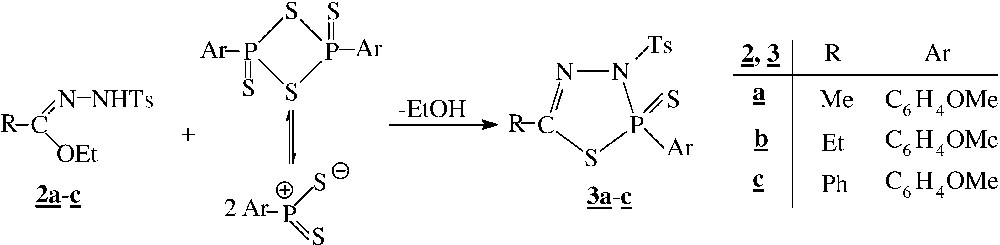
Dans de nombreuses réactions de condensation, le 2,4-bis(4-méthoxyphényl)-2,4-dithioxo-1,3,2,4-dithiadiphosphétane ou réactif de Lawesson (LR) réagit sous forme de zwitterion [8] et se comporte comme un agent à deux sites réactifs, l’un électrophile et l’autre nucléophile [9–12].
La condensation mole à mole des N1-tosylhydrazonates 2a–c et du réactif de Lawesson (LR) à reflux de toluène conduit aux thiadiazaphospholines 3a–c correspondantes (Fig. 1). Les N1-tosylhydrazonates se comportent donc comme des réactifs bipolaires 1,3.
2.2 Action du cyanamide sur les N1-tosylhydrazonates
De la même manière, le cyanamide, qui présente deux centres réactifs – l’un nucléophile, l’autre électrophile en position 1,2 – réagit avec les N1-tosylhydrazonates pour conduire aux C-aminotriazoles tosylés 4 (Fig. 2).
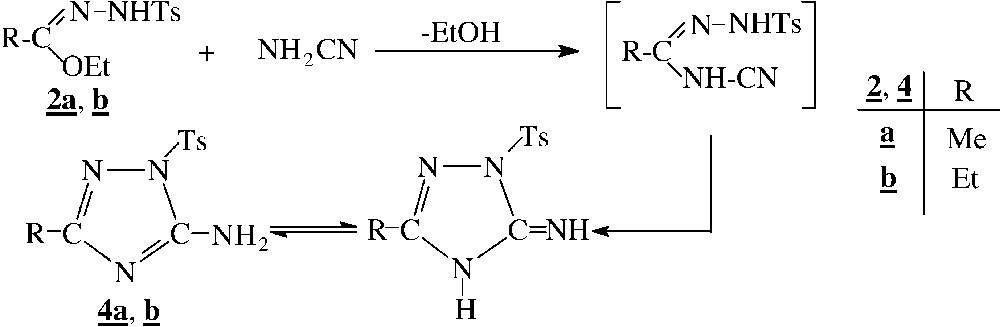
Ces composés sont intéressants à cause des propriétés biologiques qu’ils sont susceptibles de présenter [13–18], d’une part, et en raison de leur possibilité d’utilisation ultérieure dans la synthèse de composés bishétérocycliques [19], d’autre part.
Cependant, le N1-tosylhydrazonate, dans lequel R est un groupement phényle, est sans action sur le cyanamide, probablement en raison de la forte conjugaison de la liaison C=N avec le noyau aromatique, ce qui rend le carbone imidique peu électrophile. Une observation identique a, par ailleurs, été signalée par Chihaoui et Baccar [1] lors de l’étude des propriétés chimiques des hydrazonates phénylés.
2.3 Action des hydrazides sur les N1-tosylhydrazonates
Les N1-tosylhydrazonates 2 réagissent avec les hydrazides au reflux du méthanol pour conduire directement à des composés cycliques identifiés à des N-aminotriazoles 6. Notons qu’en réalisant la réaction à froid dans le chloroforme, on isole après quelques jours les mêmes produits. Il est intéressant de préciser qu’à froid, leurs homologues dérivant de la phénylhydrazine conduisent à des produits acycliques. Leur cyclisation en triazole n’est obtenue qu’après chauffage prolongé dans le xylène [2].
Par rapport aux exemples précédents, la différence de comportement intervient particulièrement au niveau de la deuxième étape. La cyclisation intramoléculaire selon la voie a fait intervenir une attaque par l’azote du type amidine (–N=C–NH–), nettement plus réactif que celui du type sulfonamide (–NH–SO2–), qui intervient dans la voie b. Par ailleurs, le cycle à cinq chaînons obtenu dans ce cas précis est aromatique, alors que celui à six ne l’est pas (Fig. 3).
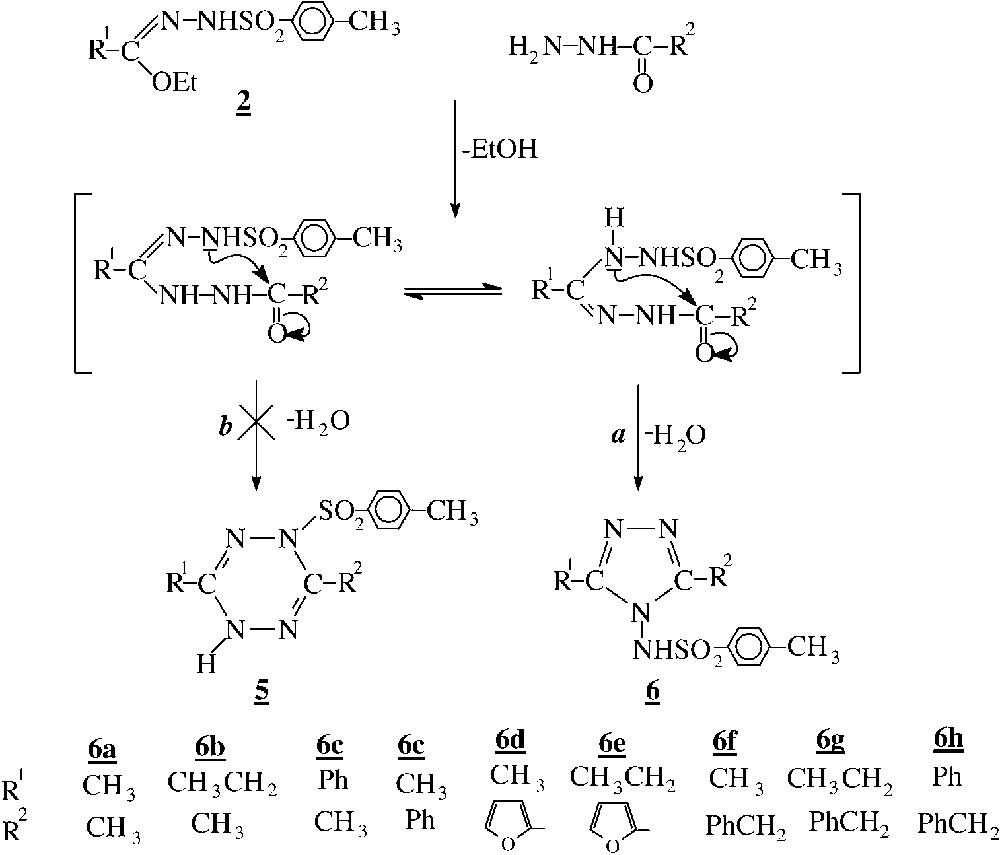
L’évolution de la réaction selon la voie a est confirmée par l’étude des spectres de RMN du 1H et du 13C des produits obtenus. En particulier, les spectres RMN du produit 6c obtenu pour (R1=CH3, R2=Ph) et (R1=Ph, R2=CH3) sont identiques, ce qui confirme bien la formation de N-aminotriazole (Fig. 4).
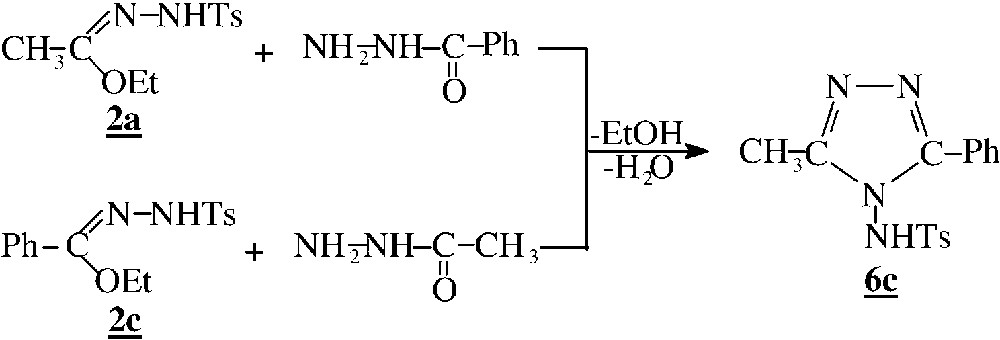
En outre, les spectres du composé 6c mettent en évidence la symétrie de la molécule.
3 Partie expérimentale
3.1 Appareillage
- • RMN. Les spectres de RMN du 1H et 13C ont été enregistrés en solution dans le DMSO-d6 pour les composés 4 et 6 et dans le CDCl3 pour les composés 3 sur spectrographe Bruker à 80, 200, 300 et 400 MHz. Les déplacements chimiques, exprimés en ppm, sont comptés positivement à champ faible par rapport au TMS comme référence interne.
Les multiplicités des signaux sont indiquées par des abréviations suivantes : s, singulet ; d, doublet ; t, triplet ; q, quadruplet ; m, multiplet ; dd : doublet dédoublé. Les constantes de couplage 3J sont exprimées en Hz.
- • IR. Les spectres IR ont été réalisés dans KBr sur un spectromètre JASCO FT–IR-420, dont la précision est de ± 2 cm–1 dans le domaine 4000–400 cm–1.
- • Point de fusion. Les points de fusion ont été déterminés sur banc Koffler.
La pureté des produits est vérifiée par chromatographie sur couche mince de gel de silice.
Les N1-tosylhydrazonates 2 ont été synthétisés par action des orthoesters sur la tosylhydrazine, selon un mode opératoire que nous avons décrit antérieurement [4].
3.2 Synthèse des thiadiazaphospholines tosylés 3
Un mélange de N1-tosylhydrazonate (0,01 mol), de réactif de Lawesson (LR) (0,01 mol) et de 20 ml de toluène est porté à reflux pendant 12 h. Le déroulement de la réaction est suivi par chromatographie sur couche mince (CCM) en utilisant un mélange chloroforme/méthanol (9,5:0,5) comme éluant. Après disparition complète du N1-tosylhydrazonate et apparition d’une seule nouvelle tache, on refroidit le mélange réactionnel, puis on filtre l’excès de réactif de Lawesson. Le filtrat est concentré sous vide. On ajoute au résidu obtenu 30 ml d’éther, le précipité qui apparaît est filtré et recristallisé dans l’éther.
3.2.1 5-Méthyl-2-p-méthoxyphényl-3-tosyl-thiadiazaphospholine 3a
Rdt : 90%, Pf = 176–178 °C, IR : νC=N = 1590 cm–1, νP=S = 1100 cm–1 ; RMN 1H : (300 MHz, CDCl3) : 2,27 (s, 3H) ; 2,42 (s, 3H) ; 3,88 (s, 3H) ; 7,04 (dd, 2H, 3JHH = 8,8 ; 4JHP = 3,8) ; 7,26 (d, 2H, 3JHH = 8,2) ; 7,95 (d, 2H, 3JHH = 8,2) ; 8,06 (dd, 2H, 3JHH = 8,8 ; 3JHP = 16,2).
3.2.2 5-Éthyl-2-p-méthoxyphényl-3-tosyl-thiadiazaphospholine 3b
Rdt : 85%, Pf = 126–130 °C, IR : νC=N : 1590 cm–1, νP=S: 1103 cm–1 ; RMN 1H : (300 MHz, CDCl3) : 1,16 (t, 3H, 3JHH = 8,2) ; 2,37 (s, 3H) ; 2,51 (q, 2H, 3JHH = 8,2) ; 3,81 (s, 3H) ; 6,97 (dd, 2H, 3JHH = 8,8, 4JHP = 3,8) ; 7,26 (d, 2H, 3JHH = 8,2) ; 7,95 (d, 2H, 3JHH = 8,2) ; 8,02 (dd, 2H, 3JHH = 8,8 ; 3JHP = 16,3).
3.2.3 2-p-Méthoxyphény 5-phényl-3-tosyl-thiadiazaphospholine 3c
Rdt : 70%, Pf = 162–164 °C, IR : νC=N : 1588 cm–1, νP=S : 1097 cm–1 ; RMN 1H : (300 MHz, CDCl3) : 2,44 (s, 3H) ; 3,91 (s, 3H) ; 7,05–8,22 (m, 8H) ; 6,97 (dd, 2H, 3JHH = 8,8 ; 4JHP = 3,8) ; 7,36–7,71 (m, 5H) ; 8,05 (d, 2H, 3JHH = 8,7) ; 8,15 (dd, 2H, 3JHH = 8,8 ; 3JHP = 16,3).
Les résultats obtenus sont reportés dans le Tableau 1.
RMN du 13C (75 MHz) : déplacements chimiques des thiadiazaphospholines tosylées 3.
| Composé | 3a | 3b | 3c |
| C1 | 146,6 (d ; 2JCP = 2,6) | 152,3 (d ; 2JCP = 3,4) | 145,1 (d ; 2JCP = 3,4) |
| C2 | 124,1–146,5 | 123,8–145,2 | 125,7–134,9 |
| C3 | 21,6 (s) | 21,8 (s) | 21,6 (s) |
| C4 | 125,7 (d ; 1JCP = 115,4) | 124,5 (d ; 1JCP = 114,9) | 125,5 (d ; 1JCP = 115,1) |
| C5 | 134,7 (d ; 2JCP = 13,3) | 134,8 (d ; 2JCP = 16,3) | 134,7 (d ; 2JCP = 16,3) |
| C6 | 114,2 (d ; 3JCP = 18,6) | 114,2 (d ; 3JCP = 17,8) | 114,2 (d ; 3JCP = 17,9) |
| C7 | 163,7 (d ; 4JCP = 2,6) | 163,8 (d ; 4JCP = 3,4) | 163,8 (d ; 4JCP = 3,4) |
| C8 | 55,6 (s) | 55,7 (s) | 55,6 (s) |
| C9 | 20,2 (s) | 27,9 (s) | 125,7–134,9 |
| C10 | — | 11,7 (s) | — |
3.3 Synthèse des C-aminotriazoles tosylés 4
On chauffe pendant 20 h au reflux du méthanol un mélange de 0,01 mol de N1-tosylhydrazonates 2 et de 0,01 mol de cyanamide. Après évaporation du solvant, le produit obtenu est recristallisé dans le méthanol.
3.3.1 5-Amino-3-méthyl-1-tosyl-1,2,4-triazole 4a
Rdt : 80% ; Pf = 224–226 °C ; IR : νC=N : 1653 cm–1 ; νNH : 3306–3467 cm–1 ; RMN 1H (400 MHz) : 2,01 (s, 3H) ; 2,25 (s, 3H) ; 7,20 (s, 2H) ; 7,45–7,85 (m, 4H).
3.3.2 5-Amino-3-éthyl-1-tosyl-1,2,4-triazole 4b
Rdt : 70% ; Pf = 202–205 °C ; IR : νC=N : 1646 cm–1 ; νNH : 3363–3404 cm–1 ; RMN 1H (80 MHz) : 0,85 (t, 3H, 3JHH = 7,4) ; 1,85 (q, 2H, 3JHH = 7,4) ; 2,37 (s, 3H) ; 7,07–7,73 (m,8H) ; 9,90 (s, 2H).
Les résultats obtenus sont reportés dans le Tableau 2.
RMN du 13C (100 MHz pour 4a et 20 MHz pour 4b) : déplacements chimiques des C-aminotriazoles tosylés 4.
| Composé | C1 | C2 | C3 | C4 | C5 | C6 | C7 | C8 | C9 |
| 4a | 157,1 | 161,1 | 13,8 | — | 21,0 | 133,5 | 130,5 | 128,1 | 146,0 |
| 4b | 155,0 | 160,1 | 15,6 | 10,2 | 21,1 | 133,1 | 130,2 | 127,3 | 145,7 |
3.4 Synthèse des N-aminotriazoles 6
Un mélange de 0,01 mol de N1-tosylhydrazonates 2 et de 0,01 mol d’hydrazide dans 50 ml de méthanol est porté à reflux pendant 24 h. Après évaporation du solvant, le solide obtenu est recristallisé dans le méthanol.
3.4.1 3,5-Diméthyl-4-N-tosylamino-1,2,4-triazole 6a
Rdt : 85% ; Pf = 248–251 °C ; IR : νC=N : 1545 cm–1 ; νNH : 3444 cm–1 ; RMN 1H (400 MHz) : 1,85 (s, 6H) ; 2,38 (s, 3H) ; 7,40–7,85 (m, 5H).
3.4.2 3-Éthyl-5-méthyl-4-N-tosylamino-1,2,4-triazole 6b
Rdt : 80% ; Pf = 202–205 °C ; IR : νC=N : 1545 cm–1 ; νNH : 3442 cm–1 ; RMN 1H (80 MHz) : 1,09 (t, 3H, 3JHH = 7,3) ; 1,90 (s, 3H) ; 2,30 (q, 2H, 3JHH = 7,3) ; 2,40 (s, 3H) ; 7,40–7,70 (m, 5H).
3.4.3 5-Méthyl-3-phényl-4-N-tosylamino-1,2,4-triazole 6c
(Rdt : 60% pour R1 = Ph et R2 = CH3), (Rdt : 35% pour R1 = CH3 et R2 = Ph) ; Pf : 252–255 °C ; IR : νC=N : 1542 cm–1 ; νNH : 3443 cm–1 ; RMN 1H (200 MHz) : 2,22 (s, 3H) ; 2,26 (s, 3H) ; 7,03–7,50 (m, 5H).
3.4.4 5-Furyl-3-méthyl-4-N-tosylamino-1,2,4-triazole 6d
Rdt : 45% ; Pf = 228–230 °C ; IR : νC=N : 1546 cm–1 ; νNH : 3442 cm–1 ; RMN 1H (200 MHz) : 1,90 (s, 3H) ; 2,25 (s, 3H) ; 6,40–7,60 (m, 8H).
3.4.5 3-Éthyl-5-furyl-4-N-tosylamino-1,2,4-triazol 6e
Rdt : 35% ; Pf = 240–245 °C ; IR : νC=N : 1546 cm–1 ; νNH : 3442 cm–1 ; RMN 1H (200 MHz) : 1,15 (t, 3H, 3JHH = 7,5) ; 1,85 (s, 3H) ; 2.32 (q, 2H, 3JHH = 7,5) ; 6,40–7,60 (m, 8H).
3.4.6 5-Benzyl-3-méthyl-4-N-tosylamino-1,2,4-triazole 6f
Rdt : 80% ; Pf = 210–212 °C ; IR : νC=N : 1531 cm–1 ; νNH : 3350 cm–1 ; RMN 1H (200 MHz) : 1,70 (s, 3H) ; 2,31 (s, 3H) ; 3,70 (s, 2H) ; 7,00–7,62 (m, 10H).
3.4.7 5-Benzyl-3-éthyl-4-N-tosylamino-1,2,4-triazole 6g
Rdt : 70% ; Pf = 170–175 °C ; IR : νC=N : 1533 cm–1 ; νNH : 3342 cm–1 ; RMN 1H (200 MHz) : 1,01 (t, 3H, 3JHH = 7,3) ; 2,10 (q, 2H, 3JHH = 7,3), 2,30 (s, 3H) ; 3,65 (s, 2H) ; 7,00–7,60 (m, 10H).
3.4.8 5-Benzyl-3-phényl-4-N-tosylamino-1,2,4-triazole 6h
Rdt : 40% ; Pf = 242–245 °C ; IR : νC=N : 1537 cm–1 ; νNH : 3362 cm–1 ; RMN 1H (200 MHz) : 2,25 (s, 3H) ; 3,96 (s, 2H), 7,00–7,51 (m, 15H).
Les résultats obtenus sont reportés dans le Tableau 3.
RMN du 13C (100 MHz pour 6a, 20 MHz pour 6b et 50 MHz pour 6c–6h) : déplacements chimiques des N-aminotriazoles tosylés 6.
| Composé | 6a | 6b | 6c* | 6c** | 6d | 6e | 6f | 6g | 6h |
| C1 | 151,1 | 151,0 | 152,1 | 161,2 | 145,3 | 146,1 | 151,8 | 154,3 | 153,3 |
| C2 | 151,1 | 155,4 | 161,2 | 152,1 | 152,0 | 154,0 | 154,4 | 156,1 | 156,1 |
| C3 | 9,3 | 16,9 | 10,1 | 129,9 | 9,2 | 16,9 | 9,9 | 17,6 | 126,4 |
| C4 | — | 9,2 | — | 129,6 | — | 10,4 | — | 11,3 | 129,8 |
| C5 | — | — | — | 128,3 | — | — | — | — | 128,3 |
| C6 | — | — | — | 125,9 | — | — | — | — | 127,6 |
| C7 | 9,3 | 10,5 | 129,9 | 10,1 | 144,3 | 144,1 | 30,3 | 30,2 | 30,6 |
| C8 | __ | — | 129,6 | — | 111,3 | 111,2 | 130,3 | 130,3 | 130,6 |
| C9 | — | — | 128,3 | — | 111,6 | 111,7 | 129,6 | 129,6 | 130,3 |
| C10 | — | — | 125,9 | — | 127,2 | 127,0 | 129,2 | 129,2 | 129,0 |
| C11 | — | — | — | — | — | — | 127,5 | 127,5 | 127,9 |
| C12 | 144,5 | 144,4 | 145,5 | 145,5 | 144,7 | 144,7 | 145,7 | 145,5 | 145,2 |
| C13 | 127,5 | 127,4 | 127,6 | 127,6 | 129,8 | 129,7 | 128,4 | 128,3 | 129,3 |
| C14 | 130,2 | 130,1 | 129,9 | 129,9 | 134,7 | 135,0 | 131,2 | 131,1 | 130,6 |
| C15 | 135,8 | 136,0 | 130,0 | 130,0 | 139,8 | 139,6 | 136,5 | 136,5 | 136,6 |
| C16 | 21,1 | 21,0 | 21,2 | 21,2 | 20,9 | 21,1 | 21,9 | 21,9 | 21,8 |
4 Conclusion
Nous avons montré dans ce travail que les N1-tosylhydrazonates ont un comportement similaire à celui des N1-phénylhydrazonates, en dépit de la présence du groupe tosyle. Ils constituent d’excellentes bases pour la synthèse de divers hétérocycles polyazotés à cinq chaînons, pouvant présenter des propriétés biologiques intéressantes, mises en évidence pour des composés de structure similaire [20–22]. Les résultats obtenus viennent compléter les travaux antérieurs réalisés dans notre laboratoire sur les hydrazonates [1–3, 23–26].



