1 Introduction
L'utilisation des iminoesters fonctionnalisés en vue d'accéder à des composés hétérocycliques remonte à plusieurs décennies [1]. Dans notre laboratoire, l'emploi de ces substrats a fait l'objet de nombreuses publications [2–11].
Nous envisageons, dans le présent travail, de décrire la synthèse d'une série de triazoles, de triazolones et de triazolopyrimidines impliquant quatre familles d'iminoesters N-fonctionnalisés 1. Ces produits, qui renferment un noyau triazolique, sont très prisés dans des domaines variés. Ils sont couramment employés en tant qu'agents analgésiques [12], anti-inflammatoires [13,14] et anti-tumoraux [15–17]. Ils sont également utilisés en tant que bactéricides [18–23], fongicides [24,25] et herbicides [26,27].
2 Résultats et discussion
2.1 Synthèse des triazoles et triazolones
Le chauffage au reflux du méthanol, d'iminoesters N-fonctionnalisés 1 et des 3-hydrazino-2-(N,N-dialkylaminométhyl)propanenitriles 2 [28] conduit à une série de triazoles et de triazolones diversement substitués 3, 4, 5 et 6.
La première étape est une attaque nucléophile du motif –NH2 de l'hydrazine 2 sur le carbone imidique, engendrant ainsi des amidrazones, intermédiaires non isolés, qui se cyclisent in situ pour donner les dérivés triazoliques correspondants (Schéma 1).
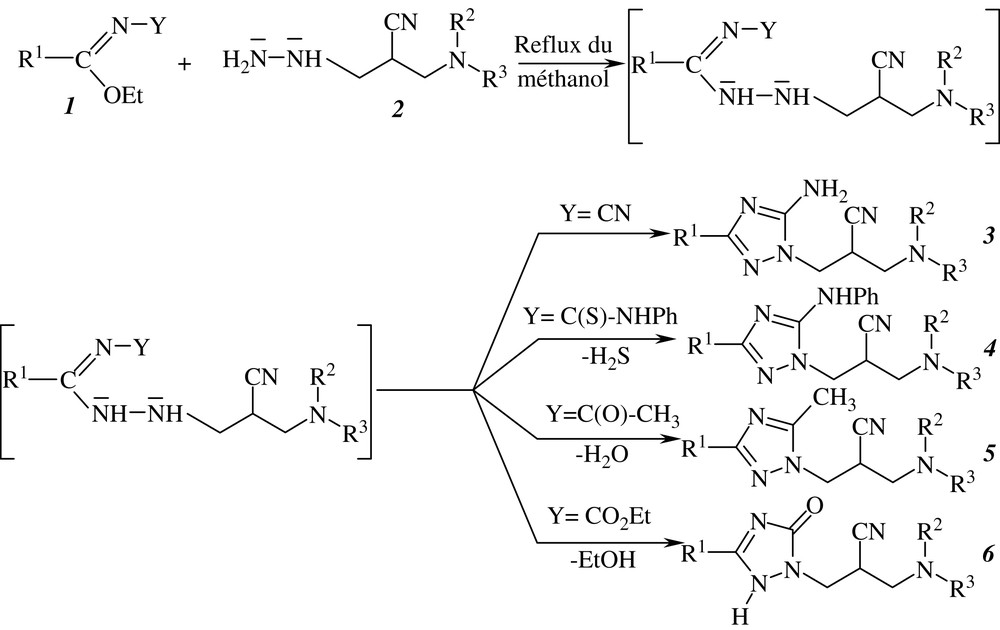
Quatre types d'iminoesters N-fonctionnalisés ont été employés. Ces derniers, possédant deux carbones électrophiles en position -1,3, peuvent réagir avec divers réactifs binucléophiles, et notamment avec les hydrazines. Le mécanisme réactionnel débute par une addition de l'hydrazine sur la fonction iminoester, suivie de l'élimination du groupement éthoxyle.
Pour des groupements amino identiques et pour un même groupement R1, nous avons remarqué que la cyclisation des iminoesters en triazoles est nettement plus rapide lorsque Y = CN. Les produits synthétisés sont indiqués dans le Tableau 1.
| produits | 3a | 3b | 3c | 3d | 3e | 3f | 3g | 3h | 3i |
| R2R3N- | |||||||||
| R1 |
La structure de ces produits est confirmée par spectroscopie RMN. En RMN, 1H, le passage des iminoesters N-cyanés aux triazoles 3 s'accompagne, entre autres, par la disparition des deux signaux dus aux protons du groupement éthoxyle. En RMN 13C, l'absence du signal à 153 ppm du carbone de la fonction nitrile lié à l'azote imidique constitue un indice en faveur de la cyclisation de l'intermédiaire amidrazone.
Bien qu'ils soient moins réactifs que leurs homologues N-cyanés, les N-thioamidoiminoesters (Y = C(S)NHPh) donnent, par le même processus, ce type de réaction. Les produits obtenus après dégagement de sulfure d'hydrogène sont des 3-N-phénylamino-1,2,4-triazoles 4 (Tableau 2).
| Produits | 4a | 4b | 4c | 4d | 4e | 4f | 4g | 4h | 4i |
| R2R3N- | |||||||||
| R1 |
Les spectres de RMN 13C des composés 4 présentent, en plus des signaux relatifs aux carbones introduits par l'hydrazine, deux signaux vers 156 et 159 ppm, correspondant aux carbones du cycle triazolique.
Lorsque les substrats de départ sont des iminoesters N-acylés (Y = COCH3), les intermédiaires correspondants se cyclisent, avec perte d'une molécule d'eau, pour conduire aux triazoles 5 (Tableau 3).
| Produits | 5a | 5b | 5c | 5d | 5e | 5f |
| R2R3N- | ||||||
| R1 |
La disparition, sur les spectres IR, de la bande de vibration de valence νCO vers 1715 cm−1 est la principale constatation. On observe, par ailleurs, un léger déplacement de νCN intracyclique par rapport aux aminotriazoles 4.
Quand le groupement acyle est remplacé par un groupement éthoxycarbonyle (Y = CO2Et), on isole des triazolones 6 (Tableau 4). Dans ce cas, le produit de cyclisation est obtenu par attaque du motif –NH sur le carbone du carboxylate, avec exclusion d'un groupement éthoxyle.
| Produits | 6a | 6b | 6c | 6d | 6e | 6f |
| R2R3N- | ||||||
| R1 |
On relève sur les spectres IR, essentiellement, une bande vers 1720–1745 cm−1, attribuable au vibrateur CO de la triazolone, et une autre bande dans la région des nombres d'ondes élevés (3440 cm−1), due au vibrateur NH.
2.2 Synthèse des triazolopyrimidines 7
Les aminotriazoles 3 renferment deux sites réactifs en position -1,6 : un nucléophile (NH2) et un autre électrophile (CN). Leur chauffage au reflux du toluène engendre les triazolopyrimidines 7, conformément à la réaction suivante (Schéma 2) :
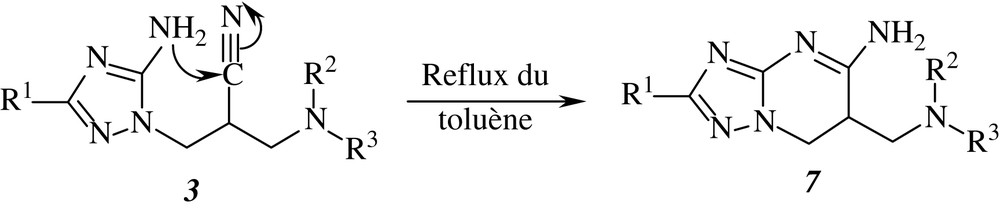
Ces triazolopyrimidines (Tableau 5) peuvent être également obtenues directement par chauffage au reflux du toluène d'un mélange d'iminoester N-cyané et d'hydrazine 2. Les rendements consignés dans la partie expérimentale sont calculés en utilisant cette dernière méthode.
| Produits | 7a | 7b | 7c | 7d | 7e | 7f | 7g | 7h | 7i |
| R2R3N- | |||||||||
| R1 |
Les données spectroscopiques sont conformes aux structures proposées. En effet, sur les spectres de RMN 13C des produits synthétisés, on note l'absence de tout signal pouvant être attribué au carbone de la fonction nitrile.
Probablement en raison de la forte conjugaison du doublet de l'azote dans le motif NH–Ph des triazoles 4, il n'a pas été possible de réaliser une seconde cyclisation conduisant aux triazolopyrimidines correspondantes, et ce, même après chauffage prolongé à reflux dans divers solvants (Schéma 3).
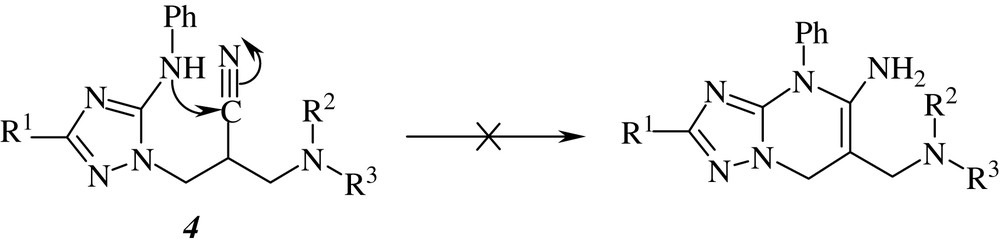
En conclusion, nous avons visé, dans le présent travail, la synthèse d'une série d'hétérocycles mono et bicycliques, en opposant une hydrazine particulière à des iminoesters fonctionnalisés 1 N-cyanés, N-acylés, N-thioamide et N-éthoxycarbonylés.
3 Partie expérimentale
3.1 Appareillage
- • IR : les spectres IR ont été enregistrés, soit à l'état solide, en dispersion dans le KBr, soit en solution dans CHCl3, à l'aide d'un spectrographe PerkinElmer Paragon 1000 PC, dont la précision de mesure est de 4 cm−1.
- • RMN : les spectres de RMN 1H et 13C ont été effectués en solution dans CDCl3 et DMSO-d6 sur un spectromètre Bruker AC 300. Le TMS est utilisé comme référence interne. Les déplacements chimiques sont exprimés en ppm. Les abréviations suivantes sont utilisées : s (singulet), t (triplet), q (quadruplet) et m (multiplet).
- • Analyse élémentaire : les analyses élémentaires ont été effectuées à l'Institut national de recherche et d'analyses physicochimiques sur un appareil SCA/CNRS, type NA.
- • Point de fusion : les points de fusion, exprimés en degrés Celsius ont été déterminés par la méthode des capillaires, avec un appareil Büchi. L'avancement et la fin des réactions ont été suivis par chromatographie sur couche mince de gel de silice 60 (Fluka).
3.2 Mode opératoire
3.2.1 Synthèse des triazoles et triazolones
Le mode opératoire est général, sauf en ce qui concerne le temps de réaction (tR), qui varie de 2 à 6 h.
À 0,01 mol d'iminoester N-fonctionnalisé 1, on ajoute 0,01 mol de 3-hydrazino-2-(N,N-dialkylaminométhyl)propanenitrile 2 et 10 mL de méthanol. On porte le mélange au reflux du méthanol. La réaction est catalysée par quelques gouttes d'acide acétique. Le solvant est ensuite évaporé, et le résidu traité à l'éther jusqu'à obtention d'un solide, qui est recristallisé dans le THF et quelques gouttes de méthanol.
3.2.1.1 3a : 3-(5-Amino-3-méthyl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
tR = 2 h. F = 139. Rdt = 78%. IR :
3.2.1.2 3b : 3-(5-Amino-3-éthyl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 122. Rdt = 67%. IR :
3.2.1.3 3c : 3-(5-Amino-3-propyl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 132. Rdt = 54%. IR :
3.2.1.4 3d : 3-(5-Amino-3-phényl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 145. Rdt = 68%. IR :
3.2.1.5 3e : 3-(5-Amino-3-méthyl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 118. Rdt = 42%. IR :
3.2.1.6 3f : 3-(5-Amino-3-éthyl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 126. Rdt = 48%. IR :
3.2.1.7 3g : 3-(5-Amino-3-méthyl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 118. Rdt = 41%. IR :
3.2.1.8 3h : 3-(5-Amino-3-éthyl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 109. Rdt = 36%. IR :
3.2.1.9 3i : 3-(5-Amino-3-phényl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 140. Rdt = 38%. IR :
3.2.1.10 4a : 3-(5-Anilino-3-phényl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
tR = 6 h. F = 148. Rdt = 75%. IR : νNH = 3443 cm−1, νCN = 2175 cm−1, νCN = 1580 cm−1. RMN 1H(CDCl3) : 9,53(s, 1H) ; 4,45(m, 2H) ; 4,41(m, 1H) ; 3,53(m, 4H) ; 2,67(m, 2H) ; 2,42(m, 4H) ; 7,5(m, 10H). RMN 13C(CDCl3) : (C1) : 156,67 ; (C2) : 162,45 ; (C3) : 47,46 ; (C4) : 32,21 ; (C5) : 118,31 ; (C6) : 56,27 ; (C7) : 52,13 ; (C8) : 65,82 ; (Carom) : (122,35–136,28). Anal. élém. C22H24N6O : Calc. C 68,02 ; H 6,23 ; N 21,63. Tr. C 68,11 ; H 6,28 ; N 21,75.
3.2.1.11 4b : 3-(5-Anilino-3-benzyl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 124. Rdt = 68%. IR : νNH = 3445 cm−1, νCN = 2175 cm−1, νCN = 1580 cm−1. RMN 1H(CDCl3) : 9,15(s, 1H) ; 4,25(m, 1H) ; 4,21(m, 2H) ; 3,69 (s, 2H) ; 3,46(m, 4H) ; 2,47(m, 2H) ; 2,32(m, 4H) ; 7,45(m, 10H). RMN 13C(CDCl3) : (C1) : 159,67 ; (C2) : 153,35 ; (C3) : 47,22 ; (C4) : 30,14 ; (C5) : 118,19 ; (C6) : 56,17 ; (C7) : 52,06 ; (C8) : 65,48 ; (C10) : 35,75 ; (Carom) : (122,27–138,34).
3.2.1.12 4c : 3-(5-Anilino-3-p-chlorophényl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 135. Rdt = 50%. IR : νNH = 3445 cm−1, νCN = 2175 cm−1, νCN = 1580 cm−1. RMN 1H (CDCl3) : 9,52(s, 1H) ; 4,25(m, 2H) ; 4,21(m, 1H) ; 3,26 (m, 4H) ; 2,36(m, 2H) ; 2,21(m, 4H) ; 7,5(m, 9H). RMN 13C(CDCl3) : (C1) : 156,61 ; (C2) : 162,29 ; (C3) : 47,36 ; (C4) : 32,29 ; (C5) : 118,24 ; (C6) : 56,13 ; (C7) : 52,10 ; (C8) : 65,42 ; (Carom) : (122,74–137,36).
3.2.1.13 4d : 3-(5-Anilino-3-phényl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 122. Rdt = 56%. IR : νNH = 3445 cm−1, νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H (CDCl3) : 9,51(s, 1H) ; 4,43(m, 2H) ; 4,40(m, 1H) ; 2,66(m, 2H) ; 2,41(m, 4H) ; 1,42(m, 6H) ; 7,51(m, 10H). RMN 13C(CDCl3) : (C1) : 155,69 ; (C2) :162,19 ; (C3) : 47,46 ; (C4) : 31,72 ; (C5) : 118,16 ; (C6) : 57,17 ; (C7) : 52,81 ; (C8) : 27,18 ; (C9) : 26,23 ; (Carom) : (121,11–137,15).
3.2.1.14 4e : 3-(5-Anilino-3-benzyl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 118. Rdt = 55%. IR :νNH = 3445 cm−1, νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H (CDCl3) : 9,12(s, 1H) ; 4,36(m, 1H) ; 4,32(m, 2H) ; 3,67(s, 2H, –CH2Ph) ; 2,65(m, 2H) ; 2,41(m, 4H) ; 64(m, 6H) ; 7,5(m, 10H). RMN 13C (CDCl3) : (C1) : 159,39 ; (C2) : 153,04 ; (C3) : 47,06 ; (C4) : 30,11 ; (C5) : 118,15 ; (C6) : 55,27 ; (C7) : 52,14 ; (C8) : 27,07 ; (C9) : 26,19 ; (C10) : 36,53 ; (Carom) : (122,01–137,12).
3.2.1.15 4f : 3-(5-Anilino-3-p-chlorophényl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 108. Rdt = 48%. IR : νNH = 3445 cm−1, νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H (CDCl3) : 9,46(s, 1H) ; 4,23(m, 2H) ; 4,21(m, 1H) ; 2,65(m, 2H) ; 2,37(m, 4H) ; 1,38(m, 6H) ; 7,5(m, 9H). RMN 13C(CDCl3) : (C1) : 155,62 ; (C2) : 162,04 ; (C3) : 47,24 ; (C4) : 30,08 ; (C5) : 118,12 ; (C6) : 55,25 ; (C7) : 52,13 ; (C8) : 27,22 ; (C9) : 26,16 ; (Carom) : (122,06–137,16).
3.2.1.16 4g : 3-(5-Anilino-3-phényl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 102. Rdt = 34%. IR : νNH = 3436 cm−1, νCN = 2175 cm−1, νCN = 1575 cm−1. RMN 1H (CDCl3) : 9,52(s, 1H) ; 4,21(m, 2H) ; 3,98(m, 1H) ; 2,61(m, 2H) ; 2,59(m, 4H) ; 1,82(m, 4H) ; 7,52(m, 10H). RMN 13C(CDCl3) : (C1) : 155,31 ; (C2) : 161,79 ; (C3) : 47,26 ; (C4) : 31,52 ; (C5) : 118,85 ; (C6) : 55,27 ; (C7) : 51,86 ; (C8) : 26,47 ; (Carom) : (121,71–138,32).
3.2.1.17 4h : 3-(5-Anilino-3-benzyl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile.
F = 95. Rdt = 38%. IR : νNH = 3445 cm−1, νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 9,06(s, 1H) ; 4,49(m, 1H) ; 4,46(m, 2H) ; 3,72(s, 2H) ; 2,48(m, 2H) ; 2,46(m, 4H1,77(m, 4H) ; 7,51(m, 10H). RMN 13C(CDCl3) : (C1) : 158,66 ; (C2) :154,14 ; (C3) : 47,31 ; (C4) : 31,64 ; (C5) : 118,73 ; (C6) : 55,13 ; (C7) : 52,21 ; (C8) : 26,42 ; (C10) : 36,28 ; (Carom) : (121,19–137,11).
3.2.1.18 4i : 3-(5-Anilino-3-p-chlorophényl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 107. Rdt = 28%. IR : νNH = 3445 cm−1, νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 9,46(s, 1H) ; 4,25(m, 2H) ; 4,22(m, 1H) ; 2,77(m, 2H) ; 2,73(m, 4H) ; 1,71(m, 4H) ; 7,5(m, 9H). RMN 13C(CDCl3) : (C1) : 156,16 ; (C2) :161,37 ; (C3) : 47,23 ; (C4) : 31,48 ; (C5) : 118,49 ; (C6) : 55,16 ; (C7) : 52,17 ; (C8) : 26,37 ; (Carom) : (121,23–138,03).
3.2.1.19 5a : 3-(5-Méthyl-3-phényl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
tR = 4 h. F = 139. Rdt = 75%. IR : νCN = 2175 cm−1, νCN = 1573 cm−1. RMN 1H(CDCl3) : 3,75(m, 2H) ; 3,6(m, 1H) ; 3,53(m, 4H) ; 2,53(m, 2H) ; 2,40(s, 3H) ; 2,27(m, 4H) ; 7,7(m, 5H). RMN 13C (CDCl3) : (C1) : 160,89 ; (C2) : 154,48 ; (C3) : 47,51 ; (C4) : 31,85 ; (C5) : 119,21 ; (C6) : 55,45 ; (C7) : 12,17 ; (C8) : 52,21 ; (C9) : 65,32 ; (Carom) : (132,99–124,21).
3.2.1.20 5b : 3-(3-Benzyl-5-méthyl-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 132. Rdt = 70%. IR : νCN = 2172 cm−1, νCN = 1571 cm−1. RMN 1H(CDCl3) : 3,76(m, 2H) ; 3,69(s, 2H) ; 3,63(m, 1H) ; 3,51(m, 4H) ; 2,5(m, 2H) ; 2,29(m, 4H) ; 2,19(s, 3H) ; 7,52(m, 5H). RMN 13C (CDCl3) : (C1) : 160,41 ; (C2) : 147,39 ; (C3) : 47,48 ; (C4) : 31,72 ; (C5) : 119,18 ; (C6) : 55,41 ; (C7) : 12,48 ; (C8) : 52,19 ; (C9) : 65,31 ; (C11) : 36,52 (Carom) : (134,54–125,56).
3.2.1.21 5c : 3-(5-Methyl-3-phényl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 130. Rdt = 51%. IR : νCN = 2172 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 3,76(m, 2H) ; 3,49(m, 1H) ; 2,60(m, 2H) ; 2,51(m, 4H) ; 2,39(s, 3H) ; 1,83(m, 6H) ; 7,5(m, 5H). RMN 13C (CDCl3) : (C1) : 159,29 ; (C2) :152,17 ; (C3) : 47,56 ; (C4) : 32,92 ; (C5) : 118,75 ; (C6) : 55,53 ; (C7) : 12,41 ; (C8) : 52,87 ; (C9) : 27,13 ; (C10) : 25,34 ; (Carom) : (131,91–124,15).
3.2.1.22 5d : 3-(3-Benzyl-5-méthyl-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 125. Rdt = 28%. IR : νCN = 2170 cm−1, νCN = 1576 cm−1. RMN 1H(CDCl3) : 3,75(m, 2H) ; 3,67(s, 2H) ; 3,64(m, 1H) ; 2,39(m, 2H) ; 2,34(m, 4H) ; 2,35(s, 3H) ; 1,85(m, 6H) ; 7,5(m, 5H). RMN 13C (CDCl3) : (C1) : 159,16 ; (C2) : 151,78 ; (C3) : 47,49 ; (C4) : 32,94 ; (C5) : 118,91 ; (C6) : 55,37 ; (C7) : 12,87 ; (C8) : 53,88 ; (C9) : 27,19 ; (C10) : 25,41 ; (C11) : 39,18 ; (Carom) : (134,73–125,78).
3.2.1.23 5e : 3-(5-Méthyl-3-phényl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 128. Rdt = 34%. IR : νCN = 2176 cm−1, νCN = 1580 cm−1. RMN 1H (CDCl3) : 3,95 (m, 2H) ; 3,6(m, 1H) ; 2,56(m, 2H) ; 2,51(m, 4H) ; 2,35(s, 3H) ; 1,91(m, 4H) ; 7,51(m, 5H). RMN 13C(CDCl3) : (C1) : 159,48 ; (C2) : 153,80 ; (C3) : 47,68 ; (C4) : 32,81 ; (C5) : 118,42 ; (C6) : 54,38 ; (C7) : 12,93 ; (C8) : 52,72 ; (C9) : 24,81 ; (Carom) : (131,47–124,51). Anal. élém. C17H21N5 : Calc. C 69,12 ; H 7,17 ; N 23,71. Tr. C 69,17 ; H 7,26 ; N 23,79.
3.2.1.24 5f : 3-(3-Benzyl-5-méthyl-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 129. Rdt = 38%. IR : νCN = 2174 cm−1, νCN = 1582 cm−1. RMN 1H (CDCl3) : 3,86(m, 2H) ; 3,61(s, 2H) ; 3,58(m, 1H) ; 2,52(m, 2H) ; 2,49(m, 4H) ; 1,29(s, 3H) ; 1,94(m, 4H) ; 7,5(m, 5H). RMN 13C(CDCl3) : (C1) : 160,13 ; (C2) :149,81 ; (C3) : 47,54 ; (C4) : 32,91 ; (C5) : 118,41 ; (C6) : 54,40 ; (C7) : 12,87 ; (C8) : 52,68 ; (C9) : 24,57 ; (C11) : 38,62 ; (Carom) : (134,48–125,61).
3.2.1.25 6a : 3-Morpholin-4-yl-2-[(5-oxo-3-phényl-2,5-dihydro-1H-1,2,4-triazol-1-yl)méthyl]propanenitrile
tR = 6 h. F = 115. Rdt = 68%. IR : νNH = 3497 cm−1, νCN = 2172 cm−1, νCO = 1610 cm−1, νCN = 1575 cm−1. RMN 1H (CDCl3) : 8,11(s, 1H) ; 3,75(m, 2H) ; 3,6(m, 4H) ; 2,61(m,1H) ; 2,58(m, 2H) ; 2,39(m, 4H) ; 7,53(m, 5H). RMN 13C(CDCl3) : (C1) : 173,34 ; (C2) :162,25 ; (C3) : 40,46 ; (C4) : 28,25 ; (C5) : 116,75 ; (C6) : 54,80 ; (C7) : 52,14 ; (C8) : 65,80 ; (Carom) : (132,51–126,83).
3.2.1.26 6b : 3-(3-Benzyl-5-oxo-2,5-dihydro-1H-1,2,4-triazol-1-yl)-2-(morpholin-4-ylméthyl)propanenitrile
F = 118. Rdt = 72%. IR : νNH = 3497 cm−1, νCN = 2173 cm−1, νCO = 1610 cm−1, νCN = 1577 cm−1. RMN 1H(CDCl3) : 7,75(s, 1H) ; 3,82(s, 2H) ; 3,62(m, 2H) ; 3,53(m, 4H) ; 2,52(m, 1H) ; 2,49(m, 2H) ; 2,29(m, 4H). RMN 13C(CDCl3) : (C1) : 169,39 ; (C2) :159,23 ; (C3) : 40,96 ; (C4) : 28,20 ; (C5) : 116,61 ; (C6) : 54,66 ; (C7) : 52,10 ; (C8) : 65,71 ; (C10) : 38,29 ; (Carom) : (134,70–125,14).
3.2.1.27 6c : 3-(5-Oxo-3-phényl-2,5-dihydro-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 105. Rdt = 32%. IR : νNH = 3496 cm−1, νCN = 2170 cm−1, νCO = 1610 cm−1, νCN = 1573 cm−1. RMN 1H (CDCl3) : 8,12(s, 1H) ; 3,77(m, 2H) ; 2,72(m, 1H) ; 2,68(m, 2H) ; 2,54(m, 4H) ; 1,53 (m, 6H) ; 7,46(m, 5H). RMN 13C(CDCl3) : (C1) : 174,13 ; (C2) :161,25 ; (C3) : 40,36 ; (C4) : 29,18 ; (C5) : 116,59 ; (C6) : 54,48 ; (C7) : 52,18 ; (C8) : 27,22 ; (C9) : 26,17 ; (Carom) : (132,51–126,20).
3.2.1.28 6d : 3-(3-Benzyl-5-oxo-2,5-dihydro-1H-1,2,4-triazol-1-yl)-2-(pipéridin-1-ylméthyl)propanenitrile
F = 127. Rdt = 21%. IR : νNH = 3496 cm−1, νCN = 2172 cm−1, νCO = 1611 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 7,72(s, 1H) ; 3,79(s, 2H) ; 3,61(m, 2H) ; 2,59(m, 1H) ; 2,55(m, 2H) ; 2,37(m, 4H) ; 1,84(m, 6H) ; 7,5(m, 5H). RMN 13C(CDCl3) : (C1) : 168,65 ; (C2) :159,15 ; (C3) : 40,46 ; (C4) : 29,31 ; (C5) : 116,64 ; (C6) : 54,37 ; (C7) : 52,36 ; (C8) : 27,30 ; (C9) : 26,21 ; (C10) : 41,19 ; (Carom) : (134,47–126,18) .
3.2.1.29 6e : 3-(5-Oxo-3-phényl-2,5-dihydro-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 126. Rdt = 36%. IR : νNH = 3497 cm−1, νCN = 2172 cm−1, νCO = 1610 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 8,11(s, 1H) ; 3,76(m, 2H) ; 2,68(m, 1H) ; 2,66(m, 4H) ; 2,57(m, 2H) ; 1,82(m, 4H), 7,45(m, 5H). RMN 13C(CDCl3) : (C1) : 173,69 ; (C2) :163,17 ; (C3) : 40,28 ; (C4) : 29,24 ; (C5) : 116,80 ; (C6) : 54,67 ; (C7) : 52,18 ; (C8) : 21,37 ; (Carom) : (130,57–126,78).
3.2.1.30 6f : 3-(3-Benzyl-5-oxo-2,5-dihydro-1H-1,2,4-triazol-1-yl)-2-(pyrrolidin-1-ylméthyl)propanenitrile
F = 133. Rdt = 19%. IR : νNH = 3497 cm−1, νCN = 2172 cm−1, νCO = 1610 cm−1, νCN = 1574 cm−1. RMN 1H(CDCl3) : 7,23(s ; 1H) ; 3,83(s, 2H) ; 3,58(m, 2H) ; 2,56(m, 1H) ; 2,52(m, 2H) ; 2,50(m, 4H) ; 1,81(m, 4H) ; 7,31(m, 5H). RMN 13C(CDCl3) : (C1) : 168,98 ; (C2) :162,52 ; (C3) : 40,17 ; (C4) : 29,21 ; (C5) : 116,62 ; (C6) : 54,70 ; (C7) : 52,21 ; (C8) : 21,64 ; (C10) : 40,98 ; (Carom) : (134,37–127,04) .
3.2.2 Synthèse des triazolopyrimidines 7
Dans un ballon de 100 mL, on mélange 0,01 mol d'iminoesters 1, 0,01 mol de 3-hydrazino-2-(N,N-dialkylaminométhyl)propanenitrile 2 et quelques gouttes d'acide acétique. Le mélange est porté au reflux du toluène pendant 1 h. Le résidu obtenu est traité à l'éther jusqu'à obtention d'un solide jaune, que l'on recristallise ensuite dans le THF.
3.2.2.1 7a : 5-Amino-2-méthyl-6-(morpholin-4-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 238. Rdt = 70%. IR :
3.2.2.2 7b : 5-Amino-2-éthyl-6-(morpholin-4-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 220. Rdt % = 68. IR :
3.2.2.3 7c : 5-Amino-6-(morpholin-4-ylméthyl)-2-propyl-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 230. Rdt = 55%. IR :
3.2.2.4 7d : 5-Amino-6-(morpholin-4-ylméthyl)-2-phényl-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 242. Rdt = 67%. IR :
3.2.2.5 7e : 5-Amino-2-méthyl-6-(pipéridin-1-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 198. Rdt = 62%. IR :
3.2.2.6 7f : 5-Amino-2-éthyl-6-(pipéridin-1-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 177. Rdt% = 50. IR :
3.2.2.7 7g : 5-Amino-2-méthyl-6-(pyrrolidin-1-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 205. Rdt = 49%. IR :
3.2.2.8 7h : 5-Amino-2-éthyl-6-(pyrrolidin-1-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 189. Rdt% = 48. IR :
3.2.2.9 7i : 5-Amino-2-phényl-6-(pyrrolidin-1-ylméthyl)-6,7-dihydro[1,2,4]triazolo[1,5-a]pyrimidine
F = 210. Rdt% = 45. IR : νNH2 = 3434–3416 cm−1,


