1 Introduction
Le soufre est généralement obtenu à partir de H2S par la méthode de Claus qui, malgré son ancienneté, a montré des performances remarquables. La modification actuelle de cette méthode concerne les étapes suivantes :
- • (1) l’étape thermique, qui consiste en l’oxydation de H2S à l’état gazeux (sans catalyseur) en présence d’une quantité d’air qui permet facilement de transformer une partie de H2S en soufre élémentaire et en SO2 par les réactions suivantes :
(a)
(une combustion stable de H2S en phase gazeuse reste une des exigences de cette étape) ;(b) - • (2) l’étape qui fait suite à la précédente (rapport H2S/SO2 = 2), au cours de laquelle intervient la réaction catalytique impliquant le SO2 formé qui n’a pas réagi durant la première phase :
(c)
Par ailleurs, on observe des réactions telles que :
| (d) |
| (e) |
Pour H2S > 20 mol% dans le gaz acide [1], la stabilité de la combustion de H2S est assurée en utilisant les chauffages traditionnels avec des chalumeaux ordinaires à gaz [2]. Pour H2S < 15 mol%, la réalisation de la combustion de H2S avec l’air devient impossible. La transformation des gaz acides « pauvres » demande une modernisation du procédé de Claus. L’une des possibilités de transformation de tels gaz est le remplacement de l’étape thermique par l’oxydation catalytique. Cette variante peut être utilisée pour la transformation de tout gaz acide, même en présence d’une très faible concentration en H2S. Les difficultés majeures rencontrées dans la réalisation d’une telle transformation résident dans le choix d’un catalyseur de haut pouvoir de conversion de H2S en soufre et jouissant d’une grande stabilité dans des conditions de réaction fortement exothermiques. Les critères fondamentaux du choix d’un tel catalyseur sont l’activité, la stabilité et le meilleur coût. Le diamètre de ses pores doit être de telle sorte que la réaction ne soit pas limitée [3]. Il doit enfin posséder une stabilité mécanique [4,5]. Les premiers catalyseurs de procédé de Claus étaient d’abord les bauxites naturelles [6,7]. Leur faible stabilité mécanique et leur composition variable ont favorisé la mise en place des catalyseurs plus efficaces. Parmi les catalyseurs d’oxydation partielle de H2S, les systèmes à composition multiple tels que les systèmes composés d’oxydes de fer, de chrome, de zinc [8] occupent une place de choix et se distinguent par une plus grande stabilité et une bonne activité dans le procédé de Claus. Ils possèdent en outre une grande résistance mécanique. Ils sont enfin de préparation simple.
2 Matériel et méthodes
H2S est obtenu à l’aide de la réaction :
Les réactions d’oxydation de H2S par SO2, O2 et l’oxydation du soufre élémentaire avec la vapeur d’eau sont étudiées au laboratoire avec des réacteurs en quartz (20 mm de diamètre et 180 mm de longueur). L’analyse de la matière première et les produits de réaction est réalisée avec un chromatographe de marque LXM-8MD, muni d’un détecteur de conductibilité calorifique. Deux colonnes chromatographiques ont été utilisées pour l’analyse. La première (3 mm de diamètre et 2 m de long) servant à l’analyse de H2S et de SO2 est remplie de silicagel, de marque ASKG (fraction 0,25–0,50 mm). La deuxième colonne (3 mm de diamètre et 1 m de long) utilisée pour l’analyse de l’oxygène est, en revanche, remplie de zéolites CaA (fraction 0,25–0,50 mm). Le gaz vecteur est l’hydrogène. Les colonnes thermostatées à 70 °C ont chacune un débit de 1,5 l h–1. La température du catharomètre est de 100 °C. La sensibilité de l’analyse en composés sulfurés est de 0,01 mol%. La méthode de synthèse du catalyseur est celle décrite par Chadrin et al. [9]. Pour l’analyse radiographique aux rayons X du catalyseur, la source de lumière est un tube à anode en cuivre (λKα = 1,54 Å). L’appareil est muni d’un filtre en nickel (1 mm d’épaisseur). L’analyse par spectroscopie infrarouge du catalyseur est réalisée à l’aide d’un spectrophotomètre UR-20 dans le domaine 450–1400 cm–1 et 1600–3800 cm–1.
3 Résultats
3.1 Étude physico-chimique du catalyseur
L’étude est réalisée à l’aide d’un catalyseur contenant des oxydes métalliques (Cr–Fe–Zn), dont la composition en% massique est : Fe2O3 = 24,85 ; ZnO = 26,5 ; Cr2O3 = 48,5 ; Co2O3 = 0,15 ; SiO2 = 0,5.
Dans son état initial, le catalyseur utilisé se présente comme un système composé de structures spinelles ZnCr2O4 et FeCr2O4 et d’un petit nombre d’oxydes ferriques et chromiques non liés. La surface spécifique du catalyseur est égale à 36 m2 g–1. L’analyse aux rayons X et celle par spectroscopie infrarouge (Fig. 1 ) suggèrent que la structure du catalyseur n’a pas changé durant son séjour dans le réacteur.
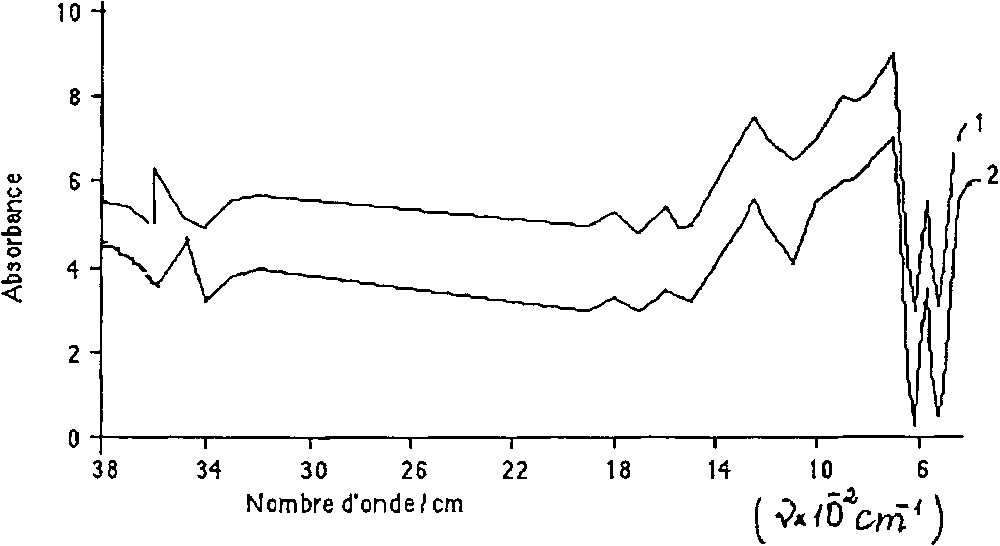
Spectre infrarouge du catalyseur avant (1) et après (2) son utilisation.
3.2 Influence de la concentration de l’oxygène
Les résultats sont obtenus avec H2S = 6 mol%, une vitesse volumique du gaz réactionnel de 6000 h–1, des températures comprises entre 250 et 600 °C. SO2 se forme avec toutes les concentrations d’oxygène choisies et, pour une concentration en O2 inférieure à la stœchiométrie dans la réaction d’oxydation de H2S en soufre (jusqu’à 3 mol%), la conversion de H2S ne dépasse pas 86% à 600 °C. Mais elle est de 62 à 76% pour une température plus basse (Fig. 2 ). L’augmentation de la concentration en O2 dans le mélange gazeux entraîne une augmentation de la vitesse de conversion de H2S et, pour une concentration en oxygène de 7 mol%, la conversion de H2S est proche de 100%. Le rendement en SO2 augmente de 18 à 82% entre les températures de 250 et 600 °C respectivement.

Conversion de H2S (à gauche) et conversion de H2S en SO2 (à droite) en fonction de la concentration initiale de O2. H2S = 6 mol% ; vitesse volumique = 6000 h–1 ; courbe 1 = 250 °C ; courbe 2 = 450 °C ; courbe 3 = 600 °C.
Les valeurs de la composition du gaz à la sortie du réacteur sont consignées dans le Tableau 1. L’interaction complète de l’oxygène a lieu à 600 °C et pour une concentration initiale de O2 ne dépassant pas 4,2 mol% (rapport O2/H2S = 0,7). Pour une température < 60 °C et un rapport O2/H2S > 0,7, la concentration de O2 est élevée dans le gaz à la sortie du réacteur. Ces résultats sont dus à l’insuffisance du temps de séjour du gaz réactionnel dans la zone catalytique et, avec l’augmentation du temps de contact, une réaction complète de O2 est obtenue avec le reste de composé gazeux.
Influence de la concentration initiale de O2 sur la composition du gaz à la sortie du réacteur. Concentration initiale H2S = 6 mol%. Vitesse volumique = 6000 h–1
| Concentration de O2 (mol%) | Concentration du gaz à la sortie du réacteur (mol%) en fonction de la concentration en O2 et de la température | ||||||||
| 250 | 450 | 600 | |||||||
| H2S | SO2 | O2 | H2S | SO2 | O2 | H2S | SO2 | O2 | |
| 2,7 | 2,22 | 0,15 | 0,43 | 1,68 | 0,24 | 0,30 | 1,20 | 0,30 | 0,00 |
| 3,0 | 1,89 | 0,18 | 0,76 | 1,44 | 0,27 | 0,45 | 0,78 | 0,39 | 0,00 |
| 4,2 | 0,92 | 0,31 | 1,35 | 0,65 | 0,67 | 0,86 | 0,30 | 1,35 | 0,00 |
| 6,0 | 0,29 | 0,56 | 2,59 | 0,14 | 1,82 | 1,25 | 0,00 | 3,60 | 0,60 |
| 9,0 | 0,04 | 1,16 | 4,86 | 0,02 | 3,20 | 2,81 | 0,00 | 4,99 | 1,52 |
3.3 Influence de la concentration de H2S
L’influence de la concentration de H2S sur son oxydation est étudiée entre 250 et 600 °C. Le mélange gazeux réactionnel est composé pour un rapport O2/H2S = 0,7. Le rendement de H2S en SO2 en fonction de la concentration initiale de H2S peut varier de 3 à 12 mol% pour une vitesse volumique de flux gazeux de 6000 h–1 (Fig. 3 ). L’augmentation de la concentration en H2S sur l’intervalle de température choisi provoque la diminution de la conversion de H2S. Elle s’observe notamment pour H2S > 6 mol%. Pour des concentrations de 3 à 6 mol%, la diminution de la conversion de H2S ne dépasse 4% et ne dépend guère de la température du procédé. Le taux de conversion de H2S en SO2 diminue également avec l’augmentation de la température. Une température de 600 °C et des concentrations de H2S de 3 à 12 mol% provoquent une baisse de la transformation de H2S en SO2 de 25 à 14% ; cette diminution est de 15 à 8% à 450 °C.
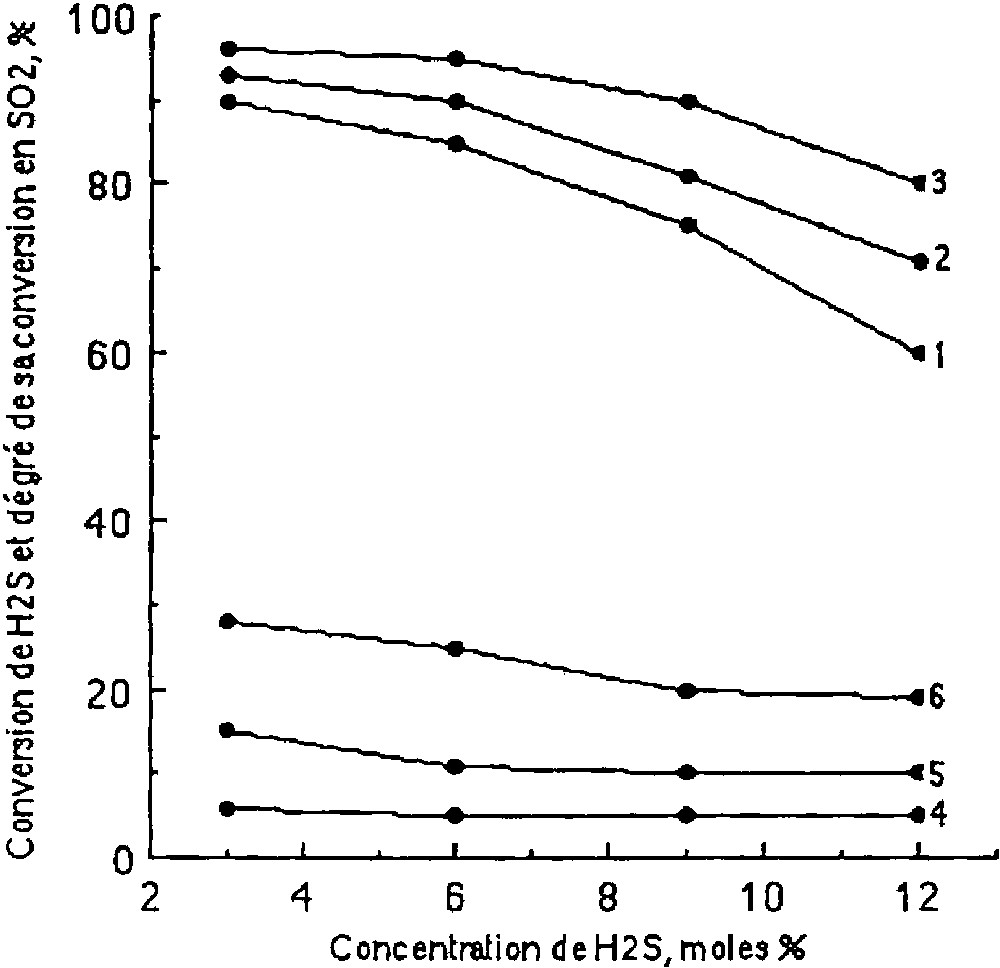
Conversion de H2S (1, 2, 3) et conversion en SO2 (4, 5, 6) en fonction de la concentration en H2S (mol%). Vitesse volumique = 6000 h–1 ; O2/H2S = 0,7 ; température (°C) : courbes 1 et 4 = 250 °C ; courbes 2 et 5 = 450 °C et courbes 3 et 6 = 600 °C.
Le taux de conversion de O2 en fonction de la concentration en H2S dans le mélange gazeux est estimé à partir de la concentration restante des composés ayant réagi. La baisse de la conversion de H2S et l’augmentation de sa concentration entraînent la diminution de la conversion de O2. L’oxygène réagit complètement à 600 °C pour des concentrations en H2S de 3 à 6 mol%. L’oxydation de H2S par l’oxygène donnant des produits tels que le soufre, le dioxyde de soufre et l’eau, il est impossible de négliger les réactions de H2S avec SO2, du soufre avec la vapeur d’eau et du soufre avec l’oxygène dans le système.
3.4 Réaction d’oxydation de H2S par SO2
La composition (en mol%) du mélange gazeux utilisé est la suivante : H2S = 3,0 ; SO2 = 1,5 ; He = 95,5. La vitesse d’alimentation du gaz réaction est de 3000 à 9000 h–1. La température du procédé est comprise entre 250 et 600 °C. Les résultats montrant l’influence de la température de l’oxydation catalytique de H2S par SO2 sont donnés dans le Tableau 2. L’oxydation de H2S par SO2 avec différentes vitesses volumiques est présentée dans le Tableau 3. Avec l’augmentation des vitesses volumiques de 3000 à 9000 h–1, il existe une légère diminution de la conversion de (H2S + SO2) de 3% à 450 °C.
Influence de la température sur l’oxydation de H2S par SO2. Concentration (mol%): H2S = 3 ; SO2 = 1,5 ; He = 95,5. Vitesse volumique = 3000 h–1
| Température,°C | Concentration restante (mol%) | Somme de conversion (SO2 + H2S) (%) | |
| H2S | SO2 | ||
| 250 | 0,68 | 0,35 | 77,10 |
| 450 | 0,51 | 0,28 | 82,00 |
| 600 | 0,83 | 0,46 | 71,10 |
Influence de la vitesse volumique sur l’oxydation de H2S par SO2. Concentration, (mol%) : H2S = 3; SO2 = 1,5; He = 95,5. Température = 450 °C
| Vitesse volumique (h–1) | Concentration restante, mole% | Somme de conversion(SO2 + H2S) (%) | |
| H2S | SO2 | ||
| 3000 | 0,51 | 0,28 | 82,00 |
| 6000 | 0,57 | 0,30 | 80,50 |
| 9000 | 0,60 | 0,32 | 79,30 |
3.5 Réaction du soufre avec la vapeur d’eau
L’alimentation d’une solution de soufre en fusion par une quantité de vapeur d’eau a été réalisée sous flux d’hélium. La vitesse volumique du gaz et la température de l’expérience sont de 3000 à 9000 h–1, 250 à 600 °C respectivement. La vitesse de la réaction est estimée en fonction de la concentration en H2S et SO2 dans le gaz à la sortie du réacteur. Les résultats obtenus sont présentés dans le Tableau 4. L’augmentation de la température et du temps de contact provoque l’augmentation du rendement de la réaction du soufre avec la vapeur d’eau. Cependant, les concentrations de H2S et SO2 ne sont pas élevées et ne dépassent guère 0,27 et 0,14 mol%, respectivement.
Influence des conditions du processus sur le rendement de la réaction du soufre avec la vapeur d’eau ; S8 = 6,3 mol% ; vapeur d’eau = 5 mol%
| Température (°C) | Composition du gaz à la sortie du réacteur (mol%) en fonction de la vitesse volumique (h–1) | |||||
| 3000 | 6000 | 9000 | ||||
| H2S | SO2 | H2S | SO2 | H2S | SO2 | |
| 250 | 0,04 | 0,02 | 0,02 | 0,01 | 0,01 | traces |
| 450 | 0,10 | 0,05 | 0,09 | 0,04 | 0,03 | 0,02 |
| 600 | 0,27 | 0,14 | 0,09 | 0,05 | 0,07 | 0,04 |
3.6 Réaction du soufre avec l’oxygène
La réaction d’oxydation du soufre par l’oxygène est réalisée dans les mêmes conditions que celle du soufre avec la vapeur d’eau, à la différence près que cette dernière est remplacée par l’oxygène. La vitesse de la réaction est mesurée en fonction de la concentration en SO2 à la sortie du réacteur (Tableau 5).
Influence des conditions du processus sur le rendement en SO2 provenant de l’oxydation du soufre par O2 ; S8 = 6,3 mol% ; O2 = 7 mol%
| Température (°C) | Concentration de SO2 à la sortie du réacteur (mole%) avec une vitesse volumique (h–1) | ||
| 3000 | 6000 | 9000 | |
| 250 | 0,08 | 0,06 | 0,02 |
| 450 | 0,10 | 0,09 | 0,06 |
| 600 | 0,22 | 0,20 | 0,17 |
Comme dans la réaction précédente, le rendement de la réaction du soufre avec l’oxygène augmente avec la température et le temps de contact. Pour une vitesse volumique de 3000 h–1, la concentration de H2S et de SO2 ne dépasse guère 0,22 mol%.
4 Discussion et conclusion
L’un des problèmes rencontrés dans l’utilisation du catalyseur à base d’oxydes métalliques (Cr–Fe–Zn) durant l’étape thermique du procédé de Claus est celui du choix de l’intervalle de température. Le catalyseur choisi pour cette étude présente une activité dès 200 °C. La limite supérieure de température définit la thermostabilité du catalyseur employé. Une calcination de 10 h entre 650 et 800 °C ne provoque pas de changement visible de l’activité catalytique (Tableau 6).
Influence de la température de calcination du catalyseur sur son activité dans l’oxydation de H2S. Durée = 10 h ; concentration H2S = 6 mol% ; vitesse volumique = 6000 h–1 ; O2/H2S = 0,70 ; température = 600 °C
| Température de calcination (°C) | 650 | 700 | 800 | 900 | 1000 |
| Conversion de H2S (%) | 95 | 94 | 95 | 80 | 60 |
En portant la température de calcination à 900 °C, la conversion de H2S diminue de 15%. Le temps nécessaire pour la désactivation de 1% du catalyseur a été calculé pour des températures de 600, 700 et 800 °C d’après les données de la littérature [10] et en fixant le coefficient de température de désactivation du catalyseur à 1,3. Les résultats suggèrent qu’avec une élévation de température dans le réacteur adiabatique à 600 °C, le catalyseur conserve ses propriétés pendant trois ans. Une courte durée de l’augmentation de la température de 700 à 800 °C ne provoque pas de changement notoire du taux de conversion de H2S. L’élévation de température du mélange gazeux dans le réacteur adiabatique dépend de la quantité de H2S utilisée et de la sélectivité de son oxydation en soufre élémentaire ou en SO2. Cette élévation de température dépend très peu du nombre d’atomes de la molécule du soufre formée (Sx). SO3 n’est pas formé au cours de l’expérience ; malgré l’augmentation de H2S dans le mélange gazeux, le rendement de SO2 diminue (Fig. 3). La température à l’entrée du réacteur adiabatique étant égale à 200 °C, l’élévation de température normale à l’intérieur ne doit pas dépasser 400 °C, bien qu’une brève élévation de température soit de 500 °C. La température et la concentration de l’oxygène dans le mélange gazeux sont les facteurs importants pour régulariser les produits d’oxydation et la conversion de H2S. Pour un rapport O2/H2S > 1, la conversion de H2S est proche de 100%. Cette conversion est indépendante de la température de l’expérience et, dans ce cas, le rendement en SO2 augmente (Fig. 3).
La Fig. 4 peut servir de base pour le choix de la concentration de O2 nécessaire pour l’oxydation de H2S de 3 à 12 mol%. Pour H2S de 3 à 6 moles%, l’élévation de température définie dans le réacteur se limite à une sélectivité en soufre de 70 à 75%. Par conséquent, le rapport O2/H2S ne devrait pas dépasser 0,7 et 0,75. Pour H2S > 6 mol%, l’élévation de température dans le réacteur de 400 à 500 °C est atteinte lorsque la sélectivité en soufre est supérieure à 90%. Le rapport O2/H2S devrait être inférieur à 0,55.

Sélectivité de l’oxydation de H2S en soufre en fonction de la concentration de l’oxygène. H2S = 6 mol% ; vitesse volumique = 6000 h–1 ; température = 600 °C.
En effet, ce n’est qu’en diminuant la concentration de l’oxygène qu’on peut obtenir une meilleure sélectivité en soufre (Tableau 7). Le changement de température dans le réacteur ne dépasse pas 400 °C pour une conversion de H2S de 46 à 49%. Les résultats obtenus justifient l’utilisation du catalyseur à base d’oxydes métalliques (Cr–Fe–Zn) dans la première étape du procédé de Claus. Il permet de réaliser l’oxydation de H2S avec une haute sélectivité et d’obtenir un rendement en soufre élémentaire d’un niveau élevé.
Influence de la concentration de O2 sur la sélectivité de l’oxydation de H2S en soufre élémentaire. ΔC caractérise la différence de concentration initiale de H2S dans le mélange gazeux. Concentration initiale de H2S = 12 mol%. Vitesse volumique = 6000 h–1. Température = 600 °C
| Concentration O2 (mol%) | O2/H2S | ΔC (mol%) | Sélectivité en soufre (%) |
| 5,4 | 0,45 | 5,50 | 90,2 |
| 6,0 | 0,50 | 5,90 | 88,7 |
| 6,6 | 0,55 | 6,75 | 86,0 |
| 8,4 | 0,70 | 8,90 | 80,0 |


