1 Introduction
Le bismuth est le plus lourd des éléments stables (même si sa stabilité a été récemment mise en cause avec l'observation de désintégration pour le 209Bi, unique isotope, ayant une demi-vie de l'ordre de 1019 années [1]), portant le numéro atomique 83, et présente la structure électronique [Xe] 4f14 5d10 6s2 6p3. Cette configuration permet les états d'oxydation +III et +V pour ce métal, sous lesquels se trouvent les composés du bismuth, sels, oxydes ou complexes.
Une particularité intéressante concernant cet élément est sa relative non-toxicité ; les composés à base de bismuth (III) ont en effet une toxicité faible en comparaison avec celle d'autres métaux lourds, dont la toxicité croît habituellement avec leur position descendante dans le tableau périodique [2]. Ceci constitue un avantage sur d'autres métaux utilisés en synthèse organique, tels que le mercure (HgO, Hg(OAc)2) et le plomb (Pb(OAc)4) en oxydation, ainsi que sur les acides de Lewis à base d'aluminium ou de titane (AlCl3 et TiCl4), générateurs d'acide chlorhydrique.
Les développements récents de réactions en synthèse organique basées sur des dérivés du bismuth sont en augmentation depuis quelques années. Plusieurs sels de bismuth (III) ont été utilisés avec succès comme catalyseurs dans des réactions très diverses.
L'utilisation du bismuth en synthèse organique a fait l'objet d'articles de revue généraliste [3], ou portant en particulier sur le bismuth (V) [4], sur le bismuth (III) [5], ou sur les applications dans des réactions d'arylation [6], d'oxydation [7–8], ainsi que de sulfonylation et d'acylation [9].
Cette revue résume les publications plus récentes concernant les réactions de couplage C–C, les réactions de protection/déprotection de groupements fonctionnels puis les processus d'oxydation.
2 Réactions de couplage
Le bismuth métallique, dont l'utilisation est extrêmement rare, a été décrit comme promoteur de réactions de type Barbier impliquant le couplage entre un aldéhyde et un halogénure d'allyle, bromure ou iodure (Équation (1)) [10]. Équation 1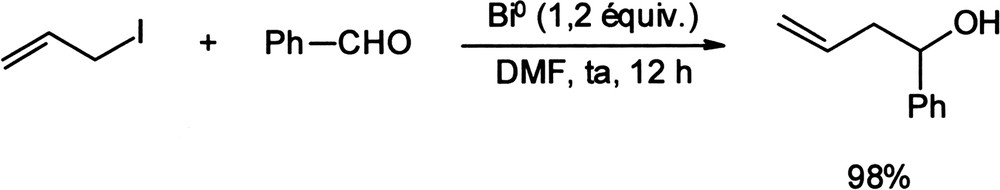
Ce principe a été plus amplement repris dans des réactions au cours desquelles le bismuth métallique est généré in situ par la mise en présence de trichlorure de bismuth (III) et d'un métal réducteur, le zinc, l'aluminium, le fer ou l'étain [11–12] pour la formation de liaisons carbone–carbone (Équation (2))[13] mais aussi carbone–soufre [14]. Équation 2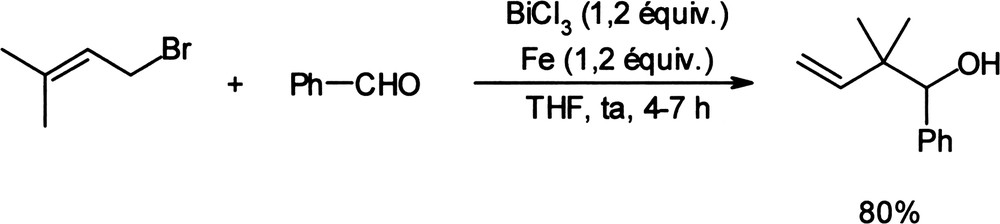
De nombreuses autres réactions mettant en jeu des dérivés du bismuth (III) ou (V) ont été décrites à ce jour. Les composés organiques du bismuth (V), et notamment les complexes de pentaarylbismuth, ont été largement décrits par Barton et al. dans des réactions d'arylation de substrats organiques [4]. Récemment, des composés aryliques du bismuth (III) tels que BiPh3 ou Bi(naphtyl)3 ont été à leur tour impliqués dans des réactions de couplage en tant que source de nucléophile aromatique, la réaction étant catalysée par des complexes du palladium [15] ou du rhodium [16].
Le diacétate de triphenylbismuth, composé du bismuth (V), a également été donneur de groupement phényle dans des réactions de couplage arylique [17] et dans des réactions de benzoylation sous pression de monoxyde de carbone en présence d'un complexe du palladium [18]. Cette réaction a été mise à profit pour la résolution cinétique d'alcools secondaires, induite par un ligand chiral du palladium (Équation (3)). Équation 3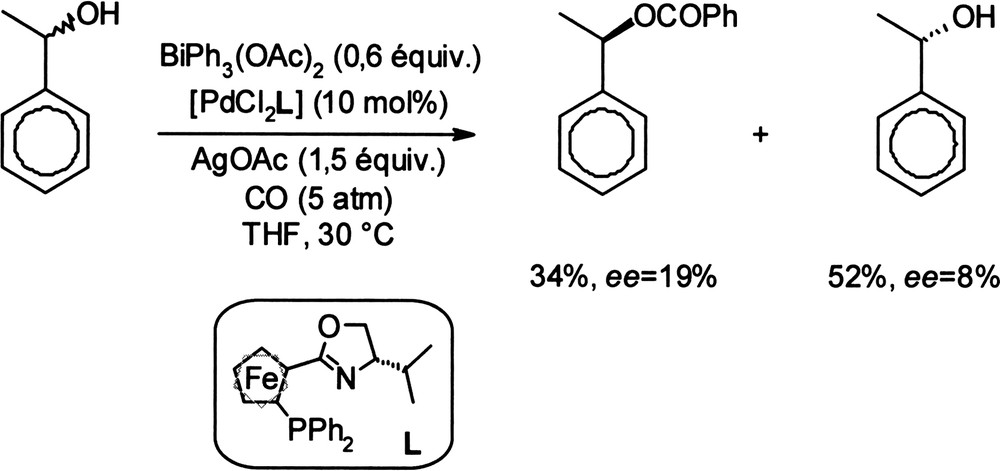
Parmi les réactions de cycloaddition, c'est le chlorure de bismuth (III) que l'on rencontre le plus souvent dans la littérature. Des réactions d'hétéro Diels–Alder ont été réalisées en série oxygénée avec la cyclisation de plusieurs diènes aliphatiques et de composés carbonylés appauvris par la conjugaison avec des fonctions esters (Équation (4)) [19]. Équation 4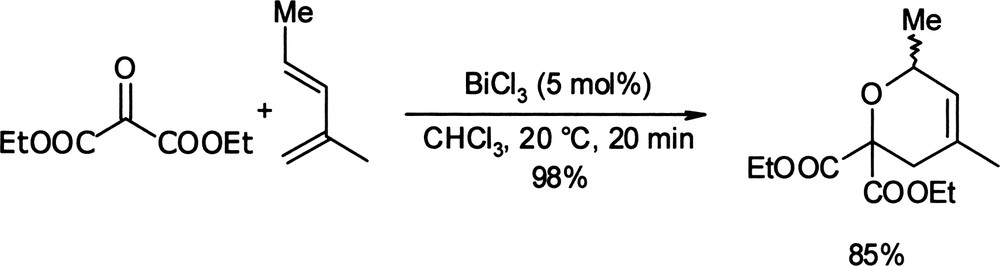
Depuis quelques années, la famille des sels du bismuth (III) s'est enrichie d'un nouveau réactif, le tris(trifluorométhanesulfonate) de bismuth (III), ou triflate de bismuth (III), de formule Bi(OTf)3, et présentant des propriétés d'acide de Lewis semblables à celles de ses homologues, les halogénures, carboxylates et autres sels, mais ayant systématiquement une activité catalytique supérieure [20].
Provenant principalement de la grande délocalisation de la charge négative des anions triflate, le caractère électrophile accru du cation Bi3+ permet de réaliser des réactions de couplage, d'additions nucléophiles ou de cycloadditions en utilisant une quantité limitée de sel, parfois inférieure au pourcent molaire, pour des nombres de rotation (turnover), souvent supérieurs à 100 sans l'aide de ligands ou de cofacteurs.
Par ailleurs, le triflate de bismuth, s'il s'hydrate spontanément à l'air ambiant, reste stable et actif [21], ce qui permet certaines réactions en solvant aqueux sans perte d'activité. Sa décomposition n'intervenant qu'à partir de 100 °C [22], une large gamme de températures est accessible à l'expérience.
La mise au point de préparations simples [23–24] et l'exploration du potentiel de ce réactif a été réalisée notamment par le groupe de J. Dubac au cours de la dernière décennie. Il en ressort plusieurs applications, dont la réaction d'aldolisation de Mukaiyama [25–26], l'acylation de Friedel–Crafts [27–28], la sulfonylation [29–30] et la chlorosulfinylation [31] de composés aromatiques, ou encore la réaction de Diels–Alder [32], également en série oxygénée [33] et azotée [34].
À titre d'exemple, dans la réaction de Mukaiyama, la supériorité de l'activité du triflate de bismuth par rapport aux triflates de scandium, ytterbium ou cérium a été démontrée sur la base de critères cinétiques [25]. La réaction est accomplie dans des temps courts, avec des rendements quasi quantitatifs pour 1% molaire de catalyseur (Équation (5)). Équation 5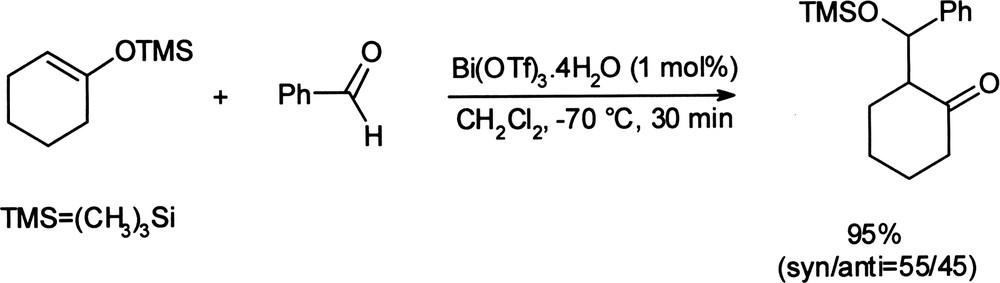
La réaction de composés aromatiques avec des agents sulfonylants comme les chlorures de sulfonyle ou les anhydrides sulfoniques en présence de triflate de bismuth (III) permet de former les sulfones aromatiques correspondantes (Équation (6)) [29]. Équation 6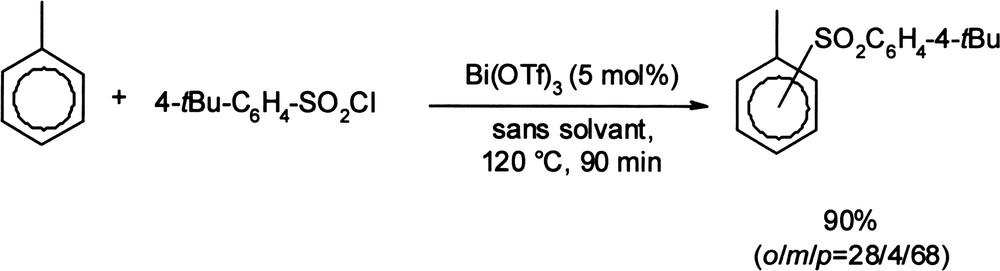
Par analogie avec la réaction de sulfonylation des composés aromatiques, on peut citer également la réaction de phosphonylation des composés aromatiques, réalisée au moyen de chlorure de phosphore, PCl3, en présence de divers acides de Lewis, dont le triflate de bismuth (III) [35].
La réaction de Sakurai intermoléculaire, IMSC, impliquant un allylsilane hydroxylé ainsi qu'un aldéhyde, peut être catalysée par Bi(OTf)3 pour conduire aux 4-méthylidènetétrahydropyranes correspondants, avec de bons rendements (84–98%) (Équation (7)) [36]. Équation 7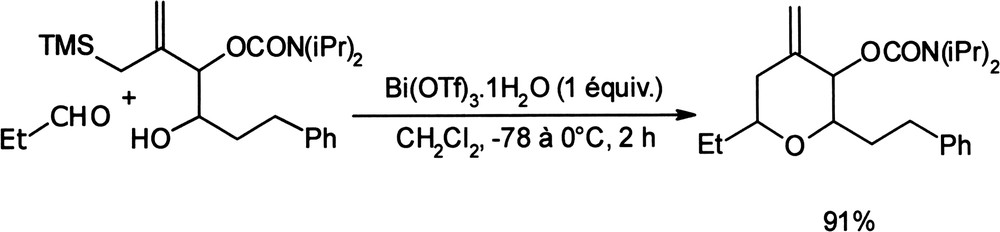
Des réactions d'allylation d'aldéhydes ou d'aldimines par l'allyltributylétain catalysées par le triflate de bismuth (III) ont été présentées [37]. Les alcools et amines homoallyliques correspondants sont alors obtenus avec des rendements de 65 à 95% (Équation (8)). Équation 8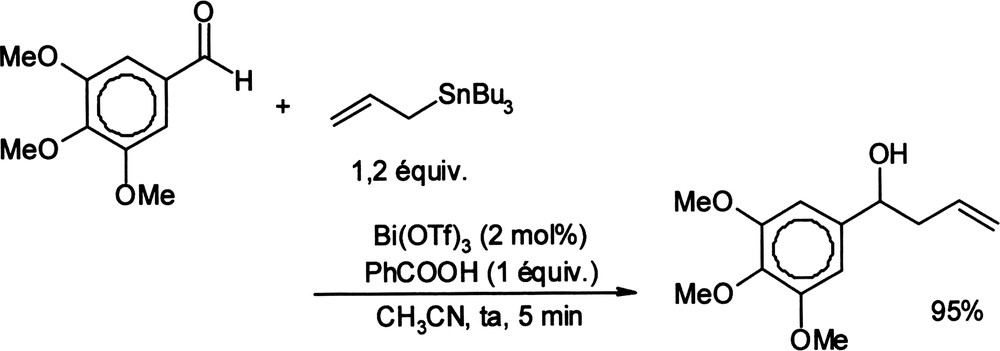
L'addition d'amines aliphatiques à des esters et nitriles α,β-insaturés a été décrite en utilisant 2 mol% de triflate de bismuth à température ambiante, avec des temps de réaction courts (0,5–3 h) et des rendements de l'ordre de 90% (Équation (9)) [38]. Équation 9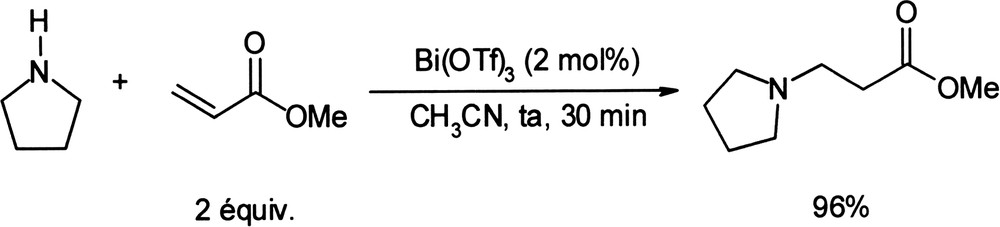
L'utilisation du chlorure de bismuth (III) est à l'origine d'une astucieuse stratégie de synthèse de systèmes polycycliques comportant un ou plusieurs hétéroatomes. Il s'agit d'une réaction de condensation de dérivés de l'aniline avec des aldéhydes aromatiques fonctionnalisés portant un groupement allyle, suivie in situ d'une réaction d'aza-Diels–Alder [39]. La réaction est rapide en présence de 5–10 mol% de catalyseur, et permet d'obtenir les produits attendus avec des rendements supérieurs à 70% (Équation (10)). Équation 10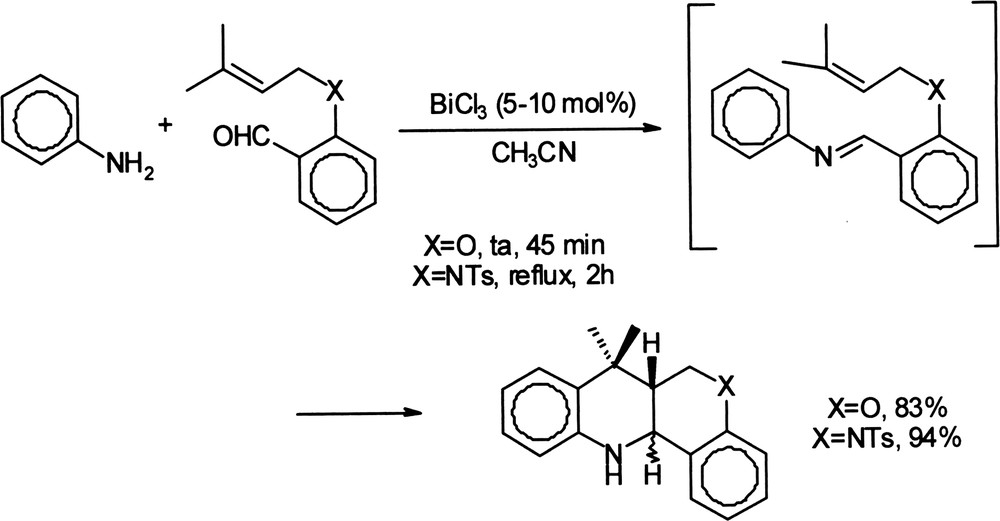
De façon similaire, la condensation–cyclisation de dérivés de l'aniline avec des aldéhydes aliphatiques tels que le citronellal a permis une nouvelle synthèse one-pot d'octahydroacridines avec des rendements quasi-quantitatifs [40].
Dans des conditions expérimentales analogues, la réaction de Biginelli, réaction multicomposants mettant en jeu l'acétoacétate d'éthyle, un aldéhyde et l'urée, a été réalisée lors d'une synthèse de dihydropyrimidinones avec des rendements compris entre 56 et 97% (Équation (11)) [41]. Équation 11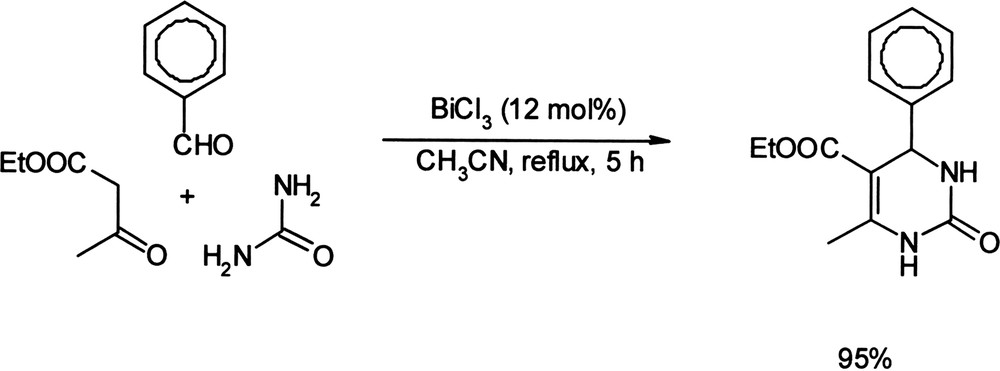
Cette réaction peut également être catalysée par le triflate de bismuth avec un gain d'activité et sous des conditions plus douces, la réaction étant réalisée à température ambiante [42]. Les rendements sont élevés dans le cas d'aldéhydes aromatiques, et la réaction est efficace avec l'urée comme avec la thio-urée.
3 Réactions de protection/déprotection
3.1 Protection de groupements fonctionnels
Des travaux portant sur des réactions catalysées par le triflate de bismuth avec seulement 0,1% de catalyseur ont été décrits. Par exemple, le traitement d'aldéhydes aromatiques par l'anhydride acétique en présence de Bi(OTf)3 conduit aux acylals correspondants avec de bons rendements (Équation (12)) [43]. Équation 12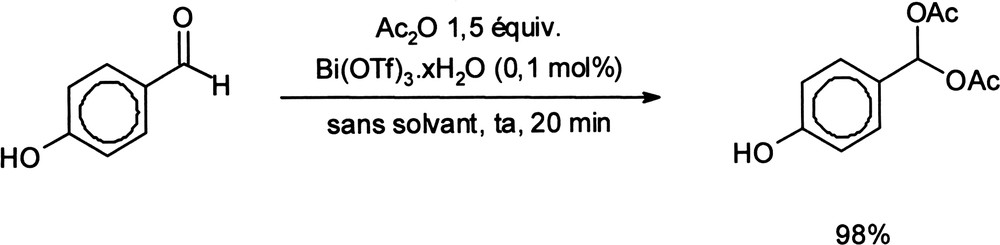
En présence d'un alcool et d'orthoformiate de trialkyle à la place de l'anhydride acétique, les acétals correspondants sont obtenus à partir d'aldéhydes mais aussi de cétones [44], et peuvent être hydrolysés par le même triflate de bismuth (III), pour reformer le composé carbonylé parent, dans un mélange eau–THF [45].
En l'absence d'eau dans le rôle de nucléophile, mais avec 1,3 équivalents d'allyltrimethylsilane, les éthers homoallyliques sont obtenus par allylation des acétals avec 69–96% de rendement (Équation (13)) [46]. Équation 13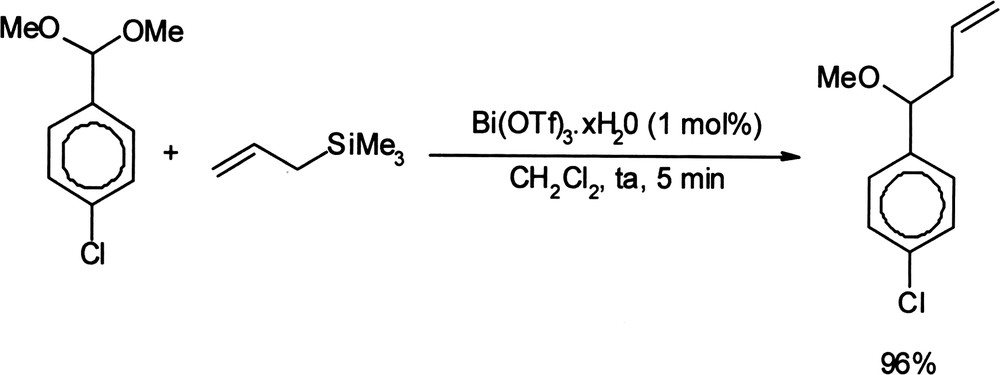
L'acétylation des alcools par l'anhydride acétique est également une transformation qui peut être catalysée efficacement par le triflate de bismuth. Plusieurs groupes ont travaillé sur le sujet et il en résulte plusieurs publications récentes montrant le potentiel de cette réaction (Équation 14) [47–49]. Équation 14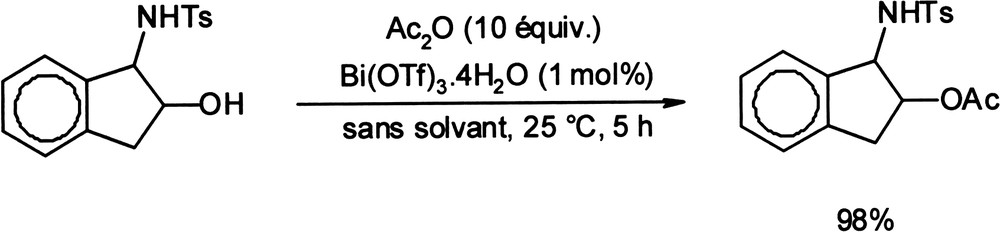
3.2 Déprotection de groupements fonctionnels
Plusieurs processus de déprotection impliquent des sels ou complexes du bismuth (III). Ainsi, une méthode de déprotection des S,S-acétals catalysée par le nitrate de bismuth (III) sous air a été décrite [50]. De nombreux S,S-acétals, aromatiques et aliphatiques, cycliques ou acycliques, issus de cétones ou aldéhydes ont pu être convertis en leur composé carbonylé parent avec de bons rendements (72–98%) à température ambiante (Équation (15)). Équation 15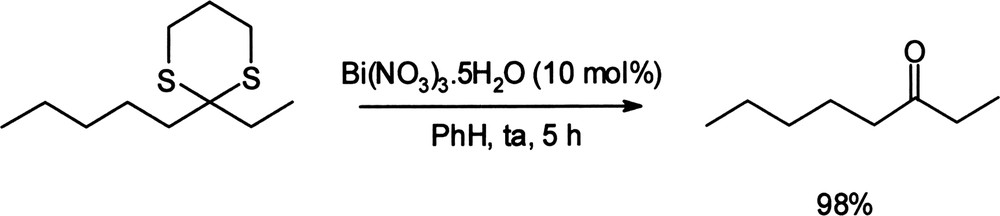
Le nitrate de bismuth (III), commercial sous forme pentahydratée, a par la suite été impliqué dans des réactions catalytiques de deprotection d'acétals acycliques[51] et d'oximes [52]. Une méthode de déprotection sélective des 1,3-dioxolanes en 1,2-diols par le chlorure de bismuth (III) a également été décrite [53].
L'hydrolyse d'esters aryliques catalysée par le mandélate de bismuth (III) permet également la libération des dérivés du phénol avec des rendements de 44 à 96%, en utilisant une proportion de 5% molaire de catalyseur [54].
4 Réactions d'oxydation
L'examen de la littérature portant sur l'utilisation du bismuth dans l'oxydation de substrats organiques en phase homogène révèle une prédominance du bismuth (V) et du bismuth (III) en tant qu'oxydants stœchiométriques, puis, plus récemment, comme catalyseurs.
Le bismuth métallique, qui se présente sous la forme d'une poudre noire relativement inerte, a été utilisé efficacement par notre groupe dans des réactions d'oxydation catalytique.
4.1 Le bismuth (V) et ses composés
C'est dans cet état d'oxydation que les premiers travaux ont porté sur la mise au point de systèmes oxydants à base de bismuth. Ainsi, le bismuthate de sodium, NaBiO3, en milieu acide acétique a été décrit pour des réactions stœchiométriques de coupure oxydante de diols vicinaux, de façon analogue à ce qui est observé avec le tétracétate de plomb ou l'acide périodique [55]. Ce système, appliqué à l'oxydation d'α-hydroxycétones, préserve la liaison carbone–carbone de la coupure oxydante, et permet d'isoler les α-dicétones correspondantes avec de bons rendements.
De façon similaire mais dans l'acide phosphorique, l'action de NaBiO3 sur des α-hydroxyacides tels que l'acide mandélique ou l'acide lactique conduit, par coupure oxydante, aux aldéhydes correspondants, benzaldéhyde et éthanal, respectivement avec 64 et 72% de rendement.
L'action du système NaBiO3–AcOH sur les oléfines conduit aux α-hydroxyacétates correspondants avec des rendements faibles, cependant accrus dans le cas d'oléfines substituées [56].
Le substrat principal des réactions d'oxydation par des dérivés du bismuth (V) est la fonction alcool, primaire et secondaire, conduisant aux composés carbonylés correspondants.
Outre le bismuthate de sodium ou le bismuthate de zinc, certains organobismuth de type Ar3BiX2, Ar4BiX ou Ar5Bi, dans lesquels Ar est un groupement aromatique et X un anion (halogénure, carboxylate, ou autre), ont été utilisés dans l'oxydation de substrats organiques, en particulier par Barton et al. [4]. Dans ces réactions, le bismuth (V) est réduit au cours du processus et la réaction est stœchiométrique.
Les alkylperoxydes de bismuth tels que Ph3Bi(OOCMe3)2, formés à partir de triphénylbismuth et d'hydroperoxyde de t-butyle, oxydent également les alcools en composés carbonylés, et ont montré une certaine capacité à convertir des alcanes en α-dicétones, puis en anhydrides carboxyliques [57].
4.2 Le bismuth (III) et ses composés
De façon similaire au bismuthate de sodium, le trioxyde de bismuth, Bi2O3, permet, en milieu acide acétique, d'oxyder les α-hydroxycétones en α-dicétones (Équation (16)) [58]. La formation des α-dicétones s'accompagne alors de la précipitation progressive de bismuth métallique, provenant de la réduction du trioxyde de bismuth, oxydant stoechiométrique du processus. Équation 16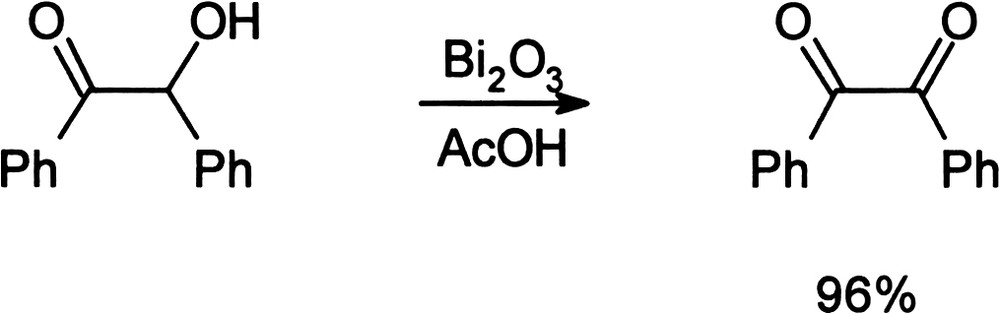
La spécificité de l'oxydation des α-hydroxycétones par l'oxyde de bismuth (III) a tout de suite été remarquée et mise à profit dans des synthèses totales, permettant de s'affranchir de l'utilisation de groupements protecteurs pour les autres fonctions oxydables, les fonctions alcools notamment [59]. L'espèce active de la réaction a été identifiée comme étant l'acétate de bismuth (III), Bi(OAc)3, qui peut être utilisé sous cette forme pour des résultats semblables. Par la suite, une réaction d'oxydation d'α-cétols aromatiques en α-dicétones catalysée par le nitrate de bismuth (III) en présence d'acétate de cuivre (II) a également été décrite [60].
L'acétate de bismuth (III) peut, en présence d'iode moléculaire, conduire à la diacétylation stéréosélective des oléfines [61]. Lorsque la réaction est réalisée dans l'acide acétique glacial, la formation du trans-diacétate est effectivement observée de façon sélective. En revanche, dans l'acide acétique aqueux, c'est la formation de cis-α-hydroxyacétate qui a lieu (Équation (17)). Au cours de telles réactions, c'est l'iode moléculaire qui joue le rôle d'oxydant, tandis que l'acétate de bismuth (III) est converti en iodure de bismuth (III). Équation 17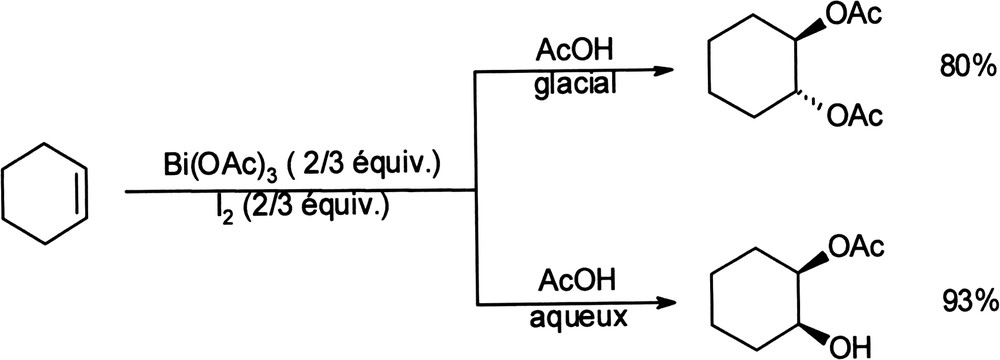
L'oxydation stœchiométrique d'alcools aliphatiques, benzyliques et allyliques sur montmorillonite imprégnée de nitrate de bismuth (III) a été décrite dans une réaction très rapide, sans solvant et dont les rendements sont compris entre 69 et 99% [62].
L'introduction de la catalyse dans les réactions d'oxydation reposant sur l'utilisation du bismuth a été permise après la conception d'un système recyclant le bismuth (III) en bismuth (V) au cours de la coupure oxydante des dérivés du glycol. Plusieurs oxydants ont été initialement utilisés dans ce but, comme par exemple le peroxyde d'hydrogène en milieu basique ou l'hydroperoxyde de t-butyle, sans toutefois aboutir à des réactions généralisables. C'est en associant la N-bromosuccinimide, NBS, avec le triphénylbismuth que le premier système oxydant catalytique à base de bismuth a été décrit [63]. Les résultats observés avec des dérivés du bismuth (V) utilisés en quantités stoechiométriques ont alors été reproduits, voire même améliorés, avec seulement 1% molaire de triphénylbismuth.
Des dérivés du bismuth (III) ont été décrits comme catalyseurs d'oxydation en présence d'autres oxydants, dont notamment l'oxygène moléculaire. Plusieurs fonctions chimiques, comme les époxydes ou les α-cétols, sont substrats de la réaction d'oxydation par le système Bi(III)/O2, aboutissant à des produits carbonylés ou à des acides carboxyliques [64–65].
Au cours de ces réactions, le catalyseur est sous la forme de carboxylate de bismuth (III), principalement de mandélate de bismuth (III), (Bi-mand), mais aussi de pyridine 2-mono- et 2,6-dicarboxylate, quinoline-2-carboxylate, phtalate ou encore biphényle 2,2′-dicarboxylate de Bi(III). Ces complexes présentent une activité catalytique dans l'oxydation des époxydes aromatiques ainsi que des α-hydroxycétones [66].
Le recyclage du bismuth (III) sous oxygène moléculaire, avec la participation du couple redox BiIII/Bi0 sous O2 a été récemment décrite [67] et a abouti à la mise au point de systèmes réactionnels au cours desquels l'espèce active du bismuth (III) est générée in situ à partir de bismuth métallique et de quantités stoechiométriques d'acide carboxylique sous O2. De cette façon, l'acide 4-hydroxy-3-méthoxymandélique, ou acide vanillo mandélique, peut être oxydé en vanilline par le système Bi0/O2/DMSO en présence d'acide acétique (Équation (18)) [68]. Équation 18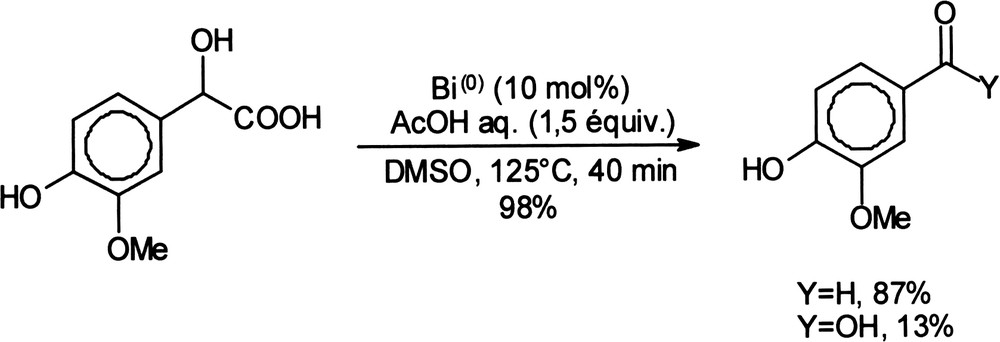
Une approche comparable a été utilisée pour la mise au point d'un système d'oxydation catalytique des époxydes internes en α-dicétones [69–70]. Cette nouvelle transformation permet d'accéder en une étape aux α-dicétones par un système oxydant basé sur l'utilisation de bismuth métallique en quantité catalytique et d'un additif (également en quantité catalytique) tel le triflate de cuivre (II), ou l'acide triflique. Au cours de ces réactions, l'espèce active du bismuth (III) peut être générée in situ, ce qui permet de s'affranchir de l'étape préalable de préparation du catalyseur (Équation 19) [71]. Équation 19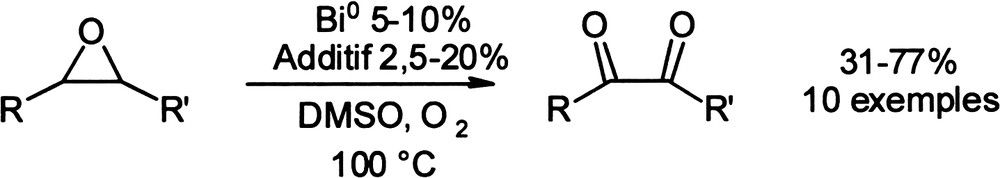
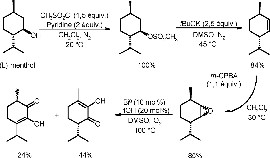
Dans le domaine des composés aromatisants et odorants, cette méthode a permis de proposer un nouvel accès à la pentane-2,3-dione, utilisé industriellement pour renforcer la note beurre de certaines denrées alimentaires [72]. La synthèse du diosphénol, terpénoïde dérivé du menthane, en quatre étapes à partir du (l)-menthol chiral a pu également être réalisée en concluant la séquence réactionnelle par une réaction d'oxydation par le bismuth (0) sous oxygène moléculaire (Schéma 1).
Cette méthode de transformation d'un époxyde en son dérivé α-dicétone a été utilisée pour la synthèse de dérivés de la quinoxaline, obtenues par couplage oxydant entre un époxyde et une ène-1,2-diamine, avec des rendements de 53-71%. Cette stratégie permet d'introduire facilement des substituants en position 2 et 3 de l'hétérocycle selon l'époxyde de départ employé (Équation (20)) [73]. Équation 20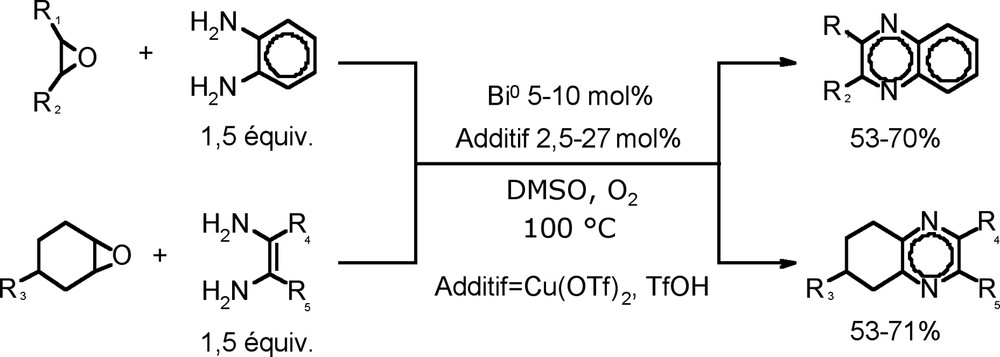
Des systèmes à base de rhodium (III) et de palladium (II) ont été décrits pour l'oxydation d'alcools et d'oléfines terminales sous oxygène moléculaire en présence de bismuth (III) comme co-catalyseur [74]. Ces réactions ne seront pas détaillées ici, le bismuth ne jouant dans ces processus qu'un rôle secondaire au niveau du complexe métallique impliqué, la transformation du substrat proprement dite étant le fait du rhodium ou du palladium.
5 Autres réactions
Le réarrangement d'époxydes aromatiques a été décrit dans un processus régiosélectif, rapide et efficace, conduisant aux aldéhydes et cétones correspondants avec des rendements de 73–92% (Équation (21)) [75]. Équation 21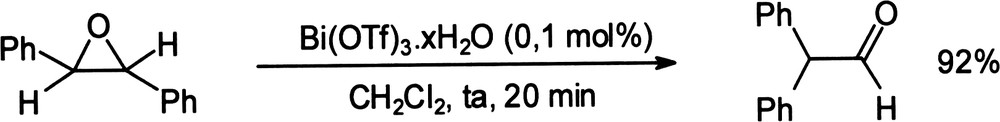
La formation de carbonates cycliques à partir de divers époxydes et de DMF a été décrite par une catalyse par BiBr3 en présence d'oxygène moléculaire [76].
En présence d'acétone, les époxydes activés par le triflate de bismuth peuvent conduire aux 1,3-dioxolanes correspondants avec des rendements supérieurs à 94% dans plusieurs cas (Équation (22)) [77]. Équation 22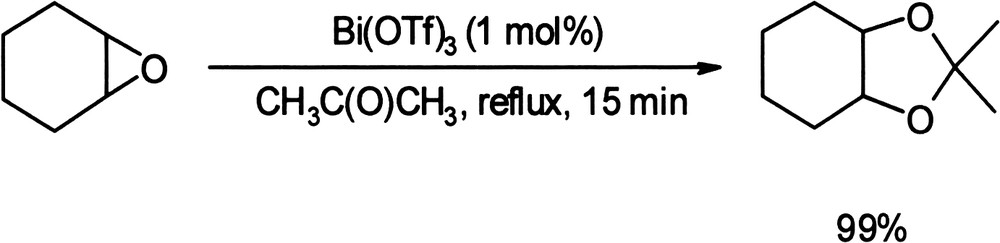
Une réaction d'échange oxygène–soufre au sein d'époxydes, faisant appel à des donneurs de soufre comme la thio-urée ou le thiocyanate d'ammonium, a été décrite. Les époxydes, activés par Bi(OTf)3, peuvent être facilement convertis en thiiranes avec des rendements élevés [78].
D'autres réactions ont été rapportées, comme la transcarbamoylation entre un N-alkyl O-alkyl carbamate et un alcool primaire [79], la coupure de liaison C–O d'éthers aromatiques [80], ou la bis-arylation de glyoxylate d'éthyle [81].
6 Conclusion
Le bismuth et ses dérivés, principalement sous la forme des sels de bismuth (III), ont donné lieu ces dernières années à de nombreuses utilisations en synthèse organique. Des réactions très variées peuvent désormais être envisagées avec des catalyseurs commerciaux ou de préparation aisée, actifs sous diverses conditions opératoires, en solvant organique, aqueux ou sans solvant.
Outre les avantages évoqués ci-dessous, un autre avantage est celui de la toxicité faible du bismuth, quelle que soit la forme sous laquelle il se trouve. Cette innocuité garantit la sécurité sanitaire lors de la manipulation, et l'absence de problèmes de toxicité associée aux produits obtenus, dont les applications pourront concerner les domaines pharmaceutiques, cosmétiques et agro-alimentaires, sans risque au niveau des résidus à l'état de traces.


