1 Introduction
Les phénomènes reliés à l'interaction des hydrocarbures aromatiques (benzène, toluène) avec la surface des métaux de transition en général et des métaux nobles en particulier présentent un intérêt fondamental et pratique significatif.
Du point de vue fondamental, grâce à leur structure électronique et géométrique (molécules aromatiques simples), le benzène et le toluène peuvent être des molécules sondes idéales pour l'étude des propriétés d'adsorption et catalytiques de la surface métallique des catalyseurs. En effet, l'adsorption de ces molécules à la surface des métaux de transition résulte des interactions entre les électrons π du noyau aromatique (densité électronique élevée) et les orbitales d du métal, formant un « complexe de surface » stable dans lequel le plan du noyau aromatique serait parallèle à la surface métallique [1]. L'adsorption étant irréversible, les forces d'interaction aromatique–métal sont d'autant plus fortes que la fraction des molécules aromatiques désorbant à l'état moléculaire (sans décomposition en carbone et hydrogène) est faible et vice-versa. Ainsi, l'étude reliée à l'interaction des molécules aromatiques avec la surface des métaux de transition peut apporter des informations importantes quant à toute modification des propriétés électroniques et par conséquent des propriétés d'adsorption et catalytiques des particules métalliques. De plus, ces deux composés sont impliqués dans plusieurs procédés catalytiques, comme produit intermédiaire ou final, dans l'industrie pétrochimique.
Contrairement au toluène, l'interaction du benzène avec les métaux de transition du groupe VIII a été largement étudiée. Les études accessibles dans la littérature peuvent être classées dans deux catégories, celles menées sur des structures cristallographiques bien définies impliquant des techniques spectroscopiques [1–11] et celles basées sur l'hydrogénation de ces molécules, sur des catalyseurs métalliques supportés [12–18].
L'adsorption du benzène sur Rh (111) a été étudiée en employant plusieurs techniques spectroscopiques et « UHV » [1–7], ainsi que la désorption en température programmée (TPD) [1,3,4,7]. Il a été conclu que l'adsorption du benzène sur le rhodium est principalement irréversible. Cette adsorption irréversible résulte des interactions entre les électrons π du noyau aromatique et les orbitales d du métal [1], formant ainsi un « complexe de surface » stable où le plan du noyau aromatique serait parallèle à la surface métallique [1].
Des conclusions similaires ont été notées, pour l'interaction du benzène avec le Pt (111) [19], Pt (100) [20] et Pt (110) [21]. Cependant, la comparaison des résultats obtenus sur les différents plans cristallographiques montre que le platine ne présente aucune préférence entre ces trois faces. Le recouvrement de la surface à saturation [20,22,23] ainsi que les spectres EELS (Electron Energy Loss Spectrometry) des espèces adsorbées [21–24] sont similaires pour les différentes surfaces cristallines. On en déduit que l'adsorption du benzène est insensible à la structure du métal. Ceci est en accord avec le classement de la réaction d'hydrogénation du benzène (et du toluène) parmi les réactions insensibles à la structure [25,26]. Ces différentes observations ont été également notées pour le toluène [27,28].
Dans le présent travail, nous avons étudié par thermodésorption programmée du toluène (toluène–TPD) et par la réaction d'hydrogénation du toluène l'effet des additifs Fe, Co, Ni sur l'interaction Rh–toluène.
2 Partie expérimentale
2.1 Préparation des catalyseurs
Les catalyseurs que nous avons étudiés sont à base de rhodium (1% en poids). Ils ont été préparés par la méthode d'imprégnation en solution [29]. Le support utilisé est une alumine industrielle γ-cubique (SBET = 210m2 g–1) . Ses principales impuretés sont le sodium (~80 ppm) et le silicium (300–400 ppm). L'alumine (diamètre de particules : 0,1–0,25 mm) est calciné sous air pendant 5 h à une température de 550 °C.
2.1.1 Modification du support
Le support de base (Al2O3-γ) ainsi traité est imprégné par une solution de nitrates des éléments suivants : Fe, Co, Ni et Pb. Leurs sels précurseurs sont respectivement : Fe(NO3)3, Co(NO3)26 H2O, Ni(NO3)36 H2O, Pb(NO3)39 H2O. La solution est évaporée à sec. Le produit obtenu est séché à l'étuve à 120 °C, puis calciné sous air à 450 °C pendant 4 h.
2.1.2 Ajout du métal actif
Le support ainsi modifié par Fe, Co, Ni et Pb plus un échantillon (Al2O3-γ) non modifié ont été mis en contact avec une solution aqueuse du précurseur de la phase active RhCl33 H2O. L'échange ionique est rapide et total (décoloration rapide de la solution). La solution est ensuite évaporée à sec. Le catalyseur ainsi obtenu est également séché à 120 °C puis calciné sous air à 450 °C pendant 4 h.
1.2 Caractérisations des catalyseurs
1.2.1 Mesure de l'aire de la surface métallique accessible de la phase active (Rh)
L'aire de la surface métallique accessible de la phase active (Rh) a été mesurée par titrage de l'oxygène chimisorbé par l'hydrogène HT (titrage H2–O2) à température ambiante [28]. Cette mesure a été réalisée sur le montage chromatographique pulsé [30].
1.2.2 Thermodésorption programmée du toluène
Pour l'étude de l'adsorption/désorption du toluène, nous avons utilisé le montage chromatographique pulsé auquel nous avons adjoint un dispositif permettant de préparer des mélanges He/toluène que l'on peut envoyer en continu sur l'échantillon.
Le mélange He/toluène (température : 30 °C, débit : 5 ml min–1) est envoyé sur l'échantillon préalablement réduit sous hydrogène à 500 °C durant 2 h et dégazé à la même température. Après avoir subi une chimisorption à la température ambiante en continu pendant 20 min, le catalyseur est ensuite balayé par le gaz vecteur (hélium) pendant 1 h. On effectue alors la thermodésorption en température programmée (TPD) à raison de 20 °C min–1 et sous un débit d'hélium de 20 ml min–1.
1.3 Test catalytique
La réaction d'hydrogénation du toluène est choisie comme réaction test pour nos catalyseurs. Le dispositif catalytique que nous avons réalisé pour cette étude a été décrit précédemment dans la référence [31]. La pression partielle du toluène est fixée à 0,025 atm, par l'intermédiaire d'un bain thermostaté à 18 °C, et celle de l'hydrogène à 0,975 atm. Le débit total est de 1,8 l h–1. Le rapport molaire des réactifs H2/toluène est de 39. Les produits de la réaction sont injectés (à l'état gazeux) automatiquement, à intervalles de temps régulier, dans une colonne (15% Réoplex 400 sur Chromosorb) d'un chromatographe à catharomètre.
L'échantillon (10 mg de catalyseur) est introduit dans le réacteur, réduit sous H2 à 500 °C durant 2 h, dégazé à la même température pendant 2 h, puis refroidi jusqu'à la température désirée de la réaction. Le mélange réactionnel est alors introduit.
2 Résultats et discussion
2.1 Chimisorption de l'hydrogène et titrage H2–O2
2.1.1 Caractérisation des additifs métalliques M–Al2O3 (M = Fe, Co, Ni et Pb)
Nous avons caractérisé les additifs métalliques par leur taux de réduction (R%) basé sur la prise d'oxygène à 500 °C (OC500) et par leur capacité d'adsorption de l'hydrogène. Les résultats sont donnés dans le Tableau 1. Nous constatons une très faible quantité d'hydrogène chimisorbée sur les métaux non nobles des colonnes 8,9 et 10. Ceci est dû en partie au faible taux de réduction observé de ces derniers [28]. D'autre part, il est bien connu que la capacité des métaux non nobles des colonnes 8,9 et 10 à activer la molécule d'hydrogène est très faible [29].
Caractéristiques des additifs métalliques comparés au métal noble (Rh). NT : nombre total de moles de métal M (Fe, Co, Ni, Pb, Rh) par gramme d'échantillon ; HC : quantité d'hydrogène chimisorbé à température ambiante en μ moles d'atome H par gramme d'échantillon ; OC500 : quantité d'oxygène prise par l'échantillon à 500 °C en μmol d'atome H par gramme d'échantillon
| Échantillon | NT (μmolM g–1) | HC (μmolH g–1) | OC500 (μmolO g–1) | Taux de réduction R (%) |
| Fe2O3/Al2O3 | 30 | 2,1 | 3,6 | 8 |
| Co3O4/Al2O3 | 30 | 2,9 | 4,2 | 11 |
| NiO/Al2O3 | 30 | 5,4 | 12,3 | 38 |
| PbO2/Al2O3 | 30 | 1,8 | — | — |
| Rh2O3/Al2O3 | 97 | 124,4 | 143,9 | 100 |
2.1.2 Caractérisation des catalyseurs métalliques Rh/M–Al2O3 (M = Fe, Co, Ni et Pb)
Pour déterminer l'accessibilité métallique des catalyseurs à base de rhodium supporté, la plupart des auteurs [29] s'accordent à donner la stœchiométrie H/RhS = 1 et O/RhS = 1,5 (RhS = rhodium de surface) respectivement pour la chimisorption de l'hydrogène et de l'oxygène à température ambiante.
La dispersion du rhodium (D%) et par conséquent l'aire de la surface métallique et la taille moyenne des particules métalliques ont été déduites des valeurs de titrage de l'oxygène chimisorbé par l'hydrogène (HT). Les résultats sont reportés dans le Tableau 2.
Caractéristiques des catalyseurs Rh–M/ Al2O3 (M = Fe, Co, Ni, Pb). Am : aire de la surface métallique en m2 gRh–1 ; Dm : taille moyenne des cristallites ; HT : quantité d'hydrogène ayant servi au titrage de l'oxygène chimisorbé, en μmolH g–1catalyseur ; D : dispersion du métal actif en pourcentage (%)
| Échantillon | HC (μmolH gcat–1) | HT (μmolH gcat–1) | D (μmolO g–1) | Am (m2 gRh–1) | Dm (Å) |
| Rh/Al2O3 | 124,4 | 363,0 | 93 | 409,0 | 11,80 |
| Rh–Fe/Al2O3 | 156,0 | 284,0 | 73 | 321,1 | 15,00 |
| Rh–Co/Al2O3 | 147,3 | 328,2 | 84 | 369,5 | 13,10 |
| Rh–Ni/Al2O3 | 148,0 | 358,5 | 92 | 404,7 | 12,00 |
| Rh–Pb/Al2O3 | 84,6 | 253,5 | 65 | 285,9 | 17,00 |
2.2 Thermodésorption du toluène
L'étude de la chimisorption du toluène sur les différents catalyseurs Rh–M/Al2O3 (M = Fe, Co, Ni) a été effectuée à la température ambiante en régime continu. Après saturation des catalyseurs, les quantités de toluène désorbé à l'état moléculaire ont été mesurées par désorption en température programmée (TPD).
2.2.1 Interaction du toluène avec le support pur ou modifié
Il est bien connu que les oxydes généralement utilisés comme support de catalyseurs sont très actifs vis-à-vis de la chimisorption des aromatiques en général [15]. Il est donc nécessaire d'étudier les caractéristiques de l'adsorption/désorption du toluène sur le support Al2O3 pur ou modifié par (Fe, Co ou Ni), pour pouvoir distinguer le toluène adsorbé à la surface du métal de celui adsorbé à la surface du support.
Les spectres TPD des différents échantillons Al2O3 et M/Al2O3 (M = Fe, Co, Ni) sont pratiquement semblables. À titre d'exemple, les spectres TPD présentés sur la Fig. 1 représentent le toluène désorbé du support Al2O3 pur ou modifié par le nickel. Dans tous les cas, nous n'avons observé qu'un seul pic de désorption de toluène, situé entre 170 et 190 °C. Les quantités de toluène désorbé (Tableau 3) sont légèrement supérieures sur supports modifiés. Ce qui semble indiquer que le réactif est pratiquement adsorbé sous une forme unique sur l'alumine ainsi que sur les additifs métalliques (Fe, Co, Ni). Notons que ces derniers se présentent essentiellement sous forme d'oxyde, notamment le fer et le cobalt, pour lesquels le taux de réduction est très faible. Or, les sites responsables de l'adsorption des aromatiques dans le cas des oxydes, sont des sites acides : soit des cations partiellement coordonnés exposés à la surface, tels que Al3+ dans le cas de l'alumine (sites acides de Lewis), soit des groupements hydroxyles superficiels (sites acides de Brønsted) [32,33].
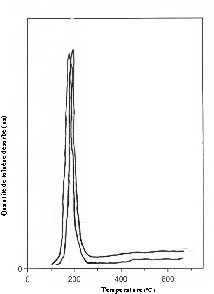
Spectres TPD du toluène sur Al2O3 et Ni/Al2O3.
Températures du maximum de désorption TM et quantités de toluène désorbé (Qtol) des supports en absence de rhodium
| Échantillon | TM (°C) | Qtol (μmol g–1) |
| Al2O3 | 180 | 70,2 |
| Fe/Al2O3 | 170 | 71,6 |
| Co/Al2O3 | 183 | 70,8 |
| Ni/Al2O3 | 190 | 72,6 |
2.2.2 Interaction du toluène avec la phase active (Rh)
Les profils de désorption du toluène adsorbé à la surface des catalyseurs Rh–M/Al2O3 (M = Fe, Co, Ni) sont représentés sur la Fig. 2. Ces profils montrent deux pics de désorption de toluène bien séparés, avec des différences de surfaces et de températures du maximum importantes. Ceci indique la présence de deux types de sites d'adsorption de toluène différents, qualitativement et quantitativement.

Effet des additifs (Fe, Co, Ni) sur les spectres TPD toluène du catalyseur 1% Rh/Al2O3. (a) Rh/Al2O3 ; (b) : Rh/Fe–Al2O3 ; (c) : Rh/Co–Al2O3 ; (d) : Rh/Ni–Al2O3.
En effet, le premier pic, qui est largement plus grand, apparaît à basse température (173–187 °C). Il est identique au pic TPD du toluène observé sur le support γ-Al2O3 (avec ou sans modification) en l'absence du rhodium. Il est donc attribué au toluène désorbé des sites superficiels du support (sites acides).
Le second pic, qui apparaît à plus haute température (320–384 °C) correspond à une nouvelle espèce, plus stable. Ce pic ne peut être attribué qu'à la quantité de toluène désorbé de la surface du rhodium, sans décomposition de l'état moléculaire). Dans le Tableau 4, nous avons reporté les quantités de toluène désorbé à l'état moléculaire (Qm exprimée en μmol gcat–1) de la surface du rhodium, en fonction de la température du maximum.
Effet des additifs sur la fraction de toluène désorbé de la surface du rhodium (surface accessible) à l'état moléculaire (Qm) et température maximum de désorption (TM)
| Catalyseur | D (%) | Qm (μmol gcat–1) | TM (°C) | fm (%) |
| Rh/Al2O3 | 93 | 2,83 | 320 | 8 |
| Rh–Fe/Al2O3 | 73 | 5,82 | 350 | 21 |
| Rh–Co/Al2O3 | 84 | 6,08 | 390 | 19 |
| Rh–Ni/Al2O3 | 92 | 8,40 | 384 | 24 |
Par ailleurs, nous avons considéré la valeur du taux de recouvrement de la surface du rhodium en toluène, R = Tol/Rhs = 0,37 à saturation (monocouche complète), telle qu'elle a été estimée par Ioannide et al. [15]. Ainsi, nous avons pu évaluer la fraction de toluène désorbé à l'état moléculaire de la surface du rhodium accessible, ƒm, à partir de l'équation (1). Les valeurs correspondantes à ƒm sont également reportées dans le Tableau 4.
| (1) |
La fraction de toluène désorbant à l'état moléculaire de la surface du rhodium est estimée à 8% pour le catalyseur Rh/Al2O3 (pris comme référence). Cette valeur paraît raisonnable lorsqu'elle est comparée à celle du benzène, qui est de 15–20% de la quantité totale adsorbée à la surface du rhodium [7,13]. En fait, l'adsorption des molécules aromatiques sur les métaux nobles est due au transfert d'électrons π du noyau aromatique vers les orbitales d du métal. Ainsi, le toluène, qui est plus électro-donneur que le benzène, serait plus fortement adsorbé [34]. Rappelons que sur Rh/TiO2, aucune désorption de toluène à l'état moléculaire n'a été détectée. Le toluène adsorbé à la surface du rhodium est totalement déshydrogéné en carbone et en hydrogène [35]. Néanmoins, ce résultat peut-être considéré comme un cas particulier, car les métaux nobles supportés sur oxydes facilement réductibles, tels que TiO2, sont connus pour leurs propriétés adsorptives assez particulières, dues aux fortes interactions métal–support (SMSI) [36].
Cependant, la modification superficielle du support γ-Al2O3 par un additif métallique tel que Fe, Co ou Ni révèle une augmentation notable de la fraction de toluène désorbé à l'état moléculaire. Elle est de deux à trois fois plus importante que sur Rh/Al2O3. On observe aussi une légère augmentation de la température du maximum de désorption. Notons que ces effets sont plus accentués en présence de nickel. Des observations similaires ont été notées avec le benzène, après dopage du support TiO2 avec WO3 pour le catalyseur Rh/TiO2 [35] ou après l'ajout d'un modificateur électropositif, tel que le potassium, à la surface du platine [8].
La faible fraction de toluène désorbé à l'état moléculaire dans le cas du catalyseur Rh/Al2O3 montre que les forces d'interaction entre le rhodium et le toluène sont importantes et que la majeure partie du toluène adsorbé aurait subi une déshydrogénation (décomposition totale en carbone et hydrogène) lors de la thermodésorption (TPD) [37]. En effet, une forte liaison métal–carbone induit une faible liaison C–H dans la molécule aromatique adsorbée [37] et conduit donc à une déshydrogénation plus probable. Cependant, l'augmentation de la fraction de toluène désorbé observée en présence de fer, de cobalt ou de nickel montre que les forces d'interaction rhodium–toluène sont affaiblies [38], ce qui pourrait s'expliquer par une diminution de la capacité d'électro-accepteur des particules de rhodium.
Ce résultat nous laisse penser que des interactions privilégiées peuvent être formées entre les différentes espèces de l'additif (espèces à l'état oxydé ou réduit) présentes sur le support et la phase active (rhodium). Ces interactions pourraient induire de nouvelles propriétés électroniques, et donc adsorptives, de la phase active, en faisant intervenir un transfert de charge entre l'additif et le rhodium. On peut alors conclure que les propriétés adsorptives et, par conséquent, catalytiques de la phase active dépendent fortement de son environnement [39]. Cette influence est d'autant plus importante que la taille des particules est petite [35].
2.3 Effet des additifs Fe, Co, Ni, Pb sur les propriétés catalytiques du catalyseur Rh/Al2O3 dans l'hydrogénation du toluène
Après caractérisation par TPD du toluène, les catalyseurs Rh–M/Al2O3 ont été testés dans la réaction d'hydrogénation du toluène en vue de l'étude de leur stabilité au cours du temps et de l'évolution de leur activité en fonction de la température.
Un échantillon de 10 mg de catalyseur, prétraité pendant deux heures à 500 °C sous hydrogène, puis dégazé à la même température sous argon, a été testé à différentes températures entre 25 et 250 °C. Les pressions partielles des réactifs sont 0,977 et 0,023 atm respectivement pour l'hydrogène et le toluène.
Il faut noter que l'analyse des produits de la réaction montre une sélectivité totale en méthylcyclohexane. Néanmoins, sur support pur ou modifié (Al2O3, Fe/Al2O3, Co/Al2O3, Ni/Al2O3 ou Pb/Al2O3), aucune activité mesurable n'a été détectée. Ceci est probablement dû à la faible teneur en métal (environ 0,16 % en poids) et à la faible activité.
2.3.1 Évolution des performances catalytiques des catalyseurs Rh–M/Al2O3 en fonction du temps
Nous avons suivi l'évolution de l'activité catalytique des catalyseurs au cours du temps, pour trois températures différentes : 80, 170 et 250 °C, en analysant périodiquement (toutes les 15 min environ) le mélange réactionnel. Les résultats obtenus sont présentés sur les Figs. 3–5.
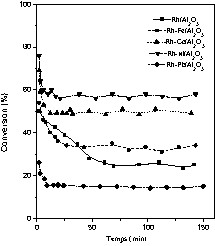
Évolution de l'activité des catalyseurs Rh–M/Al2O3 (M = Fe, Co, Ni, Pb) dans l'hydrogénation du toluène au cours du temps. Température de réaction : 80 °C.
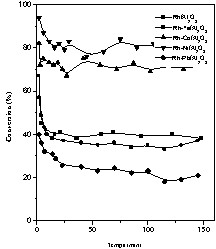
Évolution de l'activité des catalyseurs Rh–M/Al2O3 (M = Fe, Co, Ni, Pb) dans l'hydrogénation du toluène au cours du temps. Température de réaction : 170 °C.
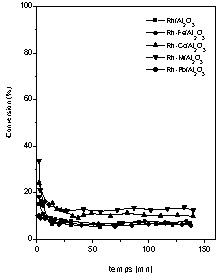
Évolution de l'activité des catalyseurs Rh-M/Al2O3 (M = Fe, Co, Ni, Pb) dans l'hydrogénation du toluène au cours du temps. Température de réaction : 250 °C.
Globalement, les courbes d'évolution du taux de transformation en fonction du temps, sur rhodium supporté, montrent, d'une part, que l'état stationnaire est plus rapidement atteint en présence de fer, de cobalt et de nickel et, d'autre part, que la stabilité catalytique des catalyseurs est plus marquée, notamment avec les deux derniers métaux : par exemple, pour une température de réaction de 80 °C, le régime stationnaire est atteint au bout de 5 à 10 min environ pour les catalyseurs promus, alors qu'il est d'environ 40 min pour le catalyseur de référence Rh/Al2O3.
Quant à l'activité, elle est pratiquement maintenue aux alentours de 65 et 79%, respectivement pour le Rh–Co/Al2O3 et le Rh–Ni/Al2O3 à 170 °C (Fig. 4). Avec le Rh–Fe/Al2O3, l'allure de la courbe est similaire à celle du Rh/Al2O3, pour lequel le taux de conversion passe de 74 à 40%. Contrairement aux métaux non nobles du groupe VIII, le plomb diminue nettement l'efficacité du catalyseur Rh/Al2O3. En effet, on observe une diminution prononcée de l'activité du catalyseur au cours de la réaction.
Cependant, à la température 250 °C (Fig. 5) on observe une chute de l'activité et de la stabilité des différents catalyseurs étudiés. Ceci est dû au processus compétitif de déshydrogénation, qui est thermiquement favorisé[15].
2.3.2 Évolution des performances catalytiques des catalyseurs Rh–M/Al2O3 en fonction de la température
Cette étude a été réalisée sur les différents catalyseurs, en faisant varier la température de réaction entre 25 et 250 °C. Les résultats concernant le taux de conversion du toluène en fonction de la température sont représentés sur la Fig. 6.
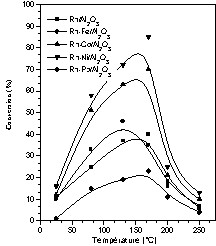
Évolution de la conversion du toluène en fonction de la température sur les catalyseurs Rh–M/Al2O3 (M = Fe, Co, Ni, Pb).
L'allure des courbes donnant le taux de conversion en fonction de la température montre un maximum vers 170 °C pour tous les catalyseurs Rh–M/Al2O3, sauf pour Rh–Fe/Al2O3, qui se distingue par un maximum aux environs de 130 °C. Ce maximum d'activité, observé en fonction de la température, est fréquemment signalé dans la littérature, notamment dans le cas des réactions d'hydrogénation des aromatiques [16]. Au-delà de la température du maximum, une diminution de l'activité est observée. Ceci a été expliqué par une diminution du taux de recouvrement de la surface en aromatiques, selon le mécanisme de Langmuir–Hinshelwood [40]. Cependant, dans une étude de la réaction d'hydrogénation du benzène sur Pt/Al2O3, Vannice et al. [16] ont constaté que la température et le taux de conversion correspondant au maximum varient avec les pressions partielles du benzène et de l'hydrogène. Ce maximum réversible s'explique également par des considérations thermodynamiques [16].
Par ailleurs, nous avons déterminé, à partir de l'équation (2), l'activité intrinsèque du catalyseur, qui mesure le nombre de molécules transformées par site actif et par unité de temps (turnover : T). Pour nous affranchir de toute modification du catalyseur au cours de la réaction, nous avons considéré l'activité initiale des catalyseurs. En fait, pour des raisons de volume mort entre le réacteur et l'analyse, nous avons pris systématiquement l'activité du catalyseur après 3 min de réaction comme activité initiale.
| (2) |
Les courbes de l'activité intrinsèque du Rh en présence de Fe, Co, Ni, Pb, représentées par la Fig. 7, permettent une comparaison rigoureuse entre les différents catalyseurs, concernant l'effet des additifs sur les propriétés catalytiques du rhodium.

Évolution de l'activité intrinsèque du rhodium (turnover) en fonction de la température. Effets des additifs (Fe, Co, Ni, Pb).
En plus de la stabilité de l'activité des catalyseurs promus observée au cours du temps, l'effet promoteur des métaux non nobles des colonnes 8, 9 et 10 apparaît nettement sur l'activité intrinsèque du rhodium, dans le domaine de température 25–170 °C. Cet effet est plus accentué avec le cobalt et le nickel. Ainsi, l'activité des catalyseurs peut être classée dans l'ordre suivant :
En ce qui concerne le catalyseur Rh–Pb/Al2O3, la diminution de l'activité intrinsèque du rhodium est remarquable dans tout le domaine de température étudié. Le plomb désactive le catalyseur dès les premières minutes de réaction.
3 Conclusion
L'étude des catalyseurs au rhodium promus par des métaux oxydables du groupe VIII (Fe, Co, Ni) montre une augmentation notable de la fraction de toluène désorbant à l'état moléculaire de la surface du rhodium par rapport au catalyseur non promu Rh/Al2O3. Ceci exprime une atténuation des forces d'interaction Rh–toluène, permettant ainsi une meilleure accessibilité aux réactifs, en diminuant la possibilité de blocage des sites actifs par les molécules de toluène fortement adsorbées. Par conséquent, on observe une meilleure activité intrinsèque du rhodium et une meilleure stabilité catalytique, en hydrogénation du toluène entre 25 et 170 °C. À 170 °C, l'activité est maximale, sauf pour le catalyseur Rh–Fe/Al2O3 qui présente un maximum d'activité vers 130 °C.
Cependant, en présence du plomb, un effet inhibiteur est observé sur le catalyseur. L'activité intrinsèque et la stabilité catalytique du rhodium sont sérieusement diminuées dans tout le domaine de température étudié (25–250 °C).


