1 Introduction
La demande en eau potable est tellement grande qu’il est nécessaire de faire appel aux eaux superficielles (rivières, fleuves, lacs...). Durant leurs trajets, celles-ci se chargent de polluants d’origines différentes, naturels (microorganismes, végétaux...) et artificiels (pesticides, hydrocarbures, métaux lourds...). La présence de tels polluants impose des traitements particuliers de cette eau avant qu’elle puisse être destinée à la consommation. Cependant, des efforts restent encore à faire au niveau de l’élimination des ions métalliques à partir des effluents industriels.
La consultation des données bibliographiques montre qu’au cours de ces dernières années, une grande importance a été accordée à l’extraction liquide–solide pour traiter ces effluents. La phase solide peut être un polymère hydrophile [1–4] ou hydrophobe [5,6]. La matrice extractante peut être aussi une résine échangeuse d’ions [7–9]. Au cours de ces dernières années, de nouveaux matériaux à base de phosphate de calcium, présentant une stabilité chimique et une capacité de rétention durable d’un grand nombre d’éléments chimiques, ont été testés [10–14]. Ces matériaux sont considérés comme d’excellents biomatériaux. Leur analogie chimique et leur similitude cristallographique avec la partie inorganique des tissus calcifiés leur permettent de s’adapter à un grand nombre de physiologies différentes. On les rencontre aussi bien dans l’émail dentaire dur et résistant que dans l’os, sous différentes stœchiométries et différentes cristallinités [15–18].
Notre travail vise plus particulièrement le traitement des solutions aqueuses diluées contenant du chlorure de zinc, au moyen de deux supports apatitiques, de caractéristiques différentes SAP1 et SAP2.
2 Partie expérimentale
2.1 Matériaux utilisés
Deux types de supports apatitiques phosphocalciques ont été utilisés comme matrice extractante :
- – l’hydroxyapatite phosphocalcique Ca10(PO4)6(OH)2, SAP1 ;
- – le phosphate tricalcique anhydre Ca3(PO4)2 ; SAP2.
Ces apatites ont été élaborées par le laboratoire d’électrochimie et traitement de surface de la faculté des sciences d’El Jadida (Maroc). Ils présentent plusieurs avantages par rapport aux autres produits utilisés classiquement pour l’extraction des métaux :
- – ils sont peu coûteux et faciles à préparer ;
- – leur mise en œuvre en extraction est facile ;
- – ils présentent une grande stabilité chimique dans un large domaine de pH.
2.2 Technique d’extraction
Une quantité de support phosphocalcique, de masse connue, est placée dans une cellule thérmorégulée à 25 °C, contenant 100 ml de solution métallique de zinc, de concentration connue. La cellule est munie d’un thermomètre de contrôle, d’une électrode de verre combinée et d’un agitateur magnétique. Pour éviter de casser les grains formant l’apatite par le barreau aimanté durant l’agitation de la solution, l’échantillon utilisé a été préalablement introduit dans un sachet (3 cm × 2 cm) préparé à base de papier filtre. Cette technique nous permet également d’effectuer facilement des prélèvements, en fonction du temps, dans la solution métallique, sans problème d’entraînement des grains d’apatite dans les échantillons à doser. Cette méthode est utilisée pour l’étude cinétique.
Dans le cas ou l’apatite est mise directement au contact de la solution métallique, l’agitation est assurée par-dessus, au moyen d’un moteur Heidolph RZR 2000. Lorsque l’équilibre d’extraction est atteint, le support chargé en métal est séparé de la solution surnageante par filtration. Cette procédure est utilisée pour l’étude de la saturation des supports par le métal.
2.3 Méthode d’analyse
Dans ce travail, la technique utilisée pour le dosage du zinc, du cobalt et du cadmium est la spectrométrie d’absorption atomique à flamme. Le spectromètre utilisé est du type Unicam 929 AA Spectrometer. L’étalonnage du spectromètre est effectué en utilisant des solutions étalons pour chaque métal. La gamme d’étalonnage varie entre 0,5 et 2 ppm.
Le rendement d’extraction du métal est donné par la relation suivante :
On définit aussi la capacité de fixation du métal par le support (SAP1 ou SAP2) par le rapport :
C = nombre de moles du métal fixé/nombre de moles de l’apatite
3 Résultats
3.1 Cinétique d’extraction
Nous avons tracé sur la Fig. 1 les variations simultanées de la concentration du zinc et du pH en fonction du temps. L’étude a été réalisée en effectuant des prélèvements en fonction du temps dans la solution surnageante. D’après ces courbes, nous observons un appauvrissement de la solution en métal. Un palier correspondant à l’équilibre d’extraction est atteint au bout de 10 min pour SAP1 et de 30 min pour SAP2. Dans les deux cas, plus de 70% de zinc ont été extraits. En même temps, nous constatons une augmentation du pH, qui passe de 5 à 6,34 à l’équilibre pour SAP1 et à 6,65 pour SAP2. L’augmentation du pH montre que l’apatite s’équilibre avec la solution métallique en consommant des protons H+. Il y a une compétition entre les cations métalliques et les protons pour se fixer sur le support phosphocalcique.
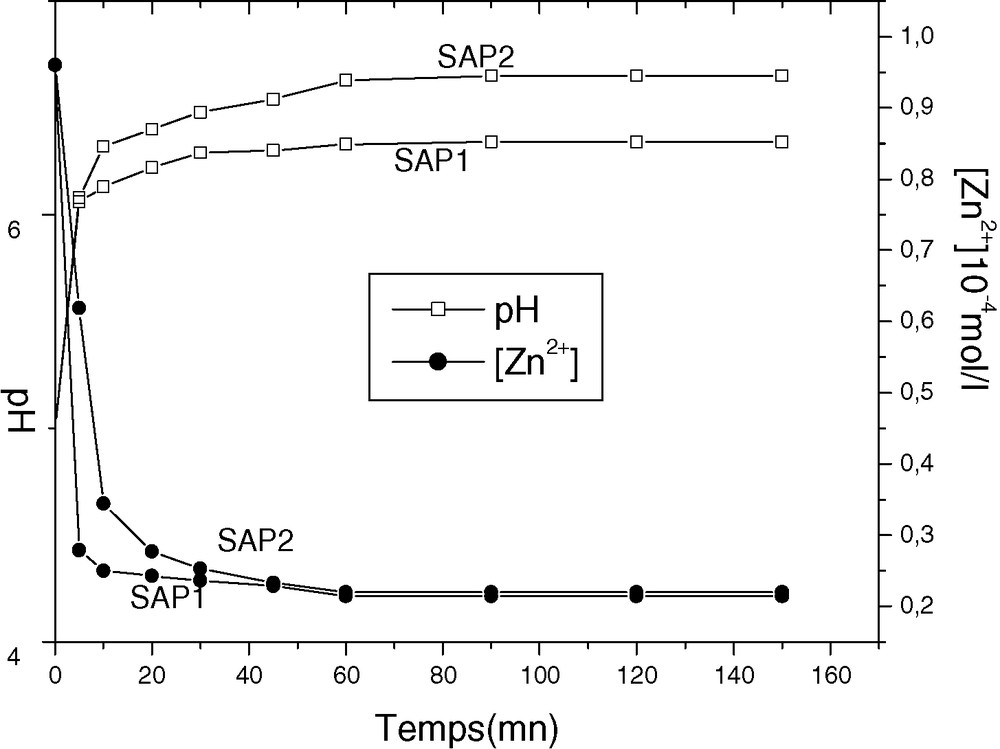
Cinétique d’extraction du zinc par SAP1et SAP2.
3.2 Effet du pH sur l’extraction du zinc par SAP1 et SAP2
Nous reportons sur la Fig. 2 les variations de la capacité de fixation du zinc par SAP1 et SAP2 en fonction du pH de la solution aqueuse. La courbe obtenue est constituée de deux zones :
- – la première correspond à une augmentation rapide de la capacité en fonction du pH ;
- – la deuxième est un palier obtenu à pH = 6, sur lequel la capacité de fixation du zinc est maximale. Elle est de 0,21 pour SAP1 et de 0,19 pour SAP2. Ces résultats montrent qu’un meilleur rendement d’extraction est obtenu pour des pH > 6.
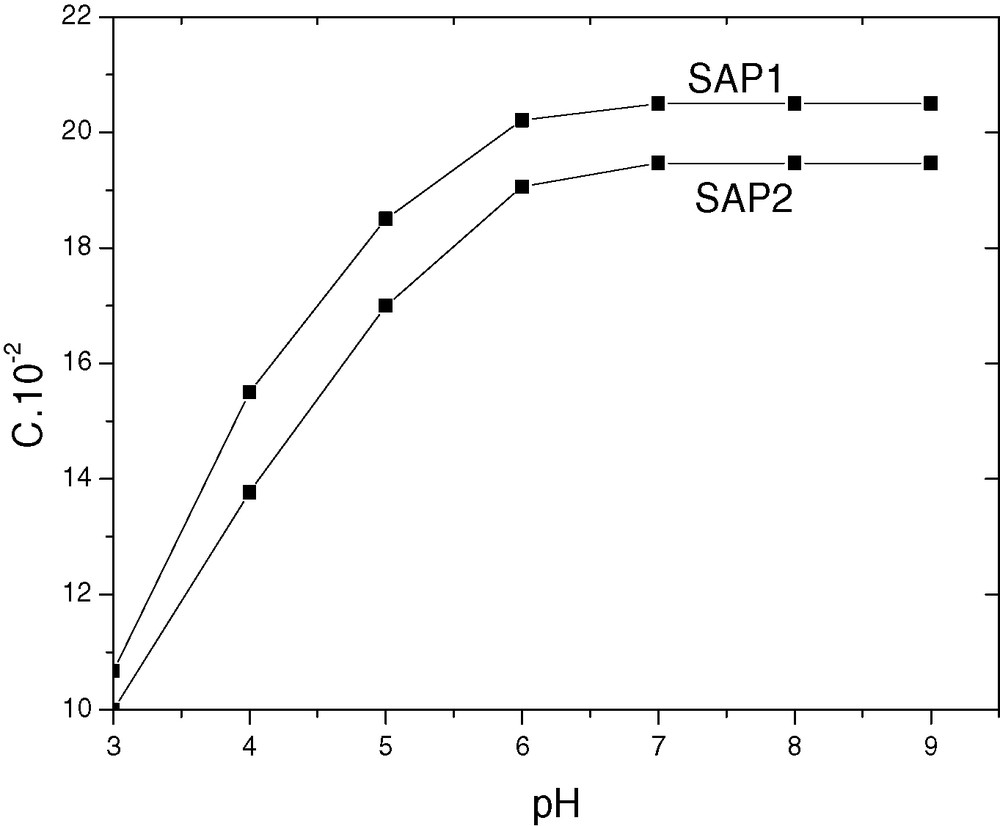
Effet du pH de la solution surnageante sur la capacité d’extraction du zinc par SAP1 et SAP2.
3.3 Saturation des supports
Nous illustrons sur la Fig. 3 les variations de la capacité de fixation du zinc en fonction de sa concentration initiale. On remarque une augmentation de celle-ci au fur et à mesure que la concentration du zinc augmente. Nous observons un palier de saturation où Cmax est de 0,27 pour SAP1 et de 0,23 pour SAP2.
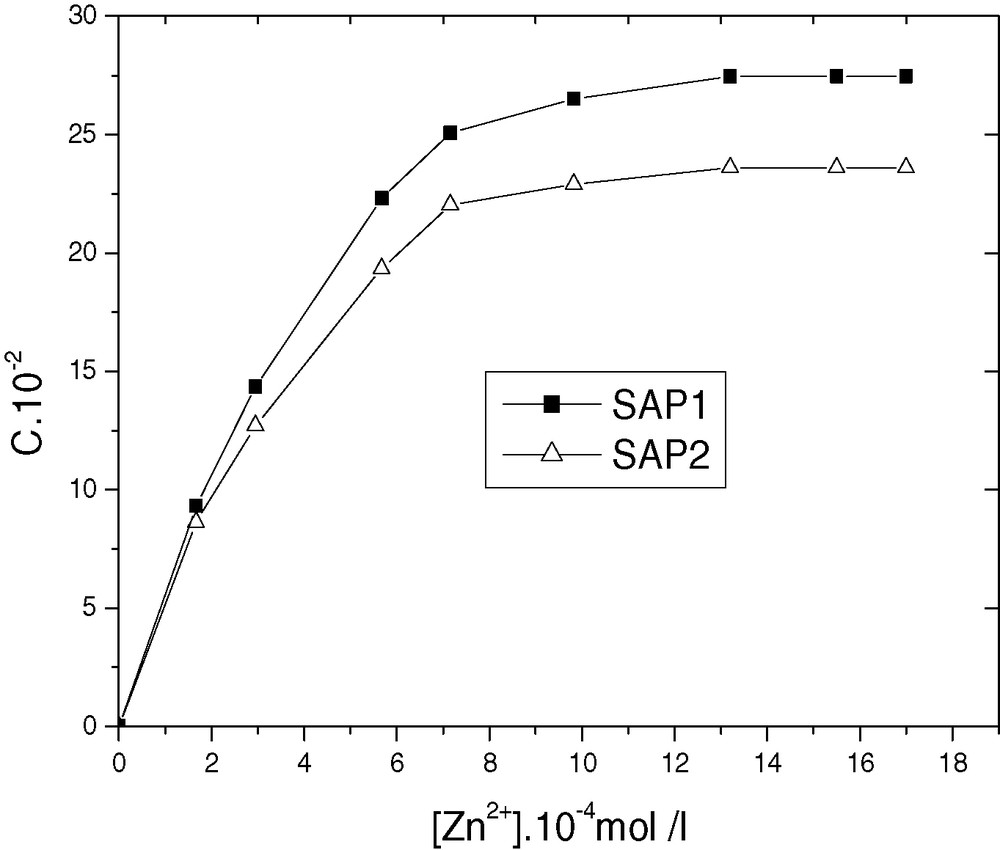
Saturation des supports SAP1 et SAP2 par le zinc.
3.4 Épuisement des solutions de zinc
Pour étudier l’épuisement des solutions aqueuses du zinc par SAP1 et SAP2, nous avons plongé des quantités de ces deux supports, de masses croissantes, dans 100 ml de la solution aqueuse, de concentration 10–4 M.
Le Tableau 1 montre que l’épuisement total d’une solution de zinc à 6,54 ppm est obtenu par une masse de 60 mg de SAP1 ou de SAP2. Ce résultat montre la possibilité d’utilisation de ce procédé pour la décontamination des rejets industriels.
Rendements et capacités d’extraction du Zn par SAP1 et SAP2
| Masse (mg) | SAP1 | SAP2 | ||
| C × 10–2 | R% | C × 10–2 | R% | |
| 10 | 1,568 | 6,96 | 2,258 | 7,54 |
| 20 | 3,670 | 12,10 | 9,750 | 33,16 |
| 30 | 9,332 | 30,68 | 14,210 | 47,59 |
| 40 | 15,897 | 69,56 | 24,478 | 83,16 |
| 50 | 26,341 | 87,06 | 25,647 | 99,10 |
| 60 | 30,357 | 100 | 28,457 | 100 |
3.5 Sélectivité des deux supports vis-à-vis des métaux (Zn, Cd, Co)
Le mélange que nous avons traité est une solution équimolaire (10–4 Met à pH = 5,5) de zinc, cadmium et cobalt. On introduit dans un volume de 100 ml environ 120 mg de SAP1 (ou 45 mg de SAP2). Les rendements d’extraction de ces métaux sont rassemblés dans le Tableau 2. Nous constatons que l’extraction est meilleure lorsqu’on utilise SAP1 pour les trois métaux. Ceci est probablement du à la différence de la structure de deux supports. Par ailleurs, on remarque que la sélectivité d’extraction suit l’ordre Cd > Zn > Co
Sélectivité d’extraction par SAP1 et SAP2 à partir du mélange Zn, Cd et Co
| Rendement (%) | |||
| Cd | Zn | Co | |
| SAP1 | 98 | 83 | 72 |
| SAP2 | 92 | 67 | 39 |
4 Conclusion
Parmi les matériaux susceptibles d’être utilisés pour éliminer les métaux lourds des solutions aqueuses diluées, les apatites requièrent une attention particulière, car elles présentent une certaine stabilité chimique ainsi qu’une capacité à fixer un grand nombre d’éléments chimiques. Par ailleurs, la performance d’extraction de cations métalliques par ces matériaux dépend essentiellement des paramètres liés à la solution dans laquelle est immergé le support apatitique (pH, concentration...).
Notre étude concerne plus particulièrement l’extraction du zinc à partir des solutions aqueuses diluées par deux supports phosphocalciques, SAP1 et SAP2.
La cinétique d’extraction a montré que l’équilibre est atteint au bout de 10 min pour SAP1 et de 30 min pour SAP2. La diminution de la concentration du zinc s’accompagne d’une augmentation du pH de la solution surnageante : ceci montre que l’apatite s’équilibre avec la solution métallique par fixation de protons H+. La capacité de fixation est d’autant plus grande que le pH initial de la solution est élevé. La saturation est atteinte pour C = 0,27 pour SAP1 et C = 0,23 pour SAP2.
Par ailleurs, l’épuisement des solutions diluées de zinc par ces supports phosphocalciques, en utilisant des masses croissantes, a permis d’atteindre l’épuration totale des solutions aqueuses en zinc avec 60 mg de support.
Le traitement du mélange contenant le zinc, le cadmium et le cobalt a permis de montrer que la sélectivité d’extraction évolue dans le sens suivant : Cd > Zn > Co.


