1 Introduction
La protéine Akt (aussi appelée PKB) joue un rôle essentiel dans la régulation de l'apoptose cellulaire et se retrouve de ce fait, impliquée dans un grand nombre de processus néoplasique. Ainsi, la recherche d'inhibiteurs spécifiques d'Akt constitue un axe prometteur dans la découverte de nouvelles substances anticancéreuses. Dans une démarche rationnelle, la connaissance du site d'interaction spécifique d'un effecteur physiologique avec sa protéine cible constitue une étape importante dans la conception d'inhibiteurs. La définition de ce site d'interaction peut être apportée par la résolution de la structure 3D du complexe cible–effecteur. Nous avons déjà démontré que les protéines de la famille TCL1 (un proto-oncogène impliqué dans des leucémies de type T) interagissaient avec le domaine homologue à la pleckstrine (PHD) d'Akt et fonctionnaient comme des coactivateurs de cette kinase [1]. Une approche combinant les techniques de RMN et de SAXS nous a permis de déterminer les affinités, les surfaces d'interaction, ainsi que d'obtenir une structure à basse résolution du complexe Akt-PHD : TCL1 [2]. Sur la base de ces informations, nous avons synthétisé un peptide (Akt-in) correspondant au brin A du tonneau β de TCL1, directement impliqué dans l'interaction avec Akt-PHD. Nous avons pu démontrer que ce peptide inhibait la prolifération cellulaire, aussi bien in vitro qu'in vivo [3]. Une étude RMN préliminaire suggérait que ce peptide liait le domaine PH d'Akt sur une surface similaire à celle reconnue par TCL1, mais provoquait également des changements conformationnels à plus longue distance, au niveau de la boucle VL1 du domaine PH [3]. Cette boucle, située à l'opposé du site reconnu par TCL1, forme avec la boucle VL2 la « poche de l'inositol », site de reconnaissance des têtes polaires des phosphatidyl-inositol-phosphates commun à la plupart des domaines PH. C'est cette reconnaissance qui permet l'ancrage membranaire de la kinase, une étape essentielle pour son activation. Nous avions donc émis l'hypothèse que la baisse de l'activité d'Akt due à la fixation du peptide Akt-in pourrait être corrélée à la baisse de l'affinité de son domaine PH pour les phosphatidyl-inositols membranaires [3]. Afin d'appuyer cette hypothèse, nous présentons dans ce manuscrit des expériences de titrage RMN qui montrent une baisse d'affinité significative d'Akt-PHD pour l'Ins(1,3,4,5)P4 (IP4, la tête polaire des phosphatidyl-inositols membranaires) en présence du peptide Akt-in en solution.
2 Matériel et méthodes
2.1 La protéine Akt-PHD
La construction du domaine PH de la kinase Akt (isoforme 2) (Akt-PHD) utilisée pour les expériences de titrage comprend sept résidus en C-terminal de plus que celle utilisée dans les publications précédentes. Cette modification conduit à peu de perturbations dans le spectre [1H–15N] HSQC qui a pu être attribué presque essentiellement sur la base d'une comparaison avec celui de la construction antérieure. Une expérience 3D [1H–15N] NOESY-HSQC a permis de compléter et vérifier cette attribution. Cette nouvelle construction est plus stable en solution que la précédente, et ne nécessite ni l'ajout d'Ins(1,4,5)P3 (IP3) comme agent stabilisateur, ni le traitement préliminaire des tubes avec de la silicone. Sa production, son marquage à l'azote-15 et sa purification sont autrement similaires à celles de la construction précédente [4].
2.2 Synthèse du peptide inhibiteur Akt-in
Le peptide Akt-in (NH2-AVTDHPDRLWAWEKF-CONH2) est synthétisé sur un Pioneer Peptide Synthesis System de chez Applied Biosystems en utilisant la stratégie Fmoc-tBu, TBTU comme agent de couplage et la résine Pal-Peg-Ps. Les couplages sont effectués avec un excès de quatre équivalents d'acides aminés. Le clivage et la déprotection du peptide sont réalisés par le traitement d'un mélange de TFA 88 %, eau 5 %, phénol 5 % et tri-isopropylsilane 2 %. Le peptide brut est purifié par HPLC préparative sur une colonne C-18 en utilisant un gradient linéaire d'acétonitrile (0,08 % TFA) dans l'eau (0,1 % TFA) sur un système Waters et caractérisé par spectrométrie de masse (ESI-MS) sur un QSTAR de chez Applied Biosystems. La masse du peptide est calculée à partir des rapports de masse à la charge (m/z) pour tous les états protonés du peptide (théorique 1870,04 ; calculée 1869,80).
2.3 Spectroscopie RMN
Les spectres RMN ont été enregistrés à 600 MHz (spectromètre Bruker AVANCE, équipé d'une sonde cryogénique triple résonance) et 8 °C sur des échantillons de 0,3 ml (tube Shigemi) à une concentration de 90 μM en protéine uniformément enrichie en 15N et dissoute dans un tampon Tris-HCl 10 mM, pH 7,4, 150 mM NaCl et 5 % 2H2O pour le lock. Leur traitement a été réalisé avec le logiciel Gifa (version 4.4) [5]. Les expériences de titrage ont toujours été réalisées par mélange d'une solution de protéine à une concentration de 90 μM avec différentes aliquotes de la même solution de protéine en mélange avec le ligand (Ins(1,3,4,5)P4 (IP4), Akt-in) à la concentration maximum (7 et 6 mM, respectivement), de façon à maintenir une concentration de protéine strictement identique pour tous les points du titrage.
2.4 Expériences de titrage
Les constantes de dissociation (kD) ont été obtenues en ajustant les variations de déplacement chimique mesurées sur les pics de corrélation des spectres HSQC en fonction de la concentration en ligand, selon la formule suivante [6] :
| [Eq. 1] |
| [Eq. 2] |
3 Résultats
3.1 Cartographie du site d'interaction du peptide Akt-in et mesure d'affinité
Les variations de déplacement chimique mesurées sur les pics de corrélation amide sur un spectre HSQC enregistré sur 15N-Akt-PHD en présence d'une concentration de 4 mM de peptide Akt-in concernent essentiellement des résidus situés sur les brins β5 (S56, A58, M63, T65) et β6 (T72, F73, I75) du β-sandwich et l'hélice α (V90, E95, E97, E98, W99, R101, A 102, M105, S109, L110) C-terminale du domaine PH (Fig. 1). Elles confirment les résultats obtenus avec la construction précédente, à savoir que le peptide se fixe sur un site proche de celui reconnu par la protéine TCL1. De plus, des variations plus faibles mais significatives sont enregistrées sur des résidus situés sur (R15, G16, T21) ou proches (G37) de la boucle VL1 du domaine PH, qui, avec la boucle VL2, forment la « poche » où vient se fixer la tête polaire des phosphatidyl-inositol phoshates (PtdIns).
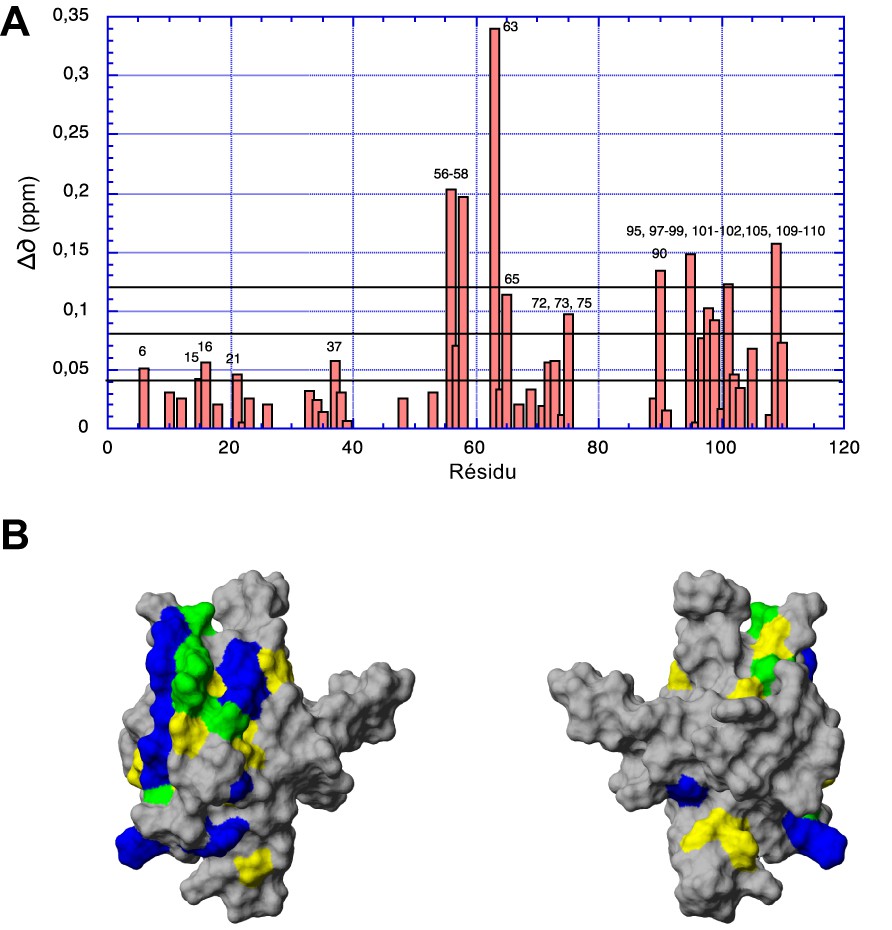
Site de liaison du peptide inhibiteur Akt-in sur la surface du domaine PH d'Akt. (A) Variations de déplacement chimique en fonction de la séquence mesurée entre un spectre HSQC enregistré sur un échantillon de 15N-Akt-PHD en présence de peptide à une concentration de 4 mM et un spectre HSQC de référence de la protéine marquée. (B) Site de liaison révélé par les variations de déplacement chimique mesurées au niveau des groupements amides d'Akt-PHD en présence d’Akt-in (jaune) et de TCL1 (bleu). Les zones reconnues à la fois par le peptide inhibiteur et TCL1 sont coloriées en vert.
Les variations de déplacement chimique les plus importantes après ajout de peptide concernent le résidu M63 : ce sont ces variations que nous avons utilisées pour établir la courbe de titrage (Fig. 2). L'ajustement de ces variations en fonction de la concentration en peptide avec l'équation [1] donne une constante de dissociation de 4,6 ± 0,5 mM pour le complexe Akt-PHD : Akt-in.
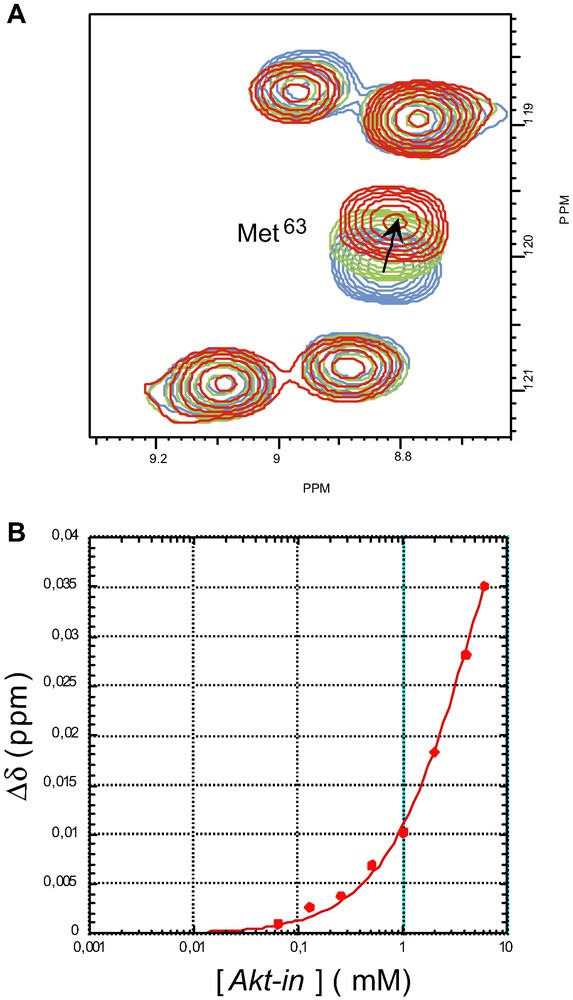
Expérience de titrage de la protéine 15N-Akt-PHD par le peptide Akt-in. (A) Superposition d'extraits de l'expérience HSQC montrant les variations de déplacement chimique du groupement amide du résidu Met-63 sous l'effet de l'addition de concentrations croissantes de peptide inhibiteur Akt-in ([Akt-in] = 0 mM (bleu), 2 mM (vert), 6 mM (rouge)). (B) Courbe de titrage obtenue en ajustant la variation de déplacement chimique moyen (Eq. 2) du groupement amide de Met-63 en fonction de la concentration en Akt-in avec l'équation 1.
3.2 Affinité de Akt-PHD pour IP4
Les variations de déplacement chimique enregistrées sur le spectre du 15N-Akt-PHD en présence d'IP4 concernent sans surprise essentiellement des résidus localisés dans les boucles VL1 et VL2 (Fig. 3), formant la « poche » de l'inositol commune à la plupart des domaines PH. Cela confirme nos résultats précédents, obtenus avec une construction légèrement différente pour le domaine PH [4]. Là encore, nous avons utilisé le résidu qui présente les plus grandes variations de déplacement chimique pour construire notre courbe de titrage (Fig. 4) : il s'agit du résidu N53, dont la chaîne latérale est engagée dans une interaction électrostatique avec un des groupes phosphate de l'IP4 [7]. Les courbes de titrage réalisées en suivant sur le spectre HSQC le déplacement chimique des pics correspondant au groupement amide de la chaîne latérale de ce résidu ont permis d'établir une constante de dissociation de 168 ± 40 μM pour le complexe Akt-PHD : IP4. Ce kD atteint 390 ± 50 μM si le titrage est réalisé strictement dans les mêmes conditions, mais en présence d'une concentration de 2 mM en peptide Akt-in dans la solution (soit environ 30 % du complexe Akt-PHD : Akt-in en solution), indiquant une baisse significative de l'affinité du domaine PH d'Akt pour l'IP4. Nous avons par ailleurs vérifié que le peptide ne possédait aucune affinité par lui-même pour l'IP4 : son spectre demeure inchangé en présence d'IP4 à une concentration de 0,6 mM.

Cartographie du site de liaison de l'IP4 sur la surface du domaine PH d'Akt. L'IP4 est représenté dans la position qu'il occupe dans la structure cristalline du domaine PH d'Akt1 [7]. Position de l'IP4 est dans Les variations de déplacements chimiques (A) mesurées entre un spectre HSQC de référence et un spectre HSQC enregistré sur un échantillon de 15N-Akt-PHD en présence d'IP4 à une concentration de 666 μM ont été utilisées pour colorer le diagramme en ruban de la protéine (B), avec le code couleur suivant : orange pour 0,5 ppm < Δδ < 1 ppm, et rouge Δδ > 1 ppm. Les chaînes latérales directement impliquées dans la liaison aux groupes phosphates de l'IP4 sont reportées (celle du résidu Asn53 qui a servi pour l'expérience de titrage est coloriée en rouge).

Expérience de titrage de la protéine 15N-Akt-PHD par l'IP4. (A) Superposition d'extraits de l'expérience HSQC montrant les variations de déplacement chimique du groupement amide porté par la chaîne latérale du résidu Asn-53 sous l'effet de l'addition de concentrations croissantes d'IP4 ([IP4] = 0 mM (bleu), 0,166 mM (vert), 0,666 mM (rouge)). (B) Courbe de titrage obtenue en ajustant la variation de déplacement chimique moyen (Eq. 2) du groupement amide de la chaîne latérale de Met-63 en fonction de la concentration en IP4 avec l'équation 1 (rouge). La même expérience réalisée en présence de peptide inhibiteur Akt-in à une concentration de 2 mM en solution (bleu).
4 Discussion
Ce travail confirme des résultats précédents, à savoir que le peptide Akt-in lie le domaine PH de la kinase Akt sur un site inclus dans la surface d'interaction déterminée pour le complexe Akt-PHD : TCL1 [3]. Des perturbations sont également enregistrées à plus longue distance, au niveau des déplacements chimiques de résidus impliqués dans la liaison aux phosphatidyl-inositol-phosphates membranaires. Ces variations sont probablement dues à des réarrangements conformationnels, éventuellement associés à une perturbation de la dynamique interne de la boucle VL1. Si le peptide lié au domaine PH adopte une conformation similaire au brin A du tonneau β de TCL1, son extrémité C-terminale – relativement hydrophobe et initialement structurée en coude β entre les brins A et B de TCL1 – pourrait venir se plaquer contre la boucle VL1 – également hydrophobe – sur la face opposée au site de l'inositol.
Les résultats présents ont également permis de mesurer l'affinité du domaine PH pour l'inhibiteur : cette affinité est certes relativement faible, mais reste conforme à l'affinité attendue pour un « hit » peptidique envers une cible protéique. Enfin, nous avons pu démontrer que la liaison du peptide au domaine PH diminuait significativement l'affinité de ce dernier pour l'IP4, la tête polaire des phosphatidyl-inositol-phosphates, cibles responsables de l'ancrage membranaire de la kinase. Là encore, ces résultats confirment en solution et permettent de quantifier des résultats précédents obtenus par des expériences de « pull-down » [3]. Cet effet est certainement à relier aux perturbations structurales (ou dynamiques ?) observées sur le domaine PH au niveau de la poche de l'inositol. L'ancrage membranaire est essentiel à l'activation complète d'Akt : son inhibition, même partielle, peut expliquer les perturbations des voies de signalisation de l'apoptose cellulaire.
En résumé, ces résultats sont un premier pas vers la démonstration du mécanisme d'action du peptide inhibiteur Akt-in. Ils doivent être encore affinés par une étude structurale du complexe Akt-PHD : Akt-in, en cours au laboratoire. Nous rappellerons que la conception d'inhibiteurs spécifiques de la kinase Akt constitue une voie prometteuse dans la thérapie anticancéreuse.
Remerciements
Virginie Ropars est financée par une bourse de la Ligue contre le cancer. Ce projet est également soutenu par l'Association pour la recherche contre le cancer.


