1 Introduction
L'argile joue un rôle important dans certains domaines d'activité, tels la fabrication de médicaments et le traitement des eaux polluées, par exemple dans l'adsorption de composés organiques toxiques [1,2].
L'activation est un procédé qui consiste à améliorer les propriétés d'adsorption de l'argile en lui faisant subir un traitement thermique ou chimique. Dans une activation chimique, on utilise en général le carbonate de sodium [3,4] ou des acides forts, tels que l'acide sulfurique [5,6]. Cette activation génère des effluents toxiques non valorisables et nécessitant d'énormes quantités d'eau pour le lavage des argiles activées. L'activation au chlorure d'ammonium (NH4Cl) [7] induit une diminution de la capacité d'échange cationique [8].
Les matériaux que nous avons utilisés dans ce travail sont à base de sédiments de barrage (vase), issus des dragages des barrages, et de l'argile bentonite, que nous avons testés comme adsorbants du phénol et de colorants présents à fortes concentrations dans les eaux résiduaires. Le phénol, présent dans la mer, représente un véritable danger pour l'homme, car il est rapidement absorbé par toutes les voies d'exposition. L'absorption a été estimée entre 70 à 80 % en 6 h pour une exposition à des vapeurs de phénol à des concentrations comprises entre 6 et 20 mg/m3, pratiquement uniquement par voie cutanée chez des volontaires sains [9]. Le phénol est présent dans les eaux usées de différentes industries [10–12]. À cet effet, une panoplie de procédés efficaces et peu chers est mise au point afin de traiter les rejets du phénol dans l'environnement [13–16]. Les colorants, présents dans les rejets de l'industrie du textile ainsi que les rejets domestiques, représentent un véritable danger pour l'homme et son environnement, en raison de leur stabilité et de leur faible biodégradabilité. Leur élimination passe souvent par un traitement physicochimique et biologique [17–21]. La méthode d'adsorption sur argile a fait l'objet de plusieurs travaux [22–26].
Les rejets de l'industrie du textile sont des mélanges complexes, dont l'hétérogénéité et la variabilité sont extrêmes [27]. Les procédés traditionnels de traitement tels que les procédés biologiques donnent des résultats non satisfaisants, du fait de la composition de ces rejets en matières toxiques et colorants qui sont difficilement biodégradables [28]. Pour cette raison, de nouvelles recherches sur de nouveaux produits utilisés comme dépolluants sont en cours ; parmi ces produits : l'argile. Nos matériaux à base d'argile ont été testés dans le traitement des rejets de l'industrie du textile : ils ont fait preuve d'efficacité.
2 Matériel et méthodes
2.1 Matériaux
2.1.1 Matériaux utilisés
Les sédiments de barrage (vase) ont été récupérés de la brèche du barrage de Fergoug (Ouest algérien). Ces sédiments sont classés parmi les sédiments ferrifères vu le taux élevé du fer (Fe2O3 = 5,04 %).
La bentonite est prélevée du gisement de « Hammam Boughrara », situé dans l'Ouest algérien, sur la rive droite de la Tafna, au nord-est de la ville de Maghnia.
La vase a été caractérisée par diffraction des rayons X, en utilisant un générateur des rayons X Philips type PW 3710, avec une anticathode de cuivre. Le spectre de diffraction des rayons X montre que la vase est un mélange d'illite, de kaolin, de chlorite et d'autres impuretés, comme le quartz (Fig. 1) [29]. La surface spécifique est calculée par la méthode BET [30,31], en utilisant un appareil de type Microméritics GEMINI 2375 ; elle est égale à 54,58 m2/g. Le pH est égal à 9,9.

Diffractogrammes de rayons X de la vase et la vase acidifié.
Le spectre de rayons X montre que la bentonite est bien un mélange de montmorillonite, kaolin et d'impuretés de quartz et calcite (Fig. 2). La surface spécifique vaut 55,186 m2/g. Le pH est égal à 9,48.
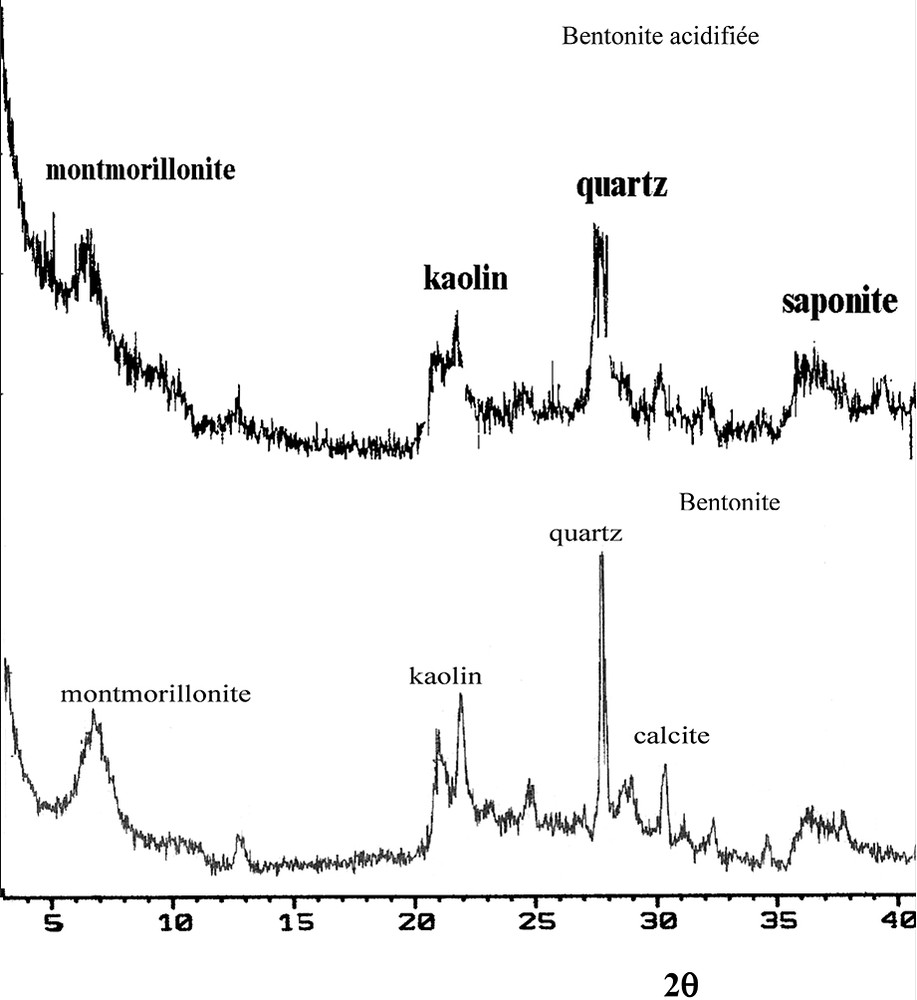
Diffractogrammes de rayons X de la bentonite et la bentonite acidifiée.
2.1.2 Matériaux activés
Cent grammes de vase brute (V), broyée sans purification préalable, ont été mis sous agitation modérée, dans 1 l de chlorure d'ammonium (2 M) à 50 °C pendant 24 h. La solution obtenue est introduite dans une éprouvette à sédimentation. Après un quart d'heure de décantation afin d'éliminer les grosses particules comme le quartz, on récupère les deux tiers du volume surnageant et on laisse décanter de nouveau. On récupère la vase qu'on lave plusieurs fois avec une eau déminéralisée jusqu'à disparition des chlorures [32–34]. Après décantation, la vase activée est séchée à température ambiante, puis mise à l'étuve entre 80 et 100 °C avant de subir différentes adsorptions. L'analyse aux rayons X de la vase activée (VN) (Fig. 1) montre une diminution du quartz et une augmentation du minéral argileux chlorite. Les processus de dissolution et de recristallisation provoqués par la réaction hydrothermale conduisent à la transformation de la berthiérine (famille des kaolins) en chamosite (famille des chlorites), constituants principaux des sédiments ferrifères [35,36] (Fig. 1). La surface spécifique augmente jusqu'à 142,36 m2/g [37–40]. La surface des micropores est de 23,60 m2/g. Le pH atteint 8,4.
La bentonite (B) a été mélangée à l'acide sulfurique à 10 % (masse de B/masse de H2SO4 = 2) à la température de 98 °C pendant 6 h, sous agitation à 550 tr/min. La suspension argileuse a été filtrée et lavée jusqu'à disparition des sulfates. On remarque une élévation de la surface spécifique à 171,59 m2/g. La surface des micropores est 19,71 m2/g. L'analyse aux rayons X de la bentonite acidifiée (BA) (Fig. 2) montre la diminution des impuretés. Le pH devient égal à 3,42.
2.2 Adsorption du phénol
Les expériences d'adsorption ont été effectuées en utilisant la méthode ASTM-D 3860 [41], par la mise en contact des matériaux obtenus avec des solutions de phénol de concentrations initiales différentes (1,59 à 50 mg/l), à la température ambiante de 20 °C et sous une agitation de 550 tr/min, pendant 4 h. Le solvant utilisé est une eau déminéralisée de pH 7 et de conductivité 0,5 μS. Le pH de chaque échantillon est ajusté approximativement à 8 par les solutions d'HCl et NaOH. Le phénol a une valeur du pKa de 10,1 ; ainsi, il existe sous la forme neutre à pH = 7. Ensuite les échantillons sont équilibrés pendant 4 h. Les expériences préliminaires de cinétique révèlent que l'équilibre de l'adsorption est atteint en moins de 24 h. La phase aqueuse est séparée par centrifugation à 1900 tr/min pendant 30 min. Le surnageant est retiré de chaque échantillon pour analyser le phénol. Les filtrats récupérés sont centrifugés et analysés à une longueur d'onde de 269,70 nm ; grâce à un spectrophotomètre de type Perkin Lamda 25, en accord avec la méthode proposée par Waterman [42], les concentrations de surface en phénol à l'équilibre (qe) sont ainsi portées en fonction des concentrations de l'adsorbat (Ce) et pour un rapport de masse VN sur volume de solution égal à 1 mg/ml et de masse BA sur volume de solution égal à 1 mg/ml [43] (Fig. 3). La concentration de surface en phénol à l'équilibre (qe) est définie [44], comme :
- ● qe : la quantité de phénol par unité de masse de vase activée (mg/g) ;
- ● C0 : la concentration initiale (mg/l) ;
- ● Ce : la concentrations résiduelles à l'équilibre de la phase liquide (mg/l) ;
- ● V : le volume de l'adsorbat (l) ;
- ● m : la masse de l'adsorbant (g).

Isotherme d'adsorption du phénol sur BA et VN à 20 °C.
2.3 Adsorption du colorant rouge
Le colorant utilisé est le colorant rouge commercialisé sous le code C.I : colorant rouge 274, de masse volumique 1,134 mg/l, de pH égal à 6,26.
Les isothermes d'adsorption ont été obtenues par le mélange de 100 ml de la solution du colorant à différentes concentrations (10 à 1000 mg/l), à température ambiante, 20 °C, et sous une agitation de 550 tr/min, pendant 4 h, avec 100 mg du matériau. Les filtrats récupérés sont centrifugés et analysés à une longueur d'onde de 570 nm.
2.4 Isotherme d'adsorption
Les isothermes d'adsorption à température ambiante pour le phénol et le colorant rouge sur la vase activée au chlorure d'ammonium et la bentonite activée à l'acide sulfurique sont représentées sur les Figs. 3 et 4. Les résultats sont analysés en utilisant l'isotherme de Langmuir :
| (1) |

Isotherme d'adsorption du colorant rouge sur BA et VN à 20 °C.
La linéarisation de l'équation (1) de Langmuir conduit à l'équation suivante :
| (2) |
L'équation obtenue est celle d'une droite de pente 1/qm KL et d'ordonnée à l'origine 1/qm, permettant de déterminer deux paramètres d'équilibre de l'équation (2) : qm et KL.
Comme attendu pour cet intervalle de concentrations, les isothermes d'adsorption du phénol sont linéaires, avec un coefficient de corrélation égal à 0,9996 et correspondant au modèle d'adsorption de Langmuir pour une adsorption dissociative [45,46]. La bentonite activée (BA) retient plus de phénol que la vase activée. La capacité d'adsorption maximale de BA est 32,23 mg/g, alors que celle de la vase activée vis-à-vis du phénol est égale à 25,33 mg/g. Ainsi, l'argile, qui a une surface spécifique élevée, adsorbe mieux le phénol.
Dans le cas du colorant rouge, les isothermes d'adsorption correspondent au modèle de Langmuir pour des matériaux microporeux, avec formation d'une ou deux monocouches monomoléculaires, et concernent des molécules flexibles pouvant pénétrer loin dans les pores pour y déplacer le solvant [47,48]. Le colorant rouge présente une meilleure adsorption sur la vase activée, qui présente une surface de micropores supérieure à celle de la bentonite acidifiée, donc l'augmentation de la porosité de la vase activée augmente la rétention du colorant rouge [49]. Les paramètres du modèle de Langmuir sont les suivants :
2.5 Traitement d'un rejet de l'industrie du textile
La vase activée au chlorure d'ammonium et la bentonite acidifiée sont ajoutées à un rejet prélevé d'une société algérienne de textile (EPE SOTEXHAM) ; le mélange est laissé sous agitation à 550 tr/min, à 20 °C, pendant 48 h, avec un rapport vase activée/volume de rejet = 1 mg/ml. Le rejet a été analysé avant et après traitement ; le Tableau 1 regroupe les différentes analyses qui indiquent une grande diminution de la concentration en phénol dans le rejet du textile, surtout avec la vase activée, ainsi que la diminution de la DCO et de la DBO, bien que ces dernières restent toujours hors normes. La concentration en phosphate est devenue nulle avec le matériau VN (vase activée). La turbidité a fortement diminué par l'utilisation des deux matériaux.
Analyse physicochimique du rejet de textile avant et après traitement par VN et BA
| pH | Turbidité | Phénol | Zn | Cu | DCO | DBO | |
| (NTU) | (ppm) | (ppm) | (ppm) | (ppm) | (ppm) | ||
| Rejet avant traitement : | 6,14 | 545 | 6,55 | 6,4 | 17 | 7000 | 2800 |
| Rejet après traitement par VN : | 7,70 | 3,27 | 0,65 | 3,72 | 10 | 390 | 1600 |
| Rejet après traitement par BA : | 8,70 | 3,40 | 1,22 | 4,5 | 5,5 | 750 | 770 |
3 Conclusion
Les matériaux que nous avons utilisés dans ce travail ont été élaborés, l'un à partir de sédiments de barrage, en abondance dans notre pays et peu coûteux, et cela après une activation chimique au chlorure d'ammonium, et l'autre à partir de bentonite, qui a subi une activation acide à l'acide sulfurique. Les analyses des matériaux ont montré l'augmentation de la surface spécifique et les expériences réalisées sur ces matériaux ont permis d'aboutir aux conclusions suivantes :
- ● les isothermes d'adsorption du phénol sont linéaires, avec un coefficient de corrélation égal à 0,9996, et correspondent au modèle d'adsorption de Langmuir pour une adsorption dissociative. La bentonite activée (BA) retient plus de phénol que la vase activée, avec une capacité d'adsorption maximale de 32,23 mg/g ;
- ● les isothermes d'adsorption du colorant rouge correspondent au modèle de Langmuir, l'adsorption est meilleure sur la vase activée, qui présente une surface de micropores supérieure à celle de la bentonite acidifiée, avec une capacité d'adsorption maximum égale à 384,61 mg/g ;
- ● les matériaux ont montré leur efficacité dans le traitement d'un rejet de l'industrie du textile, la DCO a nettement diminué, ainsi que d'autres paramètres de pollution, tels que le taux de phénol, avec une réduction atteignant 90 % sur la vase activée ;
- ● les matériaux argileux à base de sédiments de barrage, activés à l'acide, s'avèrent efficaces pour le traitement des rejets des effluents industriels.


