1 Introduction
Les diagrammes d'équilibre de phases liquide–solide à base d'eau et de nitrates métalliques ont fait l'objet de nombreux travaux antérieurs pour leurs propriétés, qui leur confèrent des possibilités d'applications industrielles intéressantes, en particulier pour la synthèse d'oxydes bi- ou trimétalliques [1].
Les nanoparticules de ferrite ont été étudiées intensivement ces dernières années, en raison de leurs propriétés catalytiques, électriques et magnétiques remarquables, ainsi que, leurs larges applications pratiques dans les domaines de la mémorisation des informations, de la technologie du ferrofluide, de la réfrigération du magnétocalorique et du diagnostic médical. Le ferrite du cobalt (CoFe2O4) est particulièrement intéressant du fait de sa haute anisotropie magnétocristalline cubique et de sa haute coercivité. Des investigations récentes ont montré que les nanoparticules de ferrite du cobalt présentent des propriétés photomagnétiques [2,3].
Pour l'élaboration de ce matériau, nous avons entrepris l'étude du système ternaire H2O–Fe(NO3)3–Co(NO3)2, qui forme une base indispensable à l'exploitation des nitrates de fer et des nitrates de cobalt dans le domaine des céramiques.
La détermination des équilibres liquide–solide du système ternaire H2O–Fe(NO3)3–Co(NO3)2 a été entreprise dans le cadre d'une étude systématique des systèmes fondés sur les binaires eau–nitrate de fer et eau–nitrate de cobalt.
2 Étude bibliographique
2.1 Système binaire H2O–Co(NO3)2
Le diagramme d'équilibre solide–liquide du système binaire H2O–Co(NO3)2 a été établi par Funk en 1900 [4] entre –26 et 91 °C, et par Wilcox et Bailey en 1927 [5], entre 15 et 30 °C. Trois hydrates du nitrate de cobalt se manifestent et présentent des équilibres avec la phase liquide ; ils possèdent trois, six, et neuf molécules d'eau.
L'étude de la décomposition thermique de l'hexahydrate de nitrate de cobalt par thermogravimétrie (TG), sous atmosphère d'azote, indique la formation de Co(NO3)2·n H2O (où n = 6, 4, 2 et 1) [6].
2.2 Système H2O–Fe(NO3)3
Le diagramme d'équilibre solide–liquide du système binaire H2O–Fe(NO3)3 a été étudié par Malquori, Zaslavskij et Ravdine en 1927 et 1929 [7]. Cette étude s'intéresse seulement à certaines valeurs de solubilité, à des températures situées entre 0 et 40 °C. Dans une autre étude, Malquori a indiqué la manifestation de l'hexahydrate du nitrate ferrique dans le système ternaire H2O–Fe(NO3)3–HNO3 à 25 °C [8].
3 Méthodes expérimentales
Les courbes de solubilité sont déterminées par une méthode synthétique fondée sur des mesures de conductivité [9–11]. Elle consiste, en pratique, à ajouter progressivement un solvant à un mélange salin de composition connue, à mesurer la conductivité de la solution en équilibre thermodynamique et à représenter son évolution en fonction de la quantité de liquide ajoutée. Les courbes obtenues présentent des points anguleux et des paliers, qui correspondent aux transformations de phases. L'analyse d'une série de mélanges permet de définir les courbes de liquidus et de déterminer la composition des solutions invariantes et des phases solides, anhydres ou hydratées.
L'identification des hydrates du nitrate de fer et du nitrate de cobalt a été conduite par la méthode des ensembles et des restes [12]. Les sels de départ sont le nitrate de fer et le nitrate de cobalt. Ce sont des produits Prolabo, dont la pureté est de l'ordre de 96–98 %. L'eau utilisée a été bidistillée. Sa conductivité est de l'ordre de 6 μS environ à 18 °C.
4 Résultats expérimentaux
4.1 Diagramme binaire H2O–Co(NO3)2
Le diagramme d'équilibre liquide–solide du système binaire H2O–Co(NO3)2 a été établi par la méthode conductimétrique sous la pression atmosphérique et à une température comprise entre –28 et 50 °C. Une étude comparative de nos déterminations expérimentales avec celles de Funk, Wilcox et Bailey a permis de définir les équilibres stables qui se manifestent dans ce système.
L'ensemble des valeurs de solubilité expérimentales et bibliographiques sont regroupées dans le Tableau 1 et représentées sur la Fig. 1.
Solubilité de nitrate de cobalt dans l'eau
| WCo(NO3)2 | Phase solide en équilibre | |
| –28a | 35,99a | G |
| –25a | 33,88a | G |
| –20a | 29,95a | G |
| –15a | 25,36a | G |
| –10a | 19,84a | G |
| –5a | 10,01a | G |
| –31,5b | 38b | G + Co.9 |
| –28a | 39,87a | Co.9 |
| –26 | 39,45c | Co.9 |
| –25a | 40,43a | Co.9 |
| –20.5 | 42,77c | Co.9 |
| –20a | 41,02a | Co.6 |
| –15a | 41,86a | Co.6 |
| –10a | 42,91a | Co.6 |
| –10 | 43,69c | Co.6 |
| –5a | 44,43a | Co.6 |
| –4 | 44,85c | Co.6 |
| 0a | 45,25a | Co.6 |
| 0 | 45,66c | Co.6 |
| 5a | 46,33a | Co.6 |
| 10a | 47,78a | Co.6 |
| 15a | 48,75a | Co.6 |
| 15 | 47,70d | Co.6 |
| 18 | 49,73c | Co.6 |
| 20a | 49,77a | Co.6 |
| 20 | 49,33d | Co.6 |
| 22,5a | 50,14a | Co.6 |
| 25a | 50,91a | Co.6 |
| 25 | 50,70d | Co.6 |
| 30a | 53,21a | Co.6 |
| 30 | 52,70d | Co.6 |
| 35a | 53,78a | Co.6 |
| 40a | 55,73a | Co.6 |
| 41 | 55,96c | Co.6 |
| 45a | 57,82a | Co.6 |
| 50a | 59,25a | Co.6 |
| 56 | 62,88c | Co.6 |
| 55 | 61,74c | Co.6 |
| 62 | 62,88c | Co.6 |
| 70 | 64,89c | Co.3 |
| 84 | 68,84c | Co.3 |
| 91 | 77,21c | Co.3 |
a Points expérimentaux.
b Point obtenu par extrapolation des courbes liquidus.
c Funk.
d Wilcox et Bailey.
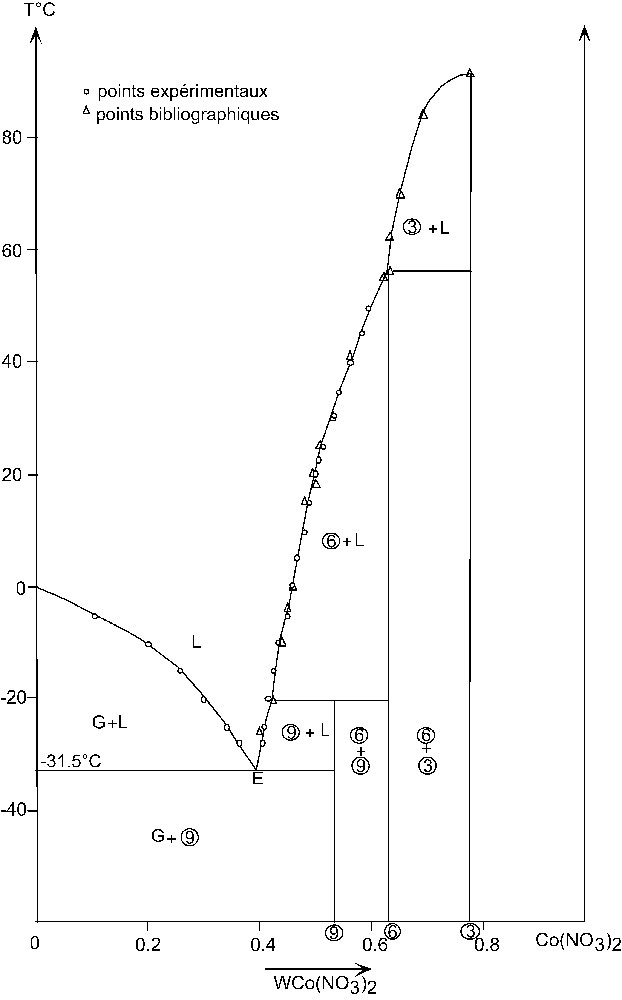
Diagramme d'équilibre du système H2O–Co(NO3)2.
G : Glace ; L : liquide ; 3 : Co(NO3)2·3 H2O ; 6 : Co(NO3)2·6 H2O ; 9 : Co(NO3)2·9 H2O.
Quatre branches de solubilité ont été définies dans ce système binaire. Leur extrapolation a permis de définir trois transformations invariantes :
- ● une transformation eutectique stable vers –31.5 °C correspond à la réaction :
- ● une transformation péritectique vers –20,5 °C correspond à la décomposition de nonahydrate de nitrate de cobalt :
- ● une transformation péritectique vers 55 °C correspond à la réaction :
4.2 Diagramme ternaire H2O–Fe(NO3)3–Co(NO3)2
4.2.1 Isotherme 30 °C
Une représentation isotherme de ce système ternaire a été complètement établie à 30 °C. Les résultats obtenus sont décrits graphiquement dans la représentation classique, dans laquelle le repère est un triangle rectangle isocèle dont l'angle droit correspond à l'eau pure. Les compositions en sels sont exprimées en fraction massique.
Les phases solides qui se manifestent à cette température sont le nonahydrate de nitrate de fer, l'hexahydrate de nitrate de fer, le trihydrate de nitrate de cobalt et l'hexahydrate de nitrate de cobalt, leurs branches de solubilité respectives étant, AB : Fe.9 ; BC : Fe.6 ; CD : Co.3 et DE : Co.6.
Les résultats expérimentaux sont regroupés dans le Tableau 2 et présentés dans la Fig. 2.
Système H2O–Fe(NO3)3–Co(NO3)2. Isotherme 30 °C
| Composition du liquide (fractions massiques) | Nature du phénomène | Phase solide en équilibre | |
| WFe(NO3)3 | WCo(NO3)2 | ||
| 0 | 0,532 | Liquidus | Co.6 |
| 0,021 | 0,501 | – | Co.6 |
| 0,066 | 0,465 | – | Co.6 |
| 0,090a | 0,455a | Liquide D | Co.6 + Co.3 |
| 0,132 | 0,398 | Liquidus | Co.3 |
| 0,154 | 0,375 | – | Co.3 |
| 0,180 | 0,361 | – | Co.3 |
| 0,201 | 0,335 | – | Co3 |
| 0,248 | 0,293 | – | Co.3 |
| 0,270 | 0,270 | Liquide C | Co.3 + Fe.6 |
| 0,292 | 0,235 | Liquidus | Fe.6 |
| 0,347 | 0,155 | – | Fe.6 |
| 0,383 | 0,112 | – | Fe.6 |
| 0,428 | 0,067 | – | Fe.6 |
| 0,435a | 0,060a | Liquide B | Fe.6 + Fe.9 |
| 0,444 | 0,044 | Liquidus | Fe.9 |
| 0,460 | 0,023 | – | Fe.9 |
| 0,468 | 0 | – | Fe.9 |
a Point de double saturation obtenu par extrapolation des courbes liquidus.
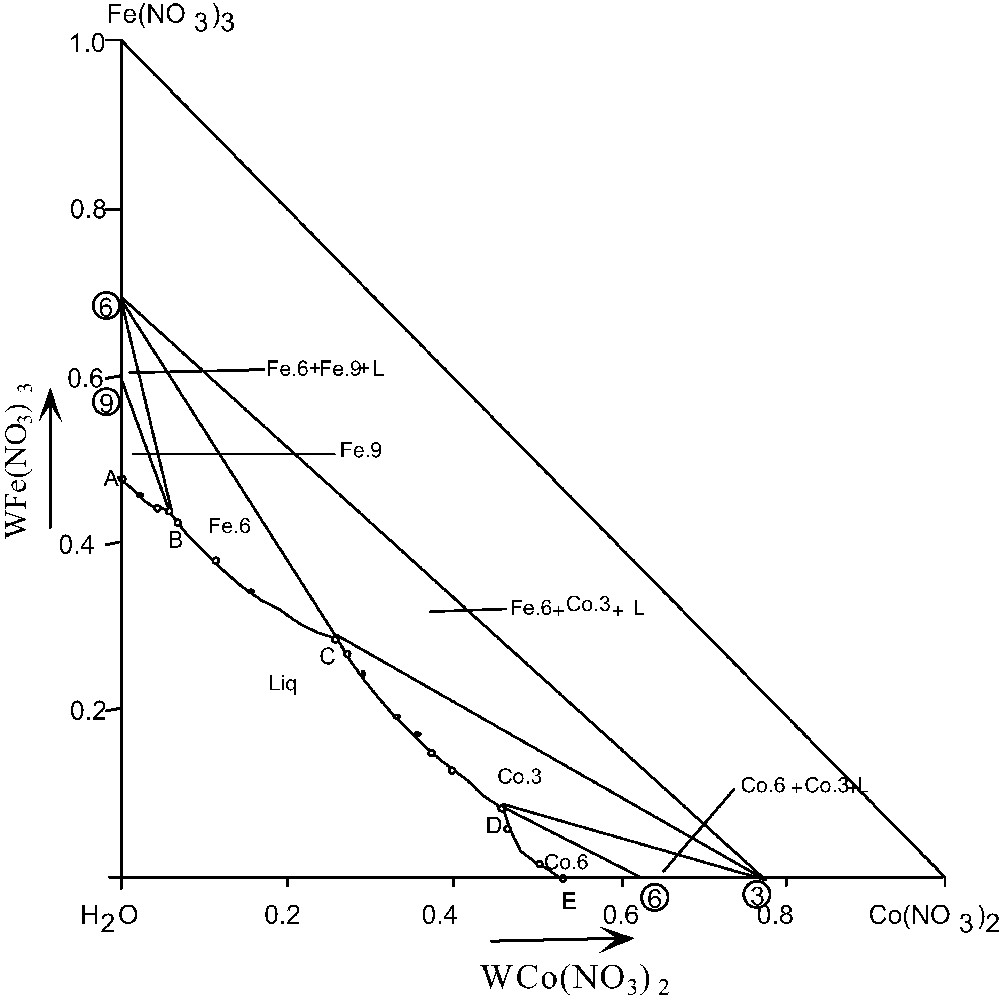
Isotherme 30 °C du système H2O–Fe(NO3)3–Co(NO3)2.
Liq : liquide ; Fe.9 : Fe(NO3)3·9 H2O ; Fe.6 : Fe(NO3)3·6 H2O ; Co.6 : Co(NO3)2·6 H2O ; Co.3 : Co(NO3)2·3 H2O.
5 Caractérisation
Afin de contrôler la nature des phases solides en équilibre avec les différentes solutions saturées, plusieurs mélanges (M1, M2, M3 et M4), de compositions convenablement choisies, ont été maintenus séparément à 30 °C sous faible agitation pendant dix jours.
Les mélanges obtenus se composent chacun d'une phase liquide en équilibre avec une phase solide. Les résultats des dosages chimiques de ces phases sont rassemblés dans le Tableau 3.
Système H2O–Fe(NO3)3–Co(NO3)2. Méthode des ensembles et des restes
| Mélange | Température d'équilibre (°C) | Composition de Mi (pourcentage massique) | Nature de la phase analysée | Composition de la phase analysée (pourcentage massique) | ||
| Fe(NO3)3 | Co(NO3)2 | Fe(NO3)3 | Co(NO3)2 | |||
| M1 | 30 | 49 | 3,5 | Cristaux | 58,15 | 0,625 |
| M2 | 30 | 38,5 | 15 | Cristaux | 66,30 | 1,43 |
| M3 | 30 | 20 | 36 | Cristaux | 4,04 | 67,32 |
| M1 | 30 | 49 | 3,5 | Liquide | 44 | 5.25 |
| M3 | 30 | 20 | 36 | Liquide | 23.57 | 31,45 |
| M4 | 30 | 2 | 54,5 | Liquide | 3,39 | 50,93 |
L'exploitation de ces résultats montre que, dans ce système ternaire, quatre phases solides présentent des équilibres stables. Elles sont :
- ● le nonahydrate de nitrate de fer ;
- ● l'hexahydrate de nitrate de fer ;
- ● le trihydrate de nitrate de cobalt ;
- ● l'hexahydrate de nitrate de cobalt.
6 Conclusion
Au cours de cette étude, nous avons établi le diagramme d'équilibre solide–liquide du système binaire H2O–Co(NO3)2 et une représentation isotherme du système ternaire H2O–Fe(NO3)3–Co(NO3)2 à 30 °C.
Les phases solides qui se manifestent dans le système binaire H2O–Co(NO3)2 sont :
- ● le nonahydrate ;
- ● l'hexahydrate ;
- ● le trihydrate de nitrate de cobalt.
La représentation isotherme ternaire étudiée comporte quatre branches de solubilité, correspondant respectivement aux hydrates suivants :
- ● l'hexahydrate de nitrate de cobalt ;
- ● le trihydrate de nitrate de cobalt ;
- ● l'hexahydrate de nitrate de fer ;
- ● le nonahydrate de nitrate de fer.


